第09章 相律与相图
- 格式:doc
- 大小:194.50 KB
- 文档页数:14

1.相律的有关概念与相律表达式(1)独立组份数C=S-R-R′。
S为物种数,R为独立化学反应计量式数目。
R′ 为同一相中独立的浓度限制条件数〔包括不同物种依反应计量式比例关系及离子物种电中性条件〕(2)自由度数f,系指相平衡体系中相数保持不变时,所具有独立可变的强度变量数。
(3)相律内容及其数学表达式。
相律就是揭示pVT平衡系统中自由度数、独立组份数和相数三者之间的制约关系。
表达式为:f=C-Φ+2;式中〔式中 2 指T、p两强度变量〕当T、p中有任一固定,则表达式为:条件自由度数f*=C-Φ+1当考虑除T、p、X B以外的其他变量或相间有某种限制时,则表达式为f=C-Φ+n;〔式中n≥2〕(4)相律的局限性与应用的关键性。
相律是一个定性规律,它指明特定条件下该平衡系统至多存在的相数及其相应的独立变量数,但不能指明是哪些相共存?哪些性质可作为独立变量及其它们之间的定量关系?相律对单相与复相都适用,但应用相律时,首先要考察系统是否满足相律成立的条件,并确定系统的组份数。
2.单组份系统的相图与特征(1)单组份系统相律与相图:因C=1 ,故相律表达式为f=3-Φ。
显然f最小为零,Φ最多应为 3 ,因相数最少为 1 ,故自由度数最多为 2 。
相图是用几何图形来描述多相平衡系统宏观状态与T、p、X B〔组成〕的关系。
在单组份相图中有单相的面、两相平衡线和三相平衡的点,自由度分别为f=2、f=1、f =0。
(2)单组份相变的特征与类型。
相变是一个连续的质的飞跃。
相平衡时物质在各相中的化学势相等,相变时某些物理性质有突变。
根据物性的不同变化有一级相变和连续相变〔包括二级相变等高阶相变〕之分;前者广为存在如气、液、固之间转变,其特点是物质在两相中的化学势一级导数不相等,且发生有限的突变〔即〕,此类相变平衡曲线斜率符合克拉贝龙方程。
后者如氦He〔Ⅰ〕与He〔Ⅱ〕的转变。
正常状态与超导状态的转变,其特点是化学势的一级导数在相变点连续〔即V1=V2,S1=S2〕,但化学势二级导数在相变点附近则迅速变化,出现一个极大峰如;或。


相图分析物理化学复习总结之相平衡f组分数,⾃由度,相图,相点,露点,泡点,共熔点,(连)结线,三相线,步冷(冷却)曲线,低共熔混合物(固相完全不互溶)本章主要要求掌握相律的使⽤条件和应⽤,单组分和双组分系统的各类典型相图特征、绘制⽅法和应⽤,利⽤杠杆规则进⾏有关计算1、相律: F = C - P + n , 其中:C=S-R-R’U+ }3 Q0 G- D4 L$ \6 e- D) l(1) 强度因素T,p可变时n=2/ n) \+ r' I3 G" P5 [3 q* A) f(2) 对单组分系统:C=1, F=3-P j(3) 对双组分系统:C=2,F=4-P;应⽤于平⾯相图时恒温或恒压,F=3-P。
Y% z2 ]7 h' z5 d- X- 2、相图(1)相图:相态与T,p,x的关系图,通常将有关的相变点联结⽽成。
(2)实验⽅法:实验主要是测定系统的相变点。
常⽤如下四种⽅法得到。
4 Z r! M- J2 u! s( _. ms 对于⽓液平衡系统,常⽤⽅法蒸⽓压法和沸点法;" A+ d4 S0 D/ v! r液固(凝聚)系统,通常⽤热分析法和溶解度法。
$ l( m3 N$ j5 a" ^3、单组分系统的典型相图对于单组分系统C=1,F=C-P+2=3-P。
当相数P=1时,⾃由度数F=2最⼤,即为双变量系统,通常绘制蒸⽓压-温度(p-T)相图,见下图。
(a) 正常相图(b) ⽔的相图(c) 硫的相图图6-1 常见的单组分系统相图/ ]. g/ W. Y' n* ?" ^# _⼆组分系统的相图j类型:恒压的t-x(y)和恒温的p-x(y)相图。
相态:⽓液相图和液-固(凝聚系统)相图。
5 f% ^( `8 E0 e; h; W! y1 |8 SB(1)⽓液相图根据液态的互溶性分为完全互溶(细分为形成理想混合物、最⼤正偏差和最⼤负偏差)、部分互溶(细分为有⼀低共溶点和有⼀转变温度的系统)和完全不溶(溶液完全分层)的相图。

第5章 相律与相图复习思考题1.什么是独立组分数独立组分数与物种数有何区别和联系2.试以NaCl 和水构成的系统为例说明系统的物种数可以随考虑问题的出发点和处理方法而有所不同,但独立组分数却不受影响。
3. 在下列物质共存的平衡系统中,有几个独立反应请写出反应式。
(a )C (s )、CO (g )、CO 2(g )、H 2(g )、H 2O (l )、O 2(g )。
(b )C (s )、CO (g )、CO 2(g )、Fe (s )、FeO (s )、Fe 3O 4(s )、Fe 2O 3(s )4.“单组分系统的相数一定少于多组分系统的相数,一个平衡系统的相数最多只有气、液、固三相。
”这个说法是否正确为什么5.水和水蒸气在363 K 平衡共存,若保持温度不变,将体积增大一倍,蒸气压将如何改变 6.什么是自由度自由度是否等于系统状态的强度变量数如何理解自由度为零的状态7.将CaCO 3置于密闭真空容器中加热,以测定其分解压强,问CaCO 3的用量是否需精确称量若CaCO 3量过少可能会发生什么现象8. I 2在水和CCl 4间的分配平衡,当无固态I 2存在时,其自由度为多少9.二液体组分若形成恒沸混合物,试讨论在恒沸点时组分数、相数和自由度各为多少。
习 题1.指出下列平衡系统的物种数、组分数、相数和自由度: (1)Ca (OH )2(s )与CaO (s )、H 2O (g )呈平衡。
(2)CaSO 4与其饱和水溶液达平衡。
(3)在标准压力下,水与水蒸气平衡。
(4)由Fe(s)、FeO(s)、C(s)、CO(g)、CO 2(g)组成的平衡系统; (5)由Fe(s)、FeO(s)、Fe 3O 4(s)、CO(g)、CO 2(g)组成的平衡系统; 解:(1)3,1,0,=3,=1SR b f ===Φ(2)2,0,0,=2,=2S R b f ===Φ (3)1,0,0,=2,=0SR b f ===Φ (4)5,2,0,=4,=1SR b f ===Φ(5)5,2,0,=4,=1S R b f ===Φ2.固体NH 4HS 和任意量的H 2S 及NH 3气体混合物组成的系统达到平衡: (1))求该系统组分数和自由度;(2)若将NH 4HS 放在一抽空容器内分解,平衡时,其组分数和自由度又为多少 解:(1)3,1,0,=2,=2SR b f ===Φ(2)3,1,1,=2,=1S R b f ===Φ3.已知Na 2CO 3(s)和H 2O(1)可形成的水合物有三种:Na 2CO 3·H 2O (s),Na 2CO 3·7 H 2O (s)和Na 2CO 3·10 H 2O (s),试问: (1)在101325 Pa 下,与Na 2CO 3水溶液及冰平衡共存的含水盐最多可有几种 (2)在 K 时,与水蒸气平衡共存的含水盐最多可有几种解:(1)设最多有x 种含水盐,则 2,,0,=2+,1S x R x b x n =+==Φ=由相律得2(2)110f x x =-++=-≥ ,所以,1x ≤。


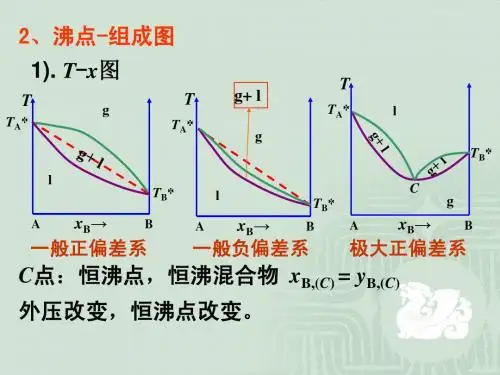


相图中的对应关系定理及其与相律的关系
相图中的对应关系定理是一种数学定理,它涉及到将一组元素分为两组,以满足以下定义:一组元素可以在另一组元素之间形成一对一(一一对应)
的映射。
相图中的对应关系定理类似于相律。
当两个结构的特定部分之间的关系
体现出一对一的映射关系时,我们就称之为相律。
两个结构间的相律称为同义相律,相律的一般性,则是指它涉及到两者
之间的概念的外部。
它解释了两个概念之间的关系,而不会破坏它们的内部
结构。
相对而言,相图中的对应关系定理只要求两组元素之间形成一对一的
关系,而不仅限于某种外部概念。
所以说,相图中的对应关系定理和相律之间是有所区别的:相图中的对
应关系定理指的是一组元素映射到另一组的的严格的要求,而相律则涉及到
两者之间的概念的外部。
总之,相图中的对应关系定理和相律之间有着本质的不同,它们涉及到
不同的数学定义,用于描述不同类型的数学关系。
第5章 相律与相图复习思考题1.什么是独立组分数?独立组分数与物种数有何区别和联系?2.试以NaCl 和水构成的系统为例说明系统的物种数可以随考虑问题的出发点和处理方法而有所不同,但独立组分数却不受影响。
3. 在以下物质共存的平衡系统中,有几个独立反应?请写出反应式。
〔a 〕C 〔s 〕、CO 〔g 〕、CO 2〔g 〕、H 2〔g 〕、H 2O 〔l 〕、O 2〔g 〕。
〔b 〕C 〔s 〕、CO 〔g 〕、CO 2〔g 〕、Fe 〔s 〕、FeO 〔s 〕、Fe 3O 4〔s 〕、Fe 2O 3〔s 〕4.“单组分系统的相数一定少于多组分系统的相数,一个平衡系统的相数最多只有气、液、固三相。
”这个说法是否正确?为什么?5.水和水蒸气在363 K 平衡共存,假设保持温度不变,将体积增大一倍,蒸气压将如何改变? 6.什么是自由度?自由度是否等于系统状态的强度变量数?如何理解自由度为零的状态?7.将CaCO 3置于密闭真空容器中加热,以测定其分解压强,问CaCO 3的用量是否需精确称量?假设CaCO 3量过少可能会发生什么现象?8. I 2在水和CCl 4间的分配平衡,当无固态I 2存在时,其自由度为多少?9.二液体组分假设形成恒沸混合物,试讨论在恒沸点时组分数、相数和自由度各为多少。
习 题1.指出以下平衡系统的物种数、组分数、相数和自由度: 〔1〕Ca 〔OH 〕2〔s 〕与CaO 〔s 〕、H 2O 〔g 〕呈平衡。
〔2〕CaSO 4与其饱和水溶液达平衡。
〔3〕在标准压力下,水与水蒸气平衡。
〔4〕由Fe(s)、FeO(s)、C(s)、CO(g)、CO 2(g)组成的平衡系统; 〔5〕由Fe(s)、FeO(s)、Fe 3O 4(s)、CO(g)、CO 2(g)组成的平衡系统; 解:〔1〕3,1,0,=3,=1SR b f ===Φ〔2〕2,0,0,=2,=2S R b f ===Φ 〔3〕1,0,0,=2,=0SR b f ===Φ 〔4〕5,2,0,=4,=1SR b f ===Φ〔5〕5,2,0,=4,=1S R b f ===Φ2.固体NH 4HS 和任意量的H 2S 及NH 3气体混合物组成的系统到达平衡: 〔1〕)求该系统组分数和自由度;〔2〕假设将NH 4HS 放在一抽空容器内分解,平衡时,其组分数和自由度又为多少? 解:〔1〕3,1,0,=2,=2SR b f ===Φ〔2〕3,1,1,=2,=1S R b f ===Φ3.已知Na 2CO 3(s)和H 2O(1)可形成的水合物有三种:Na 2CO 3·H 2O (s),Na 2CO 3·7 H 2O (s)和Na 2CO 3·10 H 2O (s),试问: 〔1〕在101325 Pa 下,与Na 2CO 3水溶液及冰平衡共存的含水盐最多可有几种? 〔2〕在293.15 K 时,与水蒸气平衡共存的含水盐最多可有几种?解:〔1〕设最多有x 种含水盐,则 2,,0,=2+,1S x R x b x n =+==Φ=由相律得2(2)110f x x =-++=-≥ ,所以,1x ≤。
第九章相律与相图复习思考题1.什么是独立组元数?独立组元数与物种数有何区别和联系?2.试以NaCl和水构成的体系为例说明体系的物种数可以随考虑问题的出发点和处理方法而有所不同,但独立组元数却不受影响。
3.“单元系的相数一定少于多元系的相数,一个平衡体系的相数最多只有气、液、固三相。
”这个说法是否正确?为什么?4.水和水蒸气在363 K平衡共存,若保持温度不变,将体积增大一倍,蒸气压将如何改变? 5.什么是自由度?自由度数是否等于体系状态的强度变量数?如何理解自由度为零的状态? 6.将CaCO3置于密闭真空容器中加热,以测定其分解压强,问CaCO3的用量是否需精确称量?若CaCO3量过少可能会发生什么现象?7.固体盐NaCl、KCl、NaNO3、KNO3的混合物与水振荡直至平衡,求体系的独立组元数和自由度数。
8.“I2在水和CCl4间的分配平衡,当无固态I2存在,C=3-1=2,Φ=2,因此其自由度f=2-2+2=2,当温度及压强一定时,则溶液的浓度一定。
”此分析对否?为什么?9.在图12—2所示的A—B二元系蒸气压—组成图中,N、c、d和e等点中哪些是相点哪些是体系点?10.由给定温度下的二元系p-x图可知,两相平衡时f=2-2+1=1,因此若指定压强,组成就一定,为何在上题中c点的组成仍能在d、e之间变化呢?11.二液体组元若形成恒沸混合物,试讨论在恒沸点时组元数、自由度数和相数各为多少? 12.“二元溶液缓慢冷却凝固时,不论体系组成为何值,也不论体系属何种类型,其凝固过程都是在一定温度范围内完成。
”这种说法对吗?为什么?13.实验室中有时用冰盐混合物做制冷剂。
试解释当把食物放入273.15 K的冰水平衡体系中时,为何会自动降温?降温的程度是否有限度?为什么?这种制冷剂最多可有几相共存?习题1.试计算下列平衡体系的自由度数:(1) 298.15 K、101 325Pa下固体NaCl与其水溶液平衡;(2) I2(s) I2(g);(3) NaCl(s)与含有HCl的NaCl饱和溶液。
(答案:①0,②1,③3)解:(1) K = 2, R = 0, b = 0, φ= 2∴C = K-R-b = 2, 又T, p已指定∴f = C -φ+ n = 2- 2 + 0 = 0(2) K=1, R = 0, b = 0, φ=2∴C = K-R-b =1- 0- 0 =1则f = C -φ+ n = 1- 2 + 2 = 1(3) K=3, R = 0, b = 0, φ=2则C = K-R-b =3–0–0 = 3∴f = C -φ+ n =3- 2 + 2 = 32.固体NH4HS和任意量的H2S及NH3气体混合物组成的体系按下列反应达到平衡:NH4HS(s) NH3(g)+H2S(g)(1) 求该体系组元数和自由度数;(2) 若将NH4HS放在一抽空容器内分解,平衡时,其组元数和自由度数又为多少?(答案:①2,2,②1,1)解:(1) K=3, R = 1, b = 0, φ=2∴C = K-R-b =3 -1- 0 = 2 即体系组元数为2而体系的自由度数f = C -φ+ n = 2 – 2 + 2 = 2(2) K=3, R = 1, b = 1, φ=2∴该体系平衡时的组元数C = K-R-b =3 – 1 – 1 = 1而体系的自由度数 f = C -φ+ n = 1- 2 + 2 = 13.求下列体系的组元数和自由度数:(1) 由Fe(s)、FeO(s)、C(s)、CO(g)、CO2(g)组成的平衡体系;(2) 由Fe(s)、FeO(s)、Fe3O4(s)、C(s)、CO(g)、CO2(g)组成的平衡体系;(3) Na2SO4水溶液,其中有Na2SO4(s)、H2O、H+ 和OH-;(4) 已知Na2SO4水溶液中有+、、(l)、(s)、H+ 和OH-。
(答案:①3,1,②3,1,③2,2,④2,2)解:(1) K = 5 而体系中的化学元素为3种∴该体系的独立化学平衡数R = 5-3 = 2此时b = 0,体系的组元数C = K-R-b = 5 – 2 – 0 = 3φ= 4,因此,自由度数f = C -φ+ n = 3 – 4 + 2 = 1(2) K = 5 同上理R = 5-3 = 2,而b = 0∴体系的组元数C = K-R-b = 5 – 2 – 0 = 3φ= 4,因此,自由度数f = C -φ+ n = 3 – 4 + 2 = 1(3) K = 4 R = 1 b = 1∴C = 4 – 1 – 1 = 2,φ= 2f = C -φ+ n = 2 - 2 + 2 =2(4) K = 6 R = 2 b = 2∴C = 6 –2 – 2 = 2,而φ= 2∴f = C -φ+ n = 2 - 2 + 2 = 24.已知Na2C O3(s)和H2O(l)可形成的水合物有三种:Na2CO3·H2O(s),Na2CO3·7H2O(s)和Na2CO3·10H2O(s)试问:(1)在101 325 Pa下,与Na2CO3水溶液及冰平衡共存的含水盐最多可有几种?(2)在293.15 K时,与水蒸气平衡共存的含水盐最多可有几种?(答案:①1,②2)解:(1) 设最多有x种含水盐,则K = 2 + xR = x,b = 0 ∴C = K-R-b = 2 + x- x – 0 = 2又φ= 2 + x n = 1∴由相律f = C -φ+ n得:f = 2- (2+x) +1 = 1-x而f≥0 ∴x≤1即最多只能有一种含水盐与之共存。
(2) 同上理K = 2 + x,R = x,b = 0∴C = K-R-b = 2 + x- x – 0 = 2,而φ= 1 + x,n = 1∴f = 2- (1+x) +1 = 2-x而f≥0 ∴x≤2即最多有两种含水盐与水蒸汽平衡共存。
5.固态氨的饱和蒸气压与温度的关系可表示为;液体氨为,试求:(1) 三相点的温度及压强;(2) 三相点时的蒸发热、升华热和熔化热。
(答案:⑴195..17K,2.17Pa,⑵5204.56,6379.33,1174.77 J·mol-1)解:(1)在三相点处液氨对应的饱和蒸气压应与固氨对应的饱和蒸气压相等,故有:解得:T =195.17K = 77.90℃将所求温度数据代入任意一个饱和蒸气压与温度的关系式可解得:(2) 由克-克公式:与题目所给关系式相比较可得:,6.CCl4的蒸气压和SnCl4的蒸气压在不同温度时的测定值如下: /K/kPa/kPa(1) 假定这两个组元形成理想溶液,绘出其沸点—组成图。
(2) CCl4的摩尔分数为0.2的溶液在101.325 kPa下蒸馏时,于多少摄氏度开始沸腾?最初的馏出物中含CCl4的摩尔分数是多少?(答案:(2) 约为376.5K,0.42)解:(1) ∵两组元形成理想溶液,∴,考虑是沸点-组成图,∴故液相中SnCl4组成与和的关系为: (1)而气相中SnCl4组成与压强的关系为:(2)按题目所给不同温度下和的值代入(1)和(2)式,可得不同温度下气相、液相组成值如下:T / K350353363373383387x200.13150.46930.72400.9279 1.000y200.04460.22350.47350.8217 1.000按上面数据作图如下:(2) 从图上找到,即处对应点可得此体系沸点为:T=376.5K馏出物含CCl4量为:7.下列数据为乙醇和乙酸乙酯在101.325 kPa下蒸馏时所得,乙醇在液相和气相中摩尔分数为x和y。
/K(1) 依据表中数量绘制T—x图。
(2) 在溶液成分x(C2H5OH)=0.75时最初馏出物的成分是什么?(3) 用分馏塔能否将x(C2H5OH)=0.75的溶液分离成纯乙醇和纯乙酸乙酯?= 0.64,(3) 不能)(答案:(2) y乙醇解:(1) 制图如下:(2).如图所示,溶液成分x(C2H5OH) = 0.75时,最初馏出物的成分为y(C2H5OH) = 0.64的混合气体。
(3).因为x(C2H5OH) = 0.75落在恒沸组成x(C2H5OH) = 0.462和纯乙醇之间,所以用分馏塔只能从改组成溶液分离出纯乙醇,而不能得到纯乙醇乙酯。
8.由Mg—Si系的冷却曲线得到下列结果:(2) 冷却含硅85% 的熔体5 kg至1 473 K时可得多少纯硅?(答案:(2) 约为2.1kg)解:(1) 作图如下:化合物含Si量为37%(wt),所以,含Mg量为63%(wt),而Si和Mg的相对原子量分别为28.09和24.31,故此化合物中Si和Mg的摩尔数为:n Si = 37/28.09 =1.3172mol,n Mg = 63/24.31 = 2.5915mol因此n Si:n Mg = 1: 2,故此化合物化学式为Mg2Si。
(2) 按杠杆规则有W b ·= W c·而= 85-74.2 =10.8 =100-85 =15 W b+ W c = 5联立求解方程组:10.8 W b=15W cW b+ W c=5得:W c=2.093kg 即可得纯硅约2.093kg9.NaCl—H2O二元系在252 K时有一个共晶点,此时冰、NaCl·2H2O(s)和质量分数为22.3% 的NaCl水溶液平衡共存。
在264K时NaCl·2H2O分解成无水NaCl和27% NaCl水溶液,已知无水NaCl在水中的溶解度受温度的影响不大。
(1)试绘出相图,并标明各相区的稳定相。
(2)在冰水平衡系中加入固态NaCl做制冷剂,可获得最低温度多少摄氏度?(3)若1 kg质量分数28% NaCl水溶液由433 K冷到264 K,最多能析出纯NaCl多少? (答案:(2) 252K,(3) 约为13.7g)解:作图如下:∵NaCl的相对分子量为58.44,水的相对分子量为18.016∴NaCl·2H2O中NaCl所占重量百分数为:58.44/(58.44+18.016×2) = 61.9%冰的溶点为273.15K。
(2) 此时就是向(I)区加入NaCl,则溶液中NaCl浓度提高,其组成-温度线将下降至共晶点,所以可获得最低温度为252K。
(3)按杠杆规则有W b ·= W c·,而=28-27=1,=100-28=72,又W b+ W c=1∴解得:W c = 0.0137kg,即可得纯硅约13.7g10.(1)试标明图12—8相图中各区的稳定相;(2)图中两条水平线分别表示哪些相平衡;(3)画出体系点x、y及M的冷却曲线。