华南理工大学有机化学考前复习重点
- 格式:ppt
- 大小:549.00 KB
- 文档页数:3


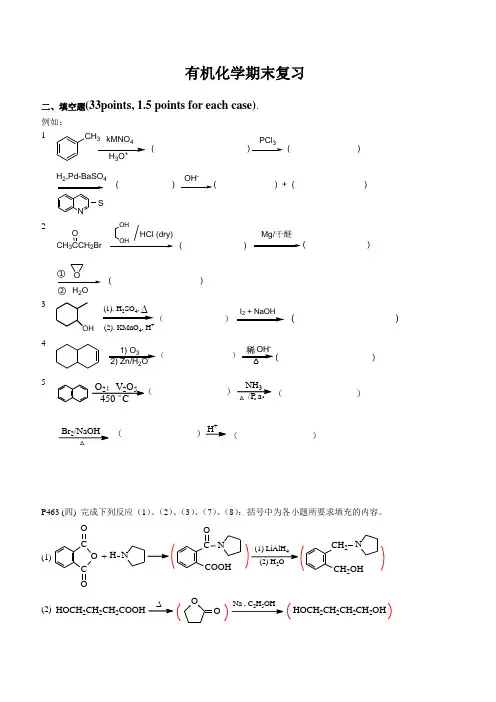
有机化学期末复习二、填空题(33points, 1.5 points for each case). 例如: 1CH 3kMNO43+( )PCl 3( )H 2,Pd-BaSO 4NS( )OH -2CH 3CCH 2BrMg/干醚HCl (dry)OH OHO H 2OO( )( )( )①②3OH(1). H SO ,∆(2). KMnO 4, H+))(41) O 32) Zn/H 2O- )5NH 3/P a Br 2/NaOHH +△△..O 2;V 2O 5 C 。
450( ( )( )( )P463 (四) 完成下列反应(1)、(2)、(3)、(7)、(8):括号中为各小题所要求填充的内容。
(1)C O CO ONH +COOHCON 4(2) H 2OCH 2OHCH 2N(2) HOCH 2CH 2CH 2COOH25∆OOHOCH 2CH 2CH 2CH 2OH(3)CH 2=C COOHCH 3323CH 2=CCOClCH 3CH 2=C COOCH 2CF 3CH 3(7)C NH CO O22COOHNH 2(8)COOHCHOCOClH , Pd-BaSO 3P509,15.15 写出下列季铵碱受热分解时,生成的主要烯烃结构。
P522,15.23 完成下列反应式。
P527,(八) 写出下列反应的最终产物:(1) CH 2ClNaCNLiAlH 4(CH 3CO)2O(CH 2CH 2NHCOCH3)(2)NO Fe, HCl22NO (CH 3)2N )(3)CH 3(CH 2)2CH=CH HBr ROORCN Na CO OH 2O, HO -( CH 3(CH 2)2CH 2CH 2NH 2 )(4)O322N(CH 3)2O)P616,20.2 写出下列反应式中(A )~ (H)的构造式。
三、选择题(反应快慢,鉴别试剂,物质的稳定性,能否发生某种反应等) 例如:P404,11.8 指出下列化合物中,哪个可以进行自身的羟醛缩合。

一、系统命名烷烃、烯烃(Z,E命名)、炔烃、醇、醚、酚、酮、羧酸及衍生物、胺、季铵盐及碱等。
烯烃:编号(从靠近双键的一端开始);炔烃:“炔”字放在最后,主链碳数在烯中体现出来。
当从两侧起,双键、叁键处于相同位置时,则应选择使双键的位置较小的编号方式。
芳烃:如果苯环上连接的两个取代烷基不同时,选取最简单碳原子相连的烷基为1位,然后将其它烷基的位次按尽可能小的方向对苯环编号。
二、变化规律有机化合物熔点、沸点的变化规律:芳烃:沸点随相对分子质量的增大而升高。
自由基的稳定性:单原子自由基如CL-,BR- I-取决于电负性和非金属性大小,如越大则越不稳定;有机分子中的自由基稳定性由取代基和分子空间构型决定,如甲基越多越稳定,苯基>CH3->C2H5->NH2->NO2-;空间构型越对称越稳定如:四苯基正碳离子>甲基正碳离子;有电子离域效应的比没有的稳定,如:丙烯基>C2H5-。
碳正离子的稳定性:1.如果连接烷基、H等,由于碳正离子是Sp2杂化,有空的p轨道,会和烷基的C-Hsigma 形成超共轭,进而分散碳正离子的电荷,使之稳定。
所以,连接的烷基越多越稳定,即叔碳正离子>仲碳正离子>伯碳正离子>甲基。
2.如果连接的卤素,以Cl为例,cl的电负性大于c,有吸电子的诱导,同时是2s2 2px2 spy2 2pz,即有未成对电子,有碳正离子是Sp2 杂化,有空的p轨道,cl未成对的电子可以到空轨道上去,则可以分散正电荷,总的效果是使碳正离子更不稳定。
3如果是烯丙型和苄基型的碳正离子,由于p-pai共轭,可以分散电荷,是碳正离子更稳定烯烃及炔烃加氢反应和亲电加成反应速度的变化规律:双键上电子云密度越高则反应越快,即烯烃上若有给电子基团反应迅速,反之电子云密度越低则反应越慢烯烃双键碳原子上连接烷基越多,亲电加成反应的速率越快不同卤代烃亲核取代反应速度的变化规律:伯卤代烃<仲卤代烃<叔卤代烃酚的酸性变化规律:当苯环上带有吸电子基团时,苯酚电离后的苯氧基负离子更稳定,即三硝基苯酚大于二硝基苯酚,大于单硝基苯酚但是必须在邻对位上的,硝基的吸电子性强于卤带基团烷基是供电子基团,使得苯氧基负离子不稳定,难以电离取代基的诱导效应,吸电子基越强,酸性越大。

2024高考化学有机物知识点总结化学是高考理科中的一门重要科目,而有机化学又是化学的重要分支。
掌握好有机化学的知识点对于考取高分至关重要。
下面是对____高考化学有机物知识点的总结,希望对你的复习有所帮助。
第一节烷烃知识点1:烷烃的命名1. 按照碳原子数命名2. 按照分支取代基命名3. 取代基的优先级顺序:取代基个数多的优先级高,相同个数时按字母顺序知识点2:烷烃的性质和反应1. 高熔点、高沸点、不溶于水、与氧气反应有剧烈的燃烧2. 合成醇类:通过卤代烷和水反应生成醇3. 催化裂化制取乙烯:将重质烃在催化剂的作用下分解为轻质烃和乙烯知识点3:烷烃的衍生物1. 烷基:烷烃的一个氢原子被取代基取代2. 卤代烷:烷烃中的一个氢原子被卤素原子取代3. 烷基卤代烷:烷烃中的一个氢原子被卤代烷中的烷基取代第二节烯烃知识点1:烯烃的命名1. 碳原子数多的烯烃命名方法与烷烃相同2. 碳原子数少的烯烃命名方法:前缀+炔烃知识点2:烯烃的性质和反应1. 反应性活泼,容易发生加成反应和聚合反应2. 反应较烷烃活泼,但较炔烃迟钝3. 烯烃的燃烧和加氢反应产生烷烃第三节炔烃知识点1:炔烃的命名1. 碳原子数多的炔烃命名方法与烷烃相同2. 碳原子数少的炔烃命名方法:前缀+炔烃知识点2:炔烃的性质和反应1. 炔烃的燃烧产生大量的热和光2. 炔烃发生卤代反应生成卤代烃3. 炔烃可以通过与水反应生成醇4. 炔烃与卤酸反应生成酸第四节卤代烷知识点1:卤代烷的命名1. 一卤代烷:前缀+卤素原子名+烷2. 多卤代烷:前缀+卤素原子数+烷知识点2:卤代烷的性质和反应1. 反应活泼,容易发生酯化反应、醇化反应等2. 与碱反应:生成对应的醇和碱盐3. 与氨水反应:生成胺类物质第五节醇的基础知识知识点1:醇的命名1. 一元醇命名:前缀+醇2. 多元醇命名:前缀+醇+次级前缀知识点2:醇的性质和反应1. 高沸点、高熔点、易溶于水2. 有醇燃性:在氧气中可燃烧,产生水和二氧化碳3. 醇的酸碱性:可与金属反应生成金属醇盐,可与氢氧化钠反应生成醇盐4. 醇的醚化反应:在酸性条件下,醇可以与醚酸酸化成醚水。

高考有机题必考知识点有机化学是高考化学考试中的重点内容,也是考生普遍认为难度较大的一部分。
为了帮助考生更好地复习和应对有机题,下面将列举高考有机题必考的知识点,并进行逐一梳理,以期帮助考生在考试中取得好成绩。
一、有机物命名高考有机题中,通常会涉及有机化合物的命名。
在进行有机物命名时,需要掌握以下几个基本原则:1. 确定主链:找到分子中最长的一条连续的碳链,以该碳链作为主链,并按照碳链上官能团的位置进行编号。
2. 确定官能团:根据分子结构中存在的官能团,进行命名。
常见的官能团有醇、醛、酮、酸等。
3. 选择前缀:根据官能团的种类和位置,选择相应的前缀进行修饰。
4. 选择后缀:根据官能团的种类,选择相应的后缀表示官能团。
5. 确定取代基:如果分子中有取代基,需要对其进行编号和命名。
6. 总结:将以上步骤综合运用,给予有机化合物一个准确、简明的名称。
二、有机反应高考有机题中,也会考察有机反应的特点、类型和具体的反应方程式。
以下为高考有机题中常见的反应类型:1. 加成反应:指多个分子结合形成一个分子的反应。
例如烯烃与卤素的加成反应,生成卤代烷。
反应方程式如下所示:C2H4 + Br2 → C2H4Br22. 消除反应:指一个分子断裂出去形成两个或多个分子的反应。
例如醇的脱水反应,生成烯烃。
反应方程式如下所示:C2H5OH → C2H4 + H2O3. 取代反应:也称为置换反应,指一个原子或基团被另一个原子或基团所取代的反应。
例如烃类的卤代反应,生成卤代烃。
反应方程式如下所示:CH4 + Cl2 → CH3Cl + HCl4. 缩合反应:指两个或多个分子结合形成一个大分子的反应。
例如醛酮的缩合反应,生成β-羟基酮。
反应方程式如下所示: CH3CHO + CH3C OCH3 → CH3C(O)CH2C(O)CH3 + H2O三、有机化合物的性质和应用除了命名和反应,高考有机题还会涉及有机化合物的性质和应用。
以下是一些常见的有机化合物及其性质和应用:1. 烃:烃是由碳和氢组成的化合物,按照分子中碳原子的连接方式可分为直链烃、支链烃和环烃。

有机化学基础复习提纲一、烯烃和炔烃:-C — -C C —1、氧化反应CnH 2n+()O 2nCO 2+nH 2OCnH 2n-2+()O 2nCO 2+(n -1)H 2O②能使溴水和酸性KMnO 4溶液褪色。
2、加成反应:可与H 2 、HX 、 H 2O 、 HCN 加成。
完成下列反应: RCH=CHR /+XRCH CHR /+X 2RCH CHR /+2X与HX 加成时,H 加在含H 较多的C 上。
即马氏规则。
3、加聚反应: nCH 2=CH 2nCH 2=CH-CH=CH 2CH CH + HClnCH 2=CHCl4、结构特点及实验室制取制CH2=CH2的反应原理:同类反应:RCH 2CH 2OHRCH=CH 2 + H 2O制CH CH 的反应原理:同类反应:ZnC 2+2H 2O Zn(OH)2+C 2H 2↑ Mg 2C 3+4H 2O2Mg(OH)2+C 3H 4↑(复分解反应原理,元素化合价不变)原子空间结构特点:与碳碳双键碳直接相连的原子与双键碳在同一个平面上;与碳碳三键直接相连的原子与三键碳在同一条直线上。
5、特殊物质:1,3-丁二烯: CH 2=CH —CH=CH 2 异戊二烯: CH 2=C —CH=CH 2二、苯及其同系物通式:CnH 2n -6 (n ≥6)苯:C 6H 6 正六边形,与苯环直接相连的原子与苯环碳在同一平面内。
性质:1、取代反应:A 、溴代反应:液溴、Fe 作催化剂(或FeBr 3作催化剂)+ Br 2B 、硝化反应:浓HNO 3 浓H 2SO 4 水浴加热+ HNO 3 +3HNO 3注:发生在邻、对位上的取代。
C 、磺化反应:浓硫酸、水浴加热 +H 2SO 4(浓)X 2发生取代反应时,若光照条件则发生在侧链上,若催化条件则发生在苯环上。
+Cl +HCl+Cl 2+HCl2、加成反应(只与H 2 、Cl 2加成) +3H 23、氧化反应:A 、燃烧生成CO 2和H 2OB 、苯不能使酸性KMnO 4溶液褪色,苯的同系物能使KMnO 4/H +褪色,但不能使溴水褪色。

物质代谢(合成代谢、分解代谢):从物质代谢来说,新陈代谢包括分解代谢和合成代谢。
分解代谢——生物大分子通过一系列的酶促反应步骤,转变为教小的、较简单的物质的过程。
合成代谢——生物体利用小分子或大分子的结构元件合成自身生物大分子的过程。
能量代谢:在生物体内,以物质代谢为基础,与物质代谢过程相伴随发生的,是蕴藏在化学物质中的能量转化,统称为能量代谢。
一、名词解释高能磷酸化合物:机体内有许多磷酸化合物,当其磷酰基水解时,释放出大量的自由能。
这类化合物为高能磷酸化合物。
高能键:高能磷酸化合物分子中的酸酐键,能释放出大量自由能,称之为“高能键”。
二、高能磷酸键化合物及其他高能化合物的类型(一)磷氧型1、酰基磷酸化合物(1)乙酰磷酸(2)氨甲酰磷酸(3)1,3-二磷酸甘油酸(4)酰基腺苷酸(5)氨酰腺苷酸2、焦磷酸化合物(1)焦磷酸(2)二磷酸腺苷3、烯醇式磷酸化合物磷酸烯醇式丙酮酸(二)氮磷型胍基磷酸化合物(1)磷酸肌酸(2)磷酸精氨酸(三)硫酯键型活性硫酸基(1)3’-腺苷磷酸5’-磷酰硫酸(2)酰基辅酶A(四)甲硫键型活性甲硫氨酸一、名词解释被动运输:指物质从高浓度的一侧,通过膜运输到低浓度的一侧,物质顺浓度梯度的方向跨膜运输的过程,是不需要消耗代谢能的穿膜运输。
主动运输:指物质逆浓度梯度的穿膜运输过程。
需消耗代谢能,并需专一性的载体蛋白。
协同运输:小分子的跨膜运送大都是通过专一性运送蛋白的作用实现的。
如果只是运输送一种分子由膜的一侧到另一侧,称为单向运输;如果一种物质的运输与另一种物质的运输相关而且方向相同,称为同向运输。
方向相反则称为反向运输,这二者又统称为协同运输。
Na+,K+—泵:Na+、K+-泵实际是分布在膜上的Na+、K+-ATP酶。
通过水解ATP提供的能量主动向外运输Na+,而向内运输K+ 。
每水解1分子ATP,向外运输3个Na+,而向内运输2个K+ 。
Ca+—泵:Ca2+泵即为Ca2+-ATP酶,Ca2+泵主动运送Ca2+到膜内是通过水解ATP提供的能量驱动的。

大学有机化学知识点提纲(一)绪论共价键价键理论(杂化轨道理论);分子轨道理论;共振论。
共价键的属性:键能;键长;键角;键的极性。
键的极性和分子极性的关系;分子的偶极矩.有机化合物的特征(二)烷烃和环烷烃基本概念烃及其分类;同分异构现象;同系物;分子间作用力;a键,e键;构型,构象,构象分析,构象异构体;烷基;碳原子和氢原子的分类(即1,2,3碳,氢;4碳);反应机理,活化能.对于基本概念,不是要求记住其定义,而是要求理解它们,应用它们说明问题.命名开链烷烃和环烷烃的IUPAC命名,简单的桥环和螺环的命名。
烷烃和环烷烃的结构碳原子sp3杂化和四面体构型;环烷烃的结构(小环的张力)。
烷烃的构象开链烷烃的构象,能量变化;环烷烃的构象:重点理解环己烷和取代环己烷的构象及能量变化,稳定构象,十氢萘及其它桥环的稳定构象。
烷烃的化学性质自由基取代反应-卤代反应及机理;碳游离基中间体-结构,稳定性;不同的卤素在反应中的活性和选择性;反应过程中的能量变化.环烷烃的化学性质自由基取代反应(与烷烃一致);小环(3,4元环)性质的特殊性—加成。
(三)烯烃烯烃的结构特点碳的sp2杂化和烯烃的平面结构;键和键。
烯烃的同分异构,命名碳架异构,双键位置异构,顺反异构(Z,E)。
烯烃的物理和化学性质烯烃的亲电加成及其机理,马氏规则;碳正离子中间体—结构,稳定性,重排。
其它加成反应:催化加氢(立体化学,氢化热);硼氢化—氧化(加成取向,立体化学);羟汞化—脱汞(加成取向);与HBr/过氧化物加成(加成取向);其它游离基加成。
氧化反应:羟基化反应—邻二醇的形成;KMnO4/H+的氧化,臭氧化反应,烯烃结构的测定。
α-位取代反应:烯丙基型取代反应(高温卤代和NBS卤代)及机理—烯丙基自由基。
(四)炔烃和二烯烃炔烃①结构:碳的sp杂化和碳—碳三键;sp杂化,sp2杂化和sp3杂化的碳的电负性的差异及相应化合物的偶极矩。
②同分异构体③化学性质:末端炔烃的酸性及相关的反应;三键的加成:催化加氢,亲电加成,亲核加成;碳—碳三键与H2/Lindlar催化剂反应(顺式烯烃);碳—碳三键与Na/液氨的反应(反式烯烃);加卤素;加HX(马氏规则);加H2O(羰基化合物的形成);加HBr/过氧化物;硼氢化—氧化;加HCN及乙炔的二聚;氧化反应:KMnO4氧化和臭氧化。

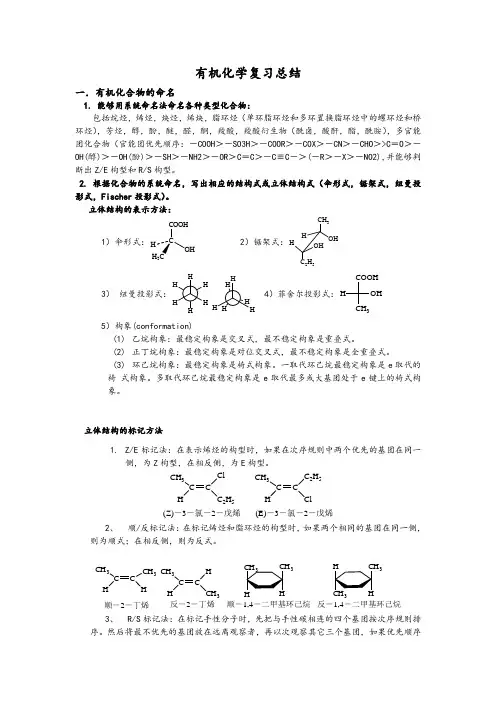
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOH3 2)锯架式:CH 3OHHHOH C 2H 53)纽曼投影式:4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C H C 2H 5CH 3C CH 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3CCH CH 3HCH 3CC H HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
高考有机化学必考知识点高考有机化学是高中化学知识的深化和拓展,是考查学生对有机化学基本概念、反应机理和实际应用的理解和掌握程度。
以下是高考有机化学的必考知识点和相关参考内容。
1. 有机物的命名和结构:- 碳骨架的命名规则(直链、支链、环状化合物的命名)- 功能团的命名(羟基、醛基、酮基、羧基等)- 通过结构式确定化合物的分子式和结构式参考内容:- 有机化学常用名称列表,包括直链烷烃、醛类、酮类等的常用名称和结构式。
- 结构式命名规则的详细说明,包括直链、支链、环状化合物的命名原则和示例。
2. 化学键和分子构象:- 化学键的类型和性质(共价键、极性共价键、离子键)- 极性分子和非极性分子的判断- 分子构象(平面构象和空间构象)、立体异构体(构造异构体和空间异构体)的概念和判断方法参考内容:- 共价键和离子键的形成原理和性质的说明。
- 极性分子和非极性分子的判断方法和例子。
- 分子构象和立体异构体的详细解释和实例。
3. 有机反应和反应机理:- 有机反应的类型(加成反应、消失反应、取代反应、氧化还原反应等)- 有机反应的官能团转化(羟基、氨基、氯基等的官能团转化)- 有机反应的机理(电子推动效应、亲电试剂和亲核试剂的介绍)- 有机反应的条件(酸性条件、碱性条件、温度和催化剂的影响)参考内容:- 不同类型有机反应的分类和说明,包括加成反应、消失反应、取代反应等的详细介绍和实例。
- 有机反应的机理图解,解释电子推动效应、亲电试剂和亲核试剂的原理。
- 常见有机反应的条件和影响因素的总结。
4. 有机物的合成和应用:- 有机物的合成方法(醇的合成、醛的合成等)- 有机物的应用(醇的应用、醛的应用等)- 有机物的结构与性质的关系参考内容:- 有机物合成方法的类型和举例,包括醇的合成、醛的合成等的详细说明和实例。
- 有机物的应用领域和实际应用,包括醇的应用、醛的应用等的介绍和实例。
- 有机物结构与性质关系的解释和相关例子。
有机化学总复习知识要点一览一、 碳原子的成键原则1、 饱和碳原子与手性碳原子;2、不饱和碳原子;3、苯环上的碳原子。
应用①利用“氢1,氧2,氮3,碳4”原则分析有机物的键线式或球棍模型;②利用“手性碳原子”的特点分析有机物结构中的手性碳原子或书写含手性碳原子的有机物结构。
二、 官能团的重要性质1、 C=C :①加成(H2、X 2或HX 、H 2O );②加聚(单聚、混聚);③氧化延生C ≡C2、:①取代(卤代,硝化,磺化);②加成(H 2)延生①引入氨基:先引入22NH NO ——还原−−→− (还原剂是Fe +HCl ) ②引入羟基:先引入OH ONa X-−−→−-−−→−-酸化水解③引入烃基: R RCl AlCl-−−→−+3 ④引入羧基:先引入烃基COOH R KMnO-−−−→−-4酸性 4、R —X :OH NaX CH CH R NaOH X CH CH R NaX OH R NaOH X R O H 22/22/;2++=-−−→−+--+-−−→−+-醇溶液卤元素检验:NaOH 水或醇溶液-加热-冷却-稀硝酸酸化-硝酸银5、醇羟基: O H CH CH R OH CH CH R OH ONO R ONO H OH R OH OR CO R COOH R OH R COOHR CHO R OH CH R O H X R HX OH R H ONa R Na OH R O O 22222222//,22222;222+=-−−−→−--+-−−−→−-+-+--−−−→−-+--−−−→−-−−−→−-+-−→−+-↑+-−→−+-∆∆∆∆浓硫酸,浓硫酸,浓硫酸,催化剂,催化剂多个羟基遇Cu(OH)2溶液呈绛蓝色6、酚羟基:①与Na ,NaOH ,Na 2CO 3反应2 —OH+2Na →2 —ONa +H 2↑—OH + H 2O —O - + H 3O +—OH +NaOH → ─ONa +H 2O─OH +Na 2CO 3→ ─ONa +NaHCO 3注意酚与NaHCO 3不反应。
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3CH2)锯架式:CH 3OHHH OH C 2H 53) 纽曼投影式:HHH H H HHH H HHH 4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C C H Cl C 2H 5CH 3C CH C 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3CCH CH 3HCH 3CC H HCH 3顺-2-丁烯反-2-丁烯CH 3H CH 3HCH 3H HCH 3顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOHOH3 2)锯架式:CH 3HH OH C 2H 53)纽曼投影式:4)菲舍尔投影式:COOH3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C C H C 2H 5CH 3C CH 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3CCH CH 3HCH 3CC H HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
有机化学考试重点一、命名烷烃,烯烃(顺/反和Z/E 命名),环烷烃(顺/反),桥环化合物,螺环化合物,多取代苯,萘衍生物,某些含氧衍生物的俗名(如巴豆醛、肉桂醛、水杨酸、茴香醚、马来酸酐、苦味酸、石炭酸),胺,偶氮化合物,杂环化合物,α-D-(+)葡萄糖和β-D-(+)葡萄糖的构象式和哈武斯式,化合物的R/S 命名。
需要记住:官能团的优先顺序表(用于找主官能团)和取代基的次序规则(用于比较取代基的大小)。
二、要求回答下列问题(共20分)(包括单项选择5分、排序10分、反应历程5分) 1、分子量相近的物质的熔沸点、溶解度的变化规律:熔沸点:羧酸(多元醇) > 醇 > 胺~醛酮 > 醚 ≥ 烷烃 (看极性大小、能否形成分子间氢键)溶解度:多元醇> 醇 >醛酮 > 醚 ≥ 烷烃 (看极性大小、与水能否形成氢键)2、有机活泼中间体的稳定性(包括正碳离子、负碳离子、自由基)P71: 正碳离子:CH 2=CHCH 2+(PhCH 2+)≥3°>2°>1°>CH 3+ 自由基:CH 2=CHCH 2·(PhCH 2·)≥3°>2°>1°>CH 3· 负碳离子:CH 2=CHCH 2-(PhCH 2-)>CH 3->1°>2°>3°。
何为3°(叔) 2°(仲) 1°(伯):3°有3个碳与被考察原子(正碳离子)相连;2°有2个碳与被考察原子(正碳离子)相连;1°有1个碳与被考察原子(正碳离子)相连 3、取代环己烷的稳定构象(优势构象)(命名或写结构式)。
顺式表示取代基取代相同方向的氢;反式表示取代基取代相反方向的氢。
位于e 键的取代基越多越稳定 4、手性碳和手性分子:1)会判断哪些分子具有手性;判断方法: 先找手性碳原子,若有一个手性碳原子一定为手性分子;若有2个以上手性碳原子则需要看有无对称面、对称中心,若无则为手性分子。