第一章 钒的基础知识
- 格式:ppt
- 大小:1.13 MB
- 文档页数:88


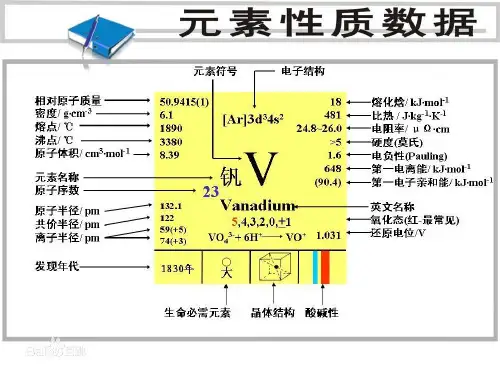
钒钒:元素符号V,银白色金属,在元素周期表中属VB族,原子序数23,原子量50.9414,体心立方晶体,常见化合价为+5、+4、+3、+2。
钒的熔点很高,常与铌、钽、钨、钼并称为难熔金属。
有延展性,质坚硬,无磁性。
具有耐盐酸和硫酸的本领,并且在耐气-盐-水腐蚀的性能要比大多数不锈钢好。
于空气中不被氧化,可溶于氢氟酸、硝酸和王水。
钒能分别以二、三、四、五价于氧结合,形成四种氧化物,一氧化钒(VO )三氧化二钒(v2o₃),二氧化钒,五氧化二钒三氧化二钒灰黑色结晶或粉末。
不溶于水,溶于硝酸、氢氟酸、热水。
在空气中慢慢吸收氧而转变为四氧化二钒。
在空气中加热猛烈燃烧。
在空气中慢慢吸收氧而转变为四氧化二钒。
在空气中加热猛烈燃烧。
为强还原剂制备:1、由氢、碳或一氧化碳还原五氧化二钒制得,或在1750℃下热分解五氧化二钒、在隔绝空气下煅烧钒酸铵制得。
[3]2、、将由偏钒酸铵热分解生成的无定形五氧化二钒在纯化的氢气流中,于600℃下还原2h(V2O5的熔点为690℃,温度不能超过此熔点),再在900℃下继续还原5~6h。
将生成物的一部分用碱熔融之后溶解于稀硫酸中,用过氧化氢进行氧化还原滴定,就可以知道得到的产品为VO1.506。
将此产品再在1250℃还原4h,则变为V2O3。
[4]3、、该发明公开了一种三氧化二钒的生产方法,是把一定粒度的钒酸铵或五氧化二钒连续地加入外热式容器中,在其容器中通入工业煤气。
通过外加热使容器内高温区达到500~650℃,使炉料通过此温度区域发生还原反应15~40分钟,使其分解还原为三氧化二钒。
冷却炉料至100℃以下出炉。
该方法的优点是大大降低了还原温度;缩短了还原时间;降低了生产的成本。
二氧化钒深蓝色晶体粉末,单斜晶系结构。
密度4.260 g/cm3。
熔点1545 ℃。
不溶于水,易溶于酸和碱中。
溶于酸时不能生成四价离子,而生成正二价的钒氧离子。
在干的氢气流中加热至赤热时被还原成三氧化二钒,也可被空气或硝酸氧化生成五氧化二钒,溶于碱中生成亚钒酸盐。

高考化学工艺流程中的新宠---钒一、认识钒及其化合物钒在周期表中位于第4周期、VB族,属于过渡金属元素,呈浅银灰色,有良好的可塑性和可锻性。
钒具有很高的熔点,用作合金的添加剂。
钒对稀硫酸、稀盐酸、稀磷酸保持相对稳定。
但在硝酸、氟氢酸中溶解。
常见的钒氧化物为+2、+3、+4、+5价的氧化物:VO、V2O3、VO2、V2O5,钒的氧化物从低价(二价)到高价(五价),系强还原剂到强氧化剂,其水溶液由强碱性逐渐变成弱酸性。
低价氧化钒不溶于水,但遇强酸会形成强酸盐如VCl2、VSO4;如遇强碱则形成V(OH)2,V(OH)2水解会放出H2。
1.五氧化二钒V2O5,是钒氧化物中最重要的,也是最常用钒化工制品。
工业上首先是制取NH4VO3,然后加热至500℃,即可制得V2O5。
其反应如下:2NH4VO3→2NH3+H2O+V2O5;另一个方法是用VOCl3水解,反应如下:2VOCl3+3H2O=V2O5+6HCl;在700~1125℃,V2O5存在下列可逆反应:V2O5=V2O5-x+(x/2)O2V2O5是两性化合物,但其碱性弱,酸性强,易溶于碱性构成钒酸盐,强酸也能溶解V2O5。
在酸、碱溶液中,生成物的形态取决于溶液的钒浓度和pH值,当溶液处于强碱性,pH值大于13,则会以VO43-存在,V2O5 + 6OH- == 2VO43- + 3H2O;若处于强酸性溶液中(pH值小于3),则主要以VO2+存在,V2O5 + 2H+== 2VO2+ + H2O;如果处在中间pH值的状态,则会以下列配合物存在:VO3-、HVO42-、V3O93-、V4O124-、V10O286-、V2O74-;V2O5有氧化性:和盐酸反应,生成VOCl2,放出Cl2,V2O5 + 6HCl == 2VOCl2 + Cl2↑+ 3H2;.在强酸中,V(Ⅴ)以VO3+、VO2+形式存在,VO2+具有较强的氧化性,易被SO32-还原为VO2+:2VO2++SO32-=2VO2++SO42-+H2O2.二氧化钒与四氧化二钒四价钒在空气中被缓慢氧化,加热则快速被氧化;四价钒的氧化物也是两性物质,在热酸中溶解形成稳定的VO2+,例如与硫酸形成VOSO4;在碱性溶液中则形成次钒酸盐HV2O5-。
![钒[1]1](https://uimg.taocdn.com/accd31f8c8d376eeaeaa31fb.webp)

钒元素的知识点汇总介绍
钒,元素符号 V,银⽩⾊⾦属,在元素周期表中属VB族,原⼦序数23,原⼦量50.9414,体⼼⽴⽅晶体,常见化合价为+5、+4、+3、+2。
钒的熔点很⾼,常与铌、钽、钨、钼并称为难熔⾦属。
有延展性,质坚硬,⽆磁性。
具有耐盐酸和硫酸的本领,并且在耐⽓、耐盐、耐⽔腐蚀的性能要⽐⼤多数不锈钢好。
室温下致密状态的⾦属钒较稳定,不与空⽓、⽔和碱作⽤,也能耐稀酸。
钒元素
纯的⾦属钒⼀般是⽤钾在⾼压下将五氧化⼆钒还原⽽得到的。
⼤多数钒是其它矿物加⼯时的副产品,1840年,俄罗斯矿物⼯程师苏宾写道“含铜(cu元素)⽣铁、⿊铜、铜锭是含钒合⾦,由于钒的存在,使它们具有较⾼的硬度”⼯业上也可以以铝,焦炭还原五氧化⼆钒⽣产纯钒。
焦炭还原五氧化⼆钒⽣产纯钒是将V2O5粉与⾼纯碳粉混合均匀,加10%樟脑⼄醚溶液或酒精,压块后放⼊真空碳阻炉或感应炉内。
炉内真空压⼒到6.66×10-1Pa后,升温⾄1573K,保温2h。
冷却后将反应产物破碎。
根据第⼀次还原产物的组分再配⼊适量碳化钒或氧化钒进⾏⼆次还原。
⼆次还原炉内的真空压⼒为2.66×10-2Pa,温度控制在1973~2023K之间,并保温⼀段时间。
真空碳还原法所得⾦属钒的成分(质量分数m/%)为:钒99.5,氧0.05,氮0.01,碳0.1。
钒收率可达98%~99%。
铝热还原法是将五氧化⼆钒和纯铝放在反应弹进⾏反应,⽣成钒铝合⾦。
钒合⾦在2063K的⾼温和真空中脱铝,可制得含钒94%~97%的粗⾦属钒。


钒及钒生产工艺第一章钒的性质及应用一、钒的性质:钒是一种十分重要的战略物资,在钢铁、电子、化工、宇航、原子能、航海、建筑、体育、医疗、电源、陶瓷等在国民经济和国防中占有十分重要的位置。
常温下钒的化学性质较稳定,但在高温下能与碳、硅、氮、氧、硫、氯、溴等大部分非金属元素生成化合物。
例如:钒在空气中加热至不同温度时可生成不同的钒氧化物。
在180℃下,钒与氯作用生成四氯化钒(VCl4);当温度超过800℃时,钒与氮反应生成氮化钒(VN);在800~1000℃时,钒与碳生成碳化钒(VC)。
钒具有较好的耐腐蚀性能,能耐淡水和海水的侵蚀,亦能耐氢氟酸以外的非氧化性酸(如盐酸、稀硫酸)和碱溶液的侵蚀,但能被氧化性酸(浓硫酸、浓氯酸、硝酸和王水)溶解。
在空气中,熔融的碱、碱金属碳酸盐可将金属钒溶解而生成相应的钒酸盐。
此外,钒亦具有一定的耐液态金属和合金(钠、铅、铋等)的腐蚀能力。
钒有多种氧化物。
V2O3和V2O4之间,存在着可用通式V n O2n-1(3≤n≤9)表示的同族氧化物,在V2O4到V2O5之间,已知有V3O5、V3O7、V4O7、V4O9、V5O9、V6O11、V6O13等氧化物。
工业上钒氧化物主要是以V2O5、V2O4和V2O3形式存在,特别是V2O5和生产尤为重要。
它们的主要性质列于下表:二、钒的应用三、五氧化二钒的性质V2O5是一种无味、无嗅、有毒的橙黄色或红棕色的粉末,微溶于水(质量浓度约为0.07g/L),溶液呈黄色。
它在约670℃熔融,冷却时结晶成黑紫色正交晶系的针状晶体,它的结晶热很大,当迅速结晶时会因灼热而发光。
V2O5是两性氧化物,但主要呈酸性。
当溶解在极浓的NaOH中时,得到一种含有八面体钒酸根离子VO43-的无色溶液。
它与Na2CO3一起共熔得到不同的可溶性钒酸钠。
第二章五氧化二钒生产工艺方法概述五氧化二钒生产工艺大致历经了70年,通过几代人的不断总结、探讨,已初步形成了不同的生产工艺模式。


化学元素钒1. 引言化学元素钒(vanadium)是一种过渡金属,原子序数为23,元素符号为V。
它在自然界中广泛存在于地壳中,并具有重要的工业应用。
本文将对钒的性质、用途、生产方法以及环境影响进行全面的探讨。
2. 钒的基本性质2.1 物理性质钒是一种银灰色的金属,在常温下呈固态。
它具有高熔点和高沸点,密度较大,是一种相对重的金属。
2.2 化学性质钒具有良好的耐腐蚀性,在常温下不易与氧气、酸、碱发生反应。
然而,在高温和一些特殊条件下,钒可以与氧、氮等元素形成化合物。
3. 钒的用途3.1 钢铁工业钒是一种重要的合金元素,在钢铁工业中广泛应用。
它可以改善钢的硬度、强度和耐磨性,提高钢的耐腐蚀性能,使钢具备更广泛的应用领域。
3.2 催化剂钒及其化合物在催化剂领域有着重要的地位。
氧化钒可以催化一些重要的化学反应,如氨氧化反应、烯烃氧化反应等。
钒催化剂具有高效率、选择性和稳定性的特点,被广泛用于化学工业的生产。
3.3 储能技术随着可再生能源的快速发展,钒电池作为一种储能技术逐渐受到关注。
钒电池具有高能量密度、长寿命、高效率等优点,可以用于储存大规模的电能,为可再生能源的应用提供支持。
3.4 医学应用钒化合物在医学领域有一定的应用。
钒化合物可以用于治疗糖尿病,具有降低血糖和改善胰岛素敏感性的作用。
钒还被用作放射治疗的辅助药物,用于治疗某些恶性肿瘤。
4. 钒的生产方法4.1 矿石提取钒矿石是钒的主要来源,主要含有钒的矿石有钒云母、钒矾石等。
通过矿石选矿、冶炼等工艺,可以提取出纯度较高的钒。
4.2 合成制备除了从矿石中提取钒外,还可以通过化学合成的方法制备钒。
常见的方法有还原法、氧化法等,可以得到不同形态和纯度的钒。
5. 钒的环境影响5.1 生态系统影响钒的广泛应用和生产会对环境造成一定的影响。
钒污染可能导致土壤和水体的污染,对生态系统产生负面影响。
5.2 人体健康影响高浓度的钒对人体健康有一定的危害。
长期接触钒可能导致呼吸系统疾病、消化系统问题等。

钒及钒生产工艺The final revision was on November 23, 2020钒及钒生产工艺第一章钒的性质及应用一、钒的性质:钒是一种十分重要的战略物资,在钢铁、电子、化工、宇航、原子能、航海、建筑、体育、医疗、电源、陶瓷等在国民经济和国防中占有十分重要的位置。
常温下钒的化学性质较稳定,但在高温下能与碳、硅、氮、氧、硫、氯、溴等大部分非金属元素生成化合物。
例如:钒在空气中加热至不同温度时可生成不同的钒氧化物。
在180℃下,钒与氯作用生成四氯化钒(VCl4);当温度超过800℃时,钒与氮反应生成氮化钒(VN);在800~1000℃时,钒与碳生成碳化钒(VC)。
钒具有较好的耐腐蚀性能,能耐淡水和海水的侵蚀,亦能耐氢氟酸以外的非氧化性酸(如盐酸、稀硫酸)和碱溶液的侵蚀,但能被氧化性酸(浓硫酸、浓氯酸、硝酸和王水)溶解。
在空气中,熔融的碱、碱金属碳酸盐可将金属钒溶解而生成相应的钒酸盐。
此外,钒亦具有一定的耐液态金属和合金(钠、铅、铋等)的腐蚀能力。
钒有多种氧化物。
V2O3和V2O4之间,存在着可用通式V n O2n-(3≤n≤9)表示的同族氧化物,在V2O4到V2O5之间,已知有V3O5、1V3O7、V4O7、V4O9、V5O9、V6O11、V6O13等氧化物。
工业上钒氧化物主要是以V2O5、V2O4和V2O3形式存在,特别是V2O5和生产尤为重要。
它们的主要性质列于下表:二、钒的应用三、五氧化二钒的性质V2O5是一种无味、无嗅、有毒的橙黄色或红棕色的粉末,微溶于水(质量浓度约为L),溶液呈黄色。
它在约670℃熔融,冷却时结晶成黑紫色正交晶系的针状晶体,它的结晶热很大,当迅速结晶时会因灼热而发光。
V2O5是两性氧化物,但主要呈酸性。
当溶解在极浓的NaOH中时,得到一种含有八面体钒酸根离子VO43-的无色溶液。
它与Na2CO3一起共熔得到不同的可溶性钒酸钠。
第二章五氧化二钒生产工艺方法概述五氧化二钒生产工艺大致历经了70年,通过几代人的不断总结、探讨,已初步形成了不同的生产工艺模式。
书山有路勤为径,学海无涯苦作舟钒知识钒是高熔点稀有金属,密度5.96,熔点1890℃,沸点3380℃,有韧性,在氢气中加热变脆,含氧和氮的钒也有脆性。
钒是电的不良导体,其电导率仅为铜的十分之一。
室温下,钒不与氧作用,在加热条件下被氧化成VO、V2O3、VO2、V2O5,高温下与多数非金属元素(如氮、碳、硫)发生反应。
钒还能与铝、钴、铜、铁、锰、钼、镍、钯、锡、硅形成合金。
钒的氧化态为- 1、+1、+2、+3、+4、+5,通常+2 和+3 价钒的氢氧化物呈碱性,+4 和+5 价钒的氢氧化物呈两性,+5 价钒在不同酸度的水溶液中形成不同组成的钒酸盐。
在常温下,钒有较好的抗蚀性,能耐盐酸、稀硫酸、碱溶液和海水腐蚀,但能被硝酸、氢氟酸或浓硫酸腐蚀。
钒在地壳中常与其他元素伴生,富集成工业矿床的很少。
主要分散于钒钛磁铁矿、铀矿、磷矿、铝钒土及煤炭中。
钒的矿物主要有绿硫钒矿(V2S+nS)、钒云母〔K2(Mg,Fe)(Al,V)4Si12O324H2O〕、钒铅矿〔PbCl23Pb3VO4〕2〕、钒钾铀矿(K2O2V2O3V2O53H2O)等。
钒矿的分解方法有:①酸法,用硫酸或盐酸处理后得到(VO2)2SO4 或VO2Cl。
②碱法,用氢氧化钠或碳酸钠与矿石熔融后得到NaVO3 或Na3VO4。
③氯化物焙烧法,用食盐和矿石一起焙烧得到NaVO3。
金属钒的制取:含钒的矿物经处理后得到五氧化二钒,再将五氧化二钒用碳、硅、铝还原得到金属钒;或用金属钠、镁还原四氯化钒的方法制取金属钒。
钒是冶金工业的重要原料。
在钢铁中,钒主要是以钒铁的形式加入,主要起脱氧和脱氮的作用,同时可提高钢的强度、韧性、淬透性和回火稳定性。
目前,90%的钒用作钢铁添加成分生产高强度低合金钢、高速钢、工具钢、轴承钢、耐热钢、不锈钢和铸铁等。
钒还用于钛合金、钴和镍基高温合金的添加剂。
人体中的微量元素——钒(V)单元素的生理意义 / 2020-09-12 16:32:09钒是第23号元素,原子量50,94,钒呈浅灰色,在地壳中的含量较丰富,为万分之一,比铜、锡、锌、镍的含量都多,但钒的分布太分散,几乎没有含量较多的矿床。
在海水中,在磁铁矿中,在多种沥青矿物和煤灰中,在落到地球的陨石和太阳的光谱线中,人们都发现了钒的踪影。
可以说,乎所有的地方都有钒。
钒在常温下不会被氧化,即使把它加热到摄氏三百度,它依旧如故,它也不怕水、各种稀酸和稀碱液的腐蚀。
如果说钢是虎,那么钒就是翼,钢含钒犹如虎添翼。
只需在钢加入百分之几的钒,就能使钢的弹性、强度大增,抗磨损和抗爆裂性极好,既耐高温又抗奇寒,在汽车、航空、铁路、电子技术、国防工业等部门,到处可风到钒的踪迹。
此外,钒的氧化物已成为化学工业中最佳催化剂之一,有“化学面包”之称。
看来,凡娜迪丝的“儿子”在人间正大受宠爱。
在元素周期表中,原子序数从23到30的8种元素均为人体必需微量元素,而钒正是23号元素,因此,有人称钒为微量元素的“排头兵”。
钒在人体中的含量约为1. 5毫克,.广泛分布于牙齿、骨骼、脂肪、血液、肺、脾、肝、肾等组织器官中,骨组织及牙齿中含量较高。
钒在胃肠吸收率仅为596,其吸收部位主要在上消化道,此外环境中的钒可以经皮肤和肺吸收。
人体吸收的钒主要通过肾脏从小便中排出。
钒在人体内含量虽然不高,但它在维持人体正常生理功能、预防和控制各种疾病方面有着不可替代的重要作用。
(一)钒的主要生理功能1.钒能促进骨骼和牙齿的形成,促进生长发育。
钒缺乏时,生长发育受阻,脾脏肿大,蛋白质代紊乱。
骨骼发育不正常,生长缓慢,生殖功能受损。
2.钒能预防龋齿。
由于钒离子在牙釉质和牙质内可增加羟基磷灰石的硬度,还可l增加有机物质和无机物质之间的粘合性。
因牙釉质和牙质都属于磷灰石,故钒可以置换到磷灰石分子中,可有效地预防龋齿。
龋齿低发区的饮用水中钒浓度较大。
3.钒能刺激骨髓的造血功能,促进血红素的合成,能有效治疗多种贫血症。
钒元素的颜色之谜揭秘钒在玻璃和颜料中的奇妙应用钒元素的颜色之谜揭秘:钒在玻璃和颜料中的奇妙应用钒元素是一种重要的过渡金属,在自然界中以多种氧化态存在。
除了在钢铁、合金、化工等行业中的广泛应用外,钒元素还有着让人惊叹的颜色表现能力。
本文将揭秘钒在玻璃和颜料中的奇妙应用。
第一章:钒元素的基本特性钒(V)的原子序数为23,原子量为50.94,其5s、4d轨道的电子结构决定了其物理、化学性质。
钒元素在不同氧化态中呈现不同的颜色,正是由于这一特性,钒得以在玻璃和颜料中发挥其独特的应用。
第二章:钒在玻璃中的应用2.1 钒元素赋予玻璃颜色的原理在玻璃中添加不同氧化态的钒,可以赋予玻璃不同的颜色。
比如,加入钒的最低氧化态,可以使玻璃呈现蓝色或绿色,而加入更高氧化态的钒则可使玻璃呈现黄色、橙色或红色。
2.2 钒玻璃制品的应用领域钒玻璃广泛应用于建筑、艺术品和光学仪器等领域。
在建筑中,钒玻璃可以通过调控钒元素的氧化态而呈现不同的颜色,增加建筑的美观性。
在艺术品中,钒玻璃的独特颜色效果使得作品更加生动鲜明。
在光学仪器中,钒玻璃可以用于滤光片、摄像机镜头等器件的制造,以调节和改善光线的颜色。
第三章:钒在颜料中的应用3.1 钒颜料的种类及特点钒颜料主要包括氧化钒黄、氧化钒红、氧化钒绿等,这些颜料都以钒元素的不同氧化态为基础,拥有鲜艳的颜色和良好的耐光性。
钒颜料的应用广泛,可以用于绘画、印刷、塑料等行业。
3.2 钒颜料对环境和健康的影响尽管钒颜料有着出色的色彩表现力,但其对环境和健康也有一定的影响。
钒颜料在加工和使用过程中会释放出部分钒元素,当超过一定浓度时可能对环境产生污染,因此在生产和使用中需要采取适当的措施来减少钒元素的释放。
结论:通过深入分析钒元素在玻璃和颜料中的应用,我们可以更好地理解钒元素在颜色表现方面的奇妙能力。
钒元素所呈现的多样化颜色,不仅丰富了人们的日常生活,而且在建筑、艺术和光学仪器等领域发挥着重要的作用。
高考钒元素知识点钒(Vanadium)是一种化学元素,原子序数为23,化学符号为V。
它在自然界中以多种矿石的形式存在。
钒元素具有广泛的应用价值,尤其在冶金、化工、材料科学等领域具有重要作用。
下面就是高考钒元素知识点的详细介绍。
1. 钒元素的基本性质钒是一种过渡金属元素,在元素周期表中位于第五族,具有金属的典型性质。
它的原子序数为23,原子量为50.94。
钒的化学符号V源自其英文名Vanadium。
2. 钒元素的发现历史钒元素最早由瑞典科学家Nils Gabriel Sefström于1830年发现。
他从矿石中提取出了一种新的金属氧化物,并将其命名为Vanadium,以纪念斯堪的纳维亚神话中的女神Vanadis。
3. 钒元素的物理性质钒是一种银白色的金属,具有良好的延展性和导电性。
它的熔点为1910℃,沸点为3407℃。
钒的密度为6.11克/立方厘米,属于中等密度的金属。
4. 钒元素的化学性质钒是一种活泼的金属,容易与氧、硫等非金属元素形成化合物。
钒的氧化态多样,常见的氧化态有+2、+3、+4和+5。
此外,钒还能形成多种配合物,并参与到许多有机化合物的合成过程中。
5. 钒元素在生物体内的作用钒在生物体内以微量元素的形式存在,并参与到机体的多种生理过程中。
例如,钒对人体的葡萄糖代谢、骨骼发育和免疫调节等方面发挥着重要的作用。
6. 钒元素的应用领域钒具有广泛的应用价值,主要体现在以下几个领域:(1) 冶金工业:钒在钢铁生产中具有重要作用,能够显著提高钢材的强度和韧性。
(2) 化工工业:钒催化剂在有机化工合成反应中广泛应用,用于制备各种有机化合物。
(3) 电池工业:钒氧化物是一种重要的正极材料,常用于制造锂离子电池和钛酸锂电池。
(4) 材料科学:钒合金具有良好的耐热性和耐腐蚀性,用于制造高温工具和高强度材料。
(5) 医学领域:钒化合物被应用于放射性同位素治疗和成像检查。
7. 钒元素的环境影响钒元素在自然界中广泛存在,但过量的钒元素对环境和生物体可能造成一定的危害。
钒的原子半径摘要:1.钒的简介2.钒的原子半径定义及意义3.钒的原子半径数值及变化规律4.钒的化学性质与原子半径的关系5.原子半径在钒的工业应用中的应用6.总结正文:【1】钒的简介钒(Vanadium)是一种硬质的、银灰色的过渡金属,原子序数为23,位于周期表的第五周期、第VB族。
钒在自然界中主要以钒矿石的形式存在,是钢铁工业的重要合金元素。
【2】钒的原子半径定义及意义原子半径是指原子核到最外层电子轨道的距离,通常用来描述原子的大小。
原子半径在化学反应中具有重要意义,因为它直接影响到原子间的相互作用力和化学键的形成。
【3】钒的原子半径数值及变化规律钒的原子半径随着原子序数的增加而逐渐减小。
在钒的同位素中,原子半径随着中子数的增加而增大。
此外,钒的原子半径在不同的电子构型中也有所差异,如3d轨道半满时,原子半径较小,而4s轨道半满时,原子半径较大。
【4】钒的化学性质与原子半径的关系钒的原子半径较小,使其在化学反应中具有较高的活性。
钒可以与多种元素形成化合物,如氮、氧、硫等。
此外,钒的原子半径变化规律也影响了其在化合物中的价态,如钒酸盐、钒酸铵等。
【5】原子半径在钒的工业应用中的应用钒在钢铁工业中的应用与其原子半径密切相关。
钒作为合金元素,可以提高钢铁的强度、硬度和耐磨性。
此外,钒还应用于超级合金、触媒剂、硬质合金等领域,这些应用都与钒的原子半径及其化学性质密切相关。
【6】总结钒的原子半径在其化学性质和工业应用中具有重要作用。
了解钒的原子半径变化规律,有助于我们更好地掌握钒的化学性质和应用领域。