化学:1.1《元素周期表》第3课时学案(新人教版必修2)
- 格式:doc
- 大小:612.86 KB
- 文档页数:4
第二节元素周期律第3课时学案学习目标: 知识与技能:1.掌握元素周期表和元素周期律的应用2.了解周期表中金属元素、非金属元素分区。
3.掌握元素化合价与元素在周期表中位置的关系。
过程与方法:1.归纳、比较。
通过对前面所学知识的归纳比较,掌握“位、构、性”的关系。
2.自主学习。
引导自主探究,分析化合价与元素在周期表中位置的关系。
情感、态度与价值观:培养学生辩证唯物主义观点,培养学生科学创新品质,培养学生理论联系实际的能力 学习重点:周期表、周期律的应用学习难点:“位、构、性”的推导。
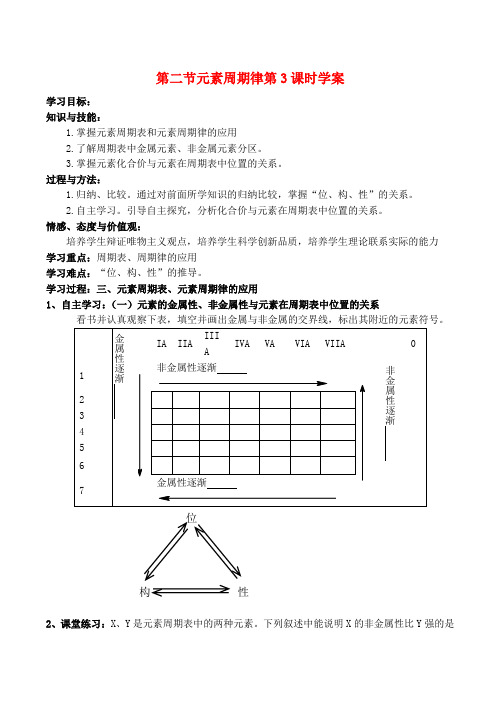
学习过程:三、元素周期表、元素周期律的应用1、自主学习:(一)元素的金属性、非金属性与元素在周期表中位置的关系看书并认真观察下表,填空并画出金属与非金属的交界线,标出其附近的元素符号。
2、课堂练习:X 、Y 是元素周期表中的两种元素。
下列叙述中能说明X 的非金属性比Y 强的是位构 性()A、X原子的电子层比Y原子的电子层数多B、X的氢化物的沸点比Y的氢化物的沸点低C、X的气态氢化物比Y的气态氢化物稳定D、Y的单质能将X从NaX的溶液中置换出来(二)元素的化合价与元素在周期表中位置的关系3、探究思考:1、标出下列有下划线元素的化合价:NaCl MgCl2 AlCl3 H2SiO3 H3PO4 H2SO4 HClO42、总结最高正化合价与什么有直接关系?得出结论:主族元素最高正化合价===4、探究思考:写出下列化合物中有下划线元素的化合价:Na2CO3与CH4 H2SO4与H2S HCl与HClO4分析最高正化合价与最低负化合价之间的关系,并解释其原因。
得出结论:。
5、课堂练习:某元素X的最高价氧化物对应水化物的化学式为HXO4,则其气态氢化物的化学式为:;若其水溶液呈现酸性,且能与AgNO3溶液反应生成白色沉淀,则它在元素周期表中的位置是:。
6、课堂探究练习:(三)元素周期律、元素周期表的应用1、预测未知物的位置与性质Ra(镭)是原子序数最大的第ⅡA族元素,下列说法不正确的是()A、原子半径是第ⅡA族中最大的B、遇冷水能剧烈反应C、位于第七周期D、Ra(OH)2是两性氢氧化物2、寻找所需物质在能找到制造半导体材料,如;在能找到制造农药的材料,如;在能找到作催化剂,耐高温,耐腐蚀的合金材料。
![[精品]新人教版必修二高中化学1.1.3元素周期表(3)导学案](https://img.taocdn.com/s1/m/01494221de80d4d8d15a4f38.png)
第一章第一节元素周期表(3)【习目标】1.了解原子结构与同位素、使生懂得质量和A的含义。
2.初步会元素周期表的位置与元素组成微粒的结构联系起运用能力。
【习重点】同位素、质量和A的含义【预备知识】原子的构成:原子看表分析:675×101、构成原子粒子所带的电性及电荷大小。
2、质子带正电,电子带负电,而原子不显电性的原因。
3、原子的质量主要取决于哪种微粒?总结原子是由居于原子中心的带正电的和核外带负电的构成的。
原子核由和构成。
【基础知识】 (一)质量定义 符号: 计算式:质量(A )= + 应用:用质量表示某种原子[思考]:它表示的含义是什么?[探究]:1、填写下表,总结A 与相对原子质量的关系。
2、原子形成离子之后构成原子的微粒哪些发生了变?如何改变?质量呢?[总结和比较]:和 中的质子、中子、质量和电子。
[课堂练习1]:1、完成表格12、完成表26(二)核素和同位素核素:同位素:[思考与交流]:1、元素、核素、同位素的不同和联系。
在周期表中收入了112种元素,是不是就只有112种原子呢?2、元素有两种天然同位素、。
⑴在形成的2分子中,会有种不同的分子,它的相对分子质量分别为、。
⑵从原子的组成看,原子的质量均为整,但氯元素的相对原子质量却是355,这是为什么?(三)元素的相对原子质量的计算公式:[课堂练习2]:1、有以下一些微粒:①②③④⑤其中互为同位素的是和质量相等但不能互为同位素的是和中子相等,但质子不等的是和、和。
2、下列各组中属于同位素的是()A、40与40B、T2O和H2O 、40与39 D、金刚石与石墨【基础达标】1.下列微粒中,决定元素种类的是( )A.质子B.中子.质量D.核外电子2.决定核素种类的是( )A.质子B.中子.原子的最外层电子D.质子和中子3.下列互为同位素的是( )A.H2D2B.14N 14.16O 17O D.金刚石石墨4136C-NMR(核磁共振)可用于含碳合物的结构分析,136C表示的是( )A.核外有13个电子,其中6个能参与成键B.核内有6个质子,核外有7个电子[].质量是13,原子序是6,核内有7个质子D.质量是13,原子序是6,核内有7个中子5.下列关于指定粒子构成的几种描述中,不正确的是( )A.37与39具有相同的中子B.第114号元素的一种核素错误!未定义书签。

第一章第一节元素周期表(3)【习目标】1.了解原子结构与同位素、使生懂得质量和A的含义。
2.初步会元素周期表的位置与元素组成微粒的结构联系起运用能力。
【习重点】同位素、质量和A的含义【预备知识】原子的构成:原子看表分析:×101、构成原子粒子所带的电性及电荷大小。
2、质子带正电,电子带负电,而原子不显电性的原因。
3、原子的质量主要取决于哪种微粒?总结原子是由居于原子中心的带正电的和核外带负电的构成的。
原子核由和构成。
【基础知识】(一)质量定义符号:计算式:质量(A)= +应用:用质量表示某种原子[思考]:它表示的含义是什么?[探究]:1、填写下表,总结A 与相对原子质量的关系。
2、原子形成离子之后构成原子的微粒哪些发生了变?如何改变?质量呢?[总结和比较]:和 中的质子、中子、质量和电子。
[课堂练习1]:1、完成表格12、完成表2(二)核素和同位素核素:同位素:[思考与交流]:1、元素、核素、同位素的不同和联系。
在周期表中收入了112种元素,是不是就只有112种原子呢?2、元素有两种天然同位素、。
⑴在形成的2分子中,会有种不同的分子,它的相对分子质量分别为、。
⑵从原子的组成看,原子的质量均为整,但氯元素的相对原子质量却是355,这是为什么?(三)元素的相对原子质量的计算公式:[课堂练习2]:1、有以下一些微粒:①②③④⑤其中互为同位素的是和质量相等但不能互为同位素的是和中子相等,但质子不等的是和、和。
2、下列各组中属于同位素的是()A、40与40B、T2O和H2O 、40与39 D、金刚石与石墨【基础达标】1.下列微粒中,决定元素种类的是( ) A.质子B.中子.质量D.核外电子2.决定核素种类的是( )A.质子B.中子.原子的最外层电子D.质子和中子3.下列互为同位素的是( )A.H2D2B.14N 14.16O 17O D.金刚石石墨4136C-NMR(核磁共振)可用于含碳合物的结构分析,136C表示的是( )A.核外有13个电子,其中6个能参与成键B.核内有6个质子,核外有7个电子[].质量是13,原子序是6,核内有7个质子D.质量是13,原子序是6,核内有7个中子5.下列关于指定粒子构成的几种描述中,不正确的是( )A.37与39具有相同的中子B.第114号元素的一种核素错误!未定义书签。

必修Ⅱ第一章物质结构元素周期律第二节元素周期律(第3课时)一、教材分析:本节在物质结构的基础上,将元素周期表的习和元素周期律的习结合起,将生所习的知识连汇贯通,体现了由感性认识上升到性认识的认知规律。
周期表和元素周期律为发展物质结构论提供了客观依据。
原子的电子层结构与元素周期表有密切关系,周期表为发展过度元素结构、镧系和锕系结构论,甚至为指导新元素的合成,预测新元素的结构和性质都提供了线索。
元素周期律和周期表在自然的许多部门,都是重要工具。
二、教目标:1、知识与技能:(1)掌握元素周期表和元素周期律。
(2)掌握元素合价与元素在周期表中位置的关系。
2、过程与方法:(1)归纳、比较。
通过对前面所知识的归纳比较,掌握“位、构、性”的关系。
(2)自主习。
引导自主探究,分析合价与元素在周期表中位置的关系。
3、情感、态度与价值观:培养生创新品质,培养生论联系实际的能力。
三、教重点难点:重点:周期表、周期律的应用难点:“位、构、性”的推导四、情分析:本节课在生已经了解元素周期律的基础上进行教,主要是让生认识周期表特别是元素周期律的应用,整体上难度不大,生能够掌握。
所以须让生动手、动脑、参与归纳,并在习的过程中帮助生查漏补缺,从而使生达到对旧知识的复习,实现由未知向已知、由浅入深的转。
进而生会了解并掌握元素在周期表中的位置(简称“位”)反映了元素的原子结构(简称“构”),而元素的原子结构,则决定、影响元素的性质(简称“性”)。
因此,我们只要知道三种量(“位、构、性”)中的一种,即可推出另外2种量。
五、教方法:启发——归纳——应用六、课前准备:多媒体、实物投影仪七、课时安排:1课时八、教过程(一)检查预习,了解生对已有知识的掌握程度及存在的困惑。
(二)情景导入,展示目标[新课导入]元素周期律、元素周期表是一种重要的结构论,它的重要性体现在什么地方呢?这就是我们这节课要习的内容。
[板书]三、元素周期表和元素周期律的应用。

第三节 元素周期表的应用第3课时【练习】已知磷元素位于第3周期ⅤA 族,(1)画出磷的原子结构示意图;(2)磷元素的最高化学价为 ,其氢化物的化学式为 。
【导入】由上例可见,元素的原子结构和元素在周期表中的位置、元素性质三者之间存在着密切的关系,这是我们本节课要讨论的重点。
【点评】通过练习导入新课,让学生对元素的“位、构、性”之间的关系有更直观的认识,还可以调动学生兴趣,吸引学生注意力。
【板书】 三、元素“位、构、性”之间的关系 【媒体展示】 两种元素组成的化合物,如果两种元素的原子最外层电子数分别是1和6,则化合物的化学式可能是( )。
A 、AB 2 B .A 2B C 、AB D 、A 2B 22、砹是原子序数最大的卤族元素,推测砹和砹的化合物不可能具有的性质是( )。
A.砹是有色固体 B.砹易溶于有机溶剂C.砹化氢很稳定D.砹化银不溶于水3、有X 、Y 、Z 三种元素,其中X 、Y 属于同一主族,加热时,其单质都能与氢气形成气态氢化物H 2X ,H 2Y 。
常温下,X 单质为气态,X 与Y 可形成两种化合物YX 2和YX 3,Y 、Z 均在X 的下一周期,而Z 可与X 生成化合物Z 2X 和Z 2X 2。
试写出: (1)元素名称X ——、Y ——、Z ——;(2)化合物Z 2X 2与H 2X 反应的化学方程式 ;(3)两个由X 、Y 、Z 三种元素所组成物质的化学式——。
【分组讨论】完成教材P25页“概括·整合1”。
【观点陈述】每组派一名代表陈述本组观点。
【教师点评】略 【媒体展示】主族元素原子得、失电子能力强弱与元素在周期表中的位置关系反映 决定 反映决定【过渡】元素周期表除了对我们学好化学有着重要意义外,还有其它的作用吗?【阅读自学】教材P23页“资料在线”至P27页。
【板书】四、元素周期表的重要意义【思考】元素周期律和元素周期表的诞生是19世纪化学科学的重大成就之一,具有重要的哲学意义、自然科学意义和实际应用价值,请你根据教材所给资料和你在网上查阅结果,分别举例说明。

第一章物质结构元素周期律第一节元素周期表(第3课时)学习目标:1.认识卤素的结构特点及其性质变化规律2、明确元素的结构特点及其性质变化规律之间的关系重点难点:卤族元素性质的相似性和递变规律知识梳理:二、元素的性质与原子结构2.卤族元素(1) 卤素的原子结构特点阅读课本第7页卤素的原子结构示意图,归纳卤素的结构特点相同点: 最外层电子数________________.不同点: 随着核电荷数的递增,电子层数逐渐_______________(2) 卤素单质的物理性质:阅读课本第8页,总结卤素单质的物理性质的变化规律:从F2→I2颜色逐渐__________, 密度逐渐_____________, 熔沸点逐渐____________ .(3)化学性质:表(一)卤素单质与H2反应表(二)卤素单质间的置换反应总结:从F→I,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,因此,F2、Cl2、Br2、I2的氧化性依次减弱。
◆元素非金属性质强弱判断依据1.非金属元素单质与H2化合的难易程度:化合越容易,非金属性也越强。
2.形成气态氢化物的稳定性:气态氢化物越稳定,元素的非金属性也越强。
3.最高价氧化物对应水化物的酸性强弱:酸性越强,对应非金属元素非金属性也越强。
4.置换反应:非金属性弱的元素能被非金属性强的元素从其盐溶液里置换出来。
◆结论:在元素周期表中,同主族元素从上到下原子核外电子层数依次增多,失电子能力逐渐增强,得电子能力逐渐减弱。
所以,金属性逐渐增强,非金属性逐渐减弱。
例1:随着卤素原子半径的增大,下列递变规律正确的是()A、单质的熔沸点逐渐降低B、卤素离子的还原性逐渐增强C、气态氢化物稳定性逐渐增强D、单质氧化性逐渐增强例2.已知溴易挥发,碘易升华.向含有NaBr和KI的混合液中通入过量的Cl2,充分反应后将溶液蒸干并灼烧所得物质,最后剩余的固体是A. NaCl 和KIB. NaCl、KCl 、I2C. KCl 和NaBrD. KCl 和NaCl解析:随着核电荷数的增加,卤素单质的氧化性逐渐减弱. 过量的Cl2将Br2、I2从他们的化合物中完全置换出来,在蒸干、灼烧的过程中溴挥发、碘升华,所以剩余固体为KCl 和NaCl知能检测1.卤素单质具有相似的化学性质,这主要是由于卤素()A.单质均为双原子分子B.均为非金属元素C.原子的最外层电子数相同,均为7个D.原子核外电子层数依次增大2.随着卤族元素核电荷数的增大,下列递变规律正确的是()A.单质的颜色逐渐加深B.单质的熔沸点逐渐降低C.单质的密度逐渐增大D.单质的水中的溶解度逐渐增大3.下列液体分别与碘水混合,充分振荡,静置后上层液体为紫色、下层液体为无色的是()A.四氯化碳B.酒精C.苯D.氯水4.关于卤素(用X表示)的下列叙述正确的是()A、卤素单质与水反应均可用X2+H2O=HXO+HX表示B、HX都极易溶于水,它们热稳定性随核电荷数增大而增强C、卤素单质的颜色从F2→I2按相对分子质量增大而加深D、X-离子的还原性依次为:F-<Cl-<Br-<I-,因此相对分子质量小的卤素单质可将相对分子质量大的卤素从它的盐溶液里置换出来。
元素周期律第三课时课前预习学案一、预习目标1.初步了解元素化合价与元素在周期表中位置的关系。
2.掌握元素周期律的应用。
二、预习内容1.元素的化合价与元素在周期表中位置的关系(1)主族元素最高正化合价= 。
(2)非金属元素, ,即: 。
2.元素周期表和元素周期律的应用(1)预测新元素(2)在寻找半导体材料。
(3)利用含有等元素合成新农药。
(4)在中寻找催化剂、耐高温、耐腐蚀的合金。
(5)进行“位、构、性”的推导。
三、提出疑惑同学们,通过你的自主学习,你还有哪些疑惑,请把它填在下面的表格中。
课内探究学案一、学习目标1.通过对前面所学知识的归纳比较,掌握“位、构、性”的关系。
2.通过自主探究,分析化合价与元素在周期表中位置的关系并得出结论。
二、学习过程1.请写出氢氧化锂、氢氧化钠、氢氧化钾的化学式,并标出Li、Na、K三种元素的化合价。
氢氧化锂:氢氧化钠:氢氧化钾:2.(1)标出下列有下划线元素的化合价:NaCl、MgCl2、AlCl3、H2SiO3、H3PO4、H2SO4、HClO4(2)根据第一问,你能总结出最高正化合价与其所在周期表中的位置什么有直接关系吗?3.写出下列化合物中有下划线元素的化合价:Na2CO3与CH4、H2SO4与H2S、HCl与HClO4,分析最高正化合价与最低负化合价之间的关系。
三、反思总结通过本节课的学习,你对元素的化合价与元素在周期表中的位置关系以及元素周期律的应用有什么新的认识?说说看。
四、当堂检测1.X、Y是元素周期表中的两种元素。
下列叙述中,能说明X的非金属性比Y强的是()A.X原子的电子层比Y原子的电子层数多B.X的单质能将Y从NaY的溶液中置换出来C.X原子的最外层电子比Y原子的最外层电子多D.Y的单质能将X从NaX的溶液中置换出来2.已知1~18号元素的离子a W3+、b X+、c Y2-、d Z-都具有相同的电子层结构,下列关系正确的是()A.质子数c>b B.离子的还原性Y2->Z-C.氢化物的稳定性H2Y>HZ D.原子半径X<W3.下列各组元素中,按最高正价递增顺序排列的是()A.F、Cl、Br、I B.K、Mg、C、SC.C、N、O、F D.Li、Na、K、Rb4.按Be、Mg、Ca、Sr、Ba的顺序而递增的性质是()A.氧化性 B.还原性 C.熔点 D.化合价5.1~18号元素的离子中,原子核电荷数和离子最外层电子数相同的是()A.Cl— B.Na+ C.O2—D.S2—6.1~18号元素中,原子的核外电子数与电子层数相同的是()A.氢 B.铍 C.铝 D.氯7.Ra(镭)是原子序数最大的第ⅡA族元素,下列说法不正确的是()A.原子半径是第ⅡA族中最大的B.遇冷水能剧烈反应C.Ra(镭)位于第七周期D.Ra(OH)2是两性氢氧化物8.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,则下列说法一定正确的是(m、n均为正整数)()A.若R(OH)n为强碱,则W(OH)n+1也为强碱B.若H n XO m为强酸,则Y是活泼非金属元素C.若Y的最低化合价为-2,则Z的最高正化合价为+6D.若X的最高正化合价为+5,则五种元素都是非金属元素9.致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷的目的。
第一章物質結構元素週期律第一節元素週期表第3課時一、教材分析:化學是在原子、分子水準上研究物質組成、結構、性質及其變化和應用的科學。
要研究物質的宏觀性質,必須從微觀粒子入手,才能尋找到原因。
化學學科涉及分子、離子、原子、質子、中子、核外電子等多種微觀粒子,但最重要的是原子。
只要瞭解了原子的結構,才可以進一步瞭解分子、離子結構,進而深入認識物質的組成和結構,瞭解化學變化規律。
在初中,學生已初步瞭解了一些化學物質的性質,因此有必要讓學生進入微觀世界,探索物質的奧秘。
通過本節瞭解原子構成、核素、同位素概念,瞭解質子數、中子數和質量數間的關係,為後續週期律的學習打好基礎。
二、教學目標知識目標:1.明確質量數和A Z X的含義。
2.認識核素、同位素等概念的含義及它們之間的關係。
能力目標:提高同學們辨別概念的能力。
情感、態度與價值觀目標:通過對原子結構的研究,激發學生從微觀角度探索自然的興趣。
三.教學重點難點:重點:明確質量數和A Z X的含義。
難點:認識核素、同位素等概念的含義及它們之間的關係。
四、學情分析:同學們在初中已經有了關於原子結構的知識,所以這節課原子表示方法比較容易接受,但對於核素同位素的概念是新知識。
五、教學方法:學案導學六、課前準備:學生學習準備:導學案教師教學準備:投影設備七、課時安排:一課時八、教學過程:(一)、檢查學案填寫,總結疑惑點(主要以學生讀答案展示的方式)(二)、情景導入,展示目標原子是構成物質的一種微粒(構成物質的微粒還有離子、分子等),是化學變化中的最小微粒。
物質的組成、性質和變化都都與原子結構密切相關,同種原子性質和品質都相同。
那麼原子能不能再分?原子又是如何構成的呢?這節課我們一起來學習有關原子的幾個概念。
(三)、合作探究,精講點撥探究一:核素和同位素1、原子結構:原子由原子核和核外電子構成,原子核在原子的中心,由帶正電的質子與不帶電的中子構成,帶負電的電子繞核作高速運動。
元素周期表及元素周期律的应用第三课时【学习目标】1. 掌握元素周期表和元素周期律的应用;2. 了解周期表中金属元素、非金属元素分区;3. 掌握元素化合价与元素在周期表中位置的关系。
【课前导学】一、元素周期律与元素周期表的意义1、发现:1869年俄国化学家____________ 发现元素周期律并编制了第一个元素周期表。
2、应用:①•元素周期表是学习和研究化学的一种重要工具;②.元素周期律和元素周期表为新元素的发现和预测它们的结构、性质提供线索;③.指导工农业生产,启发人们在一定区域内寻找新的物质。
(在氟、氯、硫、磷寻找通常用于制造________ 的元素,在金属与非金属的分界处找 ______________ 材料,在过渡元素中找 _和材料。
)二、“位置、结构、性质”之间的“三角关系”①•位置与结构关系:原子序数=质子数;周期数=电子层数;主族序数=最外层电子数②.结构与性质关系:电子层结构与原子半径、离子半径、电子得失难易、化合价的关系③.位置与性质关系:同位置一一化学性质相同,同主族相似性、递变性;同周期相似性、递变性。
三、1〜20号元素中的某些元素的特性1. 与水反应最激烈的金属是K,非金属是F。
2. 原子半径最大的是K,最小的是H。
3. 单质硬度最大的,熔、沸点最高的,形成化合物品种最多的,正负化合价代数和为零且气态氢化物中含氢百分率最高的元素是C。
4. 气体密度最小的,原子核中只有质子没有中子的,原子序数、电子层数、最外层电子数三者均相等的是Ho5. 气态氢化物最稳定的,只有负价而没有正价的,无含氧酸的非金属元素是F o6. 最高氧化物对应的水化物酸性最强的是CI,碱性最强的是K。
7. 空气中含量最多的,气态氢化物在水中的溶解度最大,其水溶液呈现碱性的是N。
8. 单质和最高价氧化物都是原子晶体的是Si。
9. 具有两性的元素是AI(Be)。
10. 最轻的金属是Li。
11. 地壳中含量最多的元素是Q12. 单质能自燃的元素是P o13. 族序数等于周期数的元素是H、Be、Al。
元素周期表第3课时【课标要求】知识与技能要求: 了解原子结构与同位素、使学生懂得质量数和A Z X 的含义。
过程与方法要求: 具有把元素周期表的位置与元素组成微粒的结构初步联系起来并在一定条件下相互转化的运用能力。
情感与价值观要求:认识事物变化过程中量变引起质变的规律性。
【教学重点】同位素、质量数和A Z X 的含义 【教学方法】讨论、比较、归纳 。
【教学过程设计】【复习导入】请同学们回忆初中所介绍的原子结构的知识。
我们按照元素在周期表中的顺序给元素编号,得到原子序数。
可见原子序数与原子结构间存在什么关系?(结合1--18号元素原子结构)1、原子序数= = =2、原子是由居于原子中心的带正电的 和核外带负电的 构成的。
原子核由 和 构成。
[归纳与整理]一、原子结构质子 1、原子 核外电子[思考与交流]从表格得出原子的质量主要取决于哪种微粒?原子的质量主要集中在 ,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有 叫做质量数。
2、质量数与质子数和中子数间的关系。
质量数(A )= +在化学上,我们为了方便地表示某一原子。
在元素符号的左下角表出其质子数,左上角标出质量数AZ X 。
[课堂练习]1、若有某种新元素,它的原子核内有161个中子,质量数为272。
该元素的原子序数与原子核内中子数的关系是( )A. 大于 B . 小于 C. 等于 D. 不能肯定原子核3、X元素原子的质量数为,核内中子数为,则gX含有电子的物质的量(mol)是( )A. (m-n)×W/mB. (m-n-1)×W/mC. (m+n)×W/mD.(m-n+1)×W/m科学研究证明,同种元素原子的原子核中,中子数。
如组成氢元素的氢原子,就有以下三种:我们把原子叫核素。
[提问]上面的11H、21H和31H就是核素。
那么11H、21H和31H间我们把他们互称为什么?[归纳与整理] 二、核素:同位素:同位素的特点:[课堂练习]4、在63Li、147N、2311Na、2412Mg、73Li、146C中:(1)和互为同位素。
第一节 元素周期表(第2课时)
【学习目标】 了解原子结构与同位素、使学生懂得质量数和A Z X 的含义。
【学习重点】同位素、质量数和A Z X 的含义 【学习难点】同位素、质量数和A Z X 的含义 【教学过程】 【知识回顾】
1、原子序数的概念: 原子序数与原子结构间存在的关系:
原子序数= = = 2、原子是由居于原子中心的 和核外带负电的 构成的。
原子核由 和 构成。
3、元素金属性强弱的判断依据:
4、元素非金属性强弱的判断依据:
【自主学习】一、原子结构
质子
1、原子
核外电子
构成原子的粒子及其性质 构成原子的粒子 电 子
质 子
中 子 电性和电量 1个电子带1个单位负电荷 1个质子带1个单
位正电荷 不显电性 质量/kg 9.109×10-31 1.673×10-27
1.675×10-27
相对质量
1/1836(电子与质子质量之比)
1.007
原子的质量主要集中在 ,质子和中子的相对质量都近似为1,
如果忽略电子的质量,将核内所有 叫做质量数。
原子核
中子
2、质量数与质子数和中子数间的关系。
质量数(A)= +
3、A
Z
X:表示一个质量数为A,质子数为Z的X原子。
【课堂练习】填表:
粒子符号质子数(Z)中子数(N)质量数(N)用A
Z
X表示
为
①O8 18
②Al24 27
③Ar18 22
④Cl35
17
Cl
⑤H1
1
H
科学研究证明,同种元素原子的原子核中,质子数中子数。
如组成氢元素的氢原子,就有以下三种:
原子符号质了数中子数氢原子名称和简称
①1
1
H 氕(H)
②2
1
H 氘(D)
③3
1
H 氚(T)
111
4、(1)核素:
那么1
1H、2
1
H和3
1
H间互称为什么?
(2)同位素:
“同位”指的是:
(3)元素、核素、同位素之间的关系图
(4)同位素的性质:
1、天然同位素无论是在单质还是化合物中原子所占的百分比一般不变。
2、同位素原子物理性质不同,但化学性质几乎完全相同,
1、在
63
Li 、147N 、2311Na 、2412
Mg 、7
3
Li 、14
6C 中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
2、下面有关14C 的叙述正确的是
A.14C 与14N 含有相同的中子数
B. 14C 与C 60互为同位素
C. 14C 与C 60中普通碳原子的化学性质不同
D. 14C 与12C 互为同位素 3、下列各组粒子属于同位素的是
A.3517Cl 和3717Cl
B.40
19K 和4020Ca
C.O 2和O 3
D.H 2O 和D 2O 4、下列说法正确的是
①氘和氚是质量数不同、质子数相同的氢的两种同位素 ②氢元素是指
1
1H ③11H 、21H 、3
1H 是氢的三种同位素,是同一元素的三种原子 ④
21H 和31
H 的化学性质几乎完全相同
A.②③
B.③④
C.①③④
D.②③④
5、某元素二价阳离子核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
A. 18
B. 20
C. 22
D. 16
6若把周期表原先的主、副族号取消,由左到右按原顺序编为18列。
如碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是() A.第3列元素种类最多,第14列元素的化合物种类最多
B.第10列元素全部是金属元素
C.第18列元素单质全部是气体
D.只有第2列元素的原子最外层有2个电子
7、铯是一种碱金属元素,下列关于铯及其化合物的叙述不正确的是()
A.硫酸铯的化学式为Cs2SO4
B.氢氧化铯是一种强碱
C.可以电解熔融的氯化铯制取铯
D.碳酸铯受热易分解成氧化铯和二氧化碳
8.下列不能说明氯元素的非金属性比硫元素强的事实是()
①HCl比H2S稳定②HClO氧化性比H2SO4强③HClO4酸性比H2SO4强④Cl2能与H2S反应生成S⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤B.①②C.①②④D.①③⑤9、两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有
A.1对
B.2对
C.3对
D.4对
10.A、B、C为短周期元素,在周期表中所处位置如图所示。
A、C两元素的原子核外电子数之和等于B原子的质子数。
B原子核内质子数和中子数相等。
A C
B
(1)A、B、C_______________、________;
(2)B元素位于元素周期表中第______周期、第____族;
(3)C的原子结构示意图为____________,C的单质与水反应的化学方程式为__________________________________________________________________ (4)比较B、C的原子半径:B____C,写出足量的A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:
____________________________________________________
11.甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是()
A.x+2 B.x+4 C.x+8 D.x+18。