2021新人教版高中化学必修二2.2《化学能与电能》(第1课时 原电池)word学案
- 格式:doc
- 大小:189.00 KB
- 文档页数:6





人教版高中化学必修2第二章第二节《化学能与电能》第一课时《原电池》说课稿一、说教材1、教材的地位及其作用本节教材是人教版化学必修2第二章第二节的教学内容,是电化学中的重要知识也是核心内容。
内容安排在化学必修1《氧化还原反应》﹑化学必修2《化学能与热能》等内容之后,符合学生认知发展规律。
初中化学已经从燃料的角度初步学习了“化学与能源”的一些知识,在选修模块“化学反应原理”中,将从科学概念的层面和定量的角度比较系统深入地学习化学反应与能量。
该节内容既是对初中化学相关内容的提升与拓展,又为选修“化学反应原理”奠定必要的基础。
该节分为两课时教学,本课为第一课时。
通过本课的学习,能使学生清楚地认识原电池的工作原理和构成条件,初步形成原电池的概念,并能够写出电极反应式和电池反应方程式。
生活在现代社会,学生对“电”有着丰富而又强烈的感性认识。
当学生了解了化学反应中能量转化的原因,并感受了探究化学能与热能的相互转化过程之后,会对化学能与电能之间的转化问题产生浓厚的兴趣。
正是基于学生的这种心理特征,教材开始的几个设问,把学生带进了“化学能与电能之间相互转化”研究之中。
从能量转换角度看,本节课程内容是对前一节课中“一种能量转化为另一种能量,能量也是守恒的;化学能是能量的一种形式,它同样可以转化为其他形式的能量,如热能和电能等”论述的补充和完善。
从反应物之间电子转移角度看,原电池概念的形成是氧化还原反应本质的拓展和应用;从思维角度看,“将化学能直接转化为电能”的思想,是是对火力发电中对“化学能→热能→机械能→电能”思维方式的反思和突破。
此外,本节内容对发展学生逻辑推理能力,提高学生科学素养,培养科学探究能力,将理论应用于实践,以及知识系统化及结构化的形成都起着重要作用。
2、教学目标分析(1)知识与技能①学生通过实验探究认识原电池的工作原理和构成条件,初步形成原电池概念。
②能够写出电极反应式和电池反应方程式。
(2)过程与方法①学生通过对化学能转化为电能的学习,体验科学探究的过程,理解科学探究的意义,理解科学探究的基本过程和方法,初步养成科学探究的能力。





教学设计《化学能与电能》一、教学内容分析本节课教学是人教版高中化学必修Ⅱ中第二章《化学反应与能量》第二节《化学能与电能》的第一课时。
本节内容则是侧重于化学能转化为电能的研究,从知识上说则是氧化还原反应的重要应用之一,也是实现氧化还原反应这一主干知识的螺旋式上升的一个重要环节。
因此本节课的重心是实现通过氧化还原反应将化学能转变成电能的装置的研究。
二、学生情况分析1.知识基础学生通过必修I的学习,已经了解了氧化还原反应的实质是电子的得失或偏移,通过初中物理的学习已经知道带电粒子的定向移动形成电流。
但是学生对于将一个氧化还原反应分为两个半反应在两个不同场所发生这种情况是第一次接触,因此在本节课教学中设置了“将铜锌和稀硫酸原电池”这一实验,分析产生电流的原因,引出电子和离子是如何做定向移动的,从现象分析反应,从实际需要出发,实现氧化剂和还原剂分开的设计思想,然后通过实验事实的直观材料去分析原电池的工作原理,降低难度,符合学生的认知规律。
2.实验技能基础经过几个月的高中学习训练,学生已经具备一定动手能力和实验设计能力,且由于物理课上的训练,学生也已经具备一定的电路组装能力。
因此本节课主要采用学生实验获得大量的感观材料之后加以分析的方法来进行学习。
三、教学设计总体思路基于以上分析,我采取了以下的设计思路:从化学小史分析两位科学家装置的共同特点→学生根据提供材料形成设计出一套产生电流的装置电能的装置→分析为什么能够产生电流→电能是由什么形式能量转化来的→原电池的工作原理(氧化还原反应的实际应用)→实验探究原电池的形成条件→通过习题来巩固原电池的原理和原电池的形成条件。
四.教学目标设计知识与技能1.学生通过Cu-Zn原电池的实验来分析原电池的原理2.实验探究构成原电池的条件3.能够运用构成原电池的条件来设计原电池装置过程与方法1.通过合作探究原电池的原理,理解化学实验研究的一般方法。
2.通过实验探究,提高实验操作能力3.通过思考与交流学会联系自己已掌握的知识通过比较归纳认识事物的本质特征。
原电池
1.了解化学能与电能的转化关系。
2.初步了解化学电池的工作原理及应用。
3.掌握原电池的构成要素以及电池正负极的判断。
4.会书写简单的电极反应式。
化学能转化为电能
1.一次能源和二次能源。
(1)一次能源。
直接从自然界取得的能源,包括风力、流水、潮汐、地热、原煤、石油、天然气、天然铀矿等。
(2)二次能源。
一次能源经过加工、转换得到的能源,如电力、蒸汽等。
2.化学能与电能的相互转化。
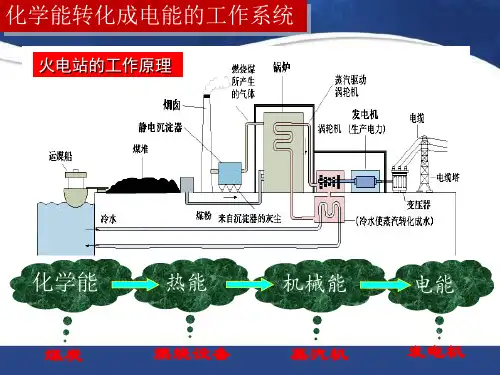
(1)燃煤发电的能量转换过程。
化学能――→燃烧热能――→蒸汽机械能――→发电机电能。
(2)原电池。
①定义:把化学能直接转化为电能的装置。
②构成条件:具有活泼性不同的两个电极;具有电解质溶液;电极间构成闭合回路。
③反应本质:化学电池的反应本质是自发进行的氧化还原反应。
(3)电极。
负极:失电子,发生氧化反应的电极。
正极:得电子,发生还原反应的电极。
(4)电极方程式。
表示正、负极发生反应的方程式。
【应用思考】
从上述火力发电和原电池的工作原理,阐述原电池的优点。
提示:火力发电需要经过较多的能量转化过程,每次转化都会有能量的消耗,所以能量利用率不高,而原电池是把化学能直接转化为电能,所以能量利用率较高。
1.以下装置不能形成原电池的是________。
答案:④⑥
2.根据Zn+2H+===Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是(D)
A.镁B.石墨C.铝D.铅
3.有关原电池的下列说法中正确的是(C)
A.在外电路中电子由正极流向负极
B.在原电池中,只有金属能作负极
C.原电池工作时,阳离子向正极方向移动
D.原电池工作时,阳离子向负极方向移动
基础训练
1.下列有关燃煤发电的一系列能量转换的过程,正确的是(A )
A .化学能→热能→机械能→电能
B .热能→化学能→机械能→电能
C .机械能→化学能→热能→电能
D .热能→机械能→化学能→电能
解析:燃煤发电原理——从煤中的化学能开始的一系列能量转化过程: 化学能――→燃烧热能――→蒸汽机械能――→发电机电能
故答案为A 。
2.下列关于原电池的叙述中正确的是(A )
A .原电池能将化学能转变为电能
B .原电池负极发生的电极反应是还原反应
C .原电池在工作时其正极不断产生电子并经外电路流向负极
D .原电池的电极只能由两种不同的金属构成
解析:原电池能将化学能转变为电能,A 正确;原电池负极发生的电极反应是氧化反应,B 错;原电池工作时电子从负极经外电路流向正极,C 错;原电池的电极可用石墨构成,D 错;答案为A 。
3.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是(D )
A .Zn +Ag 2O +H 2O===Zn(OH)2+2Ag
B .Pb +PbO 2+2H 2SO 4===2PbSO 4+2H 2O
C .Zn +CuSO 4===Cu +ZnSO 4
D .C +CO 2===2CO
解析:D 项是吸热的氧化还原反应,反应过程中吸收能量,不能设计为原电池。
4.对于原电池的电极名称,下列叙述有错误的是(C )
A .发生氧化反应的为负极
B .正极为电子流入的一极
C .比较不活泼的金属为负极
D .电流的方向由正极到负极
解析:原电池中相对活泼的金属为负极,不活泼的为正极,C 项错误;负极发生氧化反应,正极发生还原反应,A 项正确;原电池工作时,外电路中电子由负极流出,由正极流入,电流方向与电子流动方向相反,B 、D 两项正确。
5.在盛有稀H 2SO 4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是(D )
A .正极附近的SO 2-4离子浓度逐渐增大
B .正极有O 2逸出
C .电子通过导线由铜片流向锌片
D .铜片上有H 2逸出
解析:A.该原电池放电时,溶液中阴离子向负极移动,阳离子向正极移动,故A 错误;
B.正极上氢离子得电子被还原生成氢气,故B 错误;
C.电子由负极经导线流向正极,即由锌片流向铜片,故C 错误;
D.Cu 电极上氢离子得到电子生成氢气,有氢气逸出,故D 正确;故选D 。
6.如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是(D)
解析:电流计指针偏转,X棒变重,Y棒变轻,说明该装置为原电池,X棒有固体析出,Y棒失去电子进入溶液。
A.锌比铜活泼,所以锌失去电子,生成锌离子进入溶液,X棒变轻,Y上有氢气放出,错误;B.Y为Fe极,则Fe失去电子,生成亚铁离子进入溶液,Y棒变轻,而X生成氢气,错误;C.锌失去电子进入溶液,则X变轻,Y上有银形成, Y变重,错误;
D.Y为Zn,则Zn失去电子进入溶液,Y棒变轻,碳棒上有Cu析出,则碳棒增重,形成电流,正确;答案选D。
能力提升
7.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;
①③相连时,③为正极;
②④相连时,②上有气泡逸出;
③④相连时,③的质量减少。
据此判断这四种金属活动性由大到小的顺序是(B)
A.①③②④ B.①③④②
C.③④②① D.③①②④
解析:①②相连时,外电路电流从②流向①,说明电子从①流向②,则①比较活泼;①③相连时,③为正极,①为负极,①比较活泼;②④相连时,②上有气泡逸出,氢离子放电生成氢气,则②为正极,④比较活泼;③④相连时,③的质量减少,③作负极,③比较活泼。
据此判断这四种金属活动性由大到小的顺序是①③④②;答案选B。
8.等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量
浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图象表示如下,其中正确的是(D)
解析:等质量的两份锌粉中,加入等体积等物质的量浓度且均过量的稀硫酸,同时向a 中加入少量CuSO4溶液,则a中发生的反应有:Zn+Cu2+===Zn2++Cu,Zn+2H+===Zn2++H2↑,由于置换出来的Cu与Zn在稀硫酸中构成原电池,所以,a中的反应速率比b中的反应速率大,即反应完成所需的时间短,但Cu2+消耗了少量的Zn,a中产生的H2比b中产生的H2少。
b中只发生反应:Zn+2H+===Zn2++H2↑。
符合这些条件的图象就是D项。
9.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol/L H2SO4溶液中,乙同学将电极放入6 mol/L的NaOH 溶液中,如下图所示。
(1)写出甲池中正极的电极反应式。
正极:_______________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式。
负极:________________________________________。
总反应的离子方程式:__________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的。