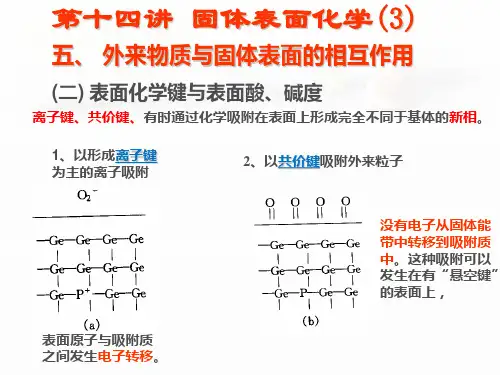
固体表面化学过程
- 格式:pdf
- 大小:1.23 MB
- 文档页数:5



固体表面的化学反应——催化剂的活性位点研究固体表面化学反应是目前材料科学和化学领域中非常重要的研究领域,它在催化剂设计、环境治理、生物医学等众多应用方面都有着重要的意义。
对于生产过程,例如石油催化和化学加工,选择正确的催化剂是至关重要的。
在催化剂表面上,具有高性能(即高反应活性和选择性)的活性位点是实现化学反应的关键。
催化剂是通过特定的化学反应增加化学反应速率的特殊物质。
在化学反应中,催化剂会提高反应物之间的作用力,从而增加反应速率。
不同的催化剂在反应中的作用是不同的,因此,为不同的化学反应设计不同的催化剂是非常重要的。
在催化剂的表面上,活性位点通常被认为是化学反应发生的关键点。
这些活性位点通常是通过选择性地调节催化剂的组成,以及通过对催化剂表面的制备和修饰来控制的。
催化剂的活性位点可以分为两种类型:表面原子和表面缺陷。
表面原子是指催化剂表面上的金属原子或氧化物原子,它们具有较高的化学反应活性,并可以吸附反应物分子。
表面缺陷是指催化剂表面上的缺陷,它们可以提高催化剂表面的电子密度,从而增加化学反应速率。
因此,了解催化剂的活性位点对于设计高性能催化剂非常重要。
如何确定催化剂的活性位点确定催化剂的活性位点是化学反应研究的一个挑战性问题。
通过表面配位理论、X射线光电子能谱、红外光谱等方法对固体表面进行分析,可以推测出催化剂表面上可能存在的活性位点。
例如,通过X射线吸收光谱分析,可以确定铜催化剂表面上的 Cu-O-Cu 配位形成了电子共价键,并可提高催化剂表面的活性位点浓度。
另一方面,计算化学方法已成为确定固体表面活性位点的重要手段。
计算化学方法可以模拟催化剂表面中可能的反应路径。
在反应通道中,可以确定能量最低的振动模式,并确定反应通道中的瓶颈。
通过这种方式,可以确定催化剂表面可能存在的活性位点。
通过实验和计算等多种手段对催化剂的活性位点的研究,可以进一步优化催化剂的结构和性能,提高固体表面化学反应的效率和选择性。

化学反应机理中的表面反应化学反应是物质发生变化的过程,其中包括了各种各样的反应类型和机理。
表面反应是其中一种重要的反应机理,涉及到物质在表面或者界面上的相互作用和转化。
本文将探讨化学反应机理中的表面反应及其在实际应用中的重要性。
一、表面反应的基本概念表面反应是指反应物分子在物理表面上发生接触反应并转化为产物的过程。
在反应过程中,反应物分子与表面的相互作用导致化学键的重构和分子结构的改变,从而产生新的化学物质。
表面反应通常发生在固体表面、液体表面以及气体界面上,具有很高的反应速率和特殊的反应动力学行为。
二、表面反应的种类及特点1. 吸附反应吸附反应是表面反应中最常见的一种类型。
吸附反应的过程包括吸附、表面扩散、反应和解吸等多个步骤。
吸附反应通常发生在固体表面或者液体表面上,吸附物质通过物理或化学吸附与表面发生相互作用。
2. 反应速率与表面积的关系表面反应的速率与反应物在表面上的接触面积密切相关。
反应物分子在表面上的吸附与反应,表面积越大,反应速率越快。
因此,在工业生产和科研实验中,常常采取增大反应器内表面积的方法来提高反应速率和效率。
三、表面反应实际应用举例1. 催化剂的应用表面反应在催化剂的应用中起着重要的作用。
催化剂可以提供更多的表面积,增加反应物在表面上的吸附和反应机会,从而加速反应速率。
常见的催化反应包括有机合成、汽车尾气净化等。
2. 表面涂层技术表面涂层技术利用表面反应原理,将一层薄薄的功能性材料覆盖在基础材料的表面上。
这种涂层可以提供额外的保护、改变表面性质或者实现特殊的功能,如防腐蚀、增加光泽度等。
3. 电化学反应电化学反应是指在电解质溶液中由于电子转移而发生的化学反应。
在电极与电解质溶液的接触界面上,会发生一系列的表面反应,涉及到电荷转移、氧化还原和析气等过程。
四、表面反应的研究方法为了深入了解表面反应的机理和过程,科学家们开发了很多研究表面反应的方法和技术。
其中包括:1. 表面敏感技术表面敏感技术通过探测表面反应物或产物的组成和结构,来研究表面反应的过程和机理。


第二章固体表面的物理化学特性1:表面:一种凝聚态物质与另外的物质或者真空之间的过渡区域,一般有一个或者几个原子组成(0.5~10nm)(表面原子近程有序)2:范德瓦尔斯键:固体中的原子、离子、或分子之间存在一定的结合键,这种结合键与原子结构有关,最简单的固体可能是凝固太的惰性气体,惰性气体因其原子外壳电子层已经填满而呈稳定状态,通常惰性气体原子之间的结合键非常微弱,只有处于很低的文ushi才会液化和凝固,这种结合键称为范德瓦尔斯键,处惰性气体外,许多分子之间也可通过这种键结合为固体。
分子间和氢键都属于物理键或次价键3:氯化钠固体是离子键结合的,硅石共价键结合,铜是金属键结合,这三种间都较强,铜属于化学键或主价键。
4:常见金属的晶体结构主要有三种:面心立方(fcc)、密排六方(hcp)、体心立方(bcc)。
5:表面能:要形成新的表面,需要外界提供能量,是一些键发生断裂。
6:固体材料的界面有三种:表面(固体材料与气体或液体的分界面);晶界(多晶材料内部成分、结构相同而取向不同地晶粒或亚晶之间的界);相界(固体材料中成分、结构不同地两相之间的界面)。
7:理想表面:一种理论上认为的结构完整的二维点阵平面,表面的原子分布位置和电子密度都和体内一样。
8:清洁表面:是指在特殊环境中经过特殊处理后获得的表面,是不存在吸附、催化反应或杂质扩散等物理、化学效应的表面。
(其结构式TLK模型P23)9:晶体表面达到稳定态的方式:自行调整;依靠表面的成分偏析。
10:θ<90°称为润湿,θ>90°称为不润湿。
11:表面电子态(表面态):能带其电子态就会和体内布洛赫波连结起来,在体内便有不为零的几率分布,严格说这就不是表面态,这称为表面共振。
12:表面态分类:外诱表面态;本征表面态。
13:表面态和界面态的重要性:表面的原子排列与体内不同;从电荷的分布来看,表面局部电子态波函数自最外一层原子面分别向体内和真空呈指数衰减,分布在表面两侧约1~1.5nm 范围内;表面态(或零界态)对半导体材料和器件的性质,尤其是对表面电导和光学性质有重大影响。

表面化学的原理及应用1. 表面化学的定义表面化学是研究物质界面和表面的化学现象及其规律的科学。
它涉及到界面的能量、结构、理化性质以及界面上发生的各种化学反应和物理过程。
2. 表面化学的原理表面化学的原理主要涉及两个方面:表面活性和吸附现象。
2.1 表面活性表面活性是指物质在界面上表现出的特殊性质,主要包括界面张力和表面张力。
2.1.1 界面张力界面张力是液体与气体或液体与液体之间的边界上分子间的相互作用力,决定了液体表面的几何形状。
例如,水的表面张力使得水珠成球状。
2.1.2 表面张力表面张力是液体内部分子间的相互作用力,决定了液体表面分子的排列方式。
表面张力越大,液体表面越平滑,液体与固体接触面也越大。
2.2 吸附现象吸附是指物质在固体表面上进行的分子或离子的附着过程。
吸附现象可以分为物理吸附和化学吸附两种类型。
2.2.1 物理吸附物理吸附是分子间的范德华力或静电作用力引起的,吸附后分子间的相互作用力较弱,易于发生解吸。
例如,活性炭对气体的吸附就属于物理吸附。
2.2.2 化学吸附化学吸附是由于化学键的形成而引起的吸附,吸附后分子间的相互作用力较强,解吸困难。
例如,某些金属表面对氢气的吸附就属于化学吸附。
3. 表面化学的应用表面化学在多个领域有着广泛的应用,以下列举了几个常见的应用领域。
3.1 表面活性剂表面活性剂是一类能够降低液体表面张力的物质,常用于洗涤剂、乳化剂、湿润剂等产品中。
它们能够改善界面的性质,提高液体与固体的接触性能,从而实现更好的清洁效果、乳化效果或湿润效果。
3.2 催化剂许多催化反应都发生在固体表面上,表面化学的原理在这些反应中起到重要的作用。
表面化学的研究可以帮助我们理解催化反应的机理,并提供设计催化剂的指导原则。
3.3 电化学电化学是研究物质界面上化学和电学相互作用的学科,表面化学在电化学领域有着广泛的应用。
例如,电解池中的阳极和阴极表面的化学反应、电化学传感器的制备等都涉及到表面化学的原理。

fluent表面化学反应案例
表面化学反应是指发生在固体表面上的化学反应。
它们在许多
领域中都有重要的应用,如催化、电化学和材料科学等。
下面是一
些常见的表面化学反应案例:
1. 氧化反应,例如,铁的表面与氧气发生氧化反应生成铁(III)氧化物,这是铁生锈的过程。
铁生锈的速度受到环境中湿度、温度
和氧气浓度等因素的影响。
2. 催化反应,催化反应是表面化学反应的重要应用之一。
例如,汽车尾气中的氮氧化物通过催化转化为氮气和水蒸气,减少对环境
的污染。
这种催化反应通常在催化剂的表面上进行,催化剂提供活
性位点来加速反应速率。
3. 吸附反应,吸附是指气体或液体中的分子或离子在固体表面
上附着的过程。
例如,活性炭可以吸附有机物,用于水处理和空气
净化。
吸附反应的速率和选择性通常受到表面吸附位点和吸附物质
浓度等因素的影响。
4. 电化学反应,电化学反应涉及到电子转移和离子迁移过程。
例如,电池中的化学反应将化学能转化为电能。
在电极表面上,氧化还原反应发生,产生电子流和离子流,从而实现电池的工作。
5. 表面合成反应,表面合成反应是指在固体表面上合成新的化合物或材料的过程。
例如,化学气相沉积(CVD)技术可以在金属或半导体表面上合成薄膜,用于微电子器件和光学器件的制备。
综上所述,表面化学反应在许多领域中都有重要的应用。
它们可以改变物质的性质、催化化学反应、吸附和释放物质等。
通过深入研究表面化学反应,我们可以更好地理解和控制这些反应,为实现更高效、环保的化学过程和材料设计提供基础。

化学气相沉积过程化学气相沉积(Chemical Vapor Deposition,简称CVD)是一种常用的制备薄膜材料的方法,它在半导体工业、材料科学和表面工程等领域得到广泛应用。
本文将介绍CVD的基本原理、过程和应用。
一、CVD的基本原理CVD是利用气相反应在固体表面上生成薄膜的方法。
它的基本原理是通过控制气体在一定温度下与固体表面发生化学反应,使固体表面的原子或分子逐层沉积形成薄膜。
这种沉积过程是在真空或低压气氛中进行的,通常需要提供一定的能量来激活反应。
二、CVD的过程CVD过程通常可以分为四个步骤:前驱体输送、热解、扩散和沉积。
1. 前驱体输送:CVD过程中需要将前驱体气体输送到反应室中。
前驱体气体可以是一种或多种气体,它们经过预处理后被输送到反应室中。
预处理可以包括加热、过滤、稀释等步骤,以确保前驱体气体的纯度和稳定性。
2. 热解:前驱体气体进入反应室后,通过加热使其分解为反应物质。
加热可以采用电加热、辐射加热或激光加热等方式。
热解过程中,前驱体分子发生裂解,生成活性物种,如自由基、离子等,这些活性物种参与后续的化学反应。
3. 扩散:热解后的活性物种在反应室中扩散到固体表面。
扩散过程受到温度、压力、气流速度等因素的影响。
扩散过程中,活性物种与固体表面发生反应,形成沉积物质。
4. 沉积:活性物种与固体表面反应后,会形成沉积物质。
沉积物质的生成速率取决于活性物种的浓度、反应速率等因素。
沉积物质以层状结构逐渐沉积在固体表面上,形成所需的薄膜。
三、CVD的应用CVD广泛应用于半导体工业、材料科学和表面工程等领域。
具体应用包括:1. 半导体器件制备:CVD可用于制备半导体材料的薄膜,如硅、氮化硅、氮化镓等。
这些薄膜可以用于制作晶体管、光电二极管等器件。
2. 表面涂层:CVD可用于在材料表面形成保护性涂层,提高材料的耐磨性、耐腐蚀性和耐高温性能。
常用的涂层材料包括金属氮化物、碳化物等。
3. 光学薄膜制备:CVD可用于制备透明、反射或吸收特定波长的光学薄膜。
溶蚀的概念
溶蚀是一种物理现象,指的是在固体物质表面发生的化学反应,
导致固体物质表面逐渐消失,最终物质消失的过程。
以下是有关溶蚀
的概念及其步骤的详细阐述。
概念:
溶蚀是指在化学反应过程中,某些化学物质会与固体食物发生作用,
从而改变它们的表面形态。
常见的溶蚀物质包括酸、碱和盐等。
这些
物质能够与金属、陶瓷、塑料、玻璃等不同种类的物质产生作用。
步骤:
下面是溶蚀过程的步骤:
1、分子分解
当酸、碱或盐与固体表面发生作用时,它们会分解成离子。
离子可以
在化学反应的过程中与固体表面的原子或分子相互作用。
2、化学反应
离子与固体表面的原子或分子发生化学反应,生成新的化合物。
通常
情况下,这些化合物会溶解在生产过程中使用的溶剂或者水中。
3、新物质生成
在发生化学反应的同时,产生的新化合物会替代掉固体表面的原子或
分子。
这个过程会逐渐形成真正的溶蚀。
4、反应终止
溶蚀反应在没有新的化合物生成时就会停止。
这通常是由于固体表面
许多化学反应的物质已完全被用尽,或者离子浓度太低而无法完成化
学反应。
总结:
溶蚀是一种危险的化学反应,因为它会导致物质表面的严重损坏。
在
很多实际应用中,如自行车车架、汽车发动机、飞机发动机等等,都
是以金属为主体材料,都容易受到溶蚀的影响。
因此,在工程设计中,
应将该问题纳入考虑范围,避免溶蚀导致机械设备受损,给人民生命财产带来损失。
0引言2007年10月10日,瑞典皇家科学院宣布将2007年度诺贝尔化学奖授予德国科学家GerhardErtl[1](图1),以表彰他对“固气界面基本分子过程的研究”所做出的杰出贡献[2]。
GerhardErtl现年71岁,1936年生于德国斯图加特,1965年获得慕尼黑技术大学(TechnicalUniversityofMunich)物理化学博士学位。
此后,他一直致力于研究发生在固体表面的物理和化学反应过程。
GerhardErtl在1973-1986年担任路德维希-马克西米利安大学(LudwigMaximiliansUniversity)教授及该校物理化学研究所所长。
1986年至2004年出任德国马普学会弗里茨-哈伯研究所(Fritz-Haber-InstitutderMax-Planck-Gesellschaft)所长,2004年至今,仍在该所从事科学研究工作,担任该所的名誉教授。
GerhardErtl的研究工作是围绕着气体分子与固体收稿日期:2007-11-20作者简介:马秀芳,中国科学院大连化学物理研究所催化基础国家重点实验室,研究方向为表面化学物理;E-mail:xiufangma@gmail.com李微雪(通讯作者),中国科学院大连化学物理研究所催化基础国家重点实验室,研究员,研究方向为表面催化;E-mail:wxli@dicp.ac.cn固体表面化学过程———2007年度诺贝尔化学奖成果简介马秀芳1,2,邓辉球2,李微雪11.中国科学院大连化学物理研究所,催化基础国家重点实验室,大连1160232.湖南大学物理与微电子科学学院,长沙410082[摘要]瑞典皇家科学院将2007年度诺贝尔化学奖授予德国科学家GerhardErtl,以表彰他在固体表面化学过程研究中做出的开拓性贡献。
GerhardErtl不仅成功地描述了合成氨、CO氧化、H在金属表面的吸附等基本化学反应的具体过程,而且建立的一套表面化学研究方法,奠定了现代表面化学研究的基础。
[关键词]诺贝尔化学奖;合成氨;CO氧化[中图分类号]O647,O6-09[文献标识码]A[文章编号]1000-7857(2007)24-0025-05ChemicalProcessesonSolidSurfaces—Introductiontothe2007NobelPrizeinChemistryMAXiufang1,2,DENGHuiqiu2,LIWeixue11.StateKeyLaboratoryofCatalysis,DalianInstituteofChemicalPhysics,ChineseAcademyofSciences,Dalian116023,LiaoningProvince,China2.CollegeofPhysicsandMicroelectronicsScience,HunanUniversity,Changsha410082,ChinaAbstract:The2007NobelPrizeinChemistryisawardedbytheRoyalSwedishAcademyofSciencestoGerhardErtlforhisthoroughstudiesonfundamentalmolecularprocessesatthegas-solidinterface.Ertlhasnotonlysucceededinprovidingadetaileddescriptionofchemicalreactionssuchasammoniasynthesis,COoxidationandhydrogenationadsorptiontakingplaceonsurfaces,butalsodevelopedageneralmethodologyappliedtothemolecularsurfacescience,whichisoneofthefoundationsformodernsurfacechemistry.KeyWords:theNobelPrizeinChemistry;ammoniasynthesis;COoxidationCLCNumbers:O647,O6-09DocumentCode:AArticleID:1000-7857(2007)24-0025-05图12007年度诺贝尔化学奖获得者GerhardErtlFig.1Thewinnerofthe2007NobelPrizeinChemistry:GerhardErtl表面发生碰撞后究竟会发生怎样的变化这一问题进行的。
气体分子在运动过程中接触到固体表面时,可能吸附在固体表面或被弹回到气相中。
如果分子吸附在固体表面,分子既可能直接与表面发生作用引起表面化学性质的变化,又可能因分子与表面的强烈作用导致分子的解离吸附,还可能与表面上吸附的其他分子发生化学反应[1]。
这些气体分子与表面相互作用的基本过程的研究对催化工业及半导体工业的发展、金属腐蚀的研究及新能源的开发等具有重要意义;同时,由于表面环境更接近真实体系,研究目标简单易行,因此其成果对基础化学也十分重要。
GerhardErtl的贡献在于他不仅综合运用多种实验技术成功地描述了一些化学反应的具体过程,而且建立了一套表面化学研究方法,奠定了现代表面化学研究的基础。
H在金属表面吸附过程的研究、合成氨反应过程的催化机理的认识和表面非线性反应动力学理论的建立,是GerhardErtl教授对固体表面化学过程研究的3个最典型的重要贡献[1]。
1研究背景催化、电化学及表面相的热力学研究始于18世纪。
1912年,法国科学家P.Sabatier因使用金属镍粉做催化剂而发现了一种制取氢化不饱和烃的有效方法,与PaulSabatier分享了1912年度的诺贝尔化学奖。
该方法是有机物氢化反应的基础,其中关键的步骤是控制氢以分子形式在金属表面吸附(氢分子在金属表面容易发生解离吸附)。
但氢在金属表面是如何参与反应的这一问题仍一直困扰着科学界,其研究不仅有助于理解有机物氢化反应的过程,而且对诸如金属电极中氢的产生与利用等电化学问题的研究也有重要作用。
F.Haber因合成氨法的发明而获得1918年度诺贝尔化学奖。
在Haber-Bosch过程中,N2+3H2→2NH3,氮气与氢气在高温高压条件下用掺杂钾的铁粉做催化剂生成氨。
这个反应由于其巨大的经济价值,20世纪70年代中期已被广泛研究,虽然人们已经通过动力学的研究发现氮气的吸附是反应的速控步骤,但对其反应机理与反应物的种类及其基元反应过程仍不清楚,对参与反应的是氮原子还是氮分子存在很大的争议。
美国科学家I.Langmuir因提出并研究表面化学获1932年度诺贝尔化学奖。
他为异相催化与水气界面过程的研究做出了一系列开创性贡献,其名字与Lang-muir吸附等温线、异相催化反应中的Langmuir-Hin-shelwood机理等紧密联系在一起[1]。
从1932年起,表面化学过程领域还没有获得过诺贝尔化学奖。
20世纪60年代以前,由于缺乏可以直接探测表面分子反应的实验技术,只能通过测量气相中的化学组分来推测分子在表面发生的化学反应,得到的结果可靠性不高。
加之制备表面时难以精确控制表面的组分与形状,而且表面具有极高的化学活性,很容易吸附气体分子或与之发生反应。
因此,自Langmuir的工作以后,在相当长时间内表面化学领域都缺乏开创性的研究工作。
直到20世纪50 ̄60年代半导体工业领域真空技术的发展,出现了一些在高真空条件下研究表面的新方法,可以从微观水平上对表面现象进行研究,现代表面化学才开始成为一项独立的基础学科并迅猛发展起来。
22007年度诺贝尔化学奖研究成果简介2.1H在金属表面的吸附20世纪60年代,由于半导体领域真空技术的发展,化学家可以在真空条件下制备表面样品,并且出现了紫外光电子能谱(UPS)、X射线光电子能谱(XPS)、低能电子衍射(LEED)等一系列在真空条件下研究表面性质的新技术。
GerhardErtl是最早认识到真空技术在固体表面化学过程研究中具有巨大潜力的科学家之一,他充分利用LEED这一新技术,结合其他实验手段,首先研究了H在金属表面的吸附。
1974年,Ertl报道了他同时利用LEED、俄歇电子能谱(AES)、电子能量损失谱(EELS)、快速脱附与激光诱导热脱附等5种技术对H在Ni(111)、Ni(100)与Ni(110)3个晶面的吸附进行研究的结果,给出了吸附热及吸附后的结构变化等信息[3]。
1979年,他又通过LEED、热脱附谱(TDS)与功函数的测量得到了H在Ni(111)吸附的几何结构[4]。
他还对H在Pd(110)、Pd(111)与台阶面的吸附过程用LEED,TDS进行了研究[5]。
以上研究不仅为当时探讨有机物氢化反应的催化机理提供了重要信息,而且展示了如何把LEED方法与其他实验技术结合起来以获得可靠的实验结果(许多化学过程的研究很难依靠单一的实验方法得出正确的结论)。
GerhardErtl还常常用新的实验技术研究他以前研究过的问题,例如,早在1976年Ertl就曾用LEED,EELS,AES和TDS对H在Pt(111)面的吸附过程及随覆盖度的变化进行过研究[6],最近他又通过高分辨电子能量损失谱(HREELS)与LEED,TDS的测量结合第一性原理计算研究了H在Pt表面吸附的吸附和振动态[7-8](图2[8])。
2.2Haber-Bosch过程中催化反应的分子机制2.2.1氮的解离及氮原子的确定20世纪70年代中期,GerhardErtl开始转向Haber-Bosch过程分子机制的研究。
Haber-Bosch过程符合Langmuir-Hinshelwood机理,反应的第一步是氢气与氮气在铁表面的吸附。
Ertl从其早期研究中知道氢分子在铁表面很容易解离,以氢原子形式吸附在表面[9]。
对于氮气,由于氮氮三键的键能非常大,在Fe表面能否解离尚不清楚,在Haber-Bosch过程中参与反应的是氮分子还是氮原子,长期以来一直争论不休。
Ertl用LEED,AES,UPS,TDS与功函数的测量研究了氮在不同温度时在Fe(111)[10],Fe(100)[10]与Fe(110)[11]面的吸附过程,发现N在铁的表面可以解离吸附,并用LEED方法测出了氮原子在Fe(100)面吸附的结构(图3)[12]。
至此,虽然知道氮在Fe表面可以解离,但在反应中氮气是直接与氢反应还是解离后再与氢反应仍不清楚。
为了解决这个问题,他设计了一个理想的模型实验:把清洁的铁表面放在真空腔中,一边向体系不断通入氢,一边用XPS与UPS测量铁表面氮原子的浓度。