探究铁钉生锈的原因的实验报告
- 格式:doc
- 大小:11.50 KB
- 文档页数:2

一、实验目的本实验旨在探究铁生锈的条件,分析铁生锈的原理,并验证影响铁生锈速度的因素。
二、实验原理铁生锈是铁与氧气和水发生氧化还原反应的过程。
在潮湿的环境中,铁与氧气和水充分接触,铁逐渐被氧化,生成铁锈。
实验中,通过控制变量法,探究不同条件下铁生锈的速度。
三、实验材料1. 实验器材:铁钉、试管、蒸馏水、植物油、干燥剂氯化钙、棉花、剪刀、镊子、秒表等。
2. 实验试剂:无。
四、实验步骤1. 将铁钉清洗干净,用剪刀将棉花剪成适当大小,放入试管底部。
2. 分别设置三个实验组,如下:(1)实验组A:在试管中加入适量蒸馏水,将铁钉完全浸入水中。
(2)实验组B:在试管中加入适量蒸馏水,将铁钉下半部分浸入水中,上半部分浸入植物油中。
(3)实验组C:将干燥剂氯化钙放入试管底部,然后将铁钉放入试管中,塞上棉花,用橡皮塞密封试管。
3. 同时开始计时,观察三个实验组铁钉生锈的情况,记录生锈时间。
五、实验结果与分析1. 实验组A:铁钉在水中生锈速度较快,约需5天时间。
2. 实验组B:铁钉下半部分在水中生锈,上半部分在植物油中未生锈,约需7天时间。
3. 实验组C:铁钉未生锈,试管内氯化钙吸收了水分,保持干燥。
分析:1. 实验组A结果表明,铁钉在水中容易生锈,说明铁与氧气和水充分接触时容易生锈。
2. 实验组B结果表明,铁钉下半部分在水中生锈,而上半部分在植物油中未生锈,说明植物油可以隔绝氧气,减缓铁生锈速度。
3. 实验组C结果表明,干燥剂氯化钙可以吸收水分,保持试管内干燥,从而防止铁生锈。
六、结论1. 铁生锈的条件是铁与氧气和水充分接触。
2. 植物油可以隔绝氧气,减缓铁生锈速度。
3. 保持干燥可以防止铁生锈。
七、实验讨论1. 实验过程中,为何铁钉在水中生锈速度较快?答案:铁钉在水中与氧气和水充分接触,铁逐渐被氧化,生成铁锈。
2. 实验过程中,为何植物油可以减缓铁生锈速度?答案:植物油可以隔绝氧气,使铁钉与氧气接触减少,从而减缓铁生锈速度。

一、实验目的通过本实验,探究铁钉生锈的原因,分析影响铁钉生锈的各种因素,并探讨有效的防锈措施。
二、实验原理铁钉生锈是铁与氧气和水发生化学反应的结果。
在潮湿的空气中,铁钉表面会形成一层氧化膜,即铁锈。
铁锈的生成是一个电化学腐蚀过程,涉及到电子的转移。
三、实验器材1. 铁钉(若干)2. 玻璃瓶(若干)3. 水(蒸馏水)4. 植物油5. 盐(食盐)6. 干燥剂(无水氯化钙)7. 橡皮塞8. 纱布9. 秒表10. 记录本四、实验步骤1. 准备实验材料:将铁钉、玻璃瓶、水、植物油、盐、干燥剂等实验材料准备好。
2. 实验分组:将铁钉分为四组,分别编号为A、B、C、D。
3. 实验组A:将铁钉放入玻璃瓶中,加入蒸馏水,使铁钉完全浸没在水中,密封瓶口。
4. 实验组B:将铁钉放入玻璃瓶中,加入蒸馏水,使铁钉部分浸没在水中,部分裸露在空气中,密封瓶口。
5. 实验组C:将铁钉放入玻璃瓶中,加入蒸馏水,使铁钉完全浸没在水中,滴加少量植物油,密封瓶口。
6. 实验组D:将铁钉放入玻璃瓶中,加入蒸馏水,使铁钉部分浸没在水中,部分裸露在空气中,滴加少量植物油,密封瓶口。
7. 对照组:将铁钉放入玻璃瓶中,加入蒸馏水,使铁钉完全浸没在水中,加入少量盐,密封瓶口。
8. 观察记录:将四个玻璃瓶放置在相同的环境中,每天观察铁钉的生锈情况,并记录数据。
五、实验现象1. 实验组A:铁钉完全浸没在水中,生锈速度较慢。
2. 实验组B:铁钉部分浸没在水中,部分裸露在空气中,生锈速度较快。
3. 实验组C:铁钉完全浸没在水中,滴加植物油,生锈速度较慢。
4. 实验组D:铁钉部分浸没在水中,部分裸露在空气中,滴加植物油,生锈速度较慢。
5. 对照组:铁钉完全浸没在水中,加入盐,生锈速度最快。
六、实验结论1. 铁钉生锈的主要原因是铁与氧气和水发生化学反应。
2. 铁钉部分浸没在水中,部分裸露在空气中时,生锈速度较快。
3. 滴加植物油可以减缓铁钉的生锈速度。
4. 在水中加入食盐可以加快铁钉的生锈速度。

铁钉生锈实验报告一、实验介绍铁钉生锈是我们生活中常见的现象之一,但是你知道铁钉为什么会生锈吗?本次实验旨在通过模拟真实环境中的条件,探究铁钉生锈的原因。
二、实验材料1. 铁钉:我们选择了三个相同材质和规格的铁钉作为实验样品。
2. 水:我们将使用自来水作为实验中的溶液。
三、实验步骤1. 准备工作:将三个铁钉清洁干净,以确保实验结果的准确性。
2. 分组操作:将三个铁钉分为三组,每组的铁钉数量相等。
3. 实验条件设置:- 组一:将铁钉放置于常温且湿度较高的室内环境。
- 组二:将铁钉放置于常温但相对湿度较低的室内环境。
- 组三:将铁钉浸泡在水中。
4. 实验观察与记录:- 每隔一天,观察并记录铁钉表面的变化情况。
- 记录实验进行的天数。
四、实验结果及分析通过实验观察与记录,我们得到了如下结果:在组一,铁钉表面开始出现少量氧化斑点,随着实验天数的增加,这些斑点逐渐扩大并蔓延。
经过五天的观察,铁钉几乎整个表面都被覆盖了。
这是因为常温且湿度较高的环境中,空气中的水分与铁钉表面的氧气反应,形成了铁的氧化物,即生锈的产物。
组二的观察结果显示,铁钉表面的生锈现象相对较少。
在相对湿度较低的环境下,由于水分供应有限,铁钉的氧化速度大大降低,导致生锈现象不明显。
相比之下,组三中浸泡在水中的铁钉表面迅速产生了大量的生锈现象。
水充当了一个催化剂的角色,加速了铁的氧化反应。
五、实验结论通过以上实验结果及分析,我们可以得出以下结论:1. 铁钉在常温且湿度较高的环境下容易生锈,这是由于铁钉与空气中的水分与氧气反应形成铁的氧化物。
2. 相对湿度较低会减缓铁钉的氧化速度,从而降低铁钉生锈的现象。
3. 水对铁钉生锈具有明显的催化作用,浸泡在水中的铁钉会迅速产生大量的生锈现象。
六、实验启示通过这个实验,我们不仅了解到了铁钉生锈的原因,还意识到环境对其生锈速度的影响。
我们可以通过控制环境条件来减缓铁制品的生锈速度,如在潮湿环境中加强通风,保持环境相对湿度的合理范围。

化学实验报告《观察铁钉生锈的过程》(精选五篇)第一篇:化学实验报告《观察铁钉生锈的过程》1>,生锈,但不严重,水中溶解有一定的空气,金属铁在潮湿的空气中生锈;2>,不生锈,只有水,但是没有空气;3>,生锈,最严重,水和空气都很充足;4>,生锈,较严重,空气中有一定量的水蒸气。
蒸馏水中的铁钉生锈速度最慢。
速度排序:2第二篇:化学实验报告格式例一定量分析实验报告格式(以草酸中h2c2o4含量的测定为例)实验题目:草酸中h2c2o4含量的测定实验目的:学习naoh标准溶液的配制、标定及有关仪器的使用;学习碱式滴定管的使用,练习滴定操作。
实验原理:h2c2o4+2naoh===na2c2o4+2h2o计量点ph值8.4左右,可用酚酞为指示剂。
naoh标准溶液采用间接配制法获得,以邻苯二甲酸氢钾标定:-cook-cooh+naoh===-cook-coona+h2o此反应计量点ph值9.1左右,同样可用酚酞为指示剂。
实验方法:一、naoh标准溶液的配制与标定准确称取0.4~0.5g邻苯二甲酸氢钾三份,分别置于250ml锥形瓶中,加20~30ml蒸馏水溶解,再加1~2滴0.2%酚酞指示剂,用naoh标准溶液滴定至溶液呈微红色,半分钟不褪色即为终点。
二、h2c2o4含量测定准确称取0.5g左右草酸试样,置于小烧杯中,加20ml蒸馏水溶解,然后定量地转入100ml容量瓶中,用蒸馏水稀释至刻度,摇匀。
实验数据记录与处理:一、naoh标准溶液的标定实验编号123备注mkhc8h4o4/g始读数终读数结果vnaoh/ml始读数终读数结果cnaoh/mol·l-1naoh/mol·l-1结果的相对平均偏差二、h2c2o4含量测定实验编号123备注cnaoh/mol·l-1m样/gv样/ml20.0020.0020.00vnaoh/ml始读数终读数结果ωh2c2o4h2c2o4结果的相对平均偏差实验结果与讨论:结论:例二合成实验报告格式实验题目:溴乙烷的合成实验目的:1.学习从醇制备溴乙烷的原理和方法2.巩固蒸馏的操作技术和学习分液漏斗的使用。

一、实验目的通过本次实验,探究铁钉生锈的原因,了解除锈的原理和方法,并验证不同除锈剂对铁钉除锈效果的影响。
二、实验原理铁钉生锈主要是由于铁与空气中的氧气和水发生氧化反应,生成氧化铁(铁锈)。
除锈实验主要基于以下原理:1. 物理除锈:通过摩擦、打磨等方式去除铁锈。
2. 化学除锈:利用酸、碱等化学物质与铁锈发生反应,溶解铁锈。
三、实验材料1. 生锈铁钉:5根2. 除锈剂:钢丝刷、砂纸、稀盐酸、稀硫酸、纯碱溶液、草酸溶液3. 实验工具:剪刀、量筒、滴管、镊子、烧杯、手套、防护眼镜、实验记录表四、实验步骤1. 物理除锈:- 将生锈铁钉用剪刀剪成相同长度。
- 用钢丝刷轻轻刷去铁钉表面的锈层。
- 用砂纸打磨铁钉表面,直至铁钉表面光滑。
2. 化学除锈:- 将生锈铁钉分别放入以下除锈剂中:- 稀盐酸溶液:1:1(体积比)- 稀硫酸溶液:1:1(体积比)- 纯碱溶液:1:1(体积比)- 草酸溶液:1:1(体积比)- 观察铁钉在除锈剂中的变化,记录除锈时间。
- 用清水冲洗铁钉,去除残留的除锈剂。
3. 除锈效果比较:- 将除锈后的铁钉分别用钢丝刷和砂纸进行处理,去除表面的残留物。
- 观察并比较不同除锈剂对铁钉除锈效果的影响。
五、实验结果1. 物理除锈:- 使用钢丝刷和砂纸可以有效去除铁钉表面的锈层,但除锈效果相对较慢。
2. 化学除锈:- 稀盐酸、稀硫酸、纯碱溶液和草酸溶液均能有效地去除铁钉表面的锈层,其中草酸溶液的除锈效果最佳。
- 除锈时间:草酸溶液 < 稀盐酸 = 稀硫酸 = 纯碱溶液。
3. 除锈效果比较:- 草酸溶液除锈后的铁钉表面光滑,锈层去除最为彻底。
- 稀盐酸、稀硫酸和纯碱溶液除锈后的铁钉表面仍有少量锈层。
六、实验结论1. 铁钉生锈的主要原因是铁与空气中的氧气和水发生氧化反应。
2. 物理除锈和化学除锈均能有效去除铁钉表面的锈层,其中草酸溶液的除锈效果最佳。
3. 在实际应用中,可根据具体情况选择合适的除锈方法。

一、实验目的通过本实验,探究铁钉生锈的条件及其影响因素,验证铁钉生锈与氧气、水分的关系,并分析铁钉纯度对生锈过程的影响。
二、实验原理铁钉生锈是铁与氧气、水分发生电化学腐蚀的结果。
在潮湿的环境中,铁钉表面会形成微电池,铁作为阳极被氧化,氧气作为阴极被还原,从而产生铁锈。
铁的纯度也会影响生锈速度,纯铁不易生锈。
三、实验材料与仪器1. 实验材料:铁钉、蒸馏水、植物油、食盐、干燥剂、三个透明塑料瓶、滴管2. 实验仪器:天平、温度计、计时器、量筒、显微镜四、实验步骤1. 将三个塑料瓶分别标记为A、B、C。
2. 在A瓶中放入干燥剂,用滴管向瓶中滴入少量蒸馏水,形成湿润的环境。
3. 在B瓶中放入食盐,用滴管向瓶中滴入少量蒸馏水,形成盐水环境。
4. 在C瓶中不加入任何物质,形成干燥环境。
5. 将三个铁钉分别放入三个瓶子中,用瓶盖密封。
6. 在实验开始时记录铁钉的重量,并观察铁钉的生锈情况。
7. 每隔一定时间(如一天、三天、一周、两周)观察铁钉的生锈情况,并记录数据。
8. 利用显微镜观察铁钉表面的微观结构,分析铁钉生锈的原因。
五、实验现象与结果1. 在A瓶中,铁钉逐渐生锈,表面出现红褐色锈斑。
2. 在B瓶中,铁钉生锈速度较快,表面出现大量红褐色锈斑。
3. 在C瓶中,铁钉未发生生锈现象。
4. 利用显微镜观察,发现A、B瓶中铁钉表面的锈斑结构相似,均为氧化铁。
5. 经过两周的实验,A瓶中铁钉的重量减轻,B瓶中铁钉的重量减轻较多。
六、实验分析与结论1. 铁钉生锈的条件是氧气和水分同时存在。
在A、B瓶中,铁钉与氧气、水分充分接触,导致生锈。
2. 盐水环境可以加速铁钉的生锈速度。
B瓶中食盐的存在使得铁钉与水分中的离子相互作用,促进了电化学腐蚀过程。
3. 干燥环境不利于铁钉生锈。
C瓶中干燥剂吸收了瓶内的水分,使得铁钉无法与水分接触,从而未发生生锈。
4. 铁的纯度对生锈速度有一定影响。
本实验中,未观察到纯铁钉的生锈现象,说明纯铁不易生锈。
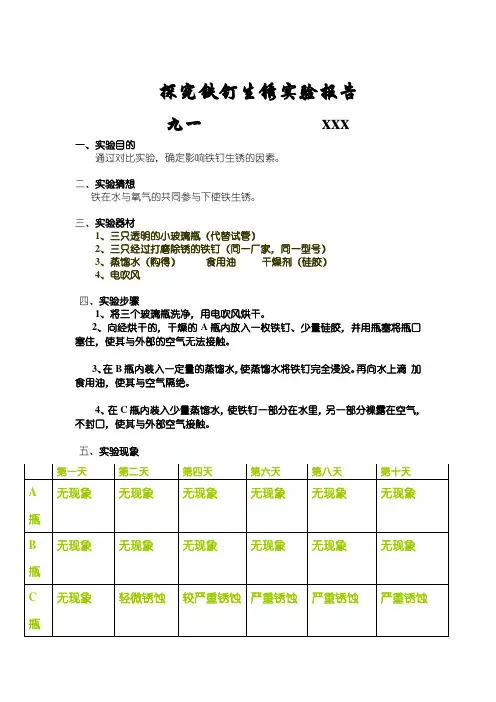
探究铁钉生锈实验报告
九一xxx
一、实验目的
通过对比实验,确定影响铁钉生锈的因素。
二、实验猜想
铁在水与氧气的共同参与下使铁生锈。
三、实验器材
1、三只透明的小玻璃瓶(代替试管)
2、三只经过打磨除锈的铁钉(同一厂家,同一型号)
3、蒸馏水(购得)食用油干燥剂(硅胶)
4、电吹风
四、实验步骤
1、将三个玻璃瓶洗净,用电吹风烘干。
2、向经烘干的,干燥的A瓶内放入一枚铁钉、少量硅胶,并用瓶塞将瓶口
塞住,使其与外部的空气无法接触。
3、在B瓶内装入一定量的蒸馏水,使蒸馏水将铁钉完全浸没。
再向水上滴
加食用油,使其与空气隔绝。
4、在C瓶内装入少量蒸馏水,使铁钉一部分在水里,另一部分裸露在空气,
不封口,使其与外部空气接触。
五、实验现象
第一天第二天第四天第六天第八天第十天
A瓶无现象无现象无现象无现象无现象无现象
B瓶无现象无现象无现象无现象无现象无现象
C瓶无现象轻微锈蚀较严重锈蚀严重锈蚀严重锈蚀严重锈蚀
六、实验结论
铁生锈的必要条件是氧气.水同时存在。
破坏其中任意一个即可防止锈蚀。

一、实验目的1. 探究铁生锈的条件和过程。
2. 分析影响铁生锈速度的因素。
3. 探讨铁生锈的防锈措施。
二、实验原理铁生锈是铁与氧气和水发生氧化反应的过程。
铁在潮湿的空气中,由于氧气和水的共同作用,会发生电化学腐蚀,从而生成铁锈。
铁锈的主要成分是氧化铁。
三、实验材料与仪器1. 实验材料:铁钉、蒸馏水、植物油、食盐、氯化钙、试管、烧杯、铁架台、橡皮塞、导管、止水夹、红墨水、稀盐酸。
2. 实验仪器:铁丝网、硬质玻璃管、单孔橡皮塞、乳胶管、止水夹、烧杯。
四、实验步骤1. 准备实验装置:按照实验原理,组装实验装置,并检查装置的气密性。
2. 放置铁钉:将事先经过除锈并在清水中漂洗干净的铁钉放入硬质玻璃管中。
3. 注入溶液:用带导管的橡皮塞塞紧下端,用止水夹夹住下端乳胶管,并从上端向硬质玻璃管中注满食盐水。
4. 密封上端:再用带导管的橡皮塞塞紧上端,并用止水夹夹住上端乳胶管。
5. 观察现象:打开两端止水夹,排净其中的食盐水后,再夹住上端的止水夹,然后把硬质玻璃管下端导管插入烧杯中红墨水液面以下。
6. 记录数据:观察并记录铁钉生锈的情况,以及红墨水在硬质玻璃管中的上升情况。
五、实验结果与分析1. 铁钉生锈现象:实验结果表明,在食盐水中,铁钉生锈速度明显加快,且红墨水在硬质玻璃管中的上升速度也相应加快。
2. 影响因素分析:- 氧气:铁钉在干燥的空气中不生锈,而在潮湿的空气中容易生锈,说明氧气是铁生锈的必要条件。
- 水:铁钉在纯水中不生锈,但在食盐水中生锈速度加快,说明水中的溶解物质(如盐)可以加速铁生锈。
- 电解质:食盐水中含有电解质,可以促进铁的电化学腐蚀,从而加快铁生锈速度。
3. 防锈措施:- 隔绝氧气和水:将铁制品涂上油漆、镀上不易生锈的金属,或将其放置在干燥的环境中,可以隔绝氧气和水,从而防止铁生锈。
- 控制电解质:在水中加入适量的防腐剂,可以抑制铁的电化学腐蚀,从而减缓铁生锈速度。
六、实验结论1. 铁生锈的条件是氧气、水和电解质的存在。

一、实验目的通过本实验,探究铁钉锈蚀的条件,分析不同环境下铁钉锈蚀的速度差异,从而加深对金属腐蚀原理的理解。
二、实验背景铁钉作为一种常见的金属材料,广泛应用于日常生活和工业生产中。
然而,铁钉在潮湿环境中容易发生锈蚀,影响其使用寿命和性能。
了解铁钉锈蚀的条件,有助于采取相应的防护措施,延长铁钉的使用寿命。
三、实验材料1. 铁钉:6根,规格一致2. 试管:6支,干净、透明3. 蒸馏水:适量4. 植物油:适量5. 干燥剂:适量6. 食盐水:适量7. 锌片:适量8. 铜丝:适量9. 记录本:1本10. 笔:1支四、实验步骤1. 将6根铁钉编号为1-6。
2. 将试管(1)放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触。
3. 将试管(2)的试管底放入干燥剂,再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触。
4. 将试管(3)先放入一根铁钉,趁热倒入煮沸的蒸馏水(赶出原先溶液在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触。
5. 将试管(4)中放入铁钉注入食盐水,使铁钉和空气及食盐水接触。
6. 将试管(5)放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片。
7. 将试管(6)放入相连的铁钉和铜丝,注入自来水浸没铁钉和铜丝。
8. 将6支试管放在试管架上,每天观察并记录铁钉锈蚀情况。
五、实验结果与分析1. 试管(1):铁钉与空气和水接触,锈蚀速度较快。
2. 试管(2):铁钉与干燥空气接触,锈蚀速度较慢。
3. 试管(3):铁钉与煮沸的蒸馏水和植物油接触,锈蚀速度最慢。
4. 试管(4):铁钉与食盐水和空气接触,锈蚀速度较快。
5. 试管(5):铁钉与锌片和自来水接触,由于锌比铁活泼,铁钉得到保护,锈蚀速度较慢。
6. 试管(6):铁钉与铜丝和自来水接触,由于铜比铁不活泼,铁钉被腐蚀,锈蚀速度较快。
六、实验结论1. 铁钉锈蚀需要氧气和水,且锈蚀速度受环境因素影响。
2. 在干燥空气中,铁钉锈蚀速度较慢。

一、实验目的通过本实验,探究铁生锈的条件,分析铁生锈的化学原理,并尝试寻找有效的防锈方法。
二、实验原理铁生锈是一种电化学腐蚀过程,其主要原因是铁与氧气和水蒸气发生反应,生成氧化铁。
在潮湿环境中,铁表面形成的水膜为电化学反应提供了电解质,加速了铁的腐蚀。
三、实验材料1. 铁钉2. 烧杯3. 蒸馏水4. 植物油5. 盐水6. 纯净水7. 干燥剂8. 玻璃片9. 铁丝网10. 铅笔四、实验步骤1. 将铁钉分为三组,分别编号为A、B、C。
2. 组A:将铁钉放入烧杯中,加入蒸馏水,使铁钉部分浸入水中。
3. 组B:将铁钉放入烧杯中,加入蒸馏水,然后在水面滴入几滴植物油,使铁钉与水隔绝。
4. 组C:将铁钉放入烧杯中,加入蒸馏水,然后在水中加入适量盐,使铁钉部分浸入盐水中。
5. 将三组铁钉分别放置在通风良好的环境中,观察并记录铁钉生锈情况。
6. 使用铁丝网包裹铁钉,观察并记录铁钉生锈情况。
7. 使用干燥剂吸收铁钉表面的水分,观察并记录铁钉生锈情况。
五、实验现象1. 组A:铁钉部分浸入水中,生锈速度较快。
2. 组B:铁钉与水隔绝,基本不生锈。
3. 组C:铁钉部分浸入盐水中,生锈速度较快。
4. 使用铁丝网包裹铁钉,铁钉生锈速度减慢。
5. 使用干燥剂吸收铁钉表面的水分,铁钉生锈速度减慢。
六、实验分析1. 铁生锈的条件是铁与氧气和水蒸气接触。
在潮湿环境中,铁钉表面形成的水膜为电化学反应提供了电解质,加速了铁的腐蚀。
2. 植物油和干燥剂可以隔绝铁钉与水蒸气的接触,从而减缓铁钉的生锈速度。
3. 盐水中的氯离子可以加速铁的腐蚀,使铁钉生锈速度加快。
4. 铁丝网可以减缓铁钉的生锈速度,但效果不如植物油和干燥剂。
七、结论1. 铁生锈的条件是铁与氧气和水蒸气接触,潮湿环境会加速铁的腐蚀。
2. 植物油、干燥剂和铁丝网可以减缓铁钉的生锈速度,但效果不同。
3. 盐水中的氯离子会加速铁的腐蚀。
八、防锈措施1. 避免铁制品暴露在潮湿环境中。

探究影响铁钉生锈的因素
一、实验目的
通过对比实验,确定影响铁钉生锈的因素。
二、实验猜想
铁在水与氧气的共同参与下使铁生锈。
三、实验器材
1、三只透明的小玻璃瓶(代替试管)
2、三只经过打磨除锈的铁钉(同一厂家,同一型号)
3、蒸馏水(购得)食用油干燥剂(硅胶)
4、电吹风
四、实验步骤
1、将三个玻璃瓶洗净,用电吹风烘干。
2、向经烘干的,干燥的A瓶内放入一枚铁钉、少量硅胶,并用瓶塞将瓶口
塞住,使其与外部的空气无法接触。
3、在B瓶内装入一定量的蒸馏水,使蒸馏水将铁钉完全浸没。
再向水上滴加
食用油,使其与空气隔绝。
4、在C瓶内装入少量蒸馏水,使铁钉一部分在水里,另一部分裸露在空气,不
封口,使其与外部空气接触。
五、实验现象
第一天第二天第四天第六天第八天第十天A瓶无现象无现象无现象无现象无现象无现象
B瓶无现象无现象无现象无现象无现象无现象
C瓶无现象轻微锈蚀较严重锈蚀严重锈蚀严重锈蚀严重锈蚀
六、实验结论
铁生锈的必要条件是氧气、水同时存在。
破坏其中任意一个即可防止锈蚀。
第1篇一、实验背景铁钉作为日常生活中常见的金属制品,其耐腐蚀性能直接影响其使用寿命。
为了探究铁钉生锈的条件及其影响因素,我们进行了铁钉生锈实验,通过对比不同条件下铁钉的生锈情况,总结出铁钉生锈的相关规律。
二、实验目的1. 探究铁钉生锈的条件。
2. 分析影响铁钉生锈速度的因素。
3. 了解铁钉生锈的机理。
三、实验材料与设备1. 实验材料:铁钉、蒸馏水、植物油、干燥剂、食盐、试管、烧杯、滴管等。
2. 实验设备:天平、温度计、计时器、显微镜等。
四、实验方法1. 将铁钉分别放入装有蒸馏水、植物油、干燥剂的试管中,观察铁钉的生锈情况。
2. 在蒸馏水中加入食盐,观察铁钉的生锈速度变化。
3. 将铁钉分为三组,分别置于干燥、潮湿、水中三种环境下,观察铁钉的生锈情况。
4. 通过显微镜观察铁钉表面微观结构变化。
五、实验结果与分析1. 蒸馏水实验:铁钉在蒸馏水中未生锈,说明铁钉生锈需要氧气。
2. 植物油实验:铁钉在植物油中未生锈,说明铁钉生锈需要与空气接触。
3. 干燥剂实验:铁钉在干燥剂中未生锈,说明铁钉生锈需要潮湿环境。
4. 食盐实验:在蒸馏水中加入食盐后,铁钉生锈速度明显加快,说明食盐可以加速铁钉生锈。
5. 环境实验:在干燥环境下,铁钉生锈速度最慢;在潮湿环境下,铁钉生锈速度最快;在水中,铁钉生锈速度次之。
6. 显微镜观察:在潮湿环境下,铁钉表面出现明显的锈蚀痕迹;在干燥环境下,铁钉表面无明显变化。
六、实验结论1. 铁钉生锈需要同时具备氧气、水分和温度三个条件。
2. 食盐、酸碱等物质可以加速铁钉生锈。
3. 潮湿环境有利于铁钉生锈,干燥环境不利于铁钉生锈。
七、实验讨论1. 实验结果表明,铁钉生锈是一个复杂的电化学腐蚀过程,涉及铁、氧气、水分等多种因素。
2. 铁钉表面形成的氧化物层(铁锈)具有一定的保护作用,但在潮湿环境下,铁锈层容易脱落,导致铁钉继续生锈。
3. 为了提高铁钉的耐腐蚀性能,可以采取以下措施:涂漆、镀锌、采用不锈钢等。
铁钉的生锈实验报告引言铁是一种常见的金属材料,而生锈则是铁在与氧气和水接触时产生的一种化学反应。
随着时间的推移,铁会逐渐变得腐蚀、生锈,影响其外观和性能。
本次实验旨在观察铁钉在不同环境条件下的生锈程度,并找出影响铁钉生锈速率的因素。
实验目标1. 观察铁钉在不同环境条件下的生锈程度。
2. 探讨影响铁钉生锈速率的因素。
实验原理铁生锈是指铁与氧气和水发生化学反应,生成氧化铁(Fe2O3)。
铁钉暴露在潮湿环境中,空气中的水分与氧气接触,加速了铁的腐蚀过程。
因此,湿度是影响铁钉生锈速率的关键因素之一。
实验材料1. 铁钉2. 湿度计3. 水4. 不同环境条件(如室内、室外、密封容器等)实验步骤1. 准备不同环境条件下的实验组:室内未封闭、室内封闭、室外未封闭、室外封闭。
2. 使用湿度计测量不同环境条件下的湿度。
3. 将铁钉分别放置在不同环境条件中,确保每组铁钉数量和尺寸相同。
4. 每隔一段时间观察和记录铁钉的生锈程度,特别注意每组实验的时间记录,以便进行比较分析。
5. 在实验结束后,拍摄照片以供记录。
实验结果不同环境下铁钉生锈程度比较环境条件初始时刻1小时2小时3小时 ... 结束时刻- - -室内未封闭无生锈轻微生锈明显生锈严重生锈 ...铁钉被完全覆盖室内封闭无生锈轻微生锈轻微生锈轻微生锈 ...铁钉表面有些许生锈室外未封闭无生锈明显生锈明显生锈明显生锈 ...铁钉被完全覆盖室外封闭无生锈无生锈无生锈无生锈 ...铁钉不生锈影响因素比较根据观察和记录的数据,我们可以得出以下结论:1. 湿度是影响铁钉生锈速率的最显著因素。
室内和室外未封闭的环境湿度较高,导致铁钉生锈较为迅速;而在室内和室外封闭的环境中,湿度较低,铁钉生锈较慢甚至不生锈。
2. 氧气是铁钉生锈的另一个关键因素。
封闭环境中氧气的供应受到限制,从而减缓了铁钉的生锈速率。
3. 潮湿的环境加速了铁钉生锈的过程。
湿度高的环境中,铁钉更容易吸收周围的水分,加速了与氧气的反应。
一、实验目的通过本实验,观察和分析铁钉在不同环境条件下的生锈情况,探究影响铁钉生锈的主要因素,并验证铁钉生锈的基本原理。
二、实验原理铁钉生锈是铁与氧气、水及酸性、碱性、盐类溶液等发生化学反应的结果。
铁钉在潮湿的环境中容易生锈,其生锈过程可以表示为:4Fe + 3O2 + 6H2O → 4Fe(OH)3Fe(OH)3 → Fe2O3·3H2O(铁锈)三、实验材料与仪器1. 实验材料:铁钉、蒸馏水、植物油、食盐水、干燥剂、烧杯、试管、镊子、记录本、笔等。
2. 实验仪器:天平、量筒、滴管、酒精灯、烘箱等。
四、实验步骤1. 准备实验材料:将铁钉、蒸馏水、植物油、食盐水、干燥剂等实验材料准备好。
2. 实验分组:将铁钉分为三组,分别编号为A、B、C。
3. A组实验:将A组铁钉放入烧杯中,加入适量的蒸馏水,观察铁钉生锈情况。
4. B组实验:将B组铁钉放入试管中,加入适量的蒸馏水,滴入几滴植物油,使铁钉部分浸入水中,观察铁钉生锈情况。
5. C组实验:将C组铁钉放入烧杯中,加入适量的食盐水,观察铁钉生锈情况。
6. 对照实验:将干燥剂放入烧杯中,将铁钉放入烧杯中,观察铁钉生锈情况。
7. 实验观察与记录:每天观察铁钉的生锈情况,并做好记录。
8. 数据分析:根据实验数据,分析影响铁钉生锈的因素。
五、实验现象1. A组实验:铁钉在蒸馏水中生锈速度较慢。
2. B组实验:铁钉在部分浸入水中时,生锈速度较A组实验快。
3. C组实验:铁钉在食盐水中生锈速度最快。
4. 对照实验:铁钉在干燥剂中不生锈。
六、实验结果与分析1. 铁钉生锈速度与水的存在密切相关,水中溶解的氧气是铁钉生锈的主要因素。
2. 植物油可以减缓铁钉的生锈速度,因为植物油隔绝了铁钉与氧气、水的接触。
3. 食盐水中含有氯离子,可以加速铁钉的腐蚀过程,导致铁钉生锈速度加快。
4. 干燥剂可以吸收铁钉周围的空气中的水分,从而减缓铁钉的生锈速度。
七、结论1. 铁钉生锈的主要原因是铁与氧气、水及酸性、碱性、盐类溶液等发生化学反应。
探究铁钉生锈的实验报告
一、实验目的
通过对比实验,确定影响铁钉生锈的因素。
二、实验猜想
铁在同时拥有水与氧气的情况下可以生锈。
三、实验器材
1、三个瓶子
2、三只一模一样的铁钉(即大小相同,形状相同)
3、纯净水 植物油 干燥剂(鞋盒中或食品中)
四、实验步骤 1、将三个瓶子洗净,放在水平桌面上
2、在第一个瓶内放入一些干燥剂(鞋盒中或食品中的都行),放入一个铁钉并用瓶塞将瓶口塞住,使其与外部的空气无法接触。
3、在第二个瓶内装入一个铁钉,用纯净水将铁钉完全浸没。
再向水上滴 加一层植物油,使其与空气隔绝,盖上盖子。
4、在第三个瓶内装入一个铁钉,用水没过铁钉一半,使铁钉一部分在水里,另一部分裸露在空气, 不盖盖,使其与外部空气接触。
五、实验现象 六、实验结论
铁生锈的必要条件是氧气.水同时存在缺一不可。
铁生锈的因素与氧气,水有关。
第一天 第二天 第四天 第六天 第八天 第十天 1瓶 无现象
无现象 无现象 无现象 无现象 无现象 2瓶 无现象
无现象 无现象 无现象 无现象 无现象 3瓶 无现象 轻微锈蚀,但不明显 较严重锈蚀,较明显 严重锈蚀非常明显 严重锈蚀,非常明显
严重锈蚀,
非常明显。
铁钉生锈的实验报告铁钉生锈的实验报告导言:生活中我们常常会见到铁制品生锈的现象,而铁钉作为一种常见的金属制品,在潮湿的环境中尤其容易生锈。
为了深入了解铁钉生锈的原因以及探究其发生的机制,我们进行了一系列的实验,并撰写了以下的实验报告。
实验目的:通过模拟潮湿环境,观察铁钉在不同条件下的生锈情况,探究生锈的原因及机制。
实验材料:1. 铁钉:选取长度相近的新铁钉,确保实验的公平性。
2. 水:用于模拟潮湿环境。
3. 盐:用于模拟海水等含盐环境。
4. 醋酸:用于模拟酸性环境。
实验步骤:1. 实验一:将一根铁钉放置于常温下的室内环境中观察。
2. 实验二:将一根铁钉浸泡于水中,观察其生锈情况。
3. 实验三:将一根铁钉浸泡于盐水中,观察其生锈情况。
4. 实验四:将一根铁钉浸泡于醋酸中,观察其生锈情况。
实验结果:1. 实验一:在常温下的室内环境中,铁钉并未发生明显的生锈现象。
2. 实验二:在水中浸泡的铁钉表面开始出现细小的锈斑,随着时间的推移,锈斑逐渐扩大。
3. 实验三:在盐水中浸泡的铁钉表面迅速出现大面积的锈斑,锈斑呈现出红棕色。
4. 实验四:在醋酸中浸泡的铁钉表面出现了与盐水类似的锈斑,但较为轻微。
实验分析:1. 实验一的结果表明,常温下的室内环境并不会引起铁钉的明显生锈。
这是因为铁钉表面的氧化层能够对空气中的氧气起到一定的保护作用,防止铁钉进一步与氧气发生反应。
2. 实验二的结果显示,水中的氧气能够与铁钉表面的氧化层发生反应,形成水分子和氧化铁,导致铁钉生锈。
这是因为水分子中的氧气能够加速铁的氧化反应,使铁钉表面逐渐失去保护层。
3. 实验三的结果表明,盐水中的盐离子能够加速铁的氧化反应,使铁钉迅速生锈。
盐离子的存在能够降低水的表面张力,使水分子更容易与铁钉表面接触,从而加速氧化反应的进行。
4. 实验四的结果显示,醋酸中的酸性物质能够与铁钉表面的氧化层发生反应,加速铁的氧化过程。
然而,醋酸的浓度较低,因此铁钉的生锈程度较轻。
探究铁钉生锈的原因的实验报告探究影响铁钉生锈的因素的实验报告
一、实验目的
通过对比实验,确定影响铁钉生锈的因素。
二、实验猜想
铁在水与氧气的共同参与下使铁生锈。
三、实验器材
1、三只透明的小玻璃瓶,代替试管,
2、三只经过打磨除锈的铁钉,同一厂家,同一型号,
3、蒸馏水,购得,食用油干燥剂,硅胶,
4、电吹风
四、实验步骤
1、将三个玻璃瓶洗净,用电吹风烘干。
2、向经烘干的,干燥的A瓶内放入一枚铁钉、少量硅胶,并用瓶塞将瓶口
塞住,使其与外部的空气无法接触。
3、在B瓶内装入一定量的蒸馏水,使蒸馏水将铁钉完全浸没。
再向水上滴加食用油,使其与空气隔绝。
4、在C瓶内装入少量蒸馏水,使铁钉一部分在水里,另一部分裸露在空气, 不封口,使其与外部空气接触。
五、实验现象
第一天第二天第四天第六天第八天第十天
A瓶无现象无现象无现象无现象无现象无现象
B瓶无现象无现象无现象无现象无现象无现象
C瓶无现象轻微锈蚀较严重锈蚀严重锈蚀严重锈蚀严重锈蚀六、实验结论
铁生锈的必要条件是氧气.水同时存在。
破坏其中任意一个即可防止锈蚀。