高考化学复习——无机化工流程专题复习
- 格式:docx
- 大小:404.81 KB
- 文档页数:8



专题讲座二无机化工流程题复习策略与解题方法指导一、解题策略化工流程中常见的操作与名词化工流程题目在流程上一般分为3个过程:错误!―→错误!―→错误!(1)原料处理阶段的常见考点与常见名词1加快反应速率2溶解:通常用酸溶。
如用硫酸、盐酸、浓硫酸等水浸:与水接触反应或溶解浸出:固体加水(酸)溶解得到离子浸出率:固体溶解后,离子在溶液中含量的多少(更多转化)酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程3灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解4控制反应条件的方法(2)分离提纯阶段的常见考点1调pH值除杂a.控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀若要除去Mn2+2+提示:先用氧化剂把Fe2+氧化为Fe3+,再调溶液的pH到3.7。
b.调节pH所需的物质一般应满足两点:能与H+反应,使溶液pH值增大;不引入新杂质。
例如:若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH值。
2试剂除杂3加热:加快反应速率或促进平衡向某个方向移动如果在制备过程中出现一些受热易分解的物质或产物,则要注意对温度的控制。
如:侯氏制碱中的NaHCO3;还有如H2O2、Ca(HCO3)2、KMnO4、AgNO3、HNO3(浓)等物质。
4降温:防止某物质在高温时会溶解(或分解)、为使化学平衡向着题目要求的方向移动5萃取(3)获得产品阶段的常见考点1洗涤(冰水、热水)洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
2蒸发、反应时的气体氛围抑制水解:如从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在HCl 的气流中加热,以防其水解。
3蒸发浓缩、冷却结晶:如除去KNO3中的少量NaCl。
4蒸发结晶、趁热过滤:如除去NaCl中的少量KNO3。
5重结晶(4)其他常见考点1化学方程式2实验仪器3计算4信息二、热点题型探究热点1碱金属及其矿物的开发利用例1(2012·广东理综,32)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2++2K++Mg2++4SO错误!+2H2O为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:(1)滤渣主要成分有________和________以及未溶杂卤石。

第59讲无机化工流程题的解题策略[复习目标] 1.提升应用物质的转化及条件控制、分离提纯操作等相关知识解决实际问题的能力。
2.树立“绿色化学”的观念,形成资源综合利用、物能充分利用的意识。
1.常考无机化工流程的呈现形式2.读图要领(1)箭头:进入的是投料(反应物),出去的是含产品中元素的物质(流程方向)、副产物或杂质(支线方向)。
(2)三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环。
3.流程图中主要环节的分析(1)原料的预处理①溶解:通常用酸溶,如用硫酸、盐酸等。
水浸与水接触发生反应或溶解浸出固体加水(酸)溶解得到离子酸浸在酸溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去浸出率固体溶解后,离子在溶液中的含量的多少②灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。
③审题时要“瞻前顾后”,注意物质性质及反应原理的前后联系。
(2)核心反应——陌生方程式的书写①氧化还原反应:熟练应用氧化还原反应规律判断产物,并根据化合价升降相等配平。
②非氧化还原反应:结合物质性质和反应实际判断产物。
(3)常用的分离方法①过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
②萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
③蒸发结晶:提取溶解度随温度变化不大的溶质,如从溶液中提取NaCl。
④冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
⑤蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
⑥冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的NH3。
一、调控化学反应速率提高效率1.向铬铁矿(FeCr2O4)中通入O2进行焙烧,焙烧时气体与矿料逆流而行,目的是___________。



高考复习——无机工艺流程专题化学工艺流程题是近年高考命题旳热点。
化学工艺流程题以化工生产、能源、材料、环境等方面旳常见化学事物为背景,规定明确,设问层次清晰,以无机或有机化合物旳构成、性质、变化等内容为载体,规定考生运用所学化学知识、原理和技能从化学视角看待、分析或处理生产、生活实际中旳简朴化学问题。
解答所需知识、措施都是化学旳关键内容。
一、题设探究1、展现形式资料卡:物质旳理化性质,如易潮解、易水解、易与某些物质反应等;流程图:生产工艺流程;表格:熔沸点、溶解度、Ksp等;图像:溶解度、反应速率等。
2、设问方式:4、知识落点:基本理论、元素化合物、试验。
因此,我们需要运用有关物质旳性质和反应原理旳基本知识,还要掌握某些分离提纯物质旳基本试验技能,关键是还要具有分析生产工艺流程旳措施和能力。
二、解题思绪1、解题环节第一,浏览全题,确定该流程旳目旳(即由何原料获得何产物,有何副产物),记住资料卡中给出旳理化性质;第二,粗读流程图,尽量弄懂流程图每部旳目旳,宏观把握整个流程,但不必将每一种物质都推出;第三,精读试题,根据问题去精心研究某一步或某一种物质。
第四,要看清所问题,不能答非所问,并注意语言体现旳科学性。
2、注意事项:答题时,不要力争把生产流程图中旳每个细节都弄清晰,只要把握住重要旳考察方向,理清每个环节旳目旳和成果,再根据题中旳详细设问,结合题中提取旳信息和头脑中原有旳知识和技能,进行针对性作答即可,切不可拘泥于流程图中旳每个细节,把时间和精力过多用于流程分析,使解题误入歧途。
前一问回答不了,并不一定会影响回答背面旳问题。
三、解题措施1、工艺流程模板2、预处理旳措施及目旳(1)粉碎或研磨:增大固液(或固气或固固)接触面积,加紧反应(溶解)速率,增大原料旳转化率(或浸取率)。
(2)煅烧或灼烧:不易转化旳物质转为轻易提取旳物质;其他矿转化为氧化物;除去有机物;除去热不稳定旳杂质(3)酸浸:溶解、去氧化物(膜)、调整pH增进水解(沉淀)(4)碱溶:去油污,去铝片氧化膜,溶解铝、二氧化硅,调整pH增进水解(沉淀)(5)控制温度:3、分离提纯旳措施及目旳①盐溶液旳分离提纯措施:结晶法:结晶法有蒸发结晶和冷却结晶两种措施,大多数同学通过一轮旳复习已经明白纯物质溶液要得到晶体旳措施,难点在于混合溶液得到晶体旳操作。


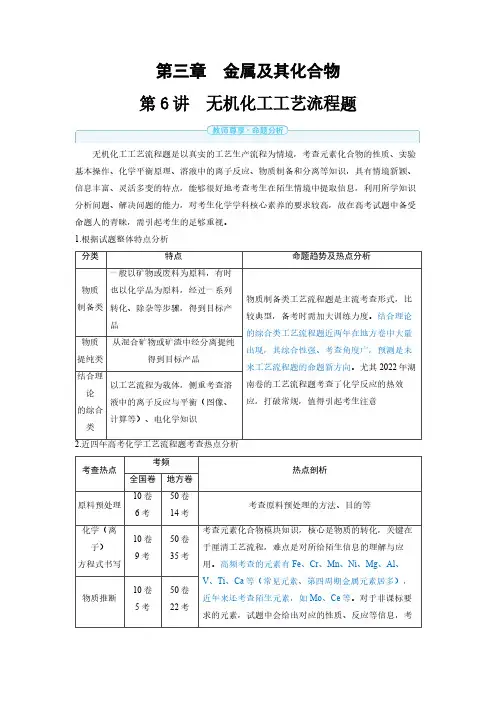
第三章金属及其化合物第6讲无机化工工艺流程题无机化工工艺流程题是以真实的工艺生产流程为情境,考查元素化合物的性质、实验基本操作、化学平衡原理、溶液中的离子反应、物质制备和分离等知识,具有情境新颖、信息丰富、灵活多变的特点,能够很好地考查考生在陌生情境中提取信息,利用所学知识分析问题、解决问题的能力,对考生化学学科核心素养的要求较高,故在高考试题中备受命题人的青睐,需引起考生的足够重视。
1.根据试题整体特点分析分类特点命题趋势及热点分析物质制备类一般以矿物或废料为原料,有时也以化学品为原料,经过一系列转化、除杂等步骤,得到目标产品物质制备类工艺流程题是主流考查形式,比较典型,备考时需加大训练力度。
结合理论的综合类工艺流程题近两年在地方卷中大量出现,其综合性强、考查角度广,预测是未来工艺流程题的命题新方向。
尤其2022年湖南卷的工艺流程题考查了化学反应的热效应,打破常规,值得引起考生注意物质提纯类从混合矿物或矿渣中经分离提纯得到目标产品结合理论的综合类以工艺流程为载体,侧重考查溶液中的离子反应与平衡(图像、计算等)、电化学知识2.近四年高考化学工艺流程题考查热点分析考查热点考频热点剖析全国卷地方卷原料预处理10卷6考50卷14考考查原料预处理的方法、目的等化学(离子)方程式书写10卷9考50卷35考考查元素化合物模块知识,核心是物质的转化,关键在于厘清工艺流程,难点是对所给陌生信息的理解与应用。
高频考查的元素有Fe 、Cr 、Mn 、Ni 、Mg 、Al 、V 、Ti 、Ca 等(常见元素、第四周期金属元素居多),近年来还考查陌生元素,如Mo 、Ce 等。
对于非课标要求的元素,试题中会给出对应的性质、反应等信息,考物质推断10卷5考50卷22考查考生对新信息的提取、理解、分析、应用能力循环利用10卷4考50卷11考引导考生将所学知识应用于生产实际,需考虑经济性、环保性,体现科学态度与社会责任化学学科核心素养生产条件的选择与优化10卷4考50卷21考实验仪器与操作—50卷11考将化学工艺流程与实验相结合,主要考查分离提纯及检验的相关操作化学平衡常数相关计算10卷4考50卷20考将化学工艺流程与化学平衡相结合,考查沉淀溶解平衡,常根据K sp计算溶液pH等,近两年地方卷开始融合沉淀转化、电离平衡、水解平衡等进行考查电化学10卷1考50卷5考将化学工艺流程与电化学相结合,考查电极反应式书写及电化学的相关计算注:本表格以近四年具有代表性的全国卷及新高考地方卷为蓝本,全国卷共10套(2020年3套、2021年2套、2022年2套、2023年3套),新高考地方卷共50套(2020年8套、2021年15套、2022年15套、2023年12套)。
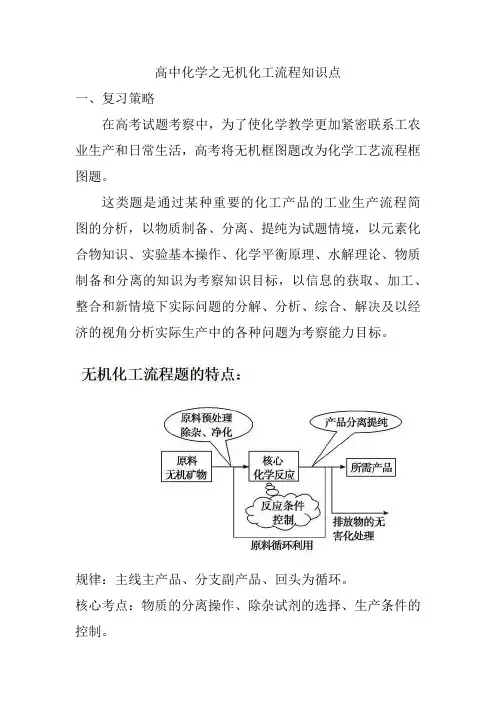
高中化学之无机化工流程知识点一、复习策略在高考试题考察中,为了使化学教学更加紧密联系工农业生产和日常生活,高考将无机框图题改为化学工艺流程框图题。
这类题是通过某种重要的化工产品的工业生产流程简图的分析,以物质制备、分离、提纯为试题情境,以元素化合物知识、实验基本操作、化学平衡原理、水解理论、物质制备和分离的知识为考察知识目标,以信息的获取、加工、整合和新情境下实际问题的分解、分析、综合、解决及以经济的视角分析实际生产中的各种问题为考察能力目标。
规律:主线主产品、分支副产品、回头为循环。
核心考点:物质的分离操作、除杂试剂的选择、生产条件的控制。
(1)流程的呈现主要有以物质转化为主线,以操作过程为主线,甚至有时候会以设备为主线。
(2)这类题常围绕以下几个知识点进行设问:①反应速率与平衡理论的运用;反应物颗粒大小:反应速率、原料的利用率等温度:反应速率、物质的稳定性、物质的结晶等②氧化还原反应的判断、化学方程式或离子方程式的书写;③利用控制pH分离除杂;④化学反应的能量变化;⑤实验基本操作:除杂、分离、检验、洗涤、干燥等;⑥流程中的物质转化和循环,资源的回收和利用;⑦环境保护与绿色化学评价。
解答无机化工流程试题的程序:(1)基本步骤①从题干中获取有用信息,了解生产的产品。
②然后整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。
③分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么B.发生了什么反应C.该反应造成了什么后果,对制造产品有什么作用。
抓住一个关键点:一切反应或操作都是为获得产品而服务。
④从问题中获取信息,帮助解题。
(2)流程具体分析:化工过程加某物质的可能作用:①参与反应:作为原料参加反应、作为除杂试剂、作为除污染试剂②提供氛围(关注参与反应的物质性质的特殊性或反应条件的特殊性):如氧化或还原性氛围、酸碱性氛围调节pH值、温度氛围如提供能量维持高温、作溶剂如调节溶解度。
③满足定量要求:如提供合适的元素比例,以符合产品的需要。
高考无机化工流程知识点高考时化学科目中无机化学是一个重要的考点,其中流程知识点又是一个重点和难点。
了解无机化工流程的原理和具体步骤,不仅有助于高考试题的解答,更能够在实际应用中有所帮助。
本文将介绍一些常见的无机化工流程知识点。
1. 酸碱中和反应酸碱中和反应是化学反应中最基本的一种类型。
在无机化工流程中,酸碱中和反应被广泛应用于酸洗、盐酸制备等过程中。
在酸碱中和反应中,酸和碱反应生成盐和水。
具体的反应方程式可以通过酸的化学式和碱的化学式来推导得出。
2. 氧化还原反应氧化还原反应是无机化工流程中常见的反应类型。
氧化还原反应指的是物质的氧化态和还原态发生变化的化学反应。
在无机化工流程中,氧化还原反应广泛应用于电镀、电解、锌与酸反应等过程中。
了解氧化还原反应的原理和条件对于解答高考试题也非常重要。
3. 沉淀反应沉淀反应是无机化工流程中常见的一种反应类型。
沉淀反应发生时,两种物质反应生成一个不溶于溶液中的固体产物,即沉淀。
沉淀反应在无机化工中被广泛应用于产生纯度较高的物质、提纯物质等过程中。
4. 配位反应配位反应是无机化学中非常重要的一种反应类型。
配位反应指的是配体与中心金属离子之间发生的配位作用。
在无机化工流程中,配位反应广泛应用于制备配合物、催化剂等过程中。
理解配位反应的原理和条件有助于高考试题的解答。
5. 晶体生长晶体生长是无机化工流程中涉及到的一个重要环节。
晶体生长指的是从溶液中沉积出具有有序结构的晶体。
在无机化工中,晶体生长被广泛应用于制备纯度较高的无机材料、光电器件等过程中。
了解晶体生长的原理和条件对于高考试题的解答和实际应用都有帮助。
无机化工流程知识点是高考化学科目中的重点和难点。
通过了解并掌握酸碱中和反应、氧化还原反应、沉淀反应、配位反应和晶体生长等知识点,可以提高化学的应用能力和解题能力。
同时,这些知识点也对于学习化学的发展历程、工业生产过程等方面有一定的帮助。
专题讲座二无机化工流程题解题方法指导一、解题策略化工流程中常见的操作与名词化工流程题目在流程上一般分为3个过程:原料处理―→分离提纯―→获得产品(1)原料处理阶段的常见考点与常见名词①加快反应速率②溶解:通常用酸溶,如用硫酸、盐酸、浓硫酸等水浸:与水接触反应或溶解浸出:固体加水(酸)溶解得到离子浸出率:固体溶解后,离子在溶液中含量的多少(更多转化)酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程③灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解④控制反应条件的方法(2)分离提纯阶段的常见考点①调pH值除杂a.控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀例如:已知下列物质开始沉淀和沉淀完全时的pH如下表所示物质开始沉淀沉淀完全Fe(OH)3 2.7 3.7Fe(OH)27.6 9.6Mn(OH)28.3 9.8若要除去Mn2+溶液中含有的Fe2+,应该怎样做?提示:先用氧化剂把Fe2+氧化为Fe3+,再调溶液的pH到3.7。
b.调节pH所需的物质一般应满足两点:能与H+反应,使溶液pH值增大;不引入新杂质。
例如:若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH值。
②试剂除杂③加热:加快反应速率或促进平衡向某个方向移动如果在制备过程中出现一些受热易分解的物质或产物,则要注意对温度的控制。
如:侯氏制碱中的NaHCO3;还有如H2O2、Ca(HCO3)2、KMnO4、AgNO3、HNO3(浓)等物质。
④降温:防止某物质在高温时会溶解(或分解)、为使化学平衡向着题目要求的方向移动⑤萃取(3)获得产品阶段的常见考点①洗涤(冰水、热水):洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
②蒸发、反应时的气体氛围抑制水解:如从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在HCl的气流中加热,以防其水解。
高考化学复习——无机化工流程专题复习
素养说明:化学工艺流程题是近几年高考的热点题型。
试题以工农业生产为背景,与产品提纯、环境保护、生产成本等相融合,依托生产流程,考查物质的制备、分离、提纯、检验等。
通过识图联题培养学生“宏观辨识与微观探析”素养,结合流程中的初始原理与目的产物分析物质的去向及相关化工措施、化学试剂的选择培养学生的“证据推理与模型认知”素养,帮助学生树立绿色环保的化学理念。
[名师点拨]
1.工艺流程题过程解读
(1)读流程图
①箭头:箭头进入的是投料(反应物)、出去的是主产物或副产物(生成物)。
②三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环。
(2)解题要点
①审题要点:a.了解生产目的、原料及产品;b.了解题目提供的信息;c.分析各步的反应条件、原理及物质成分;d.理解物质分离、提纯、条件控制等操作的目的及要点。
②答题切入点:a.原料及产品的分离提纯,b.生产目的及反应原理;c.生产要求及反应条件;
d.有关产率、产量及组成的计算;
e.绿色化学。
2.工艺流程题常见答题方向
工艺操作(结果)目的评价(或操作名称)
方法
措施
研磨(粉碎)增大接触面积,加快反应(溶解)速率
煅烧(焙烧)矿物分解、燃烧,转化为易溶于酸、碱的物质
水浸利用水溶性把物质进行分离。