阿伏伽德罗常数易错点
- 格式:doc
- 大小:34.50 KB
- 文档页数:6

专题5 阿伏加德罗常数正误判断中的常见陷阱1.已知物质的质量求微粒的数目主要应用N=mM·N A来计算,解答此类题应注意看清所求微粒的种类,分子的构成(是单原子分子,还是双原子分子或多原子分子)以及微粒中含有的质子数、中子数、电子数等。
2.已知气体的体积求微粒的数目主要应用N=VV m·N A来计算,解题时要注意:(1)若题目给出物质的体积,一要看是否是标准状况,若不是标准状况,则1 mol气体的体积一般不为22.4 L;二要看该物质在标准状况下是不是气体,若不是气体,则无法求其物质的量和分子数目;若是气体,则可求其物质的量和分子数目,这与其是混合气体还是单一气体无关。
在标准状况下,SO3是固体,水、乙醇、CCl4是液体。
(2)若题目给出气体的质量或物质的量,则微粒数目与外界条件无关。
(3)注意某些物质分子中的原子个数。
例如稀有气体为单原子分子,臭氧(O3)为三原子分子,白磷(P4)为四原子分子。
3.已知物质的量浓度求微粒的数目主要应用N=c·V·N A来计算。
解题时注意物质的组成。
如0.1 mol/L的AlCl3溶液1 L含有Cl-的数目为0.3N A。
(1)阿伏加德罗常数是指1 mol任何粒子的粒子数,这里的粒子指同种粒子,如1 mol O2中的分子数为N A,而1 mol O2中的氧原子数为2N A。
(2)考查一定物质的量的物质中含有多少粒子(分子、原子、质子、电子等),注意看清微粒的种类,常涉及稀有气体He、Ne等单原子分子,N2、O2等双原子分子及O3等多原子分子。
(3)阿伏加德罗常数具有单位(mol-1),是一个准确值,而6.02×1023无单位,是一个纯数值,是阿伏加德罗常数的近似值,计算时通常使用这个近似值,而在叙述或定义“摩尔”的概念时要用“阿伏加德罗常数”来表示。
陷阱之一:标准状况与常温、常压以及气态与非气态的难辨别性【典型例题】(2021·山东薛城·高一期中)设N A表示阿伏加德罗常数值,下列说法中正确的是A.通常状况下,16g O2和O3混合气体所含的氧原子数为N AB.1mol/L的Na2SO4溶液中,含有的氧原子数为4N AC.标准状况下,22.4L H2O中含有的分子个数为N AD.标准状况下,22.4L空气所含气体的分子总数为N A【答案】AD【详解】A.16g O2和O3的混合气体中O原子的物质的量为1mol,则氧原子的个数为NA,A正确;B.体积未知,不能计算个数,故B错误;C.标准状况下,H2O不是气体,故不能计算物质的量,故C错误;D.标准状况下,22.4L空气的物质的量为1mol,故所含气体的分子总数为N A,故D正确;故选AD。

高中化学阿伏伽德罗常数的易错点阿伏伽德罗常数是理综高考全国卷常设的一道题目,主要是以选择题的形式出现。
近5年高考,在全国卷中,总计出现了6次,而在自主命题的省份里,也绝大部分都考察了NA 的应用。
阿伏伽德罗常数的易错点一、阿伏伽德罗常数主要命题点1、摩尔质量、气体摩尔体积、以及摩尔浓度。
2、物质的组成和结构。
特别是有机物的结构式、化学键。
3、电子转移数目4、可逆反应,包括弱酸弱碱的电离,弱盐的水解。
二、阿伏伽德罗常数易错点1、外界条件及物质状态2、物质中的原子数、电子数、质子数、中子数、化学键数目3、电子转移数目,特别是关于氯气、铁等参与反应时得失电子数的计算4、特殊反应三、解题秘籍——洞悉陷阱设置1、抓“两看”:看气体是否处于标准状态;看标准状况下是否是气体。
常见的陷阱设置:①常温常压;室温;②标准状况下非气体物质:H2O、CCl4、CHCl3、SO3、HF、苯、乙醇、己烷等。
注意只有同时满足:标准状况、气体这两个条件,才可以使用22.4L/mol这个常数。
2、记“组成和结构式”:比如Na2O2与Na2O的电子式、阴阳离子比;C3H8、C2H5OH的结构式,CO2的pi键个数等;注意金刚石中C与C-C比例为1:2,石墨C与C-C比例为2:3,SiO2与Si-O比例为1:4,P4、CH4、N2的结构式。
3、利用关系式法解题。
比如2017全国III卷:0.1mol的11B 中,含有0.6NA格个中子。
分析:列出B:中子=1:6,1:6=0.1mol:x,求出x=0.6mol。
该选项正确。
4、混合气体采取极限处理。
比如2017全国II卷:标准状况下,2.24L N2和O2的混合气体中分子数为0.2NA。
解析:利用极限处理法,假设2.24L全部为N2,假设N2的物质的量为x,则N2:分子数=1:1=(2.24L/22.4L/mol):x,求出x=0.1mol;同样假设2.24L全部为O2,假设O2的物质的量为y,则O2:分子数=1:1=(2.24L/22.4L/mol):x,求出y=0.1mol;即x=y=0.1mol ≠0.2mol。

精心整理专题一:化学计量在实验中的应用知识点一:物质的量、摩尔质量以及阿伏伽德罗常数(考点,易错点)1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
(注意任何粒子)2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
(注意任何粒子)3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
(注意单位)4.物质的量=物质所含微粒数目/阿伏加德罗常数 n =N/N A5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g.mol-1(3)6.物质的量=物质的质量/摩尔质量 ( n = m/M )例1:列说法中正确的是()A.H2的摩尔质量是2 gB.1 mol氧的质量是C.氧气的摩尔质量是32 g·mol-1D.2 g H2含6.02×10变式练习1.标准状况下有①0.112 L水②0.5N A个HCl氦气⑥6.02×10232.含0.4 mol Al2(SO4)3的溶液中,含、“<”或“=”)3.(1)1 mol_______________________个氢原子。
(2)水所含氢原子数相同。
4. 5 K下呈现超导性。
据报道,该晶体的化学式为Na0.35CoO2·12.2 g该晶体中含氧原子数__________,氢原5.用N A()。
A2N AB.28 g2N AC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A知识点二:气体摩尔体积与阿伏伽德罗定律(考点,重点,易错点)1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol4. 阿伏加德罗定律:同温同压下,相同的任何气体,含有数目的分子(或气体的物质的量相同)。

微专题·大素养1 阿伏加德罗常数常考易错点【常考易错点】一、气体状态与体积1.判断正误(正确的打“√”,错误的打“×”)(1)标准状况下,22.4 L己烷中含共价键数目为19N A( )(2)常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A( )(3)标准状况下,2.24 L HF含有的HF分子数为0.1N A( )(4)标准状况下,2.24 L三氯甲烷含有的分子数目为0.1N A ( )(5)22.4 L(标准状况)氩气含有的质子数为18N A( )(6)常温常压下,124 g P4中所含P—P键数目为4N A( )(7)标准状况下,2.24 L CCl4含有的共价键数为0.4N A( )[提醒] 解答此类试题,突破的关键是抓住“三看”:二、微粒的组成与结构2.判断正误(正确的打“√”,错误的打“×”)(1)在常温常压下,32 g 18O2中含有2N A个氧原子( )(2)17 g —OH与17 g OH-所含电子数均为10N A( )(3)相同质量的N2O4与NO2中所含原子数目相同( )(4)标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2N A( )(5)18 g D2O所含的电子数为10N A( )(6)1 mol Na2O2固体中含离子总数为4N A( )(7)31 g白磷中含有的共价键数为1.5N A( )(8)2.0 g H218O与D2O的混合物中所含中子数为N A( )(9)常温常压下,32 g O2和O3的混合气体中含有的原子数为2N A( )(10)56 g乙烯中所含共用电子对数目为12N A( )(11)78 g苯中含有3N A碳碳双键( )(12)60 ℃时,92 g NO2与N2O4的混合气体中含有的原子总数为6N A( )[提醒] 熟记特殊物质的组成结构(1)记特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、—OH、OH-等,理清整体与部分的关系。

阿伏伽德罗常数易错点1、标准摩尔体积适用条件:标况下、气体。
所给条件欠缺。
如:1、常温常压下,22.4LCO2中含有n A个CO2分子;2、常温下,23gNO2含有n A个氧原子;3、常温下,4gCH4含有n A个C—H共价键;4、1mol/L NaCl溶液中含有n A个Na+例1 设N A为阿伏伽德罗常数,下列说法正确的是A、标准状况下33.6L水含有1.5N A个水分子B、2.24LCO2中含有的原子数为0.3N AC、常温常压下,22.4LO2所含电子数为32N A个D、标准状况下,2.24LCl2与足量Fe反应,转移的电子数为0.2N A2、设N A为阿伏伽德罗常数的值。
下列叙述正确的是A、1mol甲醇中含有C—H键的数目为4 N AB、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1 N AC、标准状况下,2.24L已烷含有分子的数目为0.1 N AD、常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4 N A3、设N A为阿伏加德罗常数的数值,下列说法正确的是( )A、常温下,23 g NO2含有N A个氧原子B、1 L 0.1 mol·L-1氨水含有0.1 N A个OH-C、常温常压下,22.4 L CCl4含有N A个CCl4分子D、1 mol Fe2+与足量的H2O2溶液反应,转移2 N A个电子4、下列说法正确的是A.0.5molO3与11.2LO2所含的分子数一定相等B.25℃与60℃时,水的pH相等C.中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等D.2SO2(g) + O2(g) = 2SO3(g)和4SO2(g) + 2O2(g) = 4SO3(g)的△H相等5、用N A表示阿伏加德罗常数的值。
下列叙述正确的是A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH数目为0.2N AB.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2N AC.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5N AD.标准状况下,22.4L 甲醇中含有的氧原子数为1.0N A2、注意物质的组成离子化合物有阴阳离子构成,如氯化钠,硫酸铵,氢氧化钾等。
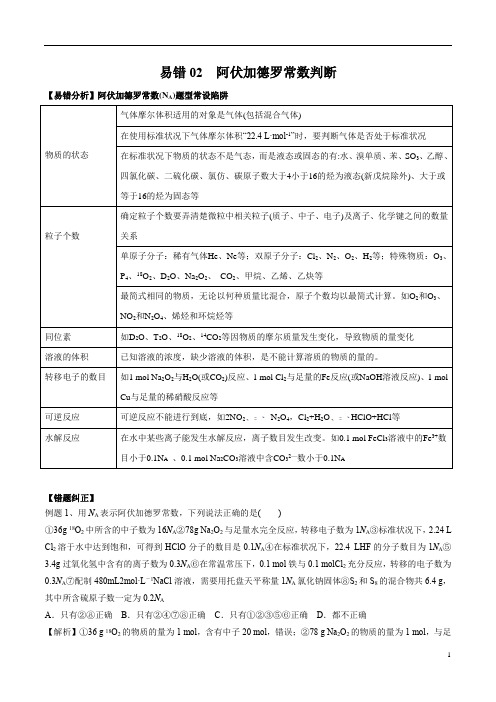
易错02 阿伏加德罗常数判断【易错分析】阿伏加德罗常数(N A)题型常设陷阱可逆反应不能进行到底,如2NO2N2O4,Cl2+H2O HClO+HCl等【错题纠正】例题1、用N A表示阿伏加德罗常数,下列说法正确的是()①36g 18O2中所含的中子数为16N A②78g Na2O2与足量水完全反应,转移电子数为1N A③标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1N A④在标准状况下,22.4 LHF的分子数目为1N A⑤3.4g过氧化氢中含有的离子数为0.3N A⑥在常温常压下,0.1 mol铁与0.1 molCl2充分反应,转移的电子数为0.3N A⑦配制480mL2mol·L-1NaCl溶液,需要用托盘天平称量1N A氯化钠固体⑧S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2N AA.只有②⑧正确B.只有②④⑦⑧正确C.只有①②③⑤⑥正确D.都不正确【解析】①36 g 18O2的物质的量为1 mol,含有中子20 mol,错误;②78 g Na2O2的物质的量为1 mol,与足量水完全反应,转移1 mol电子,正确;③氯气与水的反应属于可逆反应,不能完全反应,得到的HClO分子的数目少于0.1N A,错误;④在标准状况下,HF是液体,22.4 L HF的物质的量大于1 mol,错误;⑤3.4 g 过氧化氢的物质的量为0.1 mol,过氧化氢是共价化合物,其中没有离子,错误;⑥在常温常压下,铁与干燥的氯气不反应,错误;⑦配制480 mL 2 mol·L-1 NaCl溶液,应该选用500 mL的容量瓶,需要用托盘天平称量0.5 L×2 mol·L-1×58.5 g·mol-1=58.5 g氯化钠固体,不能称量氯化钠的数目,错误;⑧S2和S8的混合物共6.4 g,含有S原子的物质的量为6.4 g32 g·mol-1=0.2 mol,其中所含硫原子数一定为0.2N A,正确。
高中化学高考知识点---有关阿伏德罗常数易错点详细清单位一.有关阿伏加德罗常数易错点1.要特别注意单位“L”的陷阱。
如果见到题中出现单位“L”,一定要细查三个陷阱:“是否标况、是否气体、最后检查数值对否”。
而其它单位如“g”,则不必考虑上述问题,常考热点是:在标况时,苯、戊烷、溴、SO3、H2O、CCl4、CHCl3、CH2Cl2、HF、NO2不是气,而HCHO、SO2、C4H10等为气态。
2.要特别注意题目中设置与计算无关的一些干扰条件,题目常常给出非标准状况下气体的物质的量或质量,干扰学生的正确判断。
要注意物质的质量、摩尔质量、微粒个数不受“温度、压强”外界条件的影响。
3.要注意溶液的陷阱。
如果见到题中考查的对象是溶液,一定要细查三个陷阱:“是否给出溶液体积、是否考虑水的量、都需考虑哪些平衡”。
所以判断电解质溶液中粒子数目时注意“三看”:①是否存在弱电解质的电离或盐类水解。
②已知浓度,是否指明体积,是否能用公式“n=cV”计算。
③在判断溶液中微粒总数时,是否忽视溶剂水。
4.要注意化学反应过程中的陷阱。
如果见到题中考查的对象是化学反应,一定要细查三个陷阱:“是否是可逆反应、是否有条件变化、是谁真正得失电子”。
常考热点是:教材中常见的可逆反应、自身氧化还原反应,以及浓HSO4、HCl、HNO3在反应过程中浓度变稀等。
电子转移得失数目的问题分析,要做到“三注意”:一要注意是否发生歧化反应,如Cl2与H2O或NaOH发生歧化反应时,消耗1 mol Cl2转移1 mol电子;二要注意变价元素,如1 mol Fe与足量盐酸反应转移2 mol电子,而与足量硝酸反应转移3 mol电子;三要注意氧化还原的竞争及用量问题,如向FeBr2溶液中通入Cl2,Cl2的量不同,转移的电子数不同;四要注意可逆反应,反应物不能完全转化。
5.要注意物质结构中的陷阱。
如果遇到题考查的对象是关于物质的微观结构,一定细查三个陷阱:“是求什么粒子、是求什么键、是否最简式相同”。
高三化学五个容易错的专题专题一阿伏伽德罗常数【易错题1】NA表示阿伏加德罗常数,下列叙述正确的是A.等物质的量的N2和CO所含分子数均为NAB.1.7gH2O2中含有的电子数为0.9NAC.1molNa2O2固体中含离子总数为4NAD.标准状况下,2.24L戊烷所含分子数为0.1NA『错解分析』错选C,认为在Na2O2固体中,含有Na+和O-两种离子,1molNa2O2固体中含有2molNa+和2molO-,故其中的离子总数为4NA。
『正确解答』此题考查了阿伏伽德罗常数知识。
阿伏伽德罗常数是指1mol任何微粒中含有的微粒数,等物质的量不一定是1mol,A错;H2O2的相对分子质量为:34,故其1.7g的物质的量为0.05mol,其每个分子中含有的电子为18个,则其1.7g中含有的电子的物质的量为0.9mol,数目为0.9NA,B 对;Na2O2固体中,含有的是Na+和O22-两种离子,1mol固体中含有3mol离子,故其中的离子总数为:4NA,C错;戊烷在标准状况下为液态,故其2.24L不是0.1mol,D错。
『规律小结』进行阿伏伽德罗常数的正误判断的主要考查点有:①判断一定量的物质所含的某种粒子数目的多少;②物质的组成;③通过阿伏加德罗常数进行一些量之间的换算等,在解题时要抓住其中的易错点,准确解答。
【易错题2】设NA为阿伏加德罗常数的值,下列叙述正确的是A.常温下,1L0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NAB.1mol羟基中电子数为10NAC.在反应中,每生成3molI2转移的电子数为6NAD.常温常压下,22.4L乙烯中C-H键数为4NA『错解分析』选B或D。
认为羟基-OH中有8NA个电子或10NA个电子;22.4L乙烯是1mol,1mol乙烯C-H键数为4mol。
『正确解答』本题主要考查的是以阿伏伽德罗常数为载体考查如下知识点①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算等内容。
阿伏加德罗常数正误的判断试题分析出现机率:13套试题中出现过7次;13、14年卷1没有出现,15、16年卷1出现过,17年卷1没出现,但在卷2、3出现过。
总机率和间隔出现的规律来看,18年出现的机率大于60%。
这是第一层次,只是对题目的分析。
3.三看选项特点物质变化预测1.题型特征一般不会发生大的变化,还是以阿伏加德罗常数的正误判断为主。
2.所给的已知条件还会是质量、体积、物质的量浓度和物质的量四个方面,要特别关注气体,包括三个方面:一是非常温常压下的;二是常温常压下的;三是非气态物质。
3.考查点还会围绕着微粒和结构设计,主要落脚在“六子”上,包括化学键和晶体结构的考查,以充分体现出化学学科的微观思想。
4.至少有一个选项会判断化学反应过程中电子数的转移。
5.可能有选项会涉及混合物的分析和判断。
因此要关注具有相同的最简式、具有相同的分子式和相同的相对分子质量等。
6.有可能出现溶液方面的知识,如弱电解质的电离、盐类的水解等。
7.有可能会出现利用化学方程式的计算,关注过量的情况,关注可逆反应,关注稳含的反应(如二氧化氮与四氧化二氮的转化)等。
8.关注点。
(1)以物质的量为中心的概念方面要关注物质的量浓度、气体摩尔体积,也要适当关注不同量之间的转化关系、物质的组成特点以及物质在水溶液中的行为等,比如微粒的水解和电离问题。
(2)除宏观和微观之间的转换外,还要关注微观和微观之间的转换,如离子中所含的电子数、中子数和质子数。
(3)组成方面着重关注具有相同组成特点的分子式,比如含有相同的原子个数、具有相同的最简式、具有相同的分子式和相同的相对分子质量等。
(4)结构方面着重关注:晶体类型、原子结构、根和基等原子团结构等。
(5)溶液方面:弱电解质的电离平衡、盐类的水解平衡等。
(6)物质的变化:利用化学方程式的计算,关注过量的情况;关注隐含的反应(如可逆反应)等。
备考指导考题1 阿伏加德常数正误的判断一、题目结构分析1.题干此类题目的题干一般为“设N A为阿伏伽德罗常数的数值,下列说法正确的是”;2.选项(1)选项组成每个选项一般分为四部分:第一部分,宏观量,即给出物质的质量、体积、物质的量浓度或物质的量等前提条件;第二部分,宏观物质,即给出所研究的具体物质和对象;第三部分,微观粒子,即给出要求求算的对象,包括分子、原子、离子、电子、质子、中子、化学键等;第四部分,微观量,即给出微粒数目或其他微观量。
阿伏加德罗常数易失误的知识点一、要注意气体摩尔体积的适用条件:①标况下气体所含分子数为个,此公式适用于标况下的气体非标况下不能用,但此气体可以是纯净气体也可以是混合气体②若给出的是气体的物质的量或质量,则求微粒数与外界条件无关③标况下:H2O,SO3,HF,己烷,辛烷,二氯甲烷,三氯甲烷,四氯化碳,HCHO,苯为液态或固态等不适用此公式。
例:11.2L N2含有 N2分子数为0.5NA(×)标况下22.4以任意比例混合甲烷和丙烷的混合物分子数为NA(√)常温下32g SO2 气体中含有0.5NA个 SO2(√)46g NO2和 N2O4混合气体含有N原子数为NA(√)二、要注意物质的状态:NA =V×NA/22.4只适用于标况下气体不是气体的不能用此公式。
如:标况下 H2O、SO3、己烷、辛烷、二氯化碳、三氯化碳、四氯化碳、苯为液态或固态三、要注意物质的组成形式:由分子构成的物质:单原子分子:稀有气体( He、Ne、Ar )双原子分子:O2、N2、H2、NO多原子分子:NH3、O3、CH4、CO2、P4 例:1mol氦气含氦原子数为2NA(×)常温下48g O3 含氧原子数为3NA(√)四、要注意晶体结构:(1)P4(白磷):1mol白磷含4mol磷原子、6molP-P键(2) SiO2 晶体:1mol硅原子形成4mol Si-O 键,需要2mol O 与之成键例:31g白磷含0.25NA白磷分子1.5NA个P-P键(√)SiO2 晶体中1mol硅原子与2NA个氧原子形成共价键(√)五、要注意微粒种类:所求微粒个数与微粒种类必须一一对应例:标况下22.4L O2 所含氧原子为NA(×)1L 0.2mol/L Ba( NO3 )2 溶液中微粒数等于0.6NA (×)因为应大于0.6Na,还有 H2O 的电离六、要注意特殊物质摩尔质量:D2O:20g/mol 18O2:36g/mol Na 37Cl :60 1H:1 2D:2 3T:3 例:10g重水里含有的电子数为5NA(√)1.8g重水中含有NA个中子(×)七、要注意氧化还原中电子转移:(1)1mol Na2O2 与CO2与H2O反应转移电子数为NA (2) Cu + SCu2S 6.4g Cu与足量S反应铜失0.1NA个电子(2) Cu + SCu2S 6.4g Cu与足量S反应铜失0.1NA个电子八、要注意可逆过程和化学平衡:如:2NO2====N2O4 则标况下4.6g NO2小于2.24L。
阿伏伽德罗常数易错点
1、标准摩尔体积适用条件:标况下、气体。
所给条件欠缺。
如:1、常温常压下,中含有n A个CO2分子;
2、常温下,23gNO2含有n A个氧原子;
3、常温下,4gCH4含有n A个C—H共价键;
4、1mol/L NaCl溶液中含有n A个Na+
例1 设N A为阿伏伽德罗常数,下列说法正确的是
A、标准状况下水含有个水分子
B、中含有的原子数为
C、常温常压下,所含电子数为32N A个
D、标准状况下,与足量Fe反应,转移的电子数为
2、设N A为阿伏伽德罗常数的值。
下列叙述正确的是
A、1mol甲醇中含有C—H键的数目为4 N A
B、25℃,pH=13的NaOH溶液中含有OH-的数目为 N A
C、标准状况下,已烷含有分子的数目为 N A
D、常温常压下,Na2O2与足量H2O反应,共生成 O2,转移电子的数目为 N A
3、设N A为阿伏加德罗常数的数值,下列说法正确的是( )
A、常温下,23 g NO2含有N A个氧原子
B、1 L mol·L-1氨水含有 N A个OH-
C、常温常压下, L CCl4含有N A个CCl4分子
D、1 mol Fe2+与足量的H2O2溶液反应,转移2 N A个电子
4、下列说法正确的是
A.与所含的分子数一定相等
B.25℃与60℃时,水的pH相等
C.中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等
D.2SO2(g) + O2(g) = 2SO3(g)和4SO2(g) + 2O2(g) = 4SO3(g)的△H相等
5、用N A表示阿伏加德罗常数的值。
下列叙述正确的是
A.25℃时,pH=13的 Ba(OH)2溶液中含有的OH数目为
B.标准状况下, Cl2与过量稀NaOH溶液反应,转移的电子总数为
C.室温下,乙烯和丁烯的混合气体中含有的碳原子数目为
D.标准状况下,甲醇中含有的氧原子数为
2、注意物质的组成
离子化合物有阴阳离子构成,如氯化钠,硫酸铵,氢氧化钾等。
共价化合物和气体单质由分子构成,如H2O、O2、HCl等。
另外有些物质直接由原子构成,如金属、稀有气体等。
例2设N A为阿伏伽德罗常数,下列说法正确的是
A、标准状况下, HCl溶于水后溶液中含有N A个HCl分子
B、的氯化钠固体中含有N A个氯化钠分子
C、常温下,1L L的NH4NO3溶液中氮原子数为
D、中含有的阴离子数为
1、用N A表示阿伏加德罗常数的值,下列叙述中不正确的是
A、分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N A
B、28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2N A
C、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 N A
D、常温常压下, L氯气与足量镁粉充分反应,转移的电子数为2 N A
3、注意“基”和“根”的区别
基团呈电中性,不带电,没有得失电子。
而阴阳离子带点,故在计算电子数目是要注意加上或减去相应的电子数目。
例3设N A为阿伏伽德罗常数,下列说法正确的是
A、等物质的量的甲基(—CH3)和羟基(—OH)所含电子数相等
B、17g羟基(—OH)中所含电子数为10N A
C、在1 mol的OH—中所含的电子数为9 N A
D、16g CH4与18gNH4+所含质子数相等
1、设AN为阿伏加德罗常数的值,下列叙述正确的是
A.常温下, L的NH4NO3溶液中氮原子数为 N A
B.1mol羟基中电子数为10 N A
C.在反应中,每生成3molI2转移的电子数为6 N A
D.常温常压下,乙烯中CH—键数为4N A
4、氧化还原反应中注意化合价的变化
例4 设N A为阿伏伽德罗常数,下列说法正确的是
A、与足量S反应,铜失去个电子
B、标准状况下, NO2与足量H2O反应,转移的电子数为N A
C、分与足量水蒸气反应转移电子数为
D、在反应KIO3 + 6HI = KI + 3I2 + 3H2O中,每生成3 mol I2转移的电子数为6N A
5、注意可逆反应和化学平衡
氯气与水的反应;氮气和氢气反应合成氨气;盐的水解反应等。
例5设N A为阿伏伽德罗常数,下列说法正确的是
A、1mol FeCl3跟水完全反应生成氢氧化铁胶体后,生成的胶体数目为N A
B、一定条件下,1mol N2与足量H2反应,可生成2N A个NH3分子
C、常温常压下,气体中含有个NO2分子
D、标准状况下,氯气与足量水反应转移电子数小于1N A
6、注意特殊物质中的粒子数目。
一些特殊的物质如过氧化物、稀有气体、同位素等,计算粒子数目时容易混淆,故在学习中应该注意归纳总结特殊物质的特殊性。
过氧化物:Na2O2、H2O等,阴离子数为1
稀有气体:Ne、He等,单原子分子
同位素:D为H的同位素之一,其相对原子质量为2,质子数和电子数为1 1mol金刚石中含有2mol C—C键
1mol 石墨中含有六元环
1、1mol Fe2+与足量的H2O2溶液反应,转移2 N A个电子;
2、1mol Cl2与水反应,转移1mol电子;
例6设N A为阿伏伽德罗常数,下列说法正确的是
A、标准状况下,2g氖气含有N A个氖原子
B、1mol Na2O2含有阴阳离子总数为3N A
C、1mol 固体NaHSO4含有阴阳离子总数为3N A
D、常温常压下,20g重水(D2O)中含有的电子数为10N A
1.N A表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的N2和CO所含分子数均为N A
B. H2O2中含有的电子数为 N A
C.1mol Na2O2固体中含离子总数为4 N A
D.标准状况下,戊烷所含分子数为
2、N0为阿伏伽德罗常数的值.下列叙述正确的是
A.1.0·L的NaAlO2水溶液中含有的氧原子数为2N A
石墨烯(单层石墨)中含有六元环的个数为
C. 25℃时pH=13的NaOH溶液中含有OH的数目为 N A
D. 1mol的羟基与1 mot的氢氧根离子所含电子数均为9 N A
3、设NA为阿伏伽德罗常数的值。
下列说法正确的是
A.标准状况下,溶于水,转移的电子数目为
B.常温常压下,18g H2O含有的原子总数为3N A
C.标准状况下,中含有分子的数目为
D.常温常压下,和CO2混合气体中含有的碳原子数目为
7、注意弱电解质的电离和盐类的水解
弱电解质如弱酸、弱碱在水溶液中部分电离,存在电离平衡;盐类水解规律:有弱才水解,无弱不水解,都弱都水解,越弱越水解。
1、1L L的氨水中含有个OH-
2、1L L的NaHCO3中含有个HCO3-
3、常温常压下,8gO2hanyou含有4n A个电子;
例7 设N A为阿伏伽德罗常数,下列说法正确的是
A、LNa2CO3溶液中含有的阴离子数目大于
B、L的氢氧化钠溶液中含钠阴离子数为个
C、LNH4Cl与2L LNH4Cl溶液含NH4+数目相同
D、25℃时,pH=1的稀硫酸中含个H+
1、设NA 为阿伏加德罗常数的值。
下列说法正确的是
A.1 L 1 mol·L的NaClO 溶液中含有ClO的数目为N A
B.78 g 苯含有C=C 双键的数目为3N A
C.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为N A
D.标准状况下,6. 72 L NO2与水充分反应转移的电子数目为
8、注意化学反应进程。
对于一些特殊的反应,随着反应的进行,反应物的量的改变影响着原反应的进行。
如浓溶液在反应中逐渐变稀,故在计算离子数目时应考虑稀溶液能否继续与原物质反应,若不能,则该反应物反应不完全。
如浓硫酸可与金属铜反应,而稀硫酸则不能。
1、1mol Cu和足量稀硝酸反应产生N A个NO分子;
2、Fe与过量的稀硝酸反应,转移2 N A个电子;
3、1mol Na被完全氧化成Na2O2,失去2 N A个电子;
1、设N A为阿伏伽德罗常数,下列说法正确的是
A、标准状况下,和混合后分子总数为N A
B、含n molHCl的浓盐酸与足量MnO2反应可生成nN A/4个氯气
C、含2molH2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生N A个SO2气体分子
D、常温常压下,铁在中充分燃烧,转移的电子数为
2、N A表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,二氯甲烷的分子数约为N A个
B.盛有SO2的密闭容器中含有N A个氧原子,则SO2的物质的量为
C.丙烷中所含的极性共价键为4N A个
D.电解精炼铜时,若阴极得到电子数为2N A个,则阳极质量减少64g。