论他汀类药物的基本骨架及其结构与药效的关系
- 格式:doc
- 大小:235.50 KB
- 文档页数:10

他汀类药物感化机制
他汀类药物有显著的调血脂感化,人体内Ch重要来自肝脏合成,在Ch合成进程中HMG-CoA还原酶使HMG-CoA转换为中央产品MVA.他汀类具有与HMG-CoA类似的构造,且和HMG-CoA还原酶的亲和力凌驾HMG-CoA数千倍,对该酶产生竞争性克制,使Ch合成受阻,除使血浆Ch浓度降低外,还经由过程负反馈调节导致肝细胞概况LDL 受体代偿性增长及活性加强,致使血浆LDL降低,继而导致VLDL代谢加速,再加上肝脏合成及释放VLDL削减,也导致VLDL及TG响应降低.HDL的升高,可能是因为VLDL削减的间接成果.因为各类他汀类药物与HMG-CoA还原酶亲和力的不合,所以调脂的效应各别.比方经常应用的阿托伐他汀:用于治疗高胆固醇血症和混杂型高脂血症;冠芥蒂和脑中风的防治.
本品为他汀类血脂调节药,属HMG-CoA还原酶克制剂.本身无活性,口服接收后的水解产品在体内竞争性地克制胆固醇合成进程中的限速酶羟甲戊二酰辅酶A还原酶,使胆固醇的合成削减,也使低密度脂蛋白受体合成增长,重要感化部位在肝脏,成果使血胆固醇和低密度脂蛋白胆固醇程度降低,中度降低血清甘油三酯水温和增高血高密度脂蛋白程度.由此对动脉粥样硬化和冠芥蒂的防治产生感化.
本品口服接收优越,因经肝内普遍首关代谢,绝对生物应费用较低,大约为12%,本品在肝脏经细胞色素P4503A4代谢为多种活性代谢
物.阿托伐他汀的平均血浆半衰期大约为14小时,但因为其活性代谢物的影响,现实对HMG-CoA还原酶克制造用的半衰期为20~30小时.本品蛋白联合率为98%,大部分以代谢物的情势经胆汁排出.。


他汀类药物作用机制
他汀类药物有明显的调血脂作用,人体内Ch主要来自肝脏合成,在Ch合成过程中HMG-CoA还原酶使HMG-CoA转换为中间产物MVA;他汀类具有与HMG-CoA相似的结构,且和HMG-CoA还原酶的亲和力高出HMG-CoA数千倍,对该酶发生竞争性抑制,使Ch合成受阻,除使血浆Ch浓度降低外,还通过负反馈调节导致肝细胞表面LDL受体代偿性增加及活性增强,致使血浆LDL降低,继而导致VLDL代谢加快,再加上肝脏合成及释放VLDL减少,也导致VLDL及TG相应下降;HDL的升高,可能是由于VLDL减少的间接结果;由于各种他汀类药物与HMG-CoA还原酶亲和力的不同,所以调脂的效应各异;
比如常用的阿托伐他汀:用于治疗和混合型高脂血症;冠心病和脑中风的防治;
本品为他汀类血脂调节药,属HMG-CoA还原酶抑制剂;本身无活性,口服吸收后的水解产物在体内竞争性地抑制胆固醇合成过程中的限速酶羟甲戊二酰辅酶A还原酶,使胆固醇的合成减少,也使受体合成增加,主要作用部位在肝脏,结果使血胆固醇和低密度脂蛋白水平降低,中度降低血清甘油三酯水平和增高血水平;由此对动脉粥样硬化和冠心病的防治产生作用;
本品口服吸收良好,因经肝内广泛首关代谢,绝对利用度较低,大约为12%,本品在肝脏经细胞色素P4503A4代谢为多种活性代谢物;阿托伐他汀的平均血浆半衰期大约为14小时,但由于其活性代谢物的影响,实际对HMG-CoA还原酶抑制作用的半衰期为20~30小时;本品蛋白结合率为98%,大部分以代谢物的形式经胆汁排出;。


论他汀类药物的基本骨架及其结构与药效的关系目录:1.对他汀类药物的基本介绍 (2)1.1已上市或正在开发的他汀类药物 (2)1.2作用 (3)1.3.应用前景 (4)2.基本骨架 (4)3.构效关系 (5)3.1理化性质及药动学特性 (6)3.1.1.溶解度 (7)3.1.2.亲脂性 (7)3.1.3.吸收方面 (7)4.总结 (8)5【参考文献】 (8)论他汀类药物的基本骨架及其结构与药效的关系【摘要】他汀类药物泛指羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,能够调节低密度)胆固醇水平。
由于他汀类药物安全有效、不良反应少,在临床上,他汀类LDL-C脂蛋白(.药物广泛应用于高脂血症的治疗。
近年来,对他汀类药物的开发是降血脂药物研究的热点之一。
为探究他汀类药物的构效关系,本文将从其基本骨架、构效关系、溶解性、亲脂亲水性等方面进行论述。
【关键字】基本骨架降脂性构效关系1.对他汀类药物的基本介绍他汀类药物可分为天然化合物(如洛伐他丁、辛伐他汀、普伐他汀、美伐他汀)和完全人工合成化合物(如氟伐他汀、阿托伐他汀、西立伐他汀、罗伐他汀、pitavastatin)1.1已上市或正在开发的他汀类药物目前,已上市或正处于开发中的他汀类药物包括:洛伐他汀、辛伐他汀、普伐他汀、阿托伐他汀等,具体情况详见表1表1 他汀类药物概况——————————————————————————————药名英文名商品名上市时间(年)洛伐他汀 Lovastatin 美降之 1987辛伐他汀 Simvastatin 舒降之 1988普伐他汀 Pravastatin 普拉固 1989氟伐他汀 Fluvastatin 来适可 19941997立普妥 Atorvastatin 阿托伐他汀.西立伐他汀 Cerivastatin 拜斯亭 1997罗伐他汀 Rosuvastatin - 2003匹伐他汀 Pitavastatin - 处于注册前——————————————————————————————1.2作用此类药物通过竞争性抑制内源性胆固醇合成限速酶(HMG-CoA)还原酶,阻断细胞内羟甲戊酸代谢途径,使细胞内胆固醇合成减少,从而反馈性刺激细胞膜表面(主要为肝细胞)低密度脂蛋白受体数量和活性增加、使血清胆固醇清除增加、水平降低。

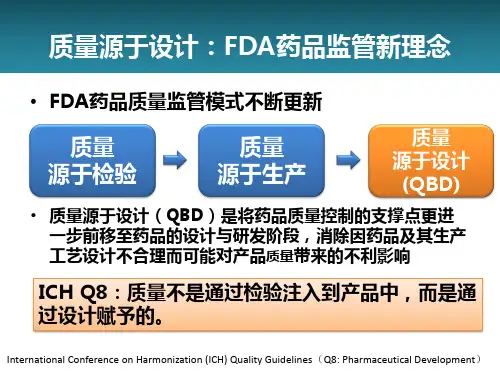

他汀类药物的介绍他汀类( statins)药物是肝脏合成胆固醇的限速酶——羟甲基戊二酰辅酶 A ( HMG-CoA )还原酶抑制剂,不仅能有效地降低总胆固醇(TC )和低密度脂蛋白—胆固醇( LDL-C ),还能轻度降低甘油三酯( TG)和轻度升高高密度脂蛋白—胆固醇( HDL-C ),为当前临床应用最广泛的调脂药物。
当前用于临床的他汀类药物有洛伐他汀、普伐他汀、辛伐他汀、氟伐他汀、阿托伐他汀和罗苏伐他汀等。
一、他汀类药物的药理作用1.他汀类药物的调脂作用(1)作用机制:他汀类药物化学结构中的开放酸部分与HMG-CoA极为相似,因而对胆固醇生物合成的限速酶—— HMG-CoA 还原酶有特异的竞争性抑制作用,从而抑制体内胆固醇的合成,起到调脂的作用。
(2)调脂疗效:美国胆固醇教育计划(NCEP) ATP 公布的数据显示,他汀类药物能使TC 下降 30%~ 40%,LDL-C 下降 35%~ 45%,TG 下降 5%~ 10%, HDL-C 升高 5%~10% 。
2.他汀类药物的非调脂作用(1)抗动脉粥样硬化作用(2)抗凝固作用(3)改善内皮细胞功能作用(4)抗炎症作用(5)抗骨质疏松作用(6)抗肿瘤作用(7)预防痴呆二、他汀类药物的不良反应1.一般不良反应消化系统表现:恶心、腹泻、腹痛、消化不良、ALT 或 AST 升高。
神经系统表现:失眠、头痛、视觉障碍、眩晕、外周神经病变等。
2.肌肉毒性临床表现:肌痛、肌无力、严重者引起横纹肌溶解。
他汀类药物单独应用时的耐受性良好,在已有报道的严重肌肉不良反应中,有相当比例与他汀类药物和其它药物的联合应用相关。
一般来说,他汀类药物单药治疗引起肌病的发生率很低,大约是千分之一,而且与剂量相关。
临床报道,补充辅酶Q10可以改善肌病症状。
3.肝毒性所有他汀类药物都产生肝毒性,其发生率1%,且呈剂量依赖性。
4.其他不良反应过敏反应,脱发,皮肤瘙痒,白内障,男性性欲丧失、勃起障碍等。



发布日期20050606栏目化药药物评价>>化药质量控制标题他汀类药物的构效关系对药学研究的提示作者张明平部门正文内容审评四部张明平他汀类血脂调节药是近来申报的一个热点。
但由于申报单位对这类药物结构的复杂性认识不足,能顺利通过审评的较少。
大量的补充意见都集中在药学研究中与药物结构有关的部分。
因此本文总结了部分文献资料,针对发补问题,就药学研究中的注意事项进行了探讨。
他汀类药物均属于HMG-CoA还原酶抑制剂。
口服吸收的水解产物在体内竞争性地抑制胆固醇合成过程中的限速酶羟甲戊二酰辅酶A还原酶,使胆固醇的合成减少,使低密度脂蛋白受体增加,主要作用部位在肝脏,使血胆固醇和低密度脂蛋白胆固醇水平降低,中度降低血清甘油三酯水平和增高血高密度脂蛋白水平。
在上述过程中,他汀类药物的HMG样部分占据了hHMGR 的酶活性位点。
同时,他汀类药物的大体积的憎水性化合物占据了HMG 结合口袋和部分CoA 的结合表面。
他们的紧密结合是由于抑制剂和hHMGR 之间的大量的范德华力相互作用。
这时,天然底物HMG2CoA 与hHMGR 的结合通路就被阻断了。
他汀类药物的结构可分为3 个部分【1】,【2】:A 部分,一个与酶的底物HMG2CoA 中HMG 结构类似的β,δ-二羟基戊酸结构;B 部分,一个与酶变构后产生的憎水性浅沟相结合的憎水性刚性平面结构;C 部分,上述二者之间的连接部分。
见下图。
A 部分: ①β,δ-二羟基戊酸是发挥抑制活性的必需基团, 其内酯结构可在体内经酶解作用转变为β,δ-二羟基戊酸形式而产生活性,但活性相对较低。
β-甲基-β,δ-二羟基戊酸结构与HMG结构更为接近,若替代β,δ-二羟基戊酸结构却导致活性明显降低。
②β,δ-二羟基戊酸结构中两个羟基位于两个手性碳上,两个羟基处于顺式且β-羟基为R 构型是活性所必需的。
若构型发生改变,则活性急剧降低。
B 部分: ①B 部分为一个憎水性的刚性平面结构,可为苯环、萘环、脱氢萘环、芳杂环或稠杂环等,一般稠合苯环或稠杂环的活性优于相应的苯环或芳杂环。
阿托伐他汀、瑞舒伐他汀、瑞舒伐他汀、匹伐他汀、辛伐他汀、普伐他汀、氟伐他汀等常用他汀类药物结构顺序、区别及与其他药物相互作用临床上常用他汀类药物有7个,分别是洛伐他汀、辛伐他汀、普伐他汀、氟伐他汀、阿托伐他汀、瑞舒伐他汀、匹伐他汀。
他汀类药物都是通过抑制体内胆固醇合成过程中的羟甲戊二酰辅酶A还原酶,促进低密度脂蛋白的代谢和增加高密度脂蛋白的浓度,除此之外还有抗炎、稳定斑块、改善内皮细胞功能、改善左心室功能以及抑制免疫反应等效应。
他汀类药物耐受性好,一般不良反应为口干、腹痛、便秘、流感样症状、消化不良、转氨酶升高、肌病等。
根据结构改造顺序可分为三代第一代。
洛伐他汀、辛伐他汀和普伐他汀。
洛伐他汀、辛伐他汀性质类似,降脂强度为中效,辛伐他汀更为常用。
普伐他汀为中效他汀。
第二代。
氟伐他汀,是第一个全人工合成的他汀类药物,为中效他汀。
第三代。
阿托伐他汀、瑞舒伐他汀和匹伐他汀,为人工合成的对映体。
阿托伐他汀、瑞舒伐他汀为强效他汀,且长效;匹伐他汀为中效他汀,且长效。
不同之处适应证不同洛伐他汀和辛伐他汀用于原发性高胆固醇血症,也用于合并有高胆固醇血症和高甘油三酯血症,而以高胆固醇血症为主的患者。
普伐他汀降低胆固醇的作用较明显,但对甘油三酯基本没有降低作用。
氟伐他汀具有直接抑制动脉平滑肌细胞增殖,延缓内膜增厚的功能。
用于饮食控制无效的高胆固醇血症。
阿托伐他汀用于原发性高胆固醇血症、混合型高脂血症或饮食控制无效杂合子家族型高胆固醇血症患者。
瑞舒伐他汀用于高脂血症和高胆固醇血症。
匹伐他汀用于高胆固醇血症,家族性高胆固醇血症。
水溶性,吸收率不同,用法和用量不同洛伐他汀、辛伐他汀亲脂性较强,口服吸收率低,与食物同服可增加吸收,因此服用时间为晚餐时最佳。
洛伐他汀剂量一日1次20mg;辛伐他汀剂量一日1次10mg。
普伐他汀、氟伐他汀、匹伐他汀三者兼具脂溶性和水溶性,口服不受食物影响,因此三者的服用时间为睡前服用。
普伐他汀剂量一日1次10~20mg;氟伐他汀剂量一日1次20mg;匹伐他汀剂量一日1~2mg。
他汀类药物的骨保护和免疫调节作用他汀类药物是一种有效降低胆固醇的药物,目前已经被广泛地运用于降低升高的脂质水平和心血管的危险度。
越来越多的研究表明[1],他汀类药物除了降脂作用外,还具有降低炎症反应和内皮素、血管紧张素Ⅱ受体1 的表达,抑制血管平滑肌细胞的增生和金属基质蛋白酶活性,降低血凝和血小板活化,增加内皮祖细胞数目和改善内皮功能等独立于降脂以外的作用。
具有抗增生、抗炎症、抑制微血栓及诱导促进内皮细胞NO表达的作用。
随着研究的深入,近年来许多证据表明,他汀类药物除了明确的降低胆固醇作用之外,还发挥着免疫调节、防治骨质疏松和改善肾功能等许多非调脂作用,他汀类药物的多效性值得关注。
1他汀类药物的多效性他汀类药物可显著降低血清低密度脂蛋白胆固醇(LDL-C)水平,明显降低心血管事件的发生率和死亡率,在冠心病的一级、二级预防中有着重要的作用。
近年来许多临床研究结果显示[2],他汀类药物具有降低心血管风险和减弱类风湿性关节炎(RA)活动度的双重作用。
辛伐他汀治疗临床肺动脉高压病人的疗效显著。
原发性肺动脉高压和继发性肺动脉高压病人,在常规治疗基础上给予辛伐他汀治疗,绝大多数病人6 min步行试验步行距离增加,右心室压下降,心排血量增加,疾病进展减缓,预后改善。
辛伐他汀治疗肺动脉高压已被初步证实有效,可能在特发性肺动脉高压的治疗中有较好的应用前景。
他汀类药物能降低尿蛋白,延缓肾动脉硬化的进展,对肾脏有保护作用,他汀类药物常规治疗组患者肌酐清除率增加了4.9%,而阿托伐他汀强化治疗组患者肌酐清除率则上升了12%。
他汀类药物的肾脏保护作用在那些合并有肾功能不全症状的人群中最为显著。
他汀类药物降脂以外的作用还包括预防痴呆,降低阿尔茨海默病危险,治疗类风湿性关节炎和骨质疏松症等[1]。
研究表明他汀类药物对于1型辅助性T细胞(Th1细胞)介导的自身免疫性疾病可能具有较好的免疫调节作用,这些自身免疫性疾病包括多发性硬化症(MS)、类风湿关节炎(RA)、系统性红斑狼疮(SLE)等[2]。
药化药物构效关系1、局麻药的构效关系:亲水性胺基部分通常为叔胺结构,即保证药物分子具有一定水溶性以利转运,也提供了与钠离子通道受点部位结合的结构基础。
局麻药的亲脂性芳环部分保证药物分子具有相当的脂溶性。
局麻药作用于神经末梢或神经干,不需要通过血脑屏障,因此对脂溶性的要求与全身麻醉药不同。
局麻药作用于神经细胞膜上钠离子通道内口,必须有一定的脂溶性才能穿透神经细胞膜到达作用部位。
而为了保持较高的局部浓度,维持相当长的作用时间,药物的脂溶性又不能太大,否则将易于穿透血管壁,被血流带走,使局部浓度很快降低。
因此,局部麻醉药的亲脂性部分和亲水性部分必须保持适当的平衡。
局麻药的亲脂性芳环上给电子取代基可增强活性,吸电子取代基则相反。
2、他汀类药物的构效关系:1、亲水性部分:3,5二羟基戊酸或其内脂是活性必需基团,含内脂结构的化合物须在体内经酶水解活化为3,5二羟基戊酸起效,3,5二羟基必须为顺式结构,3,5位碳的绝对构型必须与美伐他汀和洛伐他汀相同,为r型,如构型发生改变则可致活性急剧下降。
2、连接基为两个碳原子长度,以乙基或乙烯基为最佳,改变两个碳的距离会使活性降低或消失,当环系为氢化奈环或杂环时,连接基非双键结构对活性有利,而对其他环系时,则连接基引入双键对过活性有利,且必须为反式,顺式则活性显著下降。
3、疏水性部分多为疏水性平面4、在刚性结构二羟基戊酸侧链的邻位引入异丙基或环丙基等烷基,可增加活性。
3、苯氧烷酸类药物的构效关系:1、分子中羧基或易与水解的脂基是这类药物活性必需2、脂肪酸部分的季碳原子不必需,双甲基取代降脂作用最强,但只有一个烷基取代基时也有过活性。
3、芳环部分保证药物的亲脂性,增加芳环,活性增强4、啊法碳原子上再引入其他芳基或芳氧基取代的化合物能显著降低三县甘油的水平5、芳基与羧基之间的氧以硫代替,可以提高降血脂活性4、b受体阻断药:芳香环取代基的位置对b受体亚型的选择性存在一定的关系,2,4或236取代,活性最佳,引入酰氨基时,b阻断作用减弱,但对b1受体的选择性增加,如啊替洛尔,4位醚基时,为选择性b1受体阻断剂,如美托洛尔,在苯环引入极性的甲磺酰胺基或乙酰胺基可降低脂溶性,减小副作用。
论他汀类药物的基本骨架及其结构与药效的关系目录:
1.对他汀类药物的基本介绍 3
1.1已上市或正在开发的他汀类药物 3
1.2作用 4
1.3.应用前景 4
2.基本骨架 5
3.构效关系 6
3.1理化性质及药动学特性 8
3.1.1.溶解度 9
3.1.2.亲脂性 9
3.1.3.吸收方面 9
4.总结 9
5【参考文献】 10
论他汀类药物的基本骨架及其结构与药效的关系
【摘要】他汀类药物泛指羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,能够调节低密度脂蛋白(LDL-C)胆固醇水平。
由于他汀类药物安全有效、不良反应
少,在临床上,他汀类药物广泛应用于高脂血症的治疗。
近年来,对他汀类药物的开发是降血脂药物研究的热点之一。
为探究他汀类药物的构效关系,本文将从其基本骨架、构效关系、溶解性、亲脂亲水性等方面进行论述。
【关键字】基本骨架降脂性构效关系
1.对他汀类药物的基本介绍
他汀类药物可分为天然化合物(如洛伐他丁、辛伐他汀、普伐他汀、美伐他汀)和完全人工合成化合物(如氟伐他汀、阿托伐他汀、西立伐他汀、罗伐他汀、pitavastatin)
1.1已上市或正在开发的他汀类药物
目前,已上市或正处于开发中的他汀类药物包括:洛伐他汀、辛伐他汀、普
伐他汀、阿托伐他汀等,具体情况详见表1
表1 他汀类药物概况
——————————————————————————————
药名英文名商品名上市时间(年)
洛伐他汀 Lovastatin 美降之 1987
辛伐他汀 Simvastatin 舒降之 1988
普伐他汀 Pravastatin 普拉固 1989
氟伐他汀Fluvastatin来适可 1994
阿托伐他汀 Atorvastatin 立普妥 1997
西立伐他汀Cerivastatin拜斯亭 1997
罗伐他汀Rosuvastatin - 2003
匹伐他汀Pitavastatin - 处于注册前——————————————————————————————
1.2作用
此类药物通过竞争性抑制内源性胆固醇合成限速酶(HMG-CoA)还原酶,阻断细胞内羟甲戊酸代谢途径,使细胞内胆固醇合成减少,从而反馈性刺激细胞膜表面(主要为肝细胞)低密度脂蛋白受体数量和活性增加、使血清胆固醇清除增加、水平降低。
他汀类药物还可抑制肝脏合成载脂蛋白B-100,从而减少富含甘油三酯AV、脂蛋白的合成和分泌。
他汀类药物除降低胆固醇、甘油三酯、预防中风发作、降低缺血性心脏病病人做冠脉搭桥手术的必要以外,还具有抗增殖作用;并具有免疫抑制性,因而可能成为器官移植后排斥疗法的常规药物。
另有因为它们能使中枢神经系统的载脂蛋白E4水平下降。
作用过程如下:①他汀类药物靶器官为肝脏,其结构与 HMC-CoA相似,可在胆固醇合成的早期阶段竞争性抑制 HMC-CoA 还原酶活性,从而降低LDL-C的浓度。
②负反馈调节使肝细胞表面LDL受体代偿性增加,致使血浆LDL降低,继而导致VLDL代谢加快。
1.3.应用前景
他汀类药物除降低胆固醇、甘油三酯、预防中风发作、降低缺血性心脏病病人做冠脉搭桥手术的必要以外,还具有抗增殖作用;并具有免疫抑制性,因而可能成为器官移植后排斥疗法的常规药物。
另有因为它们能使中枢神经系统的载脂蛋白
E4水平下降。
这些将扩大HMG-CoA还原酶抑制剂的临床适应症,其市场正不断扩大,其主要的研究领域有:
1.骨质疏松症;2.老年痴呆症治疗;3.心脏病治疗;4.器官移植;5.中风治疗;6.糖尿病治疗
2.基本骨架
以下为他汀类药物的几种结构
阿托伐他汀
匹伐他汀
结合以上两种他汀类药物的结构,可以总结出其基本骨架如下:
A部分:一个与HMG结构类似的β、δ-二羟基戊酸结构,他汀类药物的药效基团。
B部分:疏水性环状结构,决定药物与还原酶的结合。
环上的取代基决定药物溶解性和药动力学特性。
C部分:上述二者之间的连接部分,可以是乙基、乙烯基、乙炔基等。
3.构效关系
A部分:分为内酯结构(活性较低),开环结构。
构象:两个羟基位于两手性碳上并处于顺式、β-羟基为R构型才能保证药物活性。
β,δ-二羟基戊酸是发挥抑制活性的必需基团,对HMG-CoA还原酶有抑制作用。
通过该基团,他汀发挥抑制胆固醇合成,降低血清胆固醇水平。
给药后在体内开环转化为有效的羟基酸。
B部分:以共价键连接到3,5- 二羟基庚酸上的疏水性环状结构,为一个憎水性的刚性平面结构,可分为苯环,萘环、脱氢萘环、芳杂环和稠杂环等(一般稠
合苯环或稠杂环的活性优于相应的苯环或芳杂环。
),它在药物与还原酶的结合中起重要作用。
取代基可分为:
①邻位1:苯基(4-氟苯基活性最佳)、环己基、环己甲基
②邻位2:异丙基(代谢稳定)、环丙基、螺戊烷
③其他位:极性取代基(抑制作用加强)
取代基如下图所示:
其他位邻位2
邻位1
C部分:可分为较高活性的乙烯基(反式具高活性)、乙基以及较低活性的乙炔基、氧亚甲基。
为母环上的取代基,它们决定药物溶解性和药动学性质。
连接A和B部分的最佳长度为两个碳原子的长度,以乙烯基或乙基为最佳,若以乙炔基或氧亚甲基取代则活性明显下降。
若为乙烯基时。
A和B部分需处于反式位置,若为顺式则会导致活性明显下降。
C部分结构举例:
阿托伐他汀:
氟伐他汀
3.1理化性质及药动学特性
相较于洛伐他汀与辛伐他汀,普伐他汀结构中用羟基取代前两者中的一个甲基,亲水性较大。
氟伐他汀和之后开发的他汀类药物在疏水性环状结构中均有氟苯取代基,表现出两亲性。
而舒瑞伐他汀引入甲磺酰胺基,具有较强的亲水性。
由结构导致的不同亲水/亲脂性决定了药物在体内跨膜转运的方式,影响吸收、分布、肝脏提取及代谢排泄的不同特征。
3.1.1.溶解度
市售类他汀类药物中除洛伐他汀、辛伐他汀外,其余均成钠盐或钙盐,成钠盐的药物均能溶于水,成钙盐的药物在水中的溶解度较低。
3.1.2.亲脂性
洛伐他汀、辛伐他汀为内酯化合物,logD值较大,亲脂性较强,其余他汀类药物均为开环羟基酸化合物,相应logD值较小,亲脂性较弱,其中普伐他汀、瑞舒伐他汀因疏水性环状结构上分别各有一个羟基及甲磺酰胺基,使得这两个药物表现为亲水。
3.1.3.吸收方面
市售他汀类药物均由小肠吸收,匹伐他汀在结肠中也有少量吸收。
药物溶解及亲水/亲脂性决定了药物的吸收程度。
所有药物给药后均迅速吸收,在4h内达峰,吸收率30﹪—98﹪。
普伐他汀、瑞舒伐他汀水溶性好,在胃肠道能迅速溶解,但不易通过被动扩散透膜主要是通过主动转运进入肝细胞。
氟伐他汀的两亲性使其易于溶解,同时也能通过被动扩散透膜。
由于肝首过提取,除西立伐他汀生物利用度为60﹪外,其余他汀类药物的利用率均较低。
洛伐他汀与辛伐他汀进入体内后会首先转换成有效的抑制剂,再通过被动扩散透膜吸收
4.总结
他汀类药物特殊的结构决定了其发挥药效的有效性。
除氟伐他汀外,他汀类类药物吸收不完全。
除普伐他汀外,大多与血浆蛋白结合率较高。
辛伐他汀(Simvastatin是洛伐他汀(Lovastatin)的甲基化衍化物,美伐他汀(Mevastatin,)药效弱而不良反应多,未用于临床,目前主要用于制备它的化衍化物普伐他汀(Pravastatin)。
洛伐他汀和辛伐他汀口服后要在肝脏内将结构中的其内酯环打开才能转化成活性物质;相对于洛伐他汀和辛伐他汀,普伐他汀本身为开环羟酸结构,在人体内无需转化即可直接发挥药理作用,且该结构具有亲水性,不易弥散至其他组织细胞,极少影响其他外周细胞内的胆固醇合成。
对于他汀类药物的开发,改造母环是其研究热点,在设计新药时,除包括基本结构外,还应适当引入极性取代基,增加亲水性,以提高药物溶解度和肝脏提取率。
5【参考文献】
1.周小华、周天红 .辛伐他汀5mg与普伐他汀10mg治疗高胆固醇血症的比较{J} 中国新药与临床杂志. 1998.17:152-153
2.罗雪琚.舒降之临床应用进展{J},心血管病学进展,1998.19:65—69
3.Lusis AJ.Atherosclerosis {J}.Nature,2000,407:234
4.张美慧、梁大伟.他汀类化合物构效关系研究进展.中国药物化学杂志,2014,4
5.吴万泰.羟甲基戊二酰辅酶A还原酶抑制剂发展与构效特征.中国新药与临床杂志.2000.5.19(3)214-216
6.尤启东.他汀类药物作用模式和构效关系研究进展.中国药学杂志,2003,6。