2017版高考化学一轮复习-专题二-微观结构与物质的多样性-课时8-同位素-原子核外电子排布
- 格式:doc
- 大小:2.04 MB
- 文档页数:44

专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表 .................................................................................... - 1 -
第1课时 元素周期律 .................................................................................................. - 1 -
第2课时 元素周期表 元素周期表的应用 .............................................................. - 6 -
第二单元 微粒之间的相互作用 .......................................................................................... - 12 -
第1课时 离子键........................................................................................................ - 12 -
第2课时 共价键 分子间作用力 ................................................................................ - 16 -
第三单元 从微观结构看物质的多样性 ............................................................................ - 21 -
微专题6 “位—构—性”在元素推断题中的应用 .............................................................. - 25 -

1 / 71 考点46 元素 核素 同位素
聚焦与凝萃
1.了解元素、核素和同位素的含义;
2.了解同位素的性质及其应用,掌握核素的表示方法。
解读与打通
常规考点
1.元素:具有相同核电荷数的同一类原子的总称。例:氧(O)元素,氢(H)元素。
特性:主要通过形成的单质或化合物来体现。
2.核素:具有一定数目的质子和一定数目的中子的一种原子如1H(H)、2H(D)、3H(T)就各为一种核素。
特性:不同的核素可能质子数相同,或中子数相同,或质量数相同,或各类数均不相同
3.同位素:质子数相同而中子数不同的用一元素的不同原子互称为同位素如16O、17O、18O是氧元素的三种核素,互为同位素。
特性:同位素质量数不同,化学性质相同;天然同位素所占原子百分比一般不变;同位素构成的化合物如H2O、D2O、T2O,物理性质不同但化学性质相同
4.元素、核素、同位素之间的关系如下图所示:
隐性考点
1.同位素的六同和三不同
2.元素、核素和同位素的概念的比较
元素 核素 同位素 2 / 72 概念 具有相同核电荷数(质子数)的同一类原子的总称 具有一定数目质子和一定数目中子的一种原子。 质子数相同而中子数不同的同一元素的原子或同一元素的不同核素。
范围 宏观概念,对同一类原子而言,既有游离态又有化合态。 微观概念,对某种元素的一种原子而言。 微观概念,对某种元素的原子而言。因同位素的存在而使原子种类多于元素种类。
特性 主要通过形成的单质或化合物来体现。 不同的核素可能质子数相同,或中子数相同,或质量数相同,或各类数均不相同。 同位素质量数不同,化学性质相同;天然同位素所占原子百分比一般不变;同位素构成的化合物如H2O、D2O、T2O,物理性质不同但化学性质相同。
实例 H、O 11H、21H、147N、146C、2412Mg 11H、21H、31H为氢元素的同位素
3.元素、核素、同位素的概念辨析

第 1 页 共 14 页 苏教版高一上学期化学(必修一)《微观结构与物质的多样性》专项测试卷-带答案
一、单选题(共20题)
1.下列元素中,属于第三周期ⅤA族的是 ( )
A.镁 B.硅 C.磷 D.硫
2.下列物质含有离子键是
A.H2 B.Fe
C.NaCl D.HCl
3.X、Y两种元素原子的质子数之和为20,X的原子序数大于Y,两元素形成的化合物在水溶液中能电离出电子层结构相同的阴、阳离子。下列说法正确的是( )。
A.X、Y形成的化合物是2MgF B.X的单质不与水反应
C.Y的单质能与水反应生成强碱 D.X的单质可以保存在煤油中
4.下列说法中错误的是
A.1H、2H、3H、H+、H2是氢元素的四种不同粒子
B.40Ca和42Ca、石墨和金刚石均为同位素
C.12C、13C、14C是不同的核素
D.16O、18O互为同位素,物理性质不同,但化学性质几乎相同
5.中国承诺2030年前,2CO的排放不再增长,达到峰值之后逐步降低,2060年前实现“碳中和”。其中研发2CO的利用技术,将2CO转化为能源是缓解环境和解决能源问题的方案之一,由2CO和4CH制备合成气(CO、2H),再由合成气制备3CHOH的反应转化关系如图所示。设AN为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,11.2L 4CH所含的极性键为2AN
B.一定条件下等物质的量的3CHOH和4CH,3CHOH的质子数比4CH多8AN 第 2 页 共 14 页 C.反应的化学方程式为23CO2HCHOH一定条件下,原子利用率为100%,符合绿色化学理念
D.制备合成气的反应中,若生成2mol CO,反应Ⅴ和Ⅴ中共转移电子数为6AN
6.下列化学用语正确的是
A.OH-的电子式:
B.CO2的结构式:O=C=O
C.中子数为8的氮元素的核素符号:158N
D.H2S的电子式:H:S:H

- 1 - 专题6.1 原子结构与性质
1、了解元素、核素和同位素的含义。
2、了解原子的构成;了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3、了解相对原子质量、相对分子质量的定义,并能进行有关的计算。
4、掌握1~18号元素的原子结构示意图的表示方法。
一、原子结构
1、构成原子的微粒及作用
(1)原子构成微粒
(2)符号cbdaeX中各数字的含义
(3)组成原子的各种微粒及相互关系
①质子数(Z)= 核电荷数 =
原子序数
②质量数(A)= 质子数(Z) + 中子数(N)
③阳离子的核外电子数=质子数-所带电荷数
④阴离子的核外电子数=质子数+所带电荷数 原子AZ X 原子核
核外电子 质子(Z)个
中子(A-Z)个
电子数(Z)个
电子排布(分层排布) 核电荷数(Z) 决定元素的种类
质量数(A) 近似相对原子质量
在质子数决定后,决定原子的种类
最外层电子数
各层电子数 同位素
决定主族元素化学性质
原子的电子式
电子层(K、L、M„„) 原子结
构示意图 - 2 - 【特别提示】规避4个易失分点
①任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子。
②有质子的微粒不一定有中子,如1H,有质子的微粒不一定有电子,如H+。
③质子数相同的微粒不一定属于同一种元素,如F与OH-。
④核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+、F-等,NH+4与OH-等。
2、元素、核素、同位素的概念及相互关系
元素 核素 同位素
概念 具有相同核电荷数(质子数)的同一类原子的总称 具有一定数目质子和一定数目中子的一种原子 质子数相同而中子数不同的原子或同一元素的不同核素
范围 宏观概念,对同一类原子而言,既有游离态又有化合态 微观概念,对某种元素的一种原子而言 微观概念,对某种元素的原子而言。因同位素的存在而使原子的种类多余元素的种类

1/19
第13讲原子结构化学键
1.掌握元素、核素、同位素、相对原子质量、相对分子质量、原子构成、原子核外电子排布的含义。
2.掌握原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.掌握1~18号元素的原子结构示意图的表示方法。
4.了解化学键的定义。
5.了解离子键、共价键的形成。
6.掌握电子式的表示方法。
本部分内容是高考的常考点,高考中常以选择题型出题。考查原子(离子)的结构及微粒间的数量关系,
也常考查对元素、核素、同位素概念的理解以及结合元素周期表的推断等。
【核心素养分析】
1.宏观辨识与微观探析:能从离子或原子结构示意图等不同层次认识原子的结构以及核外电子的排布规
律,能从宏观和微观相结合的视角分析原子结构与元素性质的关系。能从不同层次认识分子的构型,并对
共价键进行分类,能从宏观和微观相结合的视角分析与解决实际问题。
2.证据推理与模型认知:能运用原子结构模型解释化学现象,揭示现象的本质与规律。能运用构造原理
和能量最低原理揭示元素原子核外电子排布规律。认识共价键的本质及类型,能多角度、动态地分析分子
的空间结构及性质,并运用相关理论解决实际问题。
3.科学态度与社会责任:具有可持续发展意识和绿色化学观念,能对与原子结构有关的社会热点问题做出正确的价值判断。
知识点一原子结构、同位素
1.原子结构
(1)原子的构成粒子
原子AZ
X)
原子核质子Z个——决定元素的种类
中子(A-Z)个在质子数确定后
决定原子种类同位素
核外电子Z个——最外层电子数决定元素的化学性质
(2)构成原子或离子的微粒间的数量关系
2/19
①原子中:质子数(Z)=核电荷数=核外电子数。
②质量数(A)=质子数(Z)+中子数(N)。
③阳离子的核外电子数=质子数-阳离子所带电荷数。如Mg2+的核外电子数是10。
④阴离子的核外电子数=质子数+阴离子所带电荷数。如Cl-的核外电子数是18。
(3)一个信息丰富的符号
【特别提醒】
①原子中不一定都含有中子,如11H中没有中子。

1
课时检测(十五)
(45分钟 100分)
一、选择题(本题包括10小题,每小题6分,共60分)
1.地壳中铀的平均含量约为2.5%,在铀元素中,用作核燃料的U只占0.724%。铀浓缩是指提高铀元素中U的含量,铀浓缩一直是国际社会关注的问题。下列关于铀元素的说法中正确的是( )
A.U与U互为同位素
B.可利用U与U化学性质的不同将二者分离
C.利用化学反应把U转化为U提高U在铀元素中的含量
D.U与U互为同素异形体
2.(2013·西安师大模拟)下列叙述中,正确的是( )
A.两种粒子,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
3.下列关于指定粒子构成的几种描述中不正确的是( )
A.37Cl与39K具有相同的中子数
B.第114号元素的一种核素X与82Pb具有相同的最外层电子数
C.H3O+与OH-具有相同的质子数和电子数 2 D.和S2-具有相同的质子数和电子数
4.美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是( )
A.是氢元素的一种新的同素异形体
B.是氢元素的一种新的同位素
C.该微粒的组成可用H3表示
D.该微粒比普通氢分子多一个氢原子核
5.从宏观方面看物质是由元素组成的,从微观方面看物质是由粒子构成的,下列有关说法不正确的是( )
A.元素原子的多样性是由构成原子的质子和中子数目引起的
B.元素的化学性质主要取决于元素原子的最外层电子数
C.只由一种分子构成的物质一定是纯净物
D.质子数等于电子数的微粒,可能是一种分子和一种离子
6.科学家制造出的第112号元素,其原子的质量数为277,这是迄今已知元素中最重的原子。关于该元素的下列叙述中正确的是( )
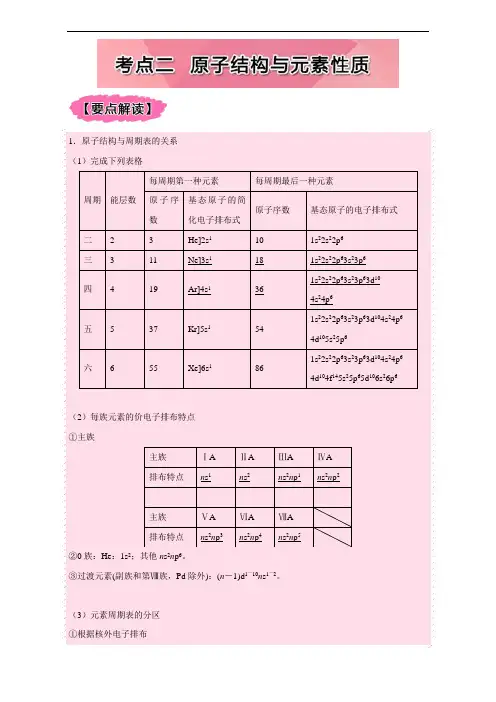
1.原子结构与周期表的关系 (1)完成下列表格 周期 能层数 每周期第一种元素 每周期最后一种元素 原子序数 基态原子的简化电子排布式 原子序数 基态原子的电子排布式 二 2 3 He]2s1 10 1s22s22p6
三
3
11
Ne]3s1
18
1s22s22p63s23p6
四
4
19
Ar]4s1
36
1s22s22p63s23p63d10 4s24p6
五
5
37
Kr]5s1
54
1s22s22p63s23p63d104s24p6
4d105s25p6
六 6 55 Xe]6s1 86 1s22s22p63s23p63d104s24p6
4d104f145s25p65d106s26p6
(2)每族元素的价电子排布特点
①主族
主族 ⅠA ⅡA ⅢA ⅣA
排布特点 ns1 ns2 ns2np1 ns2np2
主族 ⅤA ⅥA ⅦA
排布特点 ns2np3 ns2np4 ns2np5
②0族:He:1s2;其他ns2np6。
③过渡元素(副族和第Ⅷ族,Pd除外):(n-1)d1~10ns1~2。
(3)元素周期表的分区
①根据核外电子排布
a.分区
b.各区元素化学性质及原子最外层电子排布特点
分区 元素分布 外围电子排布 元素性质特点 s区 ⅠA、ⅡA族 ns1~2 除氢外都是活泼金属元素;通常是最外层电子参与反应 p区 ⅢA族~ⅦA族、0族 ns2np1~6 通常是最外层电子参与反应 d区 ⅢB族~ⅦB族、Ⅷ族(除镧系、锕系外)
(n-1)d1~9ns1~2
d轨道可以不同程度地参与化学键的形成
ds区
ⅠB族、ⅡB族
(n-1)d10ns1~2
金属元素
f区
镧系、锕系
(n-2)f0~14(n-1)d0~2ns2
镧系元素化学性质相近,锕系元素化学性质相近
②根据元素金属性与非金属性可将元素周期表分为金属元素区和非金属元素区(如下图),处于金属与非金属交界线(又称梯形线)附近的非金属元素具有一定的金属性,又称为半金属或准金属,但不能叫两性非金属。 注意:“外围电子排布”即“价电子层”,对于主族元素,价电子层就是最外电子层,而对于过渡元素原子不仅仅是最外电子层,如Fe的价电子层排布为3d64s2。 2.对角线规则 在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如

高三化学元素同位素知识点
在化学的学习中,元素是起到基础作用的,而同位素则是元素的一种特殊形式。同位素是具有相同原子序数、但具有不同质子数的一类原子,也可以说是拥有相同的化学性质但质量不同的元素。下面我将为大家介绍一些关于高三化学元素同位素的知识点。
1. 同位素的定义和性质
同位素是指同一种元素的原子,它们的原子核中质子数相同,而中子数不同。同位素拥有相同的化学性质,但相对原子质量不同。同位素的存在使得元素能够具有不同的质量数。
2. 同位素的表示方法
同位素可以通过元素符号的右上角标记质量数来表示,例如氢的两个同位素可以表示为^1H和^2H。其中,^1H称为氢的原子核通常形式,质子数为1,中子数为0;^2H称为氘,质子数为1,中子数为1。
3. 同位素的存在形式
同位素在自然界中广泛存在,例如氢的同位素有氘和氚,碳的同位素有碳-12和碳-14,钾的同位素有钾-39和钾-40等。同位素的存在丰度不同,一部分同位素占比较高,而一部分同位素的存在则较为稀少。
4. 同位素在核反应中的应用
同位素在核反应中发挥着重要的作用。例如,核聚变反应中,氘和氚是常用的燃料,通过核反应可以释放出巨大的能量。核裂变反应中,如铀-235分裂可以释放出更多的能量,也被用于核能的利用。
5. 同位素在放射性的应用
一些同位素具有放射性,可以进行放射性示踪和放射性治疗。放射性示踪利用放射性同位素的放射性衰变特性来追踪物质的流动和反应过程。放射性治疗则通过利用放射性同位素对异常细胞的杀伤作用,用来治疗一些疾病。
6. 同位素的定位方法
同位素的存在和性质可以通过多种方法进行定位。例如,同位素质量分析仪是一种常用的同位素定位方法,通过测量同位素质谱图,可以确定同位素的存在和丰度。此外,同位素的放射性特性也可以用于定位的研究。
7. 同位素的应用领域
同位素在科学研究和工业领域中有着广泛的应用。在生物科学研究中,同位素可以用于示踪生物体内物质的转移和代谢过程。在地质学研究中,同位素可以用来研究地质样品的年龄和地质过程。在工业生产中,同位素可以用于追溯和验证产品的质量和原料来源。

高考化学总复习 原子结构(提高)
【考纲要求】
1.了解元素、核素和同位素的含义。
2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布。
4.能运用核外电子排布规律推断元素的种类和性质。
5.了解相对原子质量的定义,并能比较几种量之间的关系。
6.了解微粒半径大小的比较方法。
【考点梳理】
要点一、原子
1.原子的构成
AZX的含义:代表一个质量数为A、质子数为Z的原子。
2.原子微粒间的数量关系:
①质量数(A)=质子数(Z)+中子数(N)
②中性原子:核电荷数=质子数=核外电子数
③阳离子:质子数=核电荷数=核外电子数+离子电荷数
④阴离子:质子数=核电荷数=核外电子数-离子电荷数
3.原子结构的表示方法
原子结构示意图:表示原子的核电荷数和核外电子在原子核外各电子层排布的图示。如:
要点二、元素、核素、同位素
1.概念比较
元素 同位素 核素
概念 具有相同核电荷数的同一类原子的总称 质子数相同而中子数不同的同一种元素的不同原子互称为同位素 具有一定数目的质子数和一定数目的中子数的一种原子
对象 宏观概念,对同类原子而言;既有游离态,又有化合态 微观概念,对某种元素的原子而言,因为有同位素,所以原子种类多于元素种类 微观概念,指元素的具体的某种原子
特征 以单质或化合物形式存在,性质通过形成单质或化合物来体现 同位素化学性质几乎相同,因为质量数不同,物理性质不同。天然存在的各种同位素所占的原子百分比一般不变 具有真实的质量,不同核素的质量不相同
决定因素 质子数 质子数和中子数 质子数和中子数
2.几种重要的核素及其应用:
①氢元素的三种核素
氢元素的原子核
质量数(A) 原子名称 原子符号 应用
质子数(Z) 中子数(N)
1 0 1 氕 11H ——
1 1 2 氘 21H或D 用于制造氢弹 1 2 3 氚 31H或T

回夺市安然阳光实验学校考点14 原子结构
[题组一 基础小题]
1.已知R元素的某种同位素能形成化合物AmRn,其中A的化合价为+n。该化合物中一个R微粒的核外电子数为a,核内中子数为b,则该同位素的原子符号是( )
A.b+m+n a+mR B.b+a-m a+mR
C.b+a aR D.a-m+b a-mR
答案 D
解析 AmRn中R的化合价为-m,所以R原子的质子数为(a-m),其核内中子数为b,R的质量数为(a-m+b),D正确。
2.131 53I是常规核裂变产物之一,可以通过测定大气或水中131 53I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关131 53I的叙述,错误的是( )
A.131 53I的化学性质与127 53I相同
B.131 53I的原子序数为53
C.131 53I的原子核外电子数为78
D.131 53I的原子核内中子数多于质子数
答案 C
解析 131 53I和127 53I互为同位素,同位素的化学性质相同,A正确;131 53I的原子序数和核外电子数都为53,B正确,C错误;131 53I中质子数为53,中子数=131-53=78,D正确。
3.已知R2+核内共有N个中子,R的质量数为A,m g R2+中含电子的物质的量为( ) A.mA-NA mol B.mA-N+2A mol
C.A-N+2A
m mol D.mA-N-2A mol
答案 D
解析 m g R2+的物质的量为m gA g·mol-1,每摩尔R2+含有电子的物质的量为[(A-N)-2] mol,所以m g R2+含电子的物质的量为mA(A-N-2) mol。
4.下列说法正确的是( )
①氘和氚是质量数不同、质子数相同的两种元素的原子
②氢元素是指11H ③11H、21H、31H是氢的三种核素,是同一元素的三种原子 ④21H和31H的化学性质几乎完全相同 ⑤H2、D2、T2的摩尔质量相等

第 1 页 物质结构专题复习一: 原子结构
知识点:
一、原子结构
原子的组成( ZAX)
二、同位素、核素
1、同位素
2、核素
三、核外电子电子的排布规律
四、微粒电子数的计算:
中性物质:
阳离子:
阴离子:
强化训练:
1、美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是
A. 57 B. 47 C. 61 D. 293
2、已知R2+离子核外有a个电子,b个中子,表示R原子符号正确的是 ( )
A. baR B.22baaR C.22baaR D.baa2R
3、下列说法中错误的是
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C. 除氦外的稀有气体原子的最外层电子数都是8
D. 同一元素的各种同位素的物理性质、化学性质均相同
4、氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是
A.35Cl原子所含质子数为18 B.1/18mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 L D.35Cl2气体的摩尔质量为70 g / mol
5、13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2019年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A 13C与15N有相同的中子数 B 13C与C60互为同素异形体
C 15N与14N互为同位素 D 15N的核外电子数与中子数相同
课时跟踪检测(三) 物质的分类
1.(2015·重庆高考)中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
A.用胆矾炼铜 B.用铁矿石炼铁
C.烧结黏土制陶瓷 D.打磨磁石制指南针
解析:选D 胆矾炼铜就是“湿法炼铜”,其原理是将胆矾溶于水,再将铁放入胆矾溶液中把铜置换出来,是化学反应。铁矿石炼铁是将原料(铁矿石、焦炭、石灰石和空气)加入高炉中,在高炉中发生一系列化学反应,生成铁单质,是化学反应。黏土烧结制成陶瓷的过程中有新物质生成,是化学反应。四氧化三铁常称作“磁性氧化铁”,是磁石的主要成分,打磨磁石制指南针,只是磁石的形状发生变化,是物理变化。
2.物质分类的依据通常有组成和性质。下列物质分类中,只考虑组成的是( )
A.Na2SO4是钠盐、硫酸盐、正盐
B.HNO3是一元酸、强酸、挥发性酸
C.Mg(OH)2是二元碱、难溶性碱、中强碱
D.Al2O3是两性氧化物、金属氧化物、最高价氧化物
解析:选A A项都是根据其组成而划分的;B项根据组成分为一元酸,而依据不同性质可分为强酸和挥发性酸;C中的难溶性碱、中强碱是根据其不同性质划分的;D中Al2O3依据不同性质可分别属于两性氧化物、最高价氧化物。
3.下列有关变化过程的叙述不正确的是( )
A.从海水中提取镁必须通过化学反应才能实现
B.用侯氏制碱法制纯碱必须通过化学反应才能实现
C.“地沟油”纯化的过程发生的是化学变化
D.激光法蒸发石墨得C60发生的是化学变化
解析:选C 从海水中提取镁的过程是Mg2+→Mg(OH)2→MgCl2→Mg,其中发生了化学变化,A项正确;侯氏制碱法的过程是NaCl→NaHCO3→Na2CO3,其中发生了化学变化,B项正确;“地沟油”纯化是分馏的过程,发生的是物理变化,C项错误;石墨与C60的结构不同,在转化的过程中有旧化学键的断裂与新化学键的形成,发生的是化学变化,D项正确。
1 Z 高中化学必修2知识点归纳总结
第一单元 原子核外电子排布与元素周期律
一、原子结构
质子(Z个)
原子核
注意:
中子(N个) 质量数(A)=质子数(Z)+中子数(N)
1.原子数 A X 原子序数=核电荷数=质子数=原子的核外电子
核外电子(Z个)
★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七
对应表示符号: K L M N O P Q
3.元素、核素、同位素
元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。(对于原子来说)
二、元素周期表
1.编排原则:
①按原子序数递增的顺序从左到右排列
②将电子层数相同......的各元素从左到右排成一横行..。(周期序数=原子的电子层数)
③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数
2.结构特点:
核外电子层数 元素种类
第一周期 1 2种元素
短周期 第二周期 2 8种元素
2022版高考化学一轮复习 课时分层作业十六 原子结构 核外电子排布(含解析)新人教版
- 1 - / 8- 1 - 原子结构 核外电子排布
(建议用时20分钟)
1.(2021·东台模拟U是重要的核工业原料。下列有关UU说法正确的是( ) AU原子核中含有92个中子 BU原子核外有143个电子 CU与U互为同位素 DU与U互为同素异形体
【解析】选CU原子核中含有92个质子,中子数是235-92=143,A错误;质子数等于核外电子数,则U原子核外有92个电子,B错误;质子数相同,中子数不同的同一种元素的不同核素互为同位素,则U与U互为同位素,C正确;同素异形体是指由同一种元素形成的不同单质,D错误。
2.(双选)下列说法中正确的是 ( )
A.任何元素原子的原子核都是由质子和中子构成的
B.3717 Cl、3517 Cl互为同位素,3517 Cl2与3717 Cl2互为同素异形体
C.常温下,4.48 L 3717 Cl2含有8NA个中子(NA为阿伏加德罗常数的值)
D.O2-、Mg2+、Ne的结构示意图都可以用表示 2022版高考化学一轮复习 课时分层作业十六 原子结构 核外电子排布(含解析)新人教版
- 2 - / 8- 2 - 【解析】选C、D。11 H中不含中子,A错;3517 Cl2与3717 Cl2是同一种元素同一种形态的单质,是同种物质,B错;标准状况下,4.48 L 3717 Cl2物质的量为0.2 mol,一个3717 Cl原子的中子数为20,则0.2 mol 3717 Cl2含有的中子数为8NA,C项正确;O2-、Mg2+、Ne都是10电子微粒,D项正确。
3.最近医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病病毒。则有关14C的下列说法中正确的是( )
A.14C原子与C60中普通碳原子的化学性质不同
1.3从微观结构看物质的多样性
分)382分,共一、选择题(本题共19道小题,每小题1.下列物质属于分子晶体的化合物是
A. B. C. D. 食盐干冰石英硫磺2.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,他外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A. B. C. D. 同素异同位素同系物同分异构体 形体 下列物质互为同位素的一组是3.3735O
DOOCH C. O D. HA. ClOCl B. CHCHOHCH和和和和23323223 )下列说法不正确的是( 4.1412 CCA BC互为同素异形体.石墨和为不同核素与.603735 为同种元素OC.和O互为同位素 D.X与Y321717又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能自然界中的5.CaF2 说明CaF是离子晶体的实验是( )。2 A. CaF难溶于水,其水溶液的导电性极弱2 B. CaF的熔、沸点较高,硬度较大2 )C. CaF(中的溶解度极小在有机溶剂如苯2 D. CaF固体不导电,但在熔融状态下可以导电2 )6.下列说法正确的是(1414 A. NC不是同位素,但它们是两种核素与 )(OB. ,臭氧和氧气是同分异构体氧气在放电或紫外线照射下能转化为臭氧3
COOHCH—N—C. CHCH—NOH—是同系物和22223 D. 碘晶体、碘蒸气是同素异形体20222022Ne和NeNe和7.下列ETH天文研究所报告,组成太阳的气体中存在,下列关于Ne 的说法正确的是22202022 BNeNeANeNe互为同分异构体.和和.互为同位素22222020 NeNe DCNeNe的中子数相同..和和的质量数相同 8.以下互为同位素的是( )3735Cl
C. COH与金刚石与石墨A. B. D与 D. COCl与22217179.下列各组物质互为同素异形体的是
2019-2020年高中化学 专题一 第三单元 从微观结构看物质的多样性教学设计 苏教版必修2
●课标要求
1.举例说明有机物的同分异构现象。
2.了解同素异形体、同位素的涵义。
●课标解读
1.会判断或书写同分异构体。
2.同位素、同素异形体、同分异构体的比较与判断。
●教学地位
同位素是同一元素形成多种核素的现象的原因,同素异形体是同一元素形成多种单质的现象的原因,同分异构体是同分子式形成多种结构的现象的原因,这些事实是形成物质多样性的原因,同时高考命题也常有涉及。
(教师用书独具)
●新课导入建议
我们已经知道氢元素有氕、氘、氚三种核素,氧元素可形成O2和O3,碳元素可形成金刚石和石墨,C4H10可有CH3—CH2—CH2CH3和两种分子结构,上述这些物质之间关系是什么?结构和性质有什么差异,本课时将探讨相关知识。
●教学流程设计
课前预习:安排学生课前阅读相关教材内容,完成“课前自主导学”并讨论。⇒步骤1:导入新课,分析本课教学地位。⇒步骤2:通过“思考交流1”要明确同素异形体研究的是结构和性质不同的单质。通过“思考交流2”要让学生知道烃的同分异构体是C、H原子的连接,并不一定所有分子式均存在异构体。⇒错误!
⇓
步骤5:4至5分钟完成【当堂双基达标】,教师明确答案并给予适当点评或纠错。⇐步骤4:回顾本课堂所讲,师生共同归纳总结出【课堂小结】。
课 标 解 读 重 点 难 点
1.了解同素异形现象和同素异形体。
2.了解同分异构现象和同分异构体。 1.同素异形体和同分异构体的判断。(重点)
2.O3的性质和金刚石、石墨、C60的微观结构。(难点)
同素异形现象
1.概念
同一种元素能够形成几种不同单质的现象。
2.同素异形体
(1)概念:同一种元素形成的不同单质的互称。
(2)碳的同素异形体
①碳的同素异形体有金刚石、石墨、富勒烯(包括C60、C70和纳米碳管)
②结构的差异
a.金刚石、石墨性质的差别,是由于它们的结构不同,即碳原子的成键方式和排列方式不同。金刚石晶体中每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构。而石墨为层状结构,层内碳原子间以共价键结合,每一层内碳原子排列成平面六边形,一个个六边形排列成平面网状结构,层间碳原子间存在分子间作用力。
2017版高考化学一轮复习-专题二-微观结构与物质的多样性-课时8-同位素-原子核外电子排布
2 课时8 同位素 原子核外电子排布
【课时导航】
复习目标 1. 了解元素、核素和同位素的含义。
2. 了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3. 了解原子核外电子排布。
知识网络
问题思考 问题1:从原子的组成分析各微粒决定着原子的哪些方面?
问题2:写出118号元素的原子结构示意图。
3
【课前自测】
1. (2015·上海卷)中国科学技术名词审定委员会已确定第116号元素 293116 Lv的名称为。关于Lv的叙述错误的是( )
A. 原子序数为116 B. 中子数为177
C. 核外电子数为116 D. 相对原子质量为293
【答案】 D
【解析】 原子序数=质子数=核外电子数=116,A、C正确;中子数=质量数-质子数=293-116=177,B正确;293是质量数,不是相对原子质量,D错。
4
5 【解析】 过氧化钠是离子化合物,电子式为Na+[:::oo]2-Na+,A不正确;硫离子的结构示意图为,C不正确;是对二甲苯,D不正确。
4. 判断正误,正确的打“√”,错误的打“×”。
(1)34S原子核内中子数为16 ( )
(2)质子数为27、中子数为33的Co原子6027:Co ( )
(3)1182HO的摩尔质量为20 g·mol-1 ( )
(4)13C和 15N核内中子数相差1 ( )
(5)14C可用于文物年代的鉴定,14C和 12C互为同素异形体 ( )
(6)18 g D2O和18 g H2O中含有的质子数均为10NA
( )
(7)氯离子的结构示意图: ( )
6 【答案】 (1)× (2)√ (3)√ (4)√ (5)×
(6)× (7)×
【自主学习】
考点1 元素、核素、同位素
【基础梳理】
1. 原子的组成与 AZX的含义
原子(-)ZNAZ质子 个原子核中子 个核外电子 个
(1)原子结构中基本微粒间的关系
①质子数=核电荷数=核外电子数=原子序数
②质量数=质子数+中子数
7 ③质子数=阳离子的核外电子数+阳离子所带电荷数
④质子数=阴离子的核外电子数-阴离子所带电荷数
(2) AZX的含义:X代表元素符号,Z代表 ,A(=Z+N)代表 。
2. 元素、核素、同位素
(1)元素:具有相同 的同一类原子的总称。 决定元素的种类。
(2)核素:具有一定数目 和一定数目
的一种原子。 和 共同决定核素的种类。
(3)同位素: 数相同而 数不同的同一元素的不同 互称为同位素。
(4)几种重要的核素
8 核素 23592 U 146 C 21 H 31 H
用途 核燃料 用于考古 制氢弹 示踪原子
3. 相对原子质量
(1)定义:以12C原子质量的112(约1.66×10-27 kg)作为标准,其他原子的质量跟它比较所得的值。其国际单位制(SI)单位为1,符号为1(单位1一般不写)。
(2)比较
①核素的近似相对原子质量:对核素的相对原子质量取近似整数值,数值上与该核素的质量数相等。如:35Cl为35,37Cl为37。
②元素的相对原子质量:按该元素各种天然同位素原子所占的原子百分比算出的平均值。如:Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。
9
微课9 “四同”概念的比较
同分异构体 同系物 同素异形体 同位素
定义 分子式相同、结构不同 结构相似、分子构成相差一个或若干个CH2原子团 组成元素相同、结构不同 质子数相同、中子数不同
对象 化合物 有机化合物 单质 原子(核素)
实例 正丁烷与异丁烷 甲烷与乙烷 金刚石与石墨、C60;红磷与白磷;O2与O3 C与C
10 【举题说法】
【例题1】 (2014·上海卷)“玉兔”号月球车用
23894 Pu作为热源材料,下列关于 23894 Pu的说法正确的是( )
A. 23894 Pu与 23892 U互为同位素
B. 23894 Pu与 23994 Pu互为同素异形体
C. 23894 Pu与 23892 U具有完全相同的化学性质
D. 23894 Pu与 23994 Pu具有相同的最外层电子数
【答案】 D
【解析】 A项23894,Pu与 23892 U两种核素的质子数不相同,不是同种元素,不属于同位素,错误;B项23894,Pu与 23994 Pu是两种核素,不是单质,二者互称为同位素,错误;C项23894,Pu与 23892 U两种核素的质子数不相同,不属于同种元素,不具有完全相同的化学性质,错误;D项23894,Pu与 23994 Pu两种核素的质子数相同,所以具有相同的最外层电子数,正确。
11
【题组训练】
1. (2013·海南卷)重水(D2O)是重要的核工业原料,下列说法错误的是( )
A. 氘(D)原子核外有1个电子
B. 1H与D互称同位素
C. H2O与D2O互称同素异形体
D. 1H2 18O与162DO的相对分子质量相同
【答案】 C
【解析】 组成元素相同、结构不同的单质互为同素异形体。
2. 科学家首次合成第117号元素,被美国《时代》周刊评选为当年十大科学发现。假如第117号元素符号暂时定为Up,下列关于 293117 Up和 294117 Up的说法正确的是( )
12 A. 293117 Up和 294117 Up是两种元素
B. 293117 Up和 294117 Up互为同位素
C. 293117 Up和 294117 Up质子数不同、中子数相同
D. 293117 Up和 294117 Up质量数相同、电子数不同
【答案】 B
【解析】293117 Up和 294117 Up是同种元素的两种核素,元素符号左上角的数字表示该核素的质量数,左下角的数字表示该核素的质子数,它们的质子数相同,中子数不同,互为同位素,A、C选项错误,B选项正确293117;Up和 294117 Up的质子数、电子数都是117,而质量数分别为293、294,D选项错误。
3. 地壳中铀的平均含量约为2.5%,在铀元素中,用作核燃料的 23592 U只占0.724%。铀浓缩是指提高铀元素中 23592 U的含量,铀浓缩一直是国际社会关注的问题。下列关于铀元素的说法正确的是( )
13 A. 23592 U与 23892 U互为同位素
B. 可利用 23592 U与 23892 U化学性质的不同将二者分离
C. 利用化学反应把 23892 U转化为 23592 U,提高 23592 U在铀元素中的含量
D. 23592 U与 23892 U互为同素异形体
【答案】 A
【解析】 同位素原子的化学性质相同,B项错误;同位素原子之间的转化不属于化学变化,C项错误23592;U与 23892 U互为同位素而非同素异形体,D项错误。
4. 氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良燃料。下列说法正确的是( )
A. LiH、LiD、LiT的摩尔质量之比为1∶2∶3
B. 它们都是强氧化剂
C. H、D、T互称为同素异形体
14 D. 它们都是强还原剂
【答案】 D
【解析】 LiH、LiD、LiT的摩尔质量之比等于它们的相对分子质量之比,应为8∶9∶10,A错;氕化锂、氘化锂、氚化锂中氕、氘、氚均为-1价,处于最低价态,具有强还原性,是强还原剂,B错,D正确;H、D、T互称为同位素,C错。
5. 下列有关 12753 I和 13153 I的说法正确的是( )
A. 12753 I和 13153 I的中子数相等
B. 12753 I和 13153 I的核外电子数不同
C. 12753 I和 13153 I互为同位素
D. 12753 I和 13153 I是同一种核素
【答案】 C
【解析】12753 I和 13153 I质子数相同,中子数不同,它们是两种核素,这两种核素彼此互称为同位素。
15
元素、同位素、核素概念的辨析
元素 同位素 核素
概念 具有相同核电荷数的一类原子的总称 质子数相同而中子数不同的同一元素的不同核素互称为同位素 具有一定数目质子和一定数目中子的一种原子
对象 宏观概念,对同类原子而言;既有游离态,又有化合态 微观概念,对某种元素的原子而言,因为有同位素,所以原子种类多于元素种类 微观概念,指元素的具体的某种原子
特以单质或同位素化学性质几具有真实的
16 征 化合物形式存在,性质通过形成单质或化合物来体现 乎相同,因为质量数不同,物理性质有差异。天然存在的各种同位素所占的原子个数百分比一般不变 质量,不同核素的质量不相同
决定因素 质子数 质子数和中子数 质子数和中子数
关系 元素、核素、同位素之间的关系图
举例:
6Li、7Li、23Na、24Mg、14C、14N 六种微粒中,包含五种元素,六种核素,其中互为同位素
17 的是6Li、7Li,中子数相等的核素是23Na、24Mg
考点2 核外电子排布规律
【基础梳理】
1. 在同一原子中各电子层之间的关系
电子层 1 2 3 4 n
电子层符号 K L M N ……
离核距离 近 远
电子的能量 低 高
最多能容纳的电子数 2 8 18 32 2n2
2. 原子核外电子排布规律