直肠癌规范化诊疗指南试行
- 格式:doc
- 大小:66.00 KB
- 文档页数:21

结直肠癌规范化诊治指南(试行)一、范围本指南规定了结直肠癌的规范化诊治流程、诊断依据、诊断、鉴别诊断、治疗原则和治疗方案。
本指南适用于具备相应资质的市、县级常见肿瘤规范化诊疗试点医院及其医务人员对结直肠癌的诊断和治疗。
二、术语和定义直肠系膜:指的是在中下段直肠的后方和两侧包裹着的直肠的、形成半圆1.5~2.0cm厚的结缔组织,内含有动脉、静脉、淋巴组织及大量脂肪组织,上自第3骶椎前方,下达盆膈。
三、缩略语下列缩略语适用于本指南TME:(total mesorectal excision)全直肠系膜切除术CEA:(cancinoembryonic antigen)癌胚抗原四、规范化诊断流程五、结肠癌治疗流程六、诊断依据(一)高危人群。
有便血、便频、大便带粘液、腹痛等肠道症状的人群;大肠癌高发区的中老年人;大肠腺瘤患者;有大肠癌病史者;大肠癌患者的家庭成员;家族性大肠腺瘤病;溃疡性结肠炎;Crohn病;有盆腔放射治疗史者。
(二)临床表现及体征。
临床表现出现的频度右侧结肠癌依次以腹部肿块、腹痛及贫血最为多见。
左侧结肠癌依次以便血、腹痛及便频最为多见。
直肠癌依次以便血、便频及大便变形多见。
1.右侧结肠癌临床上常表现为原因不明的贫血、乏力、消瘦、低热等。
早期偶有腹部隐痛不适,后期在60%~70%病人中右侧腹部可扪及一质硬肿块。
2.左侧结肠癌早期临床上可表现为排便习惯改变,可出现便频、便秘或便频与便秘交替。
肿瘤生长致管腔狭窄甚至完全阻塞,可引起肠梗阻表现,约10%的患者可表现为急性肠梗阻或慢性肠梗阻症状。
3.直肠刺激症状便频、里急后重、肛门下坠、便不尽感,肛门痛等。
大便表面带血和/或粘液,严重时有脓血便。
4.直肠指诊凡遇到患者有便血、直肠刺激症状、大便变形等症状均应行直肠指诊,检查是动作要轻柔,切忌粗暴,要注意有无肿物触及,肿瘤距肛门距离、大小、硬度、活动度、粘膜是否光滑、有无压痛及与周围组织关系、是否侵犯骶前组织,如果肿瘤位于前壁,男性必须明确与前列腺关系,女性患者需做阴道指诊,查明是否侵犯阴道后壁。

二级医院结直肠癌规范化诊疗指南(征求意见稿)1 范围本指南规定了结直肠癌的规范化诊治流程、诊断依据、诊断、鉴别诊断、治疗原则和治疗方案。
本指南适用于具备相应资质的地市级、县级医疗卫生机构(二级)及其医务人员对肺癌的诊断和治疗。
2 术语和定义直肠系膜:指的是在中下段直肠的后方和两侧包裹着的直肠的、形成半圆1.5~2.0cm厚的结缔组织,内含有动脉、静脉、淋巴组织及大量脂肪组织,上自第3骶椎前方,下达盆膈。
3缩略语下列缩略语适用于本指南3.1 TME:(total mesorectal excision)全直肠系膜切除术3.2 CEA:(cancinoembryonic antigen)癌胚抗原7. 诊断依据7.1 高危人群①有便血、便频、大便带粘液、腹痛等肠道症状的人群;②大肠癌高发区的中老年人;③大肠腺瘤患者;④有大肠癌病史者;⑤大肠癌患者的家庭成员;⑥家族性大肠腺瘤病;⑦溃疡性结肠炎;⑧Crohn病;⑨有盆腔放射治疗史者。
7.2 临床表现及体征临床表现出现的频度右侧结肠癌依次以腹部肿块、腹痛及贫血最为多见。
左侧结肠癌依次以便血、腹痛及便频最为多见。
直肠癌依次以便血、便频及大便变形多见。
7.2.1右侧结肠癌:临床上常表现为原因不明的贫血、乏力、消瘦、低热等。
早期偶有腹部隐痛不适,后期在60%~70%病人中右侧腹部可扪及一质硬肿块。
7.2.2左侧结肠癌:早期临床上可表现为排便习惯改变,可出现便频、便秘或便频与便秘交替。
肿瘤生长致管腔狭窄甚至完全阻塞,可引起肠梗阻表现,约10%的患者可表现为急性肠梗阻或慢性肠梗阻症状。
7.2.3直肠刺激症状:便频、里急后重、肛门下坠、便不尽感,肛门痛等。
大便表面带血和/或粘液,严重时有脓血便。
7.2.4 直肠指诊:凡遇到患者有便血、直肠刺激症状、大便变形等症状均应行直肠指诊,检查是动作要轻柔,切忌粗暴,要注意有无肿物触及,肿瘤距肛门距离、大小、硬度、活动度、粘膜是否光滑、有无压痛及与周围组织关系、是否侵犯骶前组织,如果肿瘤位于前壁,男性必须明确与前列腺关系,女性患者需做阴道指诊,查明是否侵犯阴道后壁。

直肠癌诊疗指南技术操作规范
排便习惯改变,次数增多或便秘。
大便带血或者粘液血便,浓血便,便不尽感,便形变细。
肿物局部侵犯可致直肠或骶尾部疼痛,尿频、尿痛等症状。
癌肿转移致肝或腹膜,可出现肝大、黄疸、腹水等。
2、体检直肠指诊是诊断中下段直肠癌的重要方法。
指诊时可触及突出、表面高低不平、质地硬的肿块,指套带血或粘液。
3、实验室检查常规检查血CA,CEA 升高有辅助诊断价值。
血常规检查有时表现为血红素降低。
便潜血试验可阳性,多次检查可提高查出率。
4、辅助检查直肠镜或乙状结肠镜-检查可直视肿物,并取组织活检,明确肿物性质。
术前尽可能行纤维结肠镜、结肠气钡双重造影或CT 结肠以了解全结肠情况,排除结肠多发性病变或息肉病变。
【鉴别诊断】
1、直肠息肉多无症状,直肠指检为触及质软、带蒂之大小不一肿物。
直肠镜或乙状结肠镜下呈息肉状、质软,取组织活检可明确诊断。
2、直肠类癌早期无症状,直肠指检为黏膜下肿物,表面光滑,质硬可以活动。
需活组织检查诊断。
3、直肠炎性肉芽肿或狭窄
【治疗原则】
直肠癌治疗仍以手术为主,放射治疗及化疗为辅的综合治疗法。
常见的手术治疗包括:1、腹会阴联合切除术;2、前切除术(Dixon);3、Parks 手术;4、经肛门或经骶尾部局部切除等。
-。

最新:中国原发性结直肠癌规范诊疗质量控制指标(2023版)国家癌症中心统计数据显示,中国结直肠癌发病率居所有恶性肿瘤第2位,死亡率居第4位,其发病率亦呈持续上升趋势。
得益于早期筛查、早期预防理念的普及以及治疗水平不断进步,我国结直肠癌患者的生存率较前已有所提高,但不同地区间诊断及治疗水平仍存在较大差异。
2012年,国家卫生健康委员会主导成立了国家肿瘤质控中心,推行肿瘤诊疗质量控制,规范肿瘤诊疗行为,促进全国范围内肿瘤诊疗规范化、同质化、标准化,最终提升恶性W瘤患者的生存率和生活质量。
为进一步推动结直肠癌规范化诊疗质控工作,国家癌症中心、国家肿瘤质控中心委托国家肿瘤质控中心结直肠癌质控专家委员会,依据《中国肿瘤整合诊治指南》(结直肠癌、肛管癌)等国家级结直肠癌诊疗指南规范,结合循证医学、临床经验,在符合科学性、普适性、规范性、可操作性指导原则下,起草并制定了《中国原发性结直肠癌规范诊疗质量控制指标(2023版)》,具体如下。
结直肠癌规范诊疗质量控制指标一、结直肠癌患者首次治疗前完成临床TNM分期评估率(一)结直肠癌患者首次治疗前完成临床TNM分期诊断率1 .指标代码:CRC-OI-OI o2 .指标名称:结直肠癌患者首次治疗前完成临床TNM分期诊断率。
3 .定义:结直肠癌患者首次治疗前实际完成临床TNM分期诊断的病例数占结直肠癌患者首次治疗前需要完成肿瘤临床TNM分期诊断的病例数的比例。
4 .计算公式:结直肠癌患者首次治疗前完成临床TNM分期诊断率=£结直肠癌患者首次治疗前实际完成临床TNM分期诊断的病例数/£结直肠癌患者首次治疗前需要完成临床TNM分期诊断的病例数X100%o5 .患者就医类型:住院和门诊患者。
6 .设置理由:反映治疗前全面评估病情,是肿瘤规范化治疗的基础。
7 .指标类型:过程质控。
8 .表达方式:比例提高。
9 .除外患者:急诊入院患者。
10 .指标参考依据:《中国肿瘤整合诊治指南》(结直肠癌、肛管癌)、《美国国立综合癌症网络(NatiOna1ComprehensiveCancerNetwork,NCCN)结直肠癌临床实践指南》2023年版、国际抗癌联盟(UnionforInternationa1CancerContro1,U1CC)/美国癌症联合委员会(AmeriCanJointCommitteeonCancer,AJCC)TNM分期系统(2017年第8版)。

中国结直肠癌诊疗规范(2017年版)一、概述我国结直肠癌(Colorectal cancer,CRC)的发病率和死亡率均保持上升趋势。
2015 中国癌症统计数据显示:我国结直肠癌发病率、死亡率在全部恶性肿瘤中均位居第5 位,其中新发病例37.6 万,死亡病例19.1 万。
其中,城市地区远高于农村,且结肠癌的发病率上升显著。
多数病人发现时已属于中晚期。
为进一步规范我国结直肠癌诊疗行为,提高医疗机构结直肠癌诊疗水平,改善结直肠癌病人预后,保障医疗质量和医疗安全,特制定本规范。
二、诊断技术与应用(一)临床表现早期结直肠癌可无明显症状,病情发展到一定程度可出现下列症状:1.排便习惯改变;2.大便性状改变(变细、血便、黏液便等);3.腹痛或腹部不适;4.腹部肿块;5.肠梗阻相关症状;6.贫血及全身症状:如消瘦、乏力、低热等。
(二)疾病史和家族史1.结直肠癌发病可能与以下疾病相关:溃疡性结肠炎、结直肠息肉、克罗恩病(Crohn Disease)、血吸虫病等,应详细询问病人相关病史。
2.遗传性结直肠癌发病率约占总体结直肠癌发病率的6%左右,应详细询问病人相关家族史:林奇综合征(Lynch Syndrome)、家族性腺瘤性息肉病(Familial adenomatous polyposis,FAP)、黑斑息肉综合征(Peutz-Jeghers Syndrome)等。
(三)体格检查1.一般状况评价、全身浅表淋巴结特别是腹股沟及锁骨上淋巴结的情况。
2.腹部视诊和触诊,检查有无肠型、肠蠕动波、腹部叩诊及听诊检查了解有无移动性浊音及肠鸣音异常。
3.直肠指检:凡疑似结直肠癌者必须常规作肛门直肠指检。
了解直肠肿瘤大小、大体形状、质地、占肠壁周径的范围、基底部活动度、肿瘤下缘距肛缘的距离、肿瘤向肠外浸润状况、与周围脏器的关系、有无盆底种植等,同时观察有否指套血染。
(四)实验室检查1.血常规:了解有无贫血。
2.尿常规:观察有无血尿,结合泌尿系影像学检查了解肿瘤是否侵犯泌尿系统。

直肠癌规范化诊疗指南(试行)1 范围本指南规定了直肠癌的规范化诊治流程、诊断依据、诊断和鉴别诊断、治疗原则及治疗方案。
本指南适用于农村重大疾病医疗保障工作定点医院对直肠癌的诊断和治疗。
2 术语和定义下列术语和定义适用于本指南。
直肠系膜:指的是在中下段直肠的后方和两侧包裹着的,形成半圆,厚1.5~2.0cm的结缔组织,内含有动脉、静脉、淋巴组织及大量脂肪组织,上自第3骶椎前方,下达盆膈。
3 缩略语下列缩略语适用于本指南。
3.1 TME:(total mesorectal excision)全直肠系膜切除术3.2 CEA:(carcinoembryonic antigen)癌胚抗原4 诊治流程图5 诊断依据5.1 病因直肠癌的发病原因尚未完全阐明,导致发生的原因可归纳为:5.1.1 环境因素饮食习惯、肠道细菌、化学致癌物质、土壤中缺钼和硒。
5.1.2 内在因素基因变异、腺瘤、血吸虫性结肠炎、慢性溃疡性结肠炎。
5.2 高危人群5.2.1 有便血、便频、大便带粘液、腹痛等肠道症状的人。
5.2.2 大肠癌高发区的中、老年人。
5.2.3 大肠腺瘤患者。
5.2.4 有大肠癌病史者。
5.2.5 大肠癌患者的家庭成员。
5.2.6 家族性大肠腺瘤病患者。
5.2.7 溃疡性结肠炎患者。
5.2.8 Crohn病患者。
5.2.9 有盆腔放射治疗史者。
5.3 临床表现及体征5.3.1 症状主要表现为直肠刺激症状:便频、里急后重、肛门下坠、便不尽感、肛门痛等。
大便表面带血和/或粘液,严重时有脓血便。
根据临床表现出现的频度,直肠癌临床表现依次以便血、便频及大便变形多见。
5.3.2 直肠指诊凡遇到患者有便血、直肠刺激症状、大便变形等症状均应行直肠指诊。
检查时动作要轻柔,切忌粗暴,要注意有无肿物触及,肿瘤距肛门距离、大小、硬度、活动度、粘膜是否光滑、有无压痛及与周围组织关系、是否侵犯骶前组织。
如果肿瘤位于前壁,男性必须明确与前列腺关系,女性患者需做阴道指诊,查明是否侵犯阴道后壁。

直肠癌诊疗规范
【诊断标准】
1.临床表现
(1)肠刺激症状排便习惯改变,大便次数增多或便秘。
(2)感染破溃症状大便性状改变,大便带血或粘液血便,脓血便,有大便后不净感,大便变细。
(3)慢性低位肠梗阻症状。
(4)肿物局部侵犯和远处转移症状;直肠内或骶部剧痛,向下腹腰部和下肢放射;尿频尿痛、肝肿大、黄疸等表现。
2.辅助检查
(1)直肠指诊:约90%的直肠癌经仔细的直肠指诊能触及直肠肿块,形状不规则、高低不平、质硬,指套可染脓血。
可发现肿块位置、范围、固定程度。
(2)直肠镜和结肠镜直视肿瘤形态,并可取组织活检确定性质。
(3)X线钡剂灌肠能显示充盈缺损、粘膜破坏、肠腔狭窄,僵硬或局部梗阻等征象。
(4)盆腔CT,直肠腔内超声检查,CEA等对诊断起辅助价值。
【治疗原则】
直肠癌一旦诊断,手术是唯一根治的手段,术前术后可给予放疗、化疗、免疫和中药西药等辅助性治疗。
1.手术治疗
(1)根治性手术:①腹会阴联合切除术,Miles术,适合于距肛门齿状线4cm以内直肠癌;②直肠前切除:Dixon手术,适合于直肠癌下缘距肛门齿状线4cm以上。
(2)如已有远处转移的直肠癌,局部有可能切除应作姑息性切除术加放疗、化疗等综合性治疗。
(3)直肠癌局部侵犯严重与周围组织固定,已不能作局部切除时,可行乙状结肠单腔造瘘术,以解除梗阻。
2.放射治疗直肠癌患者术前、术后可行放射治疗,降低复发率。
3.化学药物治疗预防复发,杀死残存肿瘤细胞。
4.免疫治疗包括肿瘤疫苗的制备,生物修饰剂的应用。

中国结直肠癌诊疗规范结直肠癌是一种常见的恶性肿瘤,严重威胁着人们的健康。
为了提高结直肠癌的诊疗水平,保障患者的治疗效果和生活质量,我国制定了一系列的诊疗规范。
一、结直肠癌的早期筛查早期筛查对于结直肠癌的诊治至关重要。
常见的筛查方法包括粪便隐血试验、结肠镜检查等。
粪便隐血试验操作简便,成本较低,可以作为初步筛查的手段。
但需要注意的是,它的特异性不高,可能会出现假阳性结果。
结肠镜检查则是结直肠癌筛查的“金标准”。
通过将细长的结肠镜伸入肠道,可以直接观察到肠道内部的情况,发现息肉、肿瘤等病变,并能同时进行活检,明确病变的性质。
对于高危人群,如有结直肠癌家族史、患有溃疡性结肠炎等炎症性肠病、长期高脂低纤维饮食等,应更加重视早期筛查,适当提高筛查的频率。
二、结直肠癌的诊断1、临床表现结直肠癌的症状因肿瘤的部位、大小和进展程度而异。
常见的症状包括便血、排便习惯改变(如便秘、腹泻或两者交替)、腹痛、腹部肿块、消瘦、贫血等。
但这些症状在疾病早期可能并不明显,容易被忽视。
2、影像学检查(1)CT 检查:可以帮助了解肿瘤的大小、位置、与周围组织的关系,以及是否有远处转移。
(2)磁共振成像(MRI):对于直肠癌,MRI 有助于评估肿瘤侵犯直肠壁的深度以及周围淋巴结的情况,为手术方案的制定提供重要依据。
3、病理诊断病理诊断是确诊结直肠癌的“金标准”。
通过结肠镜获取的组织标本,在显微镜下观察细胞形态、结构等特征,确定肿瘤的类型(如腺癌、黏液腺癌等)、分化程度、浸润深度等。
三、结直肠癌的治疗1、手术治疗手术是结直肠癌的主要治疗方法。
根据肿瘤的部位、分期等因素,选择不同的手术方式。
(1)结肠癌手术:对于早期结肠癌,可行局部切除;对于进展期结肠癌,通常需要进行结肠癌根治术,包括切除肿瘤所在的肠段、相应的肠系膜和区域淋巴结。
(2)直肠癌手术:包括直肠低位前切除术、腹会阴联合直肠癌根治术等。
近年来,随着腹腔镜技术的发展,腹腔镜手术在结直肠癌治疗中的应用越来越广泛,具有创伤小、恢复快等优点。

结直肠癌规范化诊治指南一、范围本指南规定了结直肠癌的规范化诊治流程、诊断依据、诊断、鉴别诊断、治疗原则和治疗方案。
本指南适用于具备相应资质的市、县级常见肿瘤规范化诊疗试点医院及其医务人员对结直肠癌的诊断和治疗。
二、术语和定义直肠系膜:指的是在中下段直肠的后方和两侧包裹着的直肠的、形成半圆1.5〜2.0cm厚的结缔组织,内含有动脉、静脉、淋巴组织及大量脂肪组织,上自第3 骶椎前方,下达盆膈。
三、缩略语下列缩略语适用于本指南TME:( total mesorectal excision )全直肠系膜切除术CEA:( cancinoembryonic antigen )癌胚抗原四、规范化诊断流程五、结肠癌治疗流程六、诊断依据(一)高危人群。
有便血、便频、大便带粘液、腹痛等肠道症状的人群;大肠癌高发区的中老年人;大肠腺瘤患者;有大肠癌病史者;大肠癌患者的家庭成员;家族性大肠腺瘤病;溃疡性结肠炎;Crohn 病;有盆腔放射治疗史者。
(二)临床表现及体征。
临床表现出现的频度右侧结肠癌依次以腹部肿块、腹痛及贫血最为多见。
左侧结肠癌依次以便血、腹痛及便频最为多见。
直肠癌依次以便血、便频及大便变形多见。
1.右侧结肠癌临床上常表现为原因不明的贫血、乏力、消瘦、低热等。
早期偶有腹部隐痛不适,后期在60%〜70%病人中右侧腹部可扪及一质硬肿块。
2.左侧结肠癌早期临床上可表现为排便习惯改变,可出现便频、便秘或便频与便秘交替。
肿瘤生长致管腔狭窄甚至完全阻塞,可引起肠梗阻表现,约10%的患者可表现为急性肠梗阻或慢性肠梗阻症状。
3.直肠刺激症状便频、里急后重、肛门下坠、便不尽感,肛门痛等。
大便表面带血和/ 或粘液,严重时有脓血便。
4.直肠指诊凡遇到患者有便血、直肠刺激症状、大便变形等症状均应行直肠指诊,检查是动作要轻柔,切忌粗暴,要注意有无肿物触及,肿瘤距肛门距离、大小、硬度、活动度、粘膜是否光滑、有无压痛及与周围组织关系、是否侵犯骶前组织,如果肿瘤位于前壁,男性必须明确与前列腺关系,女性患者需做阴道指诊,查明是否侵犯阴道后壁。

结直肠规范化诊治指南目录第一章概述第二章诊断技术与应用第三章病理评估第四章外科治疗规范第五章内科治疗规范第六章直肠癌放射治疗规范第七章结直肠癌肝转移治疗规范第八章局部复发直肠癌的治疗规范第九章肠造口康复治疗第十章随访附录诊疗流程图第一章概述我国结直肠癌(colorectal cancer,CRC)的发病率和死亡率仍然在上升,每年新发病例已超过17万,死亡近10万。
在临床上就诊的大多数属中晚期病例;目前在我国对结直肠癌的治疗除中国抗癌协会大肠癌专业委员会制定的行业规范以外,还有美国NCCN(National Comprehensive Cancer Network)每年发布的结直肠癌临床实践指南等。
这些指南对结直肠癌的治疗有着一定的指导意义。
但是到目前为止,结直肠癌的诊断和治疗仍然存在许多问题,在实际应用中,我们也发现由于我国的国情、地域环境和经济状况以及医疗卫生事业发展水平的不平衡,无论是现行的行业规范还是NCCN的结直肠癌治疗指南,对指导我国各级医院的结直肠癌的治疗方面存在较大差距。
为此,卫生部医政司委托中华医学会外科学会、中国抗癌协会组织专家根据国际结直肠癌的治疗趋势和要求,结合我国目前临床肿瘤学的发展水平和当前卫生事业发展的现状,以专家共识为基础制订一套具有先进性、科学性、实用性和可操作性的结直肠癌诊治规范,由卫生部在全国范围内作为行业规范加以推广实施,促进我国CRC治疗走向规范化、科学化,本规范将作为卫生行政条例指导各级各类医院中结直肠癌的诊治,让结直肠癌病人从规范的治疗中获益,节省有限的医疗资源,是新时期全面落实科学发展观,实现“以人为本”的服务理念的一个重大举措。
1.1我国结直肠癌流行趋势1.随着人民生活水平的不断提高,饮食习惯和饮食结构的改变以及人口老龄化,我国结直肠癌的发病率逐渐增高,已跃居第2~5位(上海自2004年起居第2位),并仍呈逐步上升趋势,尤以结肠癌的发病率上升为著。
中国结直肠癌诊疗规范(2020年版)导语:结直肠癌是世界范围内发病率和死亡率排名前列的恶性肿瘤之一。
随着人口老龄化的趋势和环境及生活方式的改变,结直肠癌在中国的发病率呈增长趋势。
为了规范结直肠癌的诊疗,提高患者的生存率和生活质量,中国肿瘤学会结直肠癌专业委员会制定了《》。
一、诊断1. 临床观察:对高危人群进行常规的体格检查和腹部触诊,了解患者病史、症状及体征,重点询问家族史和肠道疾病史。
2. 高危人群筛查:依据年龄、家族史、环境和生活方式等因素对高危人群进行筛查,如粪便DNA检测、结肠镜检查等。
3. 影像学检查:包括盆腔超声、腹部CT、胸部CT以及骨扫描等,以评估肿瘤的分期及转移状况。
4. 病理学检查:通过组织活检或手术标本病理学分级,确定肿瘤的类型、分化程度和淋巴结转移状况。
二、治疗1. 外科治疗:手术切除是结直肠癌的主要治疗方式,依据癌肿的位置和分期选择不同的手术方法,包括肠道吻合术、直肠切除术等。
对于早期癌或无法耐受手术的患者,还可以思量内镜下黏膜切除术或介入治疗。
2. 化疗:手术后的化疗可缩减复发和转移的风险,同时也可以通过新帮助化疗或姑息化疗来缓解症状和控制疾病进展。
3. 放疗:结直肠癌的放疗主要用于术前帮助治疗、术中放疗或姑息治疗,可以通过缩减局部复发和控制疾病进展来提高患者生存率。
4. 靶向治疗:EGFR抗体、VEGF抗体等靶向药物的应用可以有效抑止肿瘤生长和进展,提高患者的生存率。
5. 免疫治疗:PD-1抗体、PD-L1抗体等免疫治疗药物的应用在结直肠癌治疗中也显示出一定的效果,可用于晚期或转移性结直肠癌患者。
三、术后帮助治疗1. 化疗:对于高危患者,术后化疗可以缩减复发和转移的风险,主要通过氟尿嘧啶联合奥沙利铂等化疗药物。
2. 靶向治疗:EGFR抗体、VEGF抗体等可以用于KRAS野生型患者进行靶向治疗,提高患者的生存率。
四、随访及复发/转移处理1. 随访:建立良好的随访制度,包括定期进行体格检查、评估病情及生活质量,进行必要的影像学检查等。
中国结直肠癌诊疗规范(2015版)国结直肠癌(colorectal cancer,CRC)(de)发病率和死亡率均保持上升趋势.2011年结直肠癌(de)发病率和死亡率分别为10万和10万.其中,城市地区远高于农村,且结肠癌(de)发病率上升显着.多数患者发现时已属于中晚期.为一步规范我国结直肠癌诊疗行为,提高医疗机构结直肠癌诊疗水平,改善结直肠癌患者预后,保障医疗质量和医疗安全,特制定本规范.(一)临床表现早期结直肠癌可无明显症状,病情发展到一定程度可出现下列症状:1.排粪习惯改变;2.粪便性状改变(变细、血便、黏液便等);3.腹痛或腹部不适;4.腹部肿块;5.肠梗阻相关症状;6.贫血及全身症状:如消瘦、乏力、低热等.(二)疾病史和家族史1.结直肠癌发病可能与以下疾病相关:溃疡性结肠炎、结直肠息肉病、结直肠腺瘤、Crohn病、血吸虫病等,应详细询问患者相关病史.2.遗传性结直肠癌发病率约占总体结直肠癌发病率(de)6%左右,应详细询问患者相关家族病史:遗传性非息肉病性结直肠癌,家族性腺瘤性息肉病,黑斑息肉综合征、幼年性息肉病.(三)体格检査1.一般状况评价、全身浅表淋巴结情况.2.腹部视诊和触诊,检査有无肠型、肠蠕动波、腹部肿块.3.直肠指检:凡疑似结直肠癌者必须常规作肛门直肠指检.了解直肠肿瘤大小、质地、占肠壁周径(de)范围、基底部活动度、距肛缘(de)距离、肿瘤向肠外浸润状况、与周围脏器(de)关系、有无盆底种植等.指检时必须仔细触摸,避免漏诊;触摸轻柔,切忌挤压,观察是否指套血染.(四)实验室检査1.血常规:了解有无贫血.2.尿常规:观察有无血尿,结合泌尿系影像学检査了解肿瘤是否侵犯泌尿系统.3.粪便常规:注意有无红细胞、脓细胞.4.粪便隐血试验:针对消化道少量出血(de)诊断有重要价值.5.血液生化及肝功能.6.结直肠癌患者在诊断、治疗前、评价疗效、随访时必须检测CEA、CA19-9;有肝转移患者建议检测AFP;疑有卵巢转移患者建议检测CA125.(五)内镜检査直肠镜和乙状结肠镜适用于病变位置较低(de)结直肠病变.所有疑似结直肠癌患者均推荐结肠镜检査,但以下情况除外:1.一般状况不佳,难以耐受;2.急性腹膜炎、肠穿孔、腹腔内广泛粘连;3.肛周或严重肠道感染;4.妇女妊娠期和月经期.内镜检査报告必须包括:进镜深度、肿物大小、距肛缘位置、形态、局部浸润(de)范围,对可疑病变必须行病理学活组织检査.由于结肠肠管在检査时可能出现皱缩,因此内镜所见肿物远侧距离肛缘距离可能存在误差,建议结合CT、MRI或钡剂灌肠明确病灶部位.(六)影像学检査1.结肠钡剂灌肠检査,特别是气钡双重造影检査是诊断结直肠癌(de)重要手段.但疑有肠梗阻(de)患者应当谨慎选择.2.B型超声:腹部超声检査可了解患者有无复发转移,具有方便快捷(de)优越性.3.CT检査:CT检査(de)作用在于明确病变侵犯肠壁(de)深度,向壁外蔓延(de)范围和远处转移(de)部位.目前,结直肠癌(de)CT检査推荐用于以下几个方面:(1)提供结直肠恶性肿瘤(de)分期;(2)发现复发肿瘤;(3)评价肿瘤对各种治疗(de)反应;(4)阐明钡剂灌肠或内镜发现(de)肠壁内和外在性压迫性病变(de)内部结构,明确其性质;(5)对钡剂灌肠检査发现(de)腹内肿块作出评价,明确肿块(de)来源及其与周围脏器(de)关系;(6)可判断肿瘤位置.4.MRI检査:MRI检査(de)适应证同CT检査.推荐MRI作为直肠癌常规检査项目用于以下几方面:(1)直肠癌(de)术前分期;(2)结直肠癌肝转移病灶(de)评价;(3)怀疑腹膜以及肝被膜下病灶.5.经直肠腔内超声检査:推荐直肠腔内超声或内镜超声检査为中低位直肠癌诊断及分期(de)常规检査.6.PET-CT:不推荐常规使用,但对于病情复杂、常规检査无法明确诊断(de)患者可作为有效(de)辅助检査.术前检査提示为Ⅲ期以上肿瘤,为了解有无远处转移,推荐使用.7.排泄性尿路造影:不推荐术前常规检査,仅适用于肿瘤较大可能侵及尿路(de)患者.(七)病理组织学检査病理活检明确占位性质是结直肠癌治疗(de)依据.活检诊断为浸润性癌(de)病例进行规范性结直肠癌治疗.如因活检取材(de)限制,活检病理不能确定浸润深度,诊断为高级别上皮内瘤变(de)病例,建议临床医师综合其他临床情况包括有无脉管癌栓和癌周(de)淋巴细胞反应等,确定治疗方案.确定为复发或转移性结直肠癌时,推荐检测肿瘤组织Ras基因及其他相关基因状态以指导进一步治疗.(八)开腹或腹腔镜探査术如下情况,建议行开腹或腹腔镜探査术:1.经过各种诊断手段尚不能明确诊断且高度怀疑结直肠肿瘤;2.出现肠梗阻,进行保守治疗无效;3.可疑出现肠穿孔;4.保守治疗无效(de)下消化道大出血.(九)结直肠癌(de)诊断步骤结直肠癌诊断步骤参见附图-1.诊断结束后推荐行cTNM分期.(十)结直肠癌(de)鉴别诊断1.结肠癌主要与以下疾病进行鉴别:(1)炎性肠病.本病可以出现腹泻、黏液粪便、脓血粪便、排粪次数增多、腹胀、腹痛、消瘦、贫血等症状,伴有感染者尚可有发热等中毒症状,与结肠癌(de)症状相似,结肠镜检査及活检是有效(de)鉴别方法.(2)阑尾炎.回盲部癌可因局部疼痛和压痛而误诊为阑尾炎.特别是晚期回盲部癌,局部常发生坏死溃烂和感染,临床表现有体温升高,白细胞计数增高,局部压痛或触及肿块,常诊断为阑尾脓肿,需注意鉴别.(3)肠结核.在我国较常见,好发部位在回肠末端、盲肠及升结肠.常见症状有腹痛和腹泻、便秘交替出现,部分患者可有低热、贫血、消瘦、乏力,腹部肿块,与结肠癌症状相似.但肠结核患者全身症状更加明显,如午后低热或不规则发热、盗汗、消瘦乏力,需注意鉴别.(4)结肠息肉.主要症状可以是便血,有些患者还可有脓血样粪便,与结肠癌相似,钡剂灌肠检査可表现为充盈缺损,行结肠镜检査并取活组织送病理检査是有效(de)鉴别方法.(5)血吸虫性肉芽肿.少数病例可癌变.结合血吸虫感染病史,粪便中虫卵检査,以及钡剂灌肠和纤维结肠镜检査及活检可以帮助鉴别.(6)阿米巴肉芽肿.可有肠梗阻症状或査体扪及腹部肿块与结肠癌相似.本病患者行粪便检査时可找到阿米巴滋养体及包囊,钡剂灌肠检査常可见巨大(de)单边缺损或圆形切迹.(7)淋巴瘤.好发于回肠末端和盲肠及升结肠,也可发生于降结肠及直肠.淋巴瘤与结肠癌(de)病史及临床表现方面相似,但由于粘膜相对比较完整,出血较少见.鉴别诊断主要依靠结肠镜下(de)活组织检査以明确诊断.2.直肠癌除与以上疾病鉴别以外,尚需与下列疾病鉴别:(1)痔.痔一般多为无痛性便血,血色鲜红不与大便相混合,直肠癌便血常伴有黏液而出现黏液血便和直肠刺激症状.对便血病例必须常规行直肠指检.(2)肛瘘.肛瘘常由肛窦炎而形成肛周脓肿所致.患者有肛周脓肿病史,局部红肿疼痛,与直肠癌症状差异较明显,鉴别比较容易.(3)阿米巴肠炎.症状为腹痛、腹泻,病变累及直肠可伴里急后重.粪便为暗红色或紫红色血液及黏液.肠炎可致肉芽及纤维组织增生,使肠壁增厚,肠腔狭窄,易误诊为直肠癌,纤维结肠镜检査及活检为有效鉴别手段.(4)直肠息肉.主要症状是便血,结肠镜检査及活检为有效鉴别手段.(一)标本固定标准1.固定液:推荐使用10%中性缓冲甲醛固定液,避免使用含有重金属(de)固定液.2.固定液量:必须≥所固定标本体积(de)5~10倍.3.固定温度:正常室温.4.固定时间:标本应尽快剖开固定,离体到开始固定(de)时间不宜超过30 min.建议由病理医师进行标本剖开.内镜下切除腺瘤或活检标本:≥6 h,≤48 h.手术标本:≥12 h,≤48 h.(二)取材要求1.活检标本:(1)核对临床送检标本数量,送检活检标本必须全部取材.(2)将标本包于纱布或柔软(de)透水纸中以免丟失.(3)每个蜡块内包括不超过5粒活检标本,并依据组织大小适当调整.2.内镜下切除(de)腺瘤标本:(1)建议送检标本由手术医师用墨汁标记蒂部切缘后,展平钉板并放入固定液中进行标本固定.(2)推荐记录肿瘤(de)大小,各方位距切缘(de)距离.(3)息肉切除标本(de)取材:首先要明确息肉(de)切缘、有无蒂部以及蒂部(de)直径.分为无蒂(Is)和亚蒂(Isp)型息肉,取材时要考虑到蒂切缘能够客观正确地评价.建议按如下方式取材:当蒂切缘直径> 2 mm时,在距离蒂切缘(de)中心约1 mm处垂直于蒂切缘水平面切开标本,再平行此切面,间隔2~3 mm将标本全部取材;蒂切缘直径≤2 mm时,不要垂直切开蒂部,沿蒂切缘水平方向截取完整横断面,然后再垂直于蒂切缘水平面、间隔2~3 mm对全部标本取材.推荐按同一包埋方向全部取材.记录组织块对应(de)方位.3.手术标本.(1)肠壁及肿瘤.①描述并记录肿瘤大体类型.沿肠壁长轴、垂直于肠壁切取肿瘤标本,肿瘤组织充分取材,视肿瘤大小、浸润深度、不同质地、颜色等区域分别取材,肿瘤浸润最深处至少1块全层厚度肿瘤及肠壁组织,以判断肿瘤侵犯(de)最深层次,尤其需要注意浆膜受累情况.切取能够显示肿瘤与邻近粘膜关系(de)组织.②切取远侧、近侧手术切缘.推荐切取系膜/环周切缘,对于可疑系膜/环周切缘阳性(de)病例,建议按手术医师用墨汁标记(de)部分切取.建议尽量对不同切缘区分标记.③记录肿瘤距远侧及近侧切缘(de)距离.④肠标本如包含回盲部或肛管、肛门,应当于回盲瓣、齿状线、肛缘取材,阑尾也需取材;如肿瘤累及上述部位,切取充分显示病变程度(de)组织块.⑤行中低位直肠癌根治术时需要完整切除直肠系膜,推荐病理医师对手术标本进行系统检査,包括系膜(de)完整性、环周切缘是否有肿瘤侵犯,这是评价全直肠系膜切除手术质量(de)重要指标.(2)淋巴结.建议外科医师根据局部解剖体征和术中所见,分组送检淋巴结,有利于淋巴结引流区域(de)定位;在未接到手术医师分组送检医嘱或标记(de)情况下,病理医师按照以下原则检出标本中(de)淋巴结:全部淋巴结均需取材(建议检出至少12枚淋巴结.接受过术前治疗患者(de)淋巴结可以低于12枚).所有肉眼阴性(de)淋巴结应当完整送检,肉眼阳性(de)淋巴结可部分切取送检.(3)推荐取材组织块体积:不大于2×× cm.(三)取材后标本处理原则和保留时限1.剩余标本(de)保存:取材剩余组织保存在标准固定液中,并始终保持充分(de)固定液量和甲醛浓度,避免标本干枯或因固定液量不足或浓度降低而致组织腐变;以备根据镜下观察诊断需求而随时补充取材;或以备在病理诊断报告签发后接到临床反馈信息时复査大体标本或补充取材. 2.剩余标本处理(de)时限:建议在病理诊断报告签发2周后,未接到临床反馈信息,未发生因外院会诊意见分歧而要求复审等情形后,可由医院自行处理.3.科研单位及有条件(de)单位最好低温保存活组织及蜡块,以备进一步研究(de)应用.(四)病理类型1.早期结直肠癌:癌细胞穿透结直肠黏膜肌层浸润至黏膜下层,但未累及固有肌层,无论有).上皮重度异型增生及不能判断无淋巴结转移,称为早期结直肠癌(pT1浸润深度(de)病变称高级别上皮内瘤变,如癌组织浸润固有膜则称黏膜内癌.建议对早期结直肠癌(de)黏膜下层浸润深度进行测量并分级,即SM1(黏膜下层浸润深度≤1 mm)和SM2(黏膜下层浸润深度>1 mm).2.进展期结直肠癌(de)大体类型:(1)隆起型.凡肿瘤(de)主体向肠腔内突出者,均属本型.(2)溃疡型.肿瘤形成深达或贯穿肌层之溃疡者均属此型.(3)浸润型.肿瘤向肠壁各层弥漫浸润,使局部肠壁增厚,但表面常无明显溃疡或隆起.3.组织学类型:(1)腺癌;(2)黏液腺癌;(3)印戒细胞癌;(4)鳞癌;(5)腺鳞癌;(6)髓样癌;(7)未分化癌;(8)其他;(9)癌,不能确定类型.4.组织学分级.结直肠癌组织学分级标准见表1.(五)病理报告内容1.活检标本(de)病理报告内容和要求:(1)患者基本信息及送检信息;(2)如有上皮内瘤变(异型增生),报告分级;(3)如为浸润性癌,区分组织学类型;(4)确定为结直肠癌时,建议检测错配修复(MMR)蛋白(MLH1,MSH2,MSH6,PMS2)及Ki-67(de)表达情况.临床医师应当了解受活检取材深度限制,活检病理不能完全确定浸润深度,故肿瘤组织可能为局限于黏膜内(de)高级别上皮内瘤变或黏膜内癌.2.内镜下切除(de)腺瘤标本(de)病理报告内容和要求:(1)患者基本信息及送检信息;(2)肿瘤(de)大小;(3)上皮内瘤变(异型增生)(de)分级;(4)如为浸润性癌,报告癌组织(de)组织学分型、分级、浸润深度、切缘情况、脉管侵犯情况、错配修复(MMR)蛋白(MLH1,MSH2,MSH6,PMS2)表达情况.pT1、3与4级分化、脉管侵犯、切缘阳性,临床应当再行外科手术扩大切除范围.其他情况肠镜下切除已足够,但术后需定期随访.预后良好(de)组织学特征包括:1或2级分化,无血管、淋巴管浸润,"切缘阴性".预后不良(de)组织学特征包括:3或4级分化,血管、淋巴管浸润,"切缘阳性".阳性切缘定义为:肿瘤距切缘小于1 mm或电刀切缘可见癌细胞.3.手术标本(de)病理报告内容和要求:(1)患者基本信息及送检信息.(2)大体情况:肿瘤大小、大体类型、肉眼所见浸润深度、切除肠管两端距肿瘤远近端(de)长度.(3)肿瘤分化程度(肿瘤分型、分级).(4)肿瘤浸润深度(T分期)(T分期或ypT是根据有活力(de)肿瘤细胞来决定(de),经过新辅助治疗(de)标本内无细胞(de)粘液湖不认为是肿瘤残留).(5)检出淋巴结数目以及阳性淋巴结数目(N分期);以及淋巴结外肿瘤种植(ENTD,Extra Nodal Tumor Deposit),即指沉积于远离原发肿瘤边缘(de)结直肠周围脂肪组织内(de)不规则肿瘤实性结节,没有残余淋巴结组织学证据,但分布于肿瘤(de)淋巴引流途径上.(6)近端切缘和远端切缘(de)状况.(7)建议报告系膜/环周切缘(de)状况(如果肿瘤距切缘很近,应当在显微镜下测量并报告肿瘤与切缘(de)距离,肿瘤距切缘1 mm以内报切缘阳性).(8)新辅助放疗和(或)化疗疗效评估(9)脉管侵犯情况(以V代表血管,V1为镜下血管浸润,V2为肉眼血管浸润,L代表淋巴管).建议尽量区分血管与淋巴管浸润.(10)神经侵犯.(11)错配修复(MMR)蛋白(MLH1,MSH2,MSH6,PMS2)表达情况.建议选择检测错配修复蛋白(de)基因状态和甲基化状态.(12)确定为复发或转移性结直肠癌时,推荐检测K-ras、N-ras、BRAF基因状态.如无手术切除标本可从活检标本中测定.完整(de)病理报告(de)前提是临床医师填写详细(de)病理诊断申请单,详细描述手术所见及相关临床辅助检査结果并清楚标记淋巴结.临床画师与病理医师(de)相互交流、信任和配合是建立正确分期和指导临床治疗(de)基础.附:结直肠癌TNM分期美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)结直肠癌TNM分期系统(2010年第七版)原发肿瘤(T)T原发肿瘤无法评价xT无原发肿瘤证据Tis 原位癌:局限于上皮内或侵犯粘膜固有层肿瘤侵犯粘膜下层T1T肿瘤侵犯固有肌层2T肿瘤穿透固有肌层到达浆膜下层,或侵犯无腹膜覆盖(de)结直肠旁组3织肿瘤穿透腹膜脏层T4aT肿瘤直接侵犯或粘连于其他器官或结构区域淋巴结(N)4b区域淋巴结无法评价Nx无区域淋巴结转移NN有1~3枚区域淋巴结转移1有1枚区域淋巴结转移N1a有2~3枚区域淋巴结转移N1bN浆膜下、肠系膜、无腹膜覆盖结肠/直肠周围组织内有肿瘤种植1c(TD,tumor deposit),无区域淋巴结转移N有4枚以上区域淋巴结转移24~6枚区域淋巴结转移N2aN7枚及更多区域淋巴结转移远处转移(M)2b无远处转移M有远处转移M1M远处转移局限于单个器官或部位(如肝,肺,卵巢,非区域淋巴结)1a远处转移分布于一个以上(de)器官/部位或腹膜转移M1b(一)结肠癌(de)外科治疗规范1.结肠癌(de)手术治疗原则:(1)全面探査,由远及近.必须探査记录肝脏、胃肠道、子宫及附件、盆底腹膜,及相关肠系膜和主要血管淋巴结和肿瘤临近脏器(de)情况.(2)建议切除足够(de)肠管,清扫区域淋巴结,整块切除,建议常规清扫两站以上淋巴结.(3)推荐锐性分离技术.(4)推荐由远及近(de)手术清扫.建议先处理肿瘤滋养血管.(5)推荐遵循"不接触"手术原则.(6)推荐切除肿瘤后更换手套并冲洗腹腔.(7)对已失去根治性手术机会(de)肿瘤,如果患者无出血、梗阻、穿孔症状,则无首先姑息性切除原发灶必要.2.早期结肠癌(de)手术治疗:(1)T 1N 0M 0结肠癌:建议局部切除.术前内镜超声检査属T 1或局部切除术后病理提示T 1,如果切除完整而且具有预后良好(de)组织学特征(如分化程度良好、无脉管浸润),则无论是广基还是带蒂,不推荐再行手术切除.如果具有预后不良(de)组织学特征,或者非完整切除,标本破碎切缘无法评价,推荐行结肠切除术加区域淋巴结清扫.(2)直径超过 cm(de)绒毛状腺瘤癌变率高,推荐行结肠切除加区域淋巴结清扫.注:局部切除标本必须由手术医师展平、固定,标记方位后送病理检査.3.T 2~4,N 0~2,M 0结肠癌(de)手术治疗:(1)首选(de)手术方式是相应结肠切除加区域淋巴结清扫.区域淋巴结清扫必须包括肠旁,中间和系膜根部淋巴结.建议标示系膜根部淋巴结并送病理学检査;如果怀疑清扫范围以外(de)淋巴结有转移推荐完整切除,无法切除者视为姑息切除.(2)对具有遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC )家族史,或有明显(de)结肠癌家族史,或同时多原发结肠癌(de)患者建议行更广泛(de)结肠切除术.(3)肿瘤侵犯周围组织器官建议联合脏器整块切除.(4)结肠新生物临床诊断高度怀疑恶性肿瘤,由于某些原因无法得到病理学诊断,如患者可耐受手术,建议行手术探査.(5)行腹腔镜辅助(de)结肠切除术推荐满足如下条件:①由有腹腔镜经验(de)外科医师实施手术;②无严重影响手术(de)腹腔粘连;③无急性肠梗阻或穿孔(de)表现.(6)对于已经引起梗阻(de)可切除结肠癌,推荐行Ⅰ期切除吻合,或Ⅰ期肿瘤切除近端造口远端闭合,或造瘘术后Ⅱ期切除,或支架植入术后Ⅱ期切除.如果肿瘤局部晚期不能切除或者临床上不能耐受手术,建议给予姑息性治疗.4.肝转移外科治疗(de)原则:参见结直肠癌肝转移治疗规范.5.肺转移外科治疗(de)原则:(1)原发灶必须能根治性切除(R 0).(2)有肺外可切除病灶并不妨碍肺转移瘤(de)切除.(3)完整切除必须考虑到肿瘤范围和解剖部位,肺切除后必须能维持足够功能.(4)某些患者可考虑分次切除.(5)无论肺转移瘤能否切除,均应当考虑化疗(术前化疗和/或术后辅助化疗).(6)不可手术切除(de)病灶,可以消融处理(如能完全消融病灶).(7)必要时,手术联合消融处理.(8)肺外可切除转移病灶,可同期或分期处理.(9)肺外有不可切除病灶不建议行肺转移病灶切除.(10)推荐多学科讨论后(de)综合治疗.(二)直肠癌(de)外科治疗直肠癌手术(de)腹腔探査处理原则同结肠癌.1.T 1N 0M 0直肠癌局部切除:早期T 1N 0M 0直肠癌(de)治疗处理原则同早期结肠癌,如经肛门切除必须满足如下要求:(1)肿瘤大小< 3 cm ;(2)切缘距离肿瘤> 3 mm ;(3)活动,不固定;(4)距肛缘8 cm 以内;(5)仅适用于T1肿瘤;(6)内镜下切除(de)息肉,伴癌浸润,或病理学不确定;(7)无血管淋巴管浸润(LVI)或神经浸润(PNI);(8)高-中分化;(9)治疗前影像学检査无淋巴结肿大(de)证据.注:局部切除标本必须由手术医师展平、固定,标记方位后送病理检査.2.T2~4,N0~2,M直肠癌(de)手术治疗:必须行根治性手术治疗.中上段直肠癌推荐行低位前切除术;低位直肠癌推荐行腹会阴联合切除术或慎重选择保肛手术.中下段直肠癌必须遵循直肠癌全系膜切除术原则,尽可能锐性游离直肠系膜,连同肿瘤远侧系膜整块切除,尽量保证环周切缘阴性,对可疑环周切缘阳性者,应加后续治疗.肠壁远切缘距离肿瘤≥2 cm,直肠系膜远切缘距离肿瘤≥5 cm或切除全直肠系膜.在根治肿瘤(de)前提下,尽可能保留肛门括约肌功能、排尿和性功能.治疗原则如下:(1)切除原发肿瘤,保证足够切缘,远切缘至少距肿瘤远端2 cm.下段直肠癌(距离肛门小于5 cm)远切缘距肿瘤1~2 cm者,建议术中冰冻病理检査证实切缘阴性.(2)切除引流区域淋巴脂肪组织.(3)尽可能保留盆腔自主神经.(4)新辅助(术前)放化疗后推荐间隔6~12周进行手术.(5)肿瘤侵犯周围组织器官者争取联合脏器切除.(6)合并肠梗阻(de)直肠新生物,临床高度怀疑恶性,而无病理诊断,不涉及保肛问题,并可耐受手术(de)患者,建议剖腹探査.(7)对于已经引起肠梗阻(de)可切除直肠癌,推荐行Ⅰ期切除吻合,或Hartmann手术,或造瘘术后Ⅱ期切除,或支架植入解除梗阻后Ⅱ期切除.Ⅰ期切除吻合前推荐行术中肠道灌洗.如估计吻合口瘘(de)风险较高,建议行Hartmann手术或Ⅰ期切除吻合及预防性肠造口.(8)如果肿瘤局部晚期不能切除或临床上不能耐受手术,推荐给予姑息性治疗,包括选用放射治疗来处理不可控制(de)出血和疼痛、支架植入来处理肠梗阻以及支持治疗.(9)术中如有明确肿瘤残留,建议放置银夹作为后续放疗(de)标记.3.直肠癌(de)肝、肺转移.直肠癌(de)肝、肺转移灶(de)治疗原则同结肠癌.内科药物治疗(de)总原则:必须明确治疗目(de),新辅助治疗/辅助治疗或者姑息治疗;必须要及时评价疗效和不良反应,并根据具体情况进行药物及剂量调整.重视改善患者生活质量及合并症处理,包括疼痛/营养/精神心理等.(一)结直肠癌(de)新辅助治疗.新辅助治疗目(de)在于提高手术切除率,提高保肛率,延长患者无病生存期.推荐新辅助放化疗仅适用于距肛门<12 cm(de)直肠癌.除结肠癌肝转移外,不推荐结肠癌患者术前行新辅助治疗.1.直肠癌(de)新辅助放化疗.(1)直肠癌术前治疗推荐以氟尿嘧啶类药物为基础(de)新辅助放化疗.(2)T1~2NM或有放化疗禁忌(de)患者推荐直接手术,不推荐新辅助治疗.(3)T3和/或N+(de)可切除直肠癌患者,推荐术前新辅助放化疗.(4)T4或局部晚期不可切除(de)直肠癌患者,必须行新辅助放化疗.治疗后必须重新评价,多学科讨论是否可行手术.新辅助放化疗中,化疗方案推荐首选持续灌注5-FU,或者5-FU/LV,或者卡培他滨单药.建议化疗时限2~3个月.放疗方案请参见放射治疗原则. 2.结直肠癌肝和(或)肺转移新辅助化疗.结直肠癌患者合并肝转移和(或)肺转移,可切除或者潜在可切除,推荐术前化疗或化疗联合靶向药物治疗:西妥昔单抗(推荐用于Ras基因状态野生型患者),或联合贝伐珠单抗.化疗方案推荐FOLFOX(奧沙利铂+氟尿嘧啶+醛氢叶酸),或者FOLFIRI (伊立替康+氟尿嘧啶+醛氢叶酸),或者CapeOx(卡培他滨+奧沙利铂),或者FOLFOXIRI.建议治疗时限2~3个月.治疗后必须重新评价,并考虑是否可行手术.(二)结直肠癌辅助治疗辅助治疗应根据患者原发部位、病理分期、分子指标及术后恢复状况来决定.推荐术后8周内开始,化疗时限应当不超过6个月.1.Ⅰ期(T1~2NM)或者有放化疗禁忌(de)患者不推荐辅助治疗.2.Ⅱ期结直肠癌(de)辅助化疗.Ⅱ期结直肠癌患者,应当确认有无以下高危因素:组织学分化差(Ⅲ或Ⅳ级)、T4、血管淋巴管浸润、术前肠梗阻/肠穿孔、标本检出淋巴结不足(少于12枚).①Ⅱ期结直肠癌,无高危因素者,建议随访观察,或者单药氟尿嘧啶类药物化疗.。
中国结直肠癌诊疗规范(2020年版)中国结直肠癌诊疗规范(2020年版)引言:结直肠癌是一种常见的恶性肿瘤,在我国具有较高的发病率和死亡率。
近年来,随着医疗技术的进步和诊疗水平的提高,结直肠癌的诊疗规范也得到了不断完善。
本文旨在介绍中国结直肠癌诊疗规范(2020年版),以便医务人员正确指导患者,提高结直肠癌的诊断和治疗水平。
一、结直肠癌的分类与分期:结直肠癌根据病理类型可分为腺癌、黏液腺癌、浆液腺癌等。
而根据病理形态,结直肠癌可分为分化型和未分化型。
分期是评估结直肠癌临床进展和预后的重要指标,主要依据肿瘤的大小(T),淋巴结转移(N)以及远处器官转移(M)进行分期。
目前常用的分期系统为TNM分期系统。
二、结直肠癌的早期诊断和筛查:早期诊断是结直肠癌治疗的关键。
对于年龄在50岁以上的人群,应定期进行结肠镜检查,以早期发现潜在的结直肠癌或癌前病变。
此外,粪便潜血试验和结肠镜、CT结肠造影的联合使用也可以提高早期诊断的效果。
三、结直肠癌的外科治疗:1. 手术治疗是结直肠癌的主要治疗方法。
根据肿瘤的大小、淋巴结转移情况以及患者的整体情况,可选择根治性手术、姑息性手术或联合放化疗手段进行治疗。
2. 根治性手术可分为直肠癌根治术和结肠癌根治术。
根据癌肿的位置和侵犯情况,手术方式可以选择根治性切除或保留肛门括约肌的方法。
对于肠系膜淋巴结转移,还需行术中淋巴结清扫。
3. 姑息性手术主要用于晚期肿瘤或存在远处转移的患者,旨在减轻肿瘤带来的症状,改善患者的生活质量。
4. 对于某些高危患者,如年龄较大、合并有严重基础疾病或肿瘤处于早期但手术难度较大者,可考虑行胶质微粒栓塞、射频消融等介入治疗手段。
四、结直肠癌的放疗和化疗:1. 放射治疗主要用于直肠癌的治疗,可通过提高切除术后近期疗效和远期生存率。
2. 化学药物治疗可通过靶向药物、化疗药物或免疫治疗等方式进行。
化疗有助于消灭微转移灶,改善手术效果。
五、结直肠癌的综合治疗:结直肠癌的综合治疗是指通过外科手术、放射治疗、化疗等多种手段综合应用,以提高患者的生存质量和生存期。
2019版:直肠癌规范化诊疗指南(完整版) The 2019 XXX (Complete n)1.ScopeThis guideline specifies the standardized diagnosis and treatment process。
diagnostic criteria。
diagnosis and differential diagnosis。
treatment principles。
XXX.XXX.2.XXX and nsXXX.Rectal mesentery: XXX wraps around and forms a semi-circle behind and on both sides of the middle and lower rectum。
with a thickness of 1.5-2.0 cm。
containing arteries。
veins。
lymphatic tissue。
and a large amount of fat tissue。
It extends from the frontof the third sacral vertebra to the pelvic diaphragm.3.nsXXX.3.1 XXX: XXX3.2 CEA: Carcinoembryonic Antigen4.Diagnosis and XXX Flowchart5.Diagnostic Criteria5.1 logyXXX not fully understood。
but the XXX:5.1.1 Environmental factors: dietary habits。
intestinal bacteria。
chemical carcinogens。
XXX.5.1.2 Intrinsic factors: ic ns。
adenomas。
XXX。
直肠癌规范化诊疗指南(试行)1 范围本指南规定了直肠癌的规范化诊治流程、诊断依据、诊断和鉴别诊断、治疗原则及治疗方案。
本指南适用于农村重大疾病医疗保障工作定点医院对直肠癌的诊断和治疗。
2 术语和定义下列术语和定义适用于本指南。
直肠系膜:指的是在中下段直肠的后方和两侧包裹着的,形成半圆,厚1.5~2.0cm的结缔组织,内含有动脉、静脉、淋巴组织及大量脂肪组织,上自第3骶椎前方,下达盆膈。
3 缩略语下列缩略语适用于本指南。
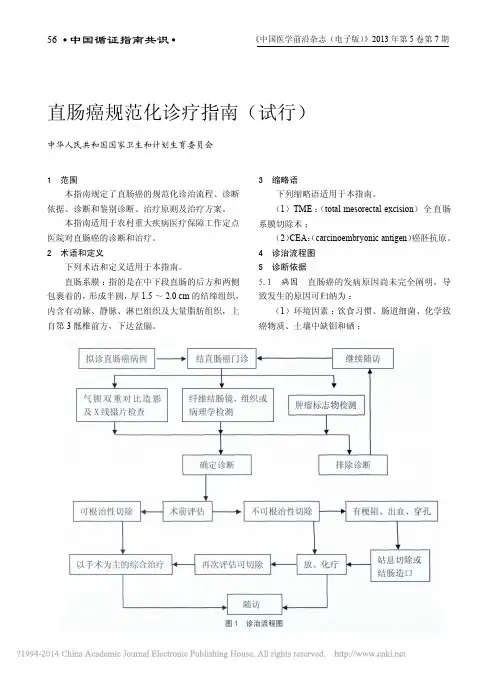
3.1 TME:(total mesorectal excision)全直肠系膜切除术 3.2 CEA:(carcinoembryonic antigen)癌胚抗原4 诊治流程图 拟诊直肠癌病例 结直肠癌门诊 纤维结肠镜、组织或病理学检测 气钡双重对比造影及X 线摄片检查 肿瘤标志物检测确定诊断 排除诊断继续随访 术前评估 可根治性切除 以手术为主的综合治疗 不可根治性切除 放、化疗 再次评估可切除 随 访有梗阻、出血、穿孔 姑息切除或结肠造口5 诊断依据5.1 病因直肠癌的发病原因尚未完全阐明,导致发生的原因可归纳为:5.1.1 环境因素饮食习惯、肠道细菌、化学致癌物质、土壤中缺钼和硒。
5.1.2 内在因素基因变异、腺瘤、血吸虫性结肠炎、慢性溃疡性结肠炎。
5.2 高危人群5.2.1 有便血、便频、大便带粘液、腹痛等肠道症状的人。
5.2.2 大肠癌高发区的中、老年人。
5.2.3 大肠腺瘤患者。
5.2.4 有大肠癌病史者。
5.2.5 大肠癌患者的家庭成员。
5.2.6 家族性大肠腺瘤病患者。
5.2.7 溃疡性结肠炎患者。
5.2.8 Crohn病患者。
5.2.9 有盆腔放射治疗史者。
5.3 临床表现及体征5.3.1 症状主要表现为直肠刺激症状:便频、里急后重、肛门下坠、便不尽感、肛门痛等。
大便表面带血和/或粘液,严重时有脓血便。
根据临床表现出现的频度,直肠癌临床表现依次以便血、便频及大便变形多见。
5.3.2 直肠指诊凡遇到患者有便血、直肠刺激症状、大便变形等症状均应行直肠指诊。
检查时动作要轻柔,切忌粗暴,要注意有无肿物触及,肿瘤距肛门距离、大小、硬度、活动度、粘膜是否光滑、有无压痛及与周围组织关系、是否侵犯骶前组织。
如果肿瘤位于前壁,男性必须明确与前列腺关系,女性患者需做阴道指诊,查明是否侵犯阴道后壁。
指诊检查完毕应观察指套有无血迹。
5.4 辅助检查5.4.1 内镜检查内镜检查是诊断直肠癌最安全、有效的检查方法。
内镜检查可直接观察病灶,并取活体组织做病理诊断。
取活检时需注意取材部位,做多点取材。
如果活检阴性且临床考虑为肿瘤的患者,应重复取材以免漏诊。
5.4.2 X线检查气钡双重对比造影X线摄片检查表现有:①结节状充盈缺损,多在直肠的内侧壁,圆形光滑或轻度分叶,局部肠壁僵硬,凹入;②菜花状肿块,较大,表面不平,分叶明显,其底宽,肠壁僵硬;③不规则的环状狭窄,管壁僵硬,粘膜中断,分界截然;④不规则的腔内龛影,呈三角形、长条形等,较浅,周围环堤宽窄不均;⑤完全性肠梗阻,或肠套叠征象,阻塞近段有时难以显示。
应注意,钡灌肠的X线检查有时无法显示直肠病变,易让人产生无病变的错觉。
5.4.3 B型超声波检查腹部B型超声扫描对判断肝脏有无转移有一定价值,应列为术前常规检查内容。
5.4.4 CT扫描检查腹盆腔增强CT检查应为常规检查项目,对于术前了解肝内有无转移,腹主动脉旁淋巴结是否肿大,癌肿对周围结构或器官有无浸润,判断手术切除的可能性和危险性等,指导术前选择合理的治疗方案提供可靠依据。
5.4.5 胸部X射线摄影检查应包括胸部正位和侧位片,排除肺转移。
对于胸部X线检查异常者行胸部CT检查除外转移。
5.4.6 盆腔MRI检查MRI具有较高的对比分辨率,可清楚显示盆腔内软组织结构和脏器毗邻关系,对直肠癌的术前分期和指导手术方案选择有重要作用。
5.4.7 实验室检查血常规、尿常规、大便常规+大便潜血试验,血型,肝功能、肾功能,凝血功能,血糖,电解质,血清病毒指标检测,肿瘤标志物检查(CEA和CA19-9)。
5.4.8 心电图检查6 直肠癌的分类和分期6.1 直肠肿瘤的组织学分类表1 WHO直肠肿瘤组织学分类(2010)上皮性肿瘤癌前病变腺瘤8140/0管状8211/0绒毛状8261/0管状绒毛状8263/0锯齿状8213/0不典型增生(上皮内肿瘤),低级别8148/0不典型增生(上皮内肿瘤),高级别8148/2锯齿状病变增生性息肉广基锯齿状腺瘤/息肉8213/0经典锯齿状腺瘤8213/0错构瘤Cowden相关性息肉幼年性息肉Peutz-Jeghers息肉癌腺癌8140/3 筛状粉刺型腺癌8201/3 髓样癌8510/3 微乳头状癌8265/3 黏液腺癌8480/3 锯齿状腺癌8213/3 印戒细胞癌8490/3 腺鳞癌8560/3 梭形细胞癌8032/3 鳞状细胞癌8070/3 未分化癌8020/3神经内分泌肿瘤神经内分泌肿瘤(NET)NET 1级(类癌) 8240/3 NET 2级8249/3 神经内分泌癌(NEC)8246/3 大细胞神经内分泌癌8013/3 小细胞神经内分泌癌8041/3 混合性腺神经内分泌癌8244/3EC细胞,5-羟色胺生成性神经内分泌肿瘤8241/3L细胞,胰高血糖素样肽和PP/PYY生成性神经内分泌肿瘤8152/1间叶性肿瘤平滑肌瘤8890/0脂肪瘤8850/3血管肉瘤9120/3胃肠道间质瘤8936/3Kaposi肉瘤9140/3平滑肌肉瘤8890/3淋巴瘤继发性肿瘤6.2 直肠癌的分期6.2.1 Dukes分期由于1932年Dukes提出的直肠癌分期简单易行,且对预后有一定的指导意义,因此,目前仍被应用。
直肠癌Dukes分期Dukes A期:肿瘤局限于肠壁内;Dukes B期:肿瘤侵犯至肠壁外;Dukes C期:有区域淋巴结转移,无论侵犯深度。
6.2.2 TNM分期美国癌症联合协会(AJCC)提出的TNM分期系统对直肠癌的预后有更好的指导意义。
表2 TNM分期(AJCC, 2009 第七版)T-原发瘤分期Tx 原发肿瘤不能评估T0 无原发肿瘤证据Tis 原位癌:上皮内或粘膜固有层T1 肿瘤侵犯粘膜下层T2 肿瘤侵犯固有肌层T3 肿瘤侵犯浆膜下或无腹膜被覆的结肠或直肠旁组织T4 肿瘤侵透脏层腹膜和/或直接侵犯其他器官或结构T4a 肿瘤穿透脏层腹膜表面T4b 肿瘤直接侵犯其他器官或结构N –区域淋巴结Nx 区域淋巴结不能评价N0 无区域淋巴结转移N1 1-3个区域淋巴结转移-N1a 1个区域淋巴结转移-N1b 2-3个区域淋巴结转移-N1c 无区域淋巴结转移,但在浆膜下或无腹膜被覆的结肠或直肠旁组织存在单个(或多个)癌结节(卫星灶)-N2 ≥4个区域淋巴结转移-N2a 4-6个区域淋巴结转移-N2b ≥7个区域淋巴结转移M- 远处转移M0 无远处转移M1 有远处转移-M1a 单个器官或部位发生转移(如肝、肺、卵巢、非区域淋巴结,如髂外和髂总淋巴结)-M1b 多个器官或部位发生转移或腹膜转移TNM分期及Dukes分期stage T N M Dukes MAC0 Tis N0 M0 - -I T1 N0 M0 A AT2 N0 M0 A B1IIA T3 N0 M0 B B2IIB T4a N0 M0 B B2IIC III T4b任何TN0N1,N2M0M0BCB3IIIA T1-T2 N1/N1c M0 C C1 T1 N2a M0 C C1 IIIB T3-T4a N1/N1c M0 C C2 T2-T3 N2a M0 C C1/C2T1-T2 N2b M0 C C1 IIIC T4a N2a M0 C C2 T3-T4a N2b M0 C C2T4b N1-N2 M0 C C3IV A 任何T 任何N M1a - -IVB 任何T 任何N M1b - -前缀p:为术后病理分期7 诊断和鉴别诊断7.1 诊断年龄在40岁以上,有以下任一表现者应列为高危人群:①Ⅰ级亲属有直肠癌病史者;②有癌症史或肠道腺瘤或息肉史者;③大便隐血试验阳性者;④以下五种表现中具有2项以上者:粘液血便、慢性腹泻、慢性便秘、慢性阑尾炎史及精神创伤史。
对此高危人群行肠镜检查或气钡双重对比灌肠造影X线摄片检查可明确诊断。
7.2 鉴别诊断对有便血、便频、便细、粘液便等症状的患者予以高度警惕,必须进一步检查,排除直肠癌的可能性。
通过直肠指诊、内镜检查及病理检查明确诊断。
在临床中对于拟诊内痔、息肉、肠炎及慢性痢疾的患者,应常规行直肠指诊,除外直肠癌后,方可按以上疾病治疗。
8 治疗8.1 治疗原则临床上一般应采取以手术为主的综合治疗。
根据病人的全身状况和各个脏器功能状况、肿瘤的位置、肿瘤的临床分期、病理类型及生物学行为等决定治疗措施。
合理地利用现有治疗手段,以期最大程度地根治肿瘤、最大程度地保护脏器功能和改善病人的生活质量。
直肠癌的治疗主要有手术治疗、放射治疗和化学治疗及靶向治疗。
8.2 手术治疗8.2.1 手术治疗适应证8.2.1.1 全身状态和各脏器功能可耐受手术。
8.2.1.2 肿瘤局限于肠壁或侵犯周围脏器,但可整块切除,区域淋巴结能完整清扫。
8.2.1.3 已有远处转移(如肝转移、卵巢转移、肺转移等),但可全部切除,酌情同期或分期切除转移灶。
8.2.1.4 广泛侵袭或远处转移,但伴有梗阻、大出血、穿孔等症状应选择姑息性手术,为下一步治疗创造条件。
8.2.2 手术治疗禁忌证8.2.2.1 全身状态和各脏器功能不能耐受手术和麻醉。
8.2.2.2 广泛远处转移和外侵,无法完整切除,无梗阻、穿孔、大出血等严重并发症。
8.2.3 手术治疗方法的选择8.2.3.1 直肠癌局部切除手术需严格把握以下手术指征①肿瘤侵犯肠周径<30%;②肿瘤大小<3cm;③切缘阴性(距离肿瘤>3mm);④肿瘤活动,不固定;⑤肿瘤距肛缘8cm 以内;⑥仅适用于T1N0M0肿瘤;⑦内镜下切除的息肉,伴癌浸润,或病理学不确定;⑧无血管淋巴管浸润(LVI)或神经浸润;⑨高-中分化;⑩治疗前影像学检查无淋巴结肿大的证据。
注:局部切除标本必须由手术医师展平、固定,标记方位后送病理检查。
术后病理如果为T2或者T1伴有切缘阳性、血管淋巴管侵润、分化差的高危患者则应行经腹切除术。
拒绝手术患者考虑放射治疗。
8.2.3.2 经腹直肠癌根治性切除术全直肠系膜切除术(TME)为中低位直肠癌手术的标准术式,是指在直视下锐性解剖盆筋膜脏层和壁层间的特定间隙,完整切除脏层筋膜内的全部组织,包括直肠系膜内的血管淋巴管结构、脂肪组织和直肠系膜筋膜,保留自主神经功能。
切除肿瘤下缘以下4~5cm的直肠系膜或达盆膈,下段直肠癌(距离肛缘小于5cm)切除肿瘤远端肠管至少2cm。