高中化学 第1讲 气体奥赛辅导讲义
- 格式:doc
- 大小:199.50 KB
- 文档页数:9

高中化学奥林匹克竞赛辅导讲座第4讲原子结构与元素周期律【竞赛要求】核外电子运动状态: 用s、p、d 等来表示基态构型(包括中性原子、正离子和负离子)核外电子排布。
电离能、电子亲合能、电负性。
四个量子数的物理意义及取值。
单电子原子轨道能量的计算。
s、p、d 原子轨道图像。
元素周期律与元素周期系。
主族与副族。
过渡元素。
主、副族同族元素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。
原子半径和离子半径。
s、p、d、ds、f 区元素的基本化学性质和原子的电子构型。
元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。
最高氧化态与族序数的关系。
对角线规则。
金属性、非金属性与周期表位置的关系。
金属与非金属在周期表中的位置。
半金属。
主、副族重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态。
铂系元素的概念。
【知识梳理】一、核外电子的运动状态 1、微观粒子的二重性(1)光的波动性λ波长:传播方向上相邻两个波峰(波谷)间距离。
频率v:频率就是物质(光子)在单位时间内振动的次数。
单位是Hz(1Hz =1 s1)。
-光速c =λ・v 真空中2.998×10 8 m・s~-1= 3×10 8 m・s1,大气中降低(但变化很小,-可忽略)。
波数v=1?(cm1)-(2)光的微粒性1900年根据实验情况,提出了原子原子只能不连续地吸收和发射能量的论点。
这种不连续能量的基本单位称为光量子,光量子的能量(E)与频率(v)成正比。
即: E = h? (4-1)式中h为普朗克常数,等于 6.626×10 �C34 J・s (3)白光是复色光可见光的颜色与波长紫兰青绿黄橙红波长(nm) 400-430 430-470 470-500 500-560 560-590590-630 630-760 (4)电子的波粒二重性――物质波- 1 -颜色 1923年德布罗意(L. de Broglie)类比爱因斯坦的光子学说后提出,电子不但具有粒子性,也具有波动性。

中学化学奥林匹克竞赛辅导讲座第1讲气体【竞赛要求】气体。
志向气体标准状态。
志向气体状态方程。
气体密度。
分压定律。
气体相对分子质量测定原理。
【学问梳理】一、气体气体、液体和固体是物质存在的三种状态。
气体的探讨对化学学科的发展起过重大作用。
气体与液体、固体相比较,具有两个明显特点。
1、扩散性当把肯定量的气体充入真空容器时,它会快速充溢整个容器空间,而且匀称分布,少量气体可以充溢很大的容器,不同种的气体可以以随意比例匀称混合。
2、可压缩性当对气体加压时,气体体积缩小,原来占有体积较大的气体,可以压缩到体积较小的容器中。
二、志向气体假如有这样一种气体:它的分子只有位置而无体积,且分子之间没有作用力,这种气体称之为志向气体。
当然它在实际中是不存在的。
实际气体分子本身占有肯定的体积,分子之间也有吸引力。
但在低压和高温条件下,气体分子本身所占的体积和分子间的吸引力均可以忽视,此时的实际气体即可看作志向气体。
三、志向气体定律1、志向气体状态方程将在高温低压下得到的波义耳定律、查理定理和阿佛加德罗定律合并,便可组成一个方程:pV= nRT(1-1)这就是志向气体状态方程。
式中p是气体压力,V是气体体积,n是气体物质的量,T是气体的肯定温度(热力学温度,即摄氏度数+273),R是气体通用常数。
在国际单位制中,它们的关系如下表:kPadm 3 mol K8.314Kmol dm kPa ··3(1-1)式也可以变换成下列形式:pV = MmRT (1-2) p =V m ·MRT = M RT ρ则: ρ =RTpM(1-3) 式中m 为气体的质量,M 为气体的摩尔质量,ρ为气体的密度。
对于肯定量(n 肯定)的同一气体在不同条件下,则有:111T V P = 222T V P (1-4) 假如在某些特定条件下,将(1-1)、(1-2)和(1-3)式同时应用于两种不同的气体时,又可以得出一些特别的应用。

高中化学1-4讲义work Information Technology Company.2020YEAR学而思教研讲义第1到4讲讲义【1】 高中化学的基本概念与理论重点包括:物质的组成性质与分类、化学用语、化学计量、物质结构与元素周期律等几个部分。
【2】 化学基本理论与概念是高中化学的基础,是解决化学问题、运用化学思维的基本工具与手段。
除此之外,在高考中,对于阿伏加德罗常数、同位素、同素异形体、电解质等概念的辨析、阿伏加德罗定律的应用、胶体的制备与性质等内容也是经常直接考查的部分。
而物质结构与元素周期律相关的元素推断,则是高考的必考点。
【3】 复习本部分知识时,除对基本知识扎实记忆外还应注意对于基本概念要辨析清楚,包括“四同”、电解质、阿伏伽德罗常数等;对于化学计量,要注意结合后面的知识掌握化学计量的相互转换,同时注意单位的转换;另外,训练逻辑思维和化学推理能力,以应对元素推断的基本要求。
一、物质的组成质子中子原子核核外电子原子构成分子共价化合物离子化合物离子化合物单质纯净物混合物物质元素化合态游离态直接构成直接构成具有相同质子数的一类原子微观构成宏观组成核素同位素同素异形体具有相同质子数与中子数的一类原子二、物质的变化高考点拨第1讲知识点睛1.1 物质的组成、性质与分类基本理论 与概念三、物质的分类【重点突破】1.胶体的性质与制备。
(1)性质:微粒半径1~100 nm;丁达尔效应;布朗运动;电泳现象;(凝聚)介稳性;胶体微粒不能透过半透膜,能透过滤纸。
(2)制备:Fe(OH)3胶体的制备。
2.电解质与非电解质的区分。
(1)电解质与非电解质是对于化合物的分类,单质无论是否导电都既不是电解质也不是非电解质。
同样对于混合物来说,也没有办法分类为电解质与非电解质。
(2)电解质只有在水溶液中或熔融状态下才会生成可自由移动的离子,因而只有在水溶液中或熔融状态下才会导电,例如NaCl在固体状态下不能导电。

全国中学生化学竞赛预赛专题讲座第一讲差量法例1、用氢气复原10克CuO,加热片刻后,冷却称得剩余固体物质量为8.4克,那么参加反响CuO的质量是多少克?例2、将CO和CO2的混合气体2.4克,通过足量的灼热的CuO后,得到CO2的质量为3.2克,求原混合气体中CO和CO2的质量比?例3、将30克铁片放入CuSO4溶液中片刻后,取出称量铁片质量为31.6克,求参加反响的铁的质量?例4、同一状态下,气体分子间的分子个数比等于气体间的体积比。
把30mL甲烷和氧气的混合气体点燃,冷却致常温,测得气体的体积为16mL,那么原30mL中甲烷和氧气的体积比?例5、给45克铜和氧化铜的混合物通入一会氢气后,加热至完全反响,冷却称量固体质量为37克,求原混合物中铜元素的质量分数?答案:1、8克2、7∶53、11.2克4、8∶7 7∶235、82.2%练习1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数?练习2、同一状态下,气体分子间的分子个数比等于气体间的体积比。
现有CO、O2、CO2混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液后,体积又减少3.5Ml,那么原混和气体中CO、O2、CO2的体积比?练习3、把CO、CO2的混合气体3.4克,通过含有足量氧化铜的试管,反响完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。
求⑴原混合气体中CO的质量?⑵反响后生成的CO2及原混合气体中CO2的质量比?练习4、CO和CO2混合气体18克,通过足量灼热的氧化铜,充分反响后,得到CO2的总质量为22克,求原混合气体中碳元素的质量分数?练习5、在等质量的以下固体中,分别参加等质量的稀硫酸(足量)至反响完毕时,溶液质量最大的是()A FeB AlC Ba(OH)2D Na2CO3练习6、在CuCl2和FeCl3溶液中参加足量的铁屑m克,反响完全后,过滤称量剩余固体为m克,那么原混合溶液中CuCl2及FeCl3物质的量之比为()(高一试题)A 1∶1B3∶2 C 7∶ D 2∶7练习7 P克结晶水合物A•nH20,受热失去全部结晶水后,质量为q克,由此可得知该结晶水合物的分子量为()A18Pn/(P—q) B 18Pn/q C18qn/P D18qn/(P—q)答案:1 、96% 5、A 6 、C7、A第二讲平均值法例题:1一块质量为4克的合金,及足量的盐酸反响,产生0.2克氢气。


高中化学奥赛培训教程(全国通用精华版)第一章 化学反应中的物质变化和能量变化第一节 氧化还原反应1、根据下列三个反应,排出氧化剂氧化性的强弱顺序: A .4HCl +MnO 2∆MnCl 2+Cl 2↑+2H 2OB .16HCl +2KMnO 4=2KCl +2MnCl 2+5Cl 2↑+8H 2OC .4HCl +O 22CuCl 450︒2Cl 2↑+2H 2O 解析:这三个反应中还原剂都是盐酸。
不同的氧化剂与同一还原剂反应时,若反应越易发生,则氧化剂的氧化性越强,反之就弱,故其氧化性顺序由强到弱:KMnO 4>MnO 2>O 2。
2、配平氧化还原方程式:P 4O +Cl 2FY=POCl 3+P 2Cl 5解析:本题中P 4O 中的P 元素对应有两种产物,故设P 4O 的化学计量数为“1”。
用待定系数法配平的关键是选准一种物质的化学计量数为1。
令P 4O +a Cl 2=b POCl 3+c P 2Cl 5,由原子守恒得:42,21/4,1,1,235,3/2。
b c a b b a b c c =+=⎧⎧⎪⎪==⎨⎨⎪⎪=+=⎩⎩解得 代入整理得:4P 4O +21Cl 2=4POCl 5+6P 2Cl 53、配平下列方程式:Fe 3C +HNO 3=Fe(NO 3)3+NO 2+CO 2+H 2O解析:复杂物质Fe 3C 按常规化合价分析无法确定Fe 和C 的具体化合价,此时可令组成该物质的各元素化合价为零价,再根据化合价升降法配平。
33Fe (03)9C 0+4 4N +5+4113→+⎫⨯⎬→⎭→⨯升共升131升降 再用观察法,不难确定各物质的化学计量数为:1、22、3、13、1、11,故为Fe 3C +22HNO 3=3Fe(NO 3)3+13NO 2↑+CO 2↑+11H 2O4、配平NH 4NO 3FY=N 2+HNO 3+H 2O解析:NH 4NO 3中N 的平均化合价为+1价,则元素化合价升降关系为:2N 2(+1→0) 降2×1 N +1→+5 升4×1用观察法调整确定各物质的化学计量数,故:5NH 4NO 3=4N 2↑+9H 2O +2HNO 3注:若配平时不用此平均标价法,则要分析同种元素化合价升降关系。
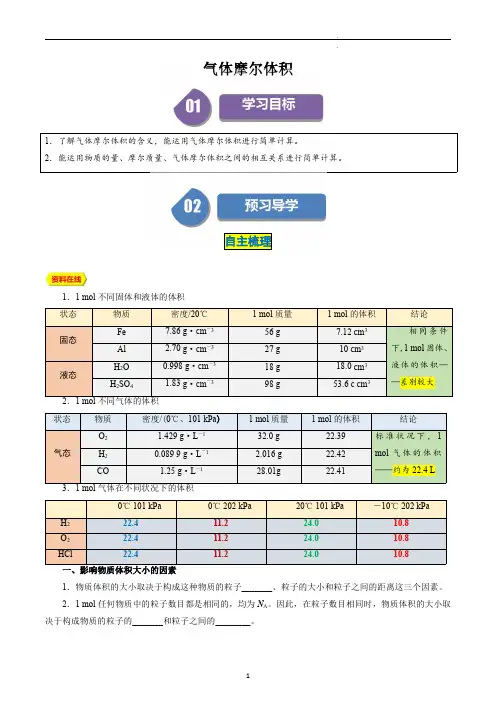
气体摩尔体积1.了解气体摩尔体积的含义,能运用气体摩尔体积进行简单计算。
2.能运用物质的量、摩尔质量、气体摩尔体积之间的相互关系进行简单计算。
自主梳理1.1mol 不同固体和液体的体积状态物质密度/20℃1mol 质量1mol 的体积结论固态Fe 7.86g ·cm -356g 7.12cm 3相同条件下,1mol 固体、液体的体积——差别较大Al 2.70g ·cm -327g 10cm 3液态H 2O 0.998g ·cm -318g 18.0cm 3H 2SO 41.83g ·cm -398g53.6c cm 32.1mol 不同气体的体积状态物质密度/(0℃、101kPa )1mol 质量1mol 的体积结论气态O 21.429g ·L-132.0g 22.39标准状况下,1mol 气体的体积——约为22.4LH 20.0899g ·L -12.016g 22.42CO1.25g ·L-128.01g22.413.1mol 气体在不同状况下的体积0℃101kPa0℃202kPa 20℃101kPa -10℃202kPaH 222.411.224.010.8O 222.411.224.010.8HCl22.411.224.010.81.物质体积的大小取决于构成这种物质的粒子_______、粒子的大小和粒子之间的距离这三个因素。
2.1mol 任何物质中的粒子数目都是相同的,均为N A 。
因此,在粒子数目相同时,物质体积的大小取决于构成物质的粒子的_______和粒子之间的________。
3.对于气体来说,粒子之间的距离远远大于粒子本身的直径。
当粒子数目相同时,气体的体积主要取决于气体_______________________。
4.气体的体积取决于分子的数目和分子的间距,分子的间距与温度、压强有关:压强一定,升高温度,分子之间的距离_______,气体体积_______;反之,气体体积_______。


第1讲物质的量气体摩尔体积【学科核心素养】1.宏观辨识与微观探析:认识物质的量是联系宏观物质和微观粒子的重要工具,能从宏观和微观相结合的视角分析与解决实际问题。
2.证据推理与模型认知:在有关物质的最计算过程中,通过分析、推理等理解计算的方法,建立阿伏加德罗常数、气体摩尔体积等题目解答的模型。
【核心素养发展目标】1.了解物质的量及其单位摩尔质量、阿伏加德罗常数的含义与应用,利用物质的量将宏观的物理量与微观粒子的个数联系起来,并能从宏观和微观结合的视角分析解决问题。
2.能从物质的量的角度认识物质的组成及变化,建立物质的量、物质的质量和微观粒子数之间计算的思维模型。
3.能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔体积的含义,能叙述阿伏加德罗定律的内容。
4.能基于物质的量认识物质的组成及变化,建立n、m、V m之间计算的模型,熟悉阿伏加德罗定律的应用。
【知识点解读】知识点一物质的量摩尔质量1.物质的量、阿伏加德罗常数(1)基本概念间的关系(2)物质的量的规范表示方法x mol H2SO4↓ ↓ ↓数值 单位 指定微粒符号或微粒名称(3)物质的量与粒子数、阿伏加德罗常数之间的关系为n =N /N A 。
【特别提醒】(1)摩尔后面应为确切的微粒名称;如1 mol 氢(不确切)和1 mol 大米(宏观物质)皆为错误说法。
(2)物质的量是物理量,摩尔是物质的量的单位,不是物理量。
(3)6.02×1023是个纯数值,没有任何物理意义,而阿伏加德罗常数(N A )是指1 mol 任何微粒所含的粒子数,它与0.012 kg 12C 所含的碳原子数相同,数值约为6.02×1023。
2.摩尔质量(1)单位物质的量的物质所具有的质量。
常用的单位是 g·mol -1。
公式:M =m n 。
(2)数值:以 g·mol -1为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对分子(原子)质量。

绝对黄冈中学化学奥赛培训教程上册Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】黄冈中学化学奥赛培训教程(精美word版)目录上册(75页,)第一章化学反应中的物质变化和能量变化第一节氧化还原反应第二节离子反应和离子方程式第三节化学反应中的能量变化第四节综合解题第二章物质结构元素周期律第一节原子结构和核外电子排布第二节元素周期律与元素周期表第三节化学键第四节分子间作用力第五节晶体结构第六节综合题解第三章气体、溶液和胶体第一节气体第二节胶体第三节溶液第四节综合题解第四章化学反应速率及化学平衡第一节化学反应速率第二节影响化学反应速率的因素第三节化学平衡第一章化学反应中的物质变化和能量变化第一节氧化还原反应1、根据下列三个反应,排出氧化剂氧化性的强弱顺序:A.4HCl+MnO2∆MnCl2+Cl2↑+2H2OB.16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2OC.4HCl+O22CuCl450︒2Cl2↑+2H2O解析:这三个反应中还原剂都是盐酸。
不同的氧化剂与同一还原剂反应时,若反应越易发生,则氧化剂的氧化性越强,反之就弱,故其氧化性顺序由强到弱:KMnO4>MnO2>O2。
2、配平氧化还原方程式:P4O+Cl2FY=POCl3+P2Cl5解析:本题中P4O中的P元素对应有两种产物,故设P4O的化学计量数为“1”。
用待定系数法配平的关键是选准一种物质的化学计量数为1。
令P4O+a Cl2=b POCl3+c P2Cl5-,由原子守恒得:代入整理得:4P4O+21Cl2=4POCl5+6P2Cl53、配平下列方程式:Fe3C+HNO3=Fe(NO3)3+NO2+CO2+H2O解析:复杂物质Fe3C按常规化合价分析无法确定Fe和C的具体化合价,此时可令组成该物质的各元素化合价为零价,再根据化合价升降法配平。
再用观察法,不难确定各物质的化学计量数为:1、22、3、13、1、11,故为Fe3C+22HNO3=3Fe(NO3)3+13NO2↑+CO2↑+11H2O4、配平NH4NO3FY=N2+HNO3+H2O解析:NH4NO3中N的平均化合价为+1价,则元素化合价升降关系为:2N 2(+1→0) 降2×1 N +1→+5 升4×1用观察法调整确定各物质的化学计量数,故:5NH 4NO 3=4N 2↑+9H 2O +2HNO 3注:若配平时不用此平均标价法,则要分析同种元素化合价升降关系。

高一化学竞赛辅导讲义主题:化学反应与能量第一课时(吸热反应和放热反应)1.下列反应既属于氧化还原反应,又属于吸热反应的是A .铝片和稀盐酸反应B .Ba(OH)2·8H 2O 与NH 4Cl 的反应C .灼热的碳与二氧化碳的反应D .甲烷在氧气中的燃烧2.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。
下列属于未来新能源标准的是①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能A .①②③④B .⑤⑥⑦⑧C .③⑤⑥⑦⑧D .③④⑤⑥⑦⑧3.下列反应中反应物总能量高于生成物总能量的是A .二氧化碳与碳生成一氧化碳B .碳与水蒸气生成一氧化碳和氢气C .碳酸钙受热分解D .盐酸与氢氧化钠反应4.下列各图所表示的反应是吸热反应的是A .B .C .D .5.下列说法不正确的是A .任何化学反应都伴随有能量变化B .化学反应中的能量变化都表现为热量的变化C .反应物的总能量高于生成物的总能量时,发生放热反应D .反应物的总能量低于生成物的总能量时,发生吸热反应6.下列说法正确的是A .化学反应除了生成新的物质外,还伴随着能量的变化B .据能量守恒定律,反应物的总能量一定等于生成物的总能量C .放热的化学反应不需要加热就能发生D .吸热反应不加热就不会发生7.已知化学反应2C(s)+O 2(g) 点燃2CO(g);2CO(g) + O 2(g) 点燃2CO 2(g)都是放热反应。
据此推断,下列说法不正确的是(相同条件下)A .56gCO 和32gO 2所具有的总能量大于88gCO 2所具有的总能量B .12gC 所具有的能量一定高于28gCO 所具有的能量C .12gC 和32gO 2所具有的总能量大于44gCO 2所具有的总能量D .将两份碳燃烧,生成CO 2的反应比生成CO 的反应放出的热量多8.如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。
导讲义【竞赛要求】气体。
理想气体标准状态。
理想气体状态方程。
气体密度。
分压定律。
气体相对分子质量测定原理。
【知识梳理】 一、气体气体、液体和固体是物质存在的三种状态。
气体的研究对化学学科的发展起过重大作用。
气体与液体、固体相比较,具有两个明显特点。
1、扩散性当把一定量的气体充入真空容器时,它会迅速充满整个容器空间,而且均匀分布,少量气体可以充满很大的容器,不同种的气体可以以任意比例均匀混合。
2、可压缩性当对气体加压时,气体体积缩小,原来占有体积较大的气体,可以压缩到体积较小的容器中。
二、理想气体如果有这样一种气体:它的分子只有位置而无体积,且分子之间没有作用力,这种气体称之为理想气体。
当然它在实际中是不存在的。
实际气体分子本身占有一定的体积,分子之间也有吸引力。
但在低压和高温条件下,气体分子本身所占的体积和分子间的吸引力均可以忽略,此时的实际气体即可看作理想气体。
三、理想气体定律 1、理想气体状态方程将在高温低压下得到的波义耳定律、查理定理和阿佛加德罗定律合并,便可组成一个方程: pV= nRT (1-1) 这就是理想气体状态方程。
式中p 是气体压力,V 是气体体积,n 是气体物质的量,T 是气体的绝对温度(热力学温度,即摄氏度数+273),R 是气体通用常数。
在国际单位制中,它们的关系如下表: 表1-1 R 的单位和值 p V n T R国际单位制Pam3molK8.314K mol m Pa ··3或K mol J · kPadm3molK8.314K mol dm kPa ··3(1-1)式也可以变换成下列形式:pV= M mRT (1-2) p = V m ·M RT = M RTρ则: ρ = RT pM(1-3)式中m 为气体的质量,M 为气体的摩尔质量,ρ为气体的密度。
对于一定量(n 一定)的同一气体在不同条件下,则有:111T V P = 222T V P (1-4) 如果在某些特定条件下,将(1-1)、(1-2)和(1-3)式同时应用于两种不同的气体时,又可以得出一些特殊的应用。
如将(1-1)式n =RT pV,在等温、等压、等容时应用于各种气体,则可以说明阿佛加德罗定律。
因为物质的量相等的气体,含有相等的分子数。
若将(1-2)式M m = RT pV在等温、等压和等容时应用于两种气体,则得出:11M m =22M m (1-5)如果将(1-3)式ρ= RT pV,在等温等压下应用于两种气体,则有:11ρρ = 21M m (1-6)若令11ρρ = D ,D 为第一种气体对第二种气体得相对密度,则有:D =21M m 或 M1 = DM2 (1-7)已知M 2H = 2g ·mol1-,M空气= 29g ·mol1-则 M1 = 2 D 2H 或 M1 = 29D 空气D 2H 为某气体相对H2的密度,D 空气为某气体相对空气的密度。
2、气体分压定律和分体积定律 (1)气体分压定律当研究对象不是纯气体,而是多组分的混合气体时,由于气体具有均匀扩散而占有容器全部空间的特点,无论是对混合气,还是混合气中的每一组分,均可按照理想气体状态方程式进行计算。
当一个体积为V 的容器,盛有A 、B 、C 三种气体,其物质的量分别为nA 、nB 、nC ,每种气体具有的分压分别是pA 、pB 、pC ,则混合气的总物质的量为: n 总= nA + nB + nC (1-8) 混合气的总压为:p 总 = pA + pB + pC (1-9) 在一定温度下,混合气体的总压力等于各组分气体的分压力之和。
这就是道尔顿分压定律。
计算混合气各组分的分压有两种方法。
①根据理想气态方程计算在一定体积的容器中的混合气体p 总V = n 总RT ,混合气中各组分的分压,就是该组分单独占据总体积时所产生的压力,其分压数值也可以根据理想气态方程式求出: pAV = nART (1-10)pBV = nBRT (1-11) pCV = nCRT (1-12) ②根据摩尔分数计算:摩尔分数(XA )为混合气中某组分A 的物质的量与混合气的总的物质的量之比: XA = 总n n A (1-13) 混合气体中某组分的分压等于总压与摩尔分数的乘积: pA= p总XA(1-14)(2)气体分体积定律在相同的温度和压强下,混合气的总体积(V 总)等于组成混合气的各组分的分体积之和: V 总 = VA +VB + VC (1-15) 这个定律叫气体分体积定律。
根据混合物中各组分的摩尔分数等于体积分数,可以计算出混合气中各组分的分体积: 据总n n 1 =总V V A得 VA = 总n n 1 V 总 (1-16) 四、实际气体状态方程理想气体定律是从实验中总结出来的,并得到了理论上的解释。
但应用实际气体时,它只有一定的适用范围(高温低压),超出这个范围就有偏差,必须加以修正。
对于实际气体的实验值与理想值的偏差,我们常用压缩系数Z 来表示:Z = RT V p ~其中p 、~V 、T 都是实验值。
若气体完全理想,则Z = 1,否则Z >1或Z <1。
出现这种偏差,是由于实际气体分子本身的体积不容忽视,那么实测体积总是大于理想状态体积(即V 理 = V – b );实际上分子之间也不可能没有吸引力(内聚力P 内),这种吸引力使气体对器壁碰撞产生的压力减小,使实测压力要比理想状态压力小(即p 理 = p + p 内),所以Z <1。
实际上以上两种因素同时存在,前者起主导作用时,Z >1,后者起主导作用时,Z <1,若两种因素恰好相当,则Z = 1(CO2在40℃和52 MPa 时)。
将以上修正项代入理想气体状态方程,即得: (p + p 内)(~V – b) = RTp 内既与容器内部得分子数目成正比,又与近壁分子数目成正比。
这两种分子数目又都与气体的密度成正比,所以 p 内∝ρ2而ρ∝~1V ,所以p 内∝(~1V )2 或 p 内 = ~2V a则 (p +~2Va)(~V – b ) = RT对于n 摩尔气体来说,则,(p + 22V an )(V – nb )= nRT (1-17)注意,上式中p 、V 、T 都是实测值;a 和b 都是气体种类有关的特性常数,统称为范德华常数。
(1-17)式称为范德华方程。
它是从事化工设计必不可少的依据。
五、气体相对分子质量测定原理 1、气体相对分子质量测定由(1-3)式:ρ = RT pM,可以变换成以下形式:M = p RTρ (1-18)可见,在一定温度和压强下,只要测出某气体的密度,就可以确定它的相对分子质量。
2、气体精确相对分子质量测定根据M = pρRT ,理想气体在恒温下的ρ/p 值应该是一个常数,但实际情况不是这样。
如:在273 K 时测得CH3F 蒸气在不同压力下的ρ值及ρ/p 值如下表:p/Pa ρ/(g ·m-3) ρ/(p ·10-2) 1.013×105 1.5454×103 1.5255 6.753×105 1.0241×103 1.5212 3.375×104 0.5091×1031.5084从表中数据可以看到,压力越大,ρ/p 越大,不是常数。
因为压力越大,气体分子间的吸引力越大 ,分子本身的体积也不能忽略,因而就不能用理想气体状态方程来描述了,所以对于实际气体ρ/p 不是一个常数。
以ρ/p 对ρ作图(图1-1)如果将直线内推到p = 0时,则CH3F 这一实际气体已接近理想气体,所以从图上所得的('ρ/p ')0=P = 1.50×10-2是符合理想气体状态方程的。
若将(ρ/p)0=P 之值代入理想气体状态方程M =pρRT ,即可求得CH3F 的精确分子量。
这种求气体分子量的方法,叫极限密度法。
M F CH 3 = (pρ)0=p RT = 1.50×10-2g ·dm-3·k Pa-1×8.314 k Pa ·dm3·mol-1·K-1×273.16K = 34.05 g ·mol-1故CH3F 的分子量为34.02。
按相对原子质量计算:M = 12.011 + 3×1.0079 + 18.9984 = 34.033 两者结果非常接近。
【典型例题】例1、300K 、3.30×105 Pa 时,一气筒含有480g 的氧气,若此筒被加热到373K ,然后启开活门(温度保持373K )一直到气体压强降低到1.01×105 Pa 时,问共放出多少重的氧气?分析:因为pV =nRT ,n = M m ;所以pV = M mRT ,由此式求出气筒的体积。
然后再根据气态方程式求出压强降到1.01×105 Pa ,气筒内剩余氧气的质量m 2O 。
最后算出放出氧气的质量。
解:pV = M mRT则气筒的体积:V =MP mRT =Pamol g KK mol m Pa g 511131003.3·0.32300···314.8480⨯⨯⨯⨯--- = 0.123 m3再根据方程式求压强降低到1.01×105 Pa 时,气筒内剩余氧气的质量m 2Om 2O = RT pVM= K K mol m Pa mol g m Pa 373···314.8·0.32123.01001.1113135⨯⨯⨯--- = 128 g 例2、设有一真空的箱子,在288 K 时,1.01×105 Pa 的压力下,称量为153.679 g ,假若在同温同压下,充满氯气后为156.844 g ;充满氧气后为155.108 g ,求氯气的分子量。
分析:M 2O =32.00g ·mol-1,若将pV= M mRT 式先用于氧气 ,求出箱子的体积V ,再将 pV=M mRT 式用于氯气,求出M 2Cl ,这当然是可行的。
但运算繁杂,既费时又易出错。
由题意可知,这实际上是在等温、等压和等容条件下,pV= M mRT 式的两次应用。
所以可以直接用11M m=22M m 式,则简便得多。
解:M 2O = 155.108g - 153.679g = 1.429g M 2Cl = 156.844g - 153.679g =3.165g∴ M 2Cl =222·O M Cl m m O=gmol g g 429.1·00.32165.31-⨯ = 70.87g ·mol-1故氯气的分子量为70.87。