人教通用版2014高三化学一轮复习专讲专练第21讲 化学平衡含详解
- 格式:doc
- 大小:75.00 KB
- 文档页数:6
化学平衡【知识一览】一、化学平衡状态:化学平衡状态是指在一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
二、平衡移动:【高考热点题型探究】一、判断化学平衡状态标志1.下列说法中能说明2HI(g) H2(g)+I2(g)已达平衡状态的是__________。
(1)单位时间内生成n mol H2的同时生成n mol HI;(2)一个H-H键断裂的同时有两个H-I键断裂;(3)c(HI)=c(I2);(4)反应速率:v(H2)=v(I2)=12v(HI);(5)c(HI)∶c(I2)∶c(H2)=2∶1∶1;(6)温度和体积一定时,某一生成物浓度不再变化;(7)温度和体积一定时,容器内压强不再变化;(8)条件一定,混合气体的平均相对分子质量不再变化;(9)温度和体积一定时,混合气体的颜色不再发生变化;(10)温度和压强一定时,混合气体的密度不再发生变化。
2.可逆反应: 2A(气) + 3B(气)3C(气), 在 一定的条件下, 使一定量A 和B 气体反应, 达 到平衡状态时, 具有的性质是: ( )A. 各物质的浓度之比为c(A):c(B):c(C)=2:3:3B. 平衡时气体的总体积是反应开始时的3/5C. 平衡时混合物中各组份的浓度相等D. 单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C 物质 3.一定条件下的密闭容器中,可逆反应2A(g) B(g)+3C(g)在下列四种状态中处于平4.在一定容积的密闭容器中发生如下可逆反应: A(g)+2B(g)3C(g); △H >0,达到平衡的标志是: ( )A. 混合气体的压强不再变化B. 混合气体的密度不再变化C. 混合气体的物质的量不再变化D. 混合气体的温度不再变化 5.在一定的温度下的定容密闭容器中,可逆反应:H 2(g )+I 2(g)2HI(g)达到平衡的标志是( )A 、混合气体密度不变B 、混合气体颜色不变C 、混合气体压强不变D 、混合气体总物质的量不变6.在一定的温度下的定容密闭容器中,不能说明可逆反应:2NO+O 22NO 2达到平衡的标志是( )A 、混合气体密度不变B 、混合气体颜色不变C 、混合气体压强不变D 、混合气体总物质的量不变7.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应: A (s ) + 2B (g )C (g )+D (g ) 已达平衡的是 ( )A 、混合气体的压强B 、混合气体的密度C 、 B 的物质的量浓度D 、气体总物质的量二、平衡的移动:8.下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移 ① 2NO(g) + O 2(g)2NO 2 (g)②CaCO3(s)CaO(s) + CO2 (g)③H2O(g) + C (s)CO(g) + H2(g)④H2O(g) + CO(g)CO2(g) + H2(g)⑤H2S(g)H2(g) + S(s)9.在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2 + O22SO3△H<0,试回答下列问题: 生产过程中常常通入过量的空气,你认为其原因是什么?10.反应2A (g)2B (g) + E (g) △H>0达到平衡时,要使反应向正反应方向移动,应采用的措施是( )A、加压B、减压C、加入正催化剂D、升温11.已知NO2能形成二聚分子2NO2N2O4△H<0 现在要测定NO2的相对分子质量,应采用的适宜条件为()A、高温低压B、低温高压C、低温低压D、高温高压12.可逆反应H2O(g)+C(s)CO(g)+H2(g) 在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO浓度有何变化?①加入更多的碳②增加H2的浓度13.反应2A (g)2B (g) + E (g) △H>0达到平衡时,要使正反应速率下降,A的浓度增大,应采用的措施是()A、加压B、减压C、减小E的浓度D、降温14.下列事实中不能用平衡移动原理解释的是()A. 密闭、低温是存放氨水的必要条件B. 实验室用排饱和食盐水法收集氯气C. 硝酸工业生产中,使用过量空气以提高NH3的利用率D. 在FeSO4溶液中,加入铁粉以防止氧化15.对于X+Y(s)Z的平衡,若增大压强,Y的转化率增大,则X和Y的状态是( )A. X为气态,Z为固态B. X为固态,Z为气态C. X为气态,Z为气态D. X为固态,Z为固态16.某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂A ①②B ②⑤C ③⑤D ④⑥17.恒温下, 反应aX(g)bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X 的物质的量浓度由0.1mol/L 增大到0.19mol/L, 下列判断正确的是: ()A. a>b+cB. a<b+cC. a=b+cD. a=b=c 18.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g) +cW(s) ;ΔH>0下列叙述正确的是()A、加入少量W,逆反应速率增大B、当容器中气体压强不变时,反应达到平衡C、升高温度,平衡逆向移动D、平衡后加入X,上述反应的ΔH增大19.反应NH4HS(s)NH3(g)+H2S(g)在某一温度下达到平衡时,下列各种情况中,不能使平衡发生移动的是()A.移走一部分NH4HS 固体B.其他条件不变时,通SO2气体C.容器体积不变时,充入氦气D.保持压强不变时,充入氦气20.在容积一定的密闭容器中,反应2A B(g) + C(g) 达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是()A.正反应是吸热反应,且A不是气态B.正反应是放热反应,且A气态C.其他条件不变,加入少量C,该平衡向逆反应方向移动D.改变压强对该平衡的移动无影响21.密闭容器中,反应xA(g) + yB(g) zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。


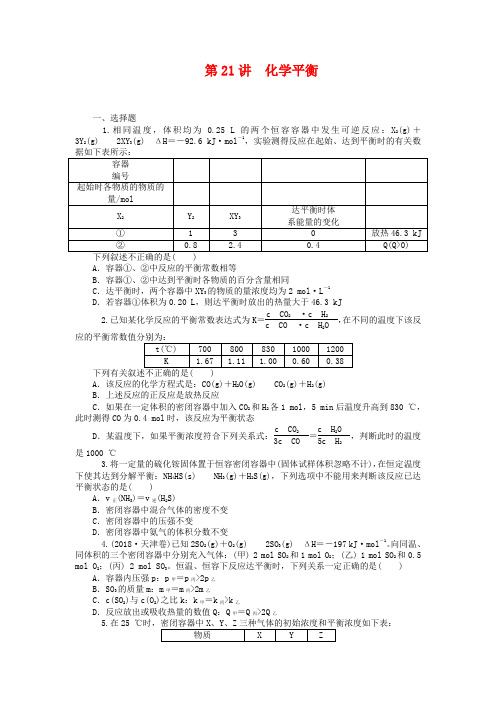
第21讲化学平衡一、选择题1.相同温度,体积均为0.25 L的两个恒容容器中发生可逆反应:X2(g)+3Y 23(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数A.容器①、②中反应的平衡常数相等B.容器①、②中达到平衡时各物质的百分含量相同C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1D.若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ2.已知某化学反应的平衡常数表达式为K=22,在不同的温度下该反2A.该反应的化学方程式是:CO(g)+H 22(g)+H2(g)B.上述反应的正反应是放热反应C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态c2D.某温度下,如果平衡浓度符合下列关系式:2=,判断此时的温度2是1000 ℃3.将一定量的硫化铵固体置于恒容密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH 43(g)+H2S(g),下列选项中不能用来判断该反应已达平衡状态的是( )A.v正(NH3)=v逆(H2S)B.密闭容器中混合气体的密度不变C.密闭容器中的压强不变D.密闭容器中氨气的体积分数不变4.(2018·天津卷)已知2SO 2(g)+O23(g) ΔH=-197 kJ·mol-1。
向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。
恒温、恒容下反应达平衡时,下列关系一定正确的是( ) A.容器内压强p:p甲=p丙>2p乙B.SO3的质量m:m甲=m丙>2m乙C.c(SO2)与c(O2)之比k:k甲=k丙>k乙D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙5.在A .反应达到平衡时,X 的转化率为50%B .反应可表示为X +,其平衡常数为1600C .增大压强使平衡向生成Z 的方向移动,平衡常数增大D .改变温度可以改变此反应的平衡常数6.将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应:①NH 4I(s)NH 3(g)+HI(g)②2HI(g)H 2(g)+I 2(g)达平衡时,c(H 2)=0.5 mol·L -1,c(HI)=4 mol·L -1,则此温度下反应①的平衡常数为( )A .9B .16C .20D .257.(2018·江苏卷)700 ℃时,向容积为2 L 的密闭容器中充入一定量的CO 和H 2O ,发生反应:CO(g)+H 2O(g)CO 2(g)+H 2(g)A .反应在t 1 min 内的平均速率为v(H 2)=0.40t 1mol·L -1·min -1 B .保持其他条件不变,起始时向容器中充入0.60 mol CO 和1.20 mol H 2O ,达到平衡时n(CO 2)=0.40 molC .保持其他条件不变,向平衡体系中再通入0.20 mol H 2O ,与原平衡相比,达到新平衡时CO 转化率增大,H 2O 的体积分数增大D .温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应二、非选择题8.t℃时,将2 mol 气体A 和1 mol 气体B 充入容积为2 L 的恒容密闭容器中,发生如下反应:2A(g)+,2 min 时反应达到平衡状态(温度仍为t℃),此时B 还有0.6 mol ,并测得C 的浓度为0.6 mol·L -1。

化学平衡状态【学习目标】1. 化学平衡状态的特征2. 化学平衡状态的判断方法3. 化学平衡移动的影响因素 ◆感知高考1. [2020·江苏]CH 4与CO 2重整生成H 2和CO 的过程中主要发生下列反应1422CH (g)CO (g)2H (g)2CO(g)247.1kJ mol H -+=+∆=⋅1222H (g)CO (g)H O(g)CO(g)41.2kJ mol H -+=+∆=⋅在恒压、反应物起始物质的量比()()42CH :CO 1:1nn =条件下,CH 4和CO 2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是A. 升高温度、增大压强均有利于提高CH 4的平衡转化率B. 曲线B 表示CH 4的平衡转化率随温度的变化C. 相同条件下,改用高效催化剂能使曲线A 和曲线B 相重叠D. 恒压、800K 、n(CH 4):n(CO 2)=1:1条件下,反应至CH 4转化率达到X 点的值,改变除温度外的特定条件继续反应,CH 4转化率能达到Y 点的值【答案】BD【解析】A.甲烷和二氧化碳反应是吸热反应,升高温度,平衡向吸热反应即正向移动,甲烷转化率增大,甲烷和二氧化碳反应是体积增大的反应,增大压强,平衡逆向移动,甲烷转化率减小,故A错误;B.根据两个反应得到总反应为CH 4(g)+2CO2(g) H2(g)+3CO(g) +H2O (g),加入的CH4与CO2物质的量相等,CO2消耗量大于CH4,因此CO2的转化率大于CH4,因此曲线B表示CH4的平衡转化率随温度变化,故B正确;C.使用高效催化剂,只能提高反应速率,但不能改变平衡转化率,故C错误;D.800K时甲烷的转化率为X点,可以通过改变二氧化碳的量来提高甲烷的转化率达到Y点的值,故D 正确。
综上所述,答案为BD。
2.[2019·课标全国Ⅰ,28(1)(2)(4)]水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。

高三化学一轮复习讲义——化学平衡黑龙江省庆安一中孙秀民一、复习目标:(1)考试大纲1.了解化学平衡建立的过程。
理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。
2.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识其一般规律。
3.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。
理解化学平衡常数及其运用;理解“起”、“转”、“平”三步骤计算的技巧;掌握有关化学平衡的基本计算。
及其勒夏特列原理;③等效平衡规律;④化学平衡常数和化学平衡计算。
化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。
本部分考查的知识点主要是:①有关反应速率的计算和比较;②条件对反应速率影响的判断;③确定某种情况是否是化学平衡状态的特征;④平衡移动原理的应用;⑤转化率的计算或比较;⑥速率、转化率、平衡移动等多种图像的分析。
要特别注意本单元知识与图像结合的试题比较多。
从题型看主要是选择题和填空题,其主要形式有:⑴根据化学方程式确定各物质的反应速率;⑵根据给定条件,确定反应中各物质的平均速率;⑶理解化学平衡特征的含义,确定某种情况下化学反应是否达到平衡状态;⑷应用等效平衡的方法分析问题;⑸应用有关原理解决模拟的实际生产问题;⑹平衡移动原理在各类平衡中的应用;⑺用图像表示外界条件对化学平衡的影响或者根据图像推测外界条件的变化;⑻根据条件确定可逆反应中某一物质的转化率、消耗量、气体体积、平均相对分子质量的变化等。
从高考试题看,近年来命题更趋向于综合考核,以常见的可逆反应为题目依托,几乎涵盖上述涉及的点,重现率非常高,也可能以新情境从多个方面来考查考生对这部分知识的理解和掌握。
二、知识归纳:1.化学平衡知识结构2.化学平衡(状态)的概念及其特征(1)概念:在一定条件下可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,这种状态称为化学平衡状态,简称化学平衡。
专题8.3 化学平衡移动1、理解影响化学平衡的因素(浓度、温度、压强、催化剂等),认识其一般规律。
2、理解化学平衡常数的定义并能进行简单计算。
3、能正确分析化学平衡图像。
一、化学平衡移动1、概念可逆反应达到平衡状态以后,若反应条件(如温度、压强、浓度等)发生了变化,平衡混合物中各组分的浓度也会随之改变,从而在一段时间后达到新的平衡状态。
这种由原平衡状态向新平衡状态的变化过程,叫做化学平衡的移动。
2、过程3、平衡移动方向与反应速率的关系(1)v正> v逆,平衡向正反应方向移动。
(2)v正= v逆,平衡不移动。
(3)v正< v逆,平衡向逆反应方向移动。
4、平衡移动会伴随着哪些变化(1)反应速率的变化(引起平衡移动的本质,但速率变化也可能平衡不移动),主要看v正与v逆是否相等,如果v正≠v逆,则平衡必然要发生移动,如v正、v逆同时改变相同倍数,则平衡不移动。
(2)浓度的变化,平衡移动会使浓度变化,但是浓度的变化不一定使平衡移动。
(3)各组分百分含量的变化。
(4)平均相对分子质量的变化。
(5)颜色的变化(颜色变化,平衡不一定发生移动)。
(6)混合气体密度的变化。
(7)转化率的变化。
(8)温度变化5、影响因素若其他条件不变,改变下列条件对化学平衡的影响如下:平衡体系条件变化速率变化平衡变化速率变化曲线任一平衡体系增大反应物的浓度v正、v逆均增大,且v正′>v逆′正向移动减小反应物的浓度v正、v逆均减小,且v逆′>v正′逆向移动任一平衡体系增大生成物的浓度v正、v逆均增大,且v逆′>v正′逆向移动减小生成物的浓度v正、v逆均减小,且v正′>v逆′正向移动正反应方向为气体体积增大的放热反应增大压强或升高温度v正、v逆均增大,且v逆′>v正′逆向移动减小压强或降低温度v正、v逆均减小,且v正′>v逆′正向移动任意平衡或反应前后气体化学计量数和相等的平衡正催化剂或增大压强v正、v逆同等倍数增大平衡不移动负催化剂或减小压强v正、v逆同等倍数减小【典型例题1】【山东滕州一中2016届10月月考】一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g) + O2(g) 2SO3(g),达到平衡后改变下述条件,SO3(g)的平衡浓度不改变的是()A.保持温度和容器内压强不变,充入1molSO3 B.保持温度和容器体积不变,充入1molSO3 C.保持温度和容器内压强不变,充入1molO2 D.保持温度和容器内压强不变,充入1molAr 【答案】A考点:平衡移动【点评】对于有气体参与的反应,充入反应体系中的气体时一定看清容器的体积是否改变,容器的体积不变,充入反应体系中的气体,可以增大该物质的浓度,使平衡移动。
2020-2021年新高三化学一轮复习讲解《化学平衡》【知识梳理】一、化学平衡状态1.化学平衡状态:化学平衡状态:在一定条件下,正反应速率和逆反应速率相等,反应混合物中各组成成分浓度、含量保持保持一定而不变的状态,叫做化学平衡状态。
2.化学平衡的特点:(1)动:化学平衡是一种动态平衡,即υ正=υ逆≠0)。
υ正=υ逆≠0是可逆反应达到平衡状态的本质。
(2)定:条件不变时,反应物与生成物浓度、百分组成保持不变(或反应物与生成物的含量保持一定)。
这是判断体系是否处于化学平衡状态的重要特征。
(3)变:任何化学平衡状态均是暂时的、相对的、有条件的。
影响平衡的外界条件改变,平衡状态即被破坏,发生平衡移动。
温馨提示:①可逆反应不能进行到底,即反应过程中反应物、生成物,不能全部转化为生成物(反应物)。
②化学平衡的建立与反应的途径无关:对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正逆反应开始(同时投入反应物和生成物),在一定条件下都能达到v(正)=v(逆)状态。
3.化学平衡的标志(1)一个可逆反应达到平衡状态的最根本标志是υ(正)=υ(逆)。
运用速率标志要注意:正逆反应速率相等是指用同一种物质表示的反应速率.若一个可逆反应的正逆反应速率是分别用两种不同物质表示时,则当这两者的速率之比应等于这两种物质的化学计量数之比时才标志着化学平衡了。
(2)υ(正)=υ(逆)其必然结果是反应混合物各组分的含量保持不变,所以,各组分的浓度或含量不再随时间而改变也一定标志着化学平衡了。
(3)如果一个可逆反应达到平衡状态,则整个反应体系的物理参数,如总压强、总体积、总物质的量以及气体的平均分子量和密度等肯定都要保持定值,不会再随时间而改变。
但反过来,在一定条件下,这些物理参数若保持不变的可逆反应,不一定就达到了化学平衡,要作具体分析。
如:aA(g)+bB(g)Cc(g)+dD(g) ,若a+b=c+d , 由于反应前后气体分子数始终不发生改变,使反应体系的总压、平均分子量等参量在任何时刻都保持不变,这种情况下这些物理参量不能作为化学平衡态的标志。
——————————教育资源共享步入知识大海————————难溶电解质的溶解均衡李仕才【课标要求】1.掌握难溶电解质的溶解均衡及溶解均衡的应用2.运用均衡挪动原理剖析、解决积淀的溶解和积淀的转变问题【教课过程】一、溶解均衡1.难溶电解质的定义是什么?难溶物的溶解度能否为0?在 20℃时电解质的溶解性与溶解度的关系以下:溶解性易溶可溶微溶难溶溶解度2.当 AgNO3与 NaCl 反响生成难溶AgCl 时,溶液中能否含有Ag+和 Cl -?此溶液能否为AgCl 的饱和溶液?3.难溶电解质(如AgCl )能否存在溶解均衡?并写出AgCl 的溶解均衡表达式。
4.溶解均衡的观点?其有哪些特点?二、积淀反响的应用1.积淀的生成(1)积淀生成的应用:在波及无体制备、提纯工艺的生产、科研、废水办理等领域中,常利用生成积淀达到分别或某些离子的目的。
(2)积淀的方法a 调理 pH法:如:工业原料氯化铵中混有氯化铁,加氨水调pH 值至 7- 8b加积淀剂法:写出使用Na2S、 H2S 作积淀剂使 Cu2+、 Hg2+形成积淀的离子方程式 .【思虑】1) 在生活中,水资源是很可贵的,假如工业废水中含有Ag+,理论上,你会选择加入什么试剂?2) 粗盐提纯时 ,NaCl 溶液中含有2- 离子,选择含2+ 2+SO Ca 仍是Ba 离子的试剂除掉?42.积淀的溶解(1)积淀溶解的原理:想法不停移去溶解均衡系统中的相应离子,使均衡向积淀溶解的方向挪动(2)应用举例:a)难溶于水的盐溶于酸中如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸b ) 难溶于水的电解质溶于某些盐溶液如:Mg(OH)2溶于NH4Cl溶液c)难溶物因发生氧化复原反响而溶解如:不溶于盐酸的硫化银可溶于硝酸3.积淀的转变(1)积淀转变的本质:(2)积淀转变的应用:如锅炉除水垢(CaSO4),一些自然现象的解说金戈铁骑三、溶度积(K sp)1.观点:2.表达式:关于积淀溶解均衡M m A nn+ m-Mm (aq)+Na (aq) , K sp =3.溶度积规则:比较K sp与溶液中相关离子浓度幂的乘积(离子积Q c)判断难溶电解质在给定条件下积淀可否生成或溶解。
第21讲 化学平衡错误!1.[2012·济南一模] 可逆反应NO 2(g)+SO 2(g)NO (g)+SO 3(g)达到平衡的标志是( )A .NO 2、SO 2、NO 和SO 3四种气体的物质的量浓度之比为1∶1∶1∶1B.密闭容器的压强不再发生变化C.K 值不再发生变化D.生成n mol SO 2的同时,有n mol SO 3生成2.在一密闭容器中进行反应:2SO 2(g)+O 2(g )2SO 3(g)。
已知反应过程中某一时刻SO 2、O2、SO3的浓度分别为0.2 mol·L -1、0.1 mo l·L-1、0.2 mo l·L -1。
当反应达平衡时,可能存在的数据是( )A.SO 2为0.4 m ol ·L -1 , O2为0.2 m ol·L -1B.SO 3为0.25 m ol·L -1C.SO 2、S O3均为0.15 mol·L -1D.S O3为0.4 mo l·L-13.已知:H2(g)+I 2(g)2HI(g) ΔH<0。
有相同容积的定容密闭容器甲和乙,甲中加入H 2和I 2各0.1 m ol,乙中加入HI 0.2 m ol,相同温度下分别达到平衡。
下列说法错误..的是( ) A.反应放出的热量一定相同B .此时体系的压强一定相同C.反应物的转化率可能相同D .此时HI 的浓度一定相同4.一密闭容器中发生反应:2SO 2(g)+O 2(g)2SO 3(g) ΔH <0,如图K21-1表示该反应的速率(v )在某一时间内的变化。
则下列时间段中,SO 3的百分含量最高的是( )图K21-1A.t0→t 1B.t 2→t 3 C .t 3→t 4 D.t 5→t 6错误!5.为了研究温度对苯催化加氢的影响,以检验新型镍催化剂的性能。
采用相同的微型反应装置,压强为0.78 MPa ,氢气、苯的物质的量之比为6.5∶1。
定时取样分离出氢气后,分析成分得如下表结果:温度/℃ 85 95 100 110~240 280 300340 质量分 数(%)苯 96.05 91.55 80.85 0 23.35 36.90 72.37环己烷 3.95 8.4519.15100 76.65 63.10 27.63下列说法错误的是( )A.当温度超过280 ℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应B.在110~240 ℃苯的转化率为100%。
说明该镍催化剂活性较高,能够在较宽的温度范围内催化而且不发生副反应C.增大压强与提高氢气、苯的物质的量比都有利于提高苯的转化率D.由表中数据来看,随着反应温度的升高,苯的转化率先升高后降低6.在三个2 L恒容的密闭容器中,保持温度相同,分别发生反应A(g)+3B(g)2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。
反应前各物质的物质的量/molA BC甲1 3 0乙00 2丙1.5 4.5 1A.乙中5min内C的反应速率为0.08 mol/(L·min)B.达到平衡时,丙中A的浓度是甲中的2倍C.丙中反应的平衡常数大于甲中反应的平衡常数D.达到平衡时,甲乙两容器中C的物质的量百分含量相等7.[2012·大连测试]一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是()A.混合气体的密度不再变化B.反应容器中Y的质量分数不变C.X的分解速率与Y的消耗速率相等D.单位时间内生成1mol Y的同时生成2mol X图K21-28.FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)Fe(SCN)2+(aq)。
已知平衡时,c[Fe(SCN)2+]与温度T的关系如图K21-2所示,则下列说法正确的是()A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)===Fe(S CN)2+(aq)ΔH>0B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2C.反应处于D点时,一定有v正>v逆D.A点与B点相比,A点的c(Fe3+)大9.某温度下,向容积为2 L的密闭反应器中充入0.10 molSO3,当反应器中的压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g)2SO3(g)的平衡常数为( )A.3.2×103 B.1.6×103C.8.0×102D.4.0×103图K21-310.在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)2HBr(g) ΔH<0。
当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图K21-3所示。
下列说法不正确的是( )A.由图可知:T1>T2B.a、b两点的反应速率:b>aC.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加11.[2012·湖南四市联考] 已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)ΔH<0。
现将一定量NO2和N2O4的混合气体通入一定体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图K21-4所示。
图K21-4(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
下列不能说明该反应已达到平衡状态的是________。
A.容器内混合气体的压强不随时间变化而改变B.容器内混合气体的密度不随时间变化而改变C.容器内混合气体的颜色不随时间变化而改变D.容器内混合气体的平均相对分子质量不随时间变化而改变(2)①前10min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min)。
②0~15 min,反应2NO2(g)N2O4(g)的平衡常数K(b)=________。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________________(用文字表达);其平衡常数K(d)________K(b)(填“>”“=”或“<”)。
(4)若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是________。
A.加入催化剂B.缩小容器体积C.升高温度D.加入一定量的N2O412.[2012·海南卷]已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:温度/℃700 830 900 1001 200平衡常数1.7 1.11.0 0.6 0.4回答下列问题(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”“>”或“=”);(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________________,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为________;(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);a.压强不随时间改变b.气体的密度不随时间改变c.c(A)不随时间改变d.单位时间里生成C和D的物质的量相等(4)1200 ℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为________。
错误!13.[2012·南阳模拟] 已知2X2(g)+Y2(g)2Z(g) ΔH=-a kJ·mol-1(a>0),在一个容积固定的密闭容器中加入2molX2和1mol Y2,在500 ℃时充分反应达平衡后Z的浓度为W m ol·L-1,放出热量bkJ。
(1)此反应平衡常数表达式为____________;若将温度降低到300 ℃,则反应平衡常数将________(填“增大”“减少”或“不变”)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度________W mol·L-1(填“>”“<”或“=”),a,b、c之间满足关系________(用代数式表示)。
(3)能说明反应已达平衡状态的是________(从下列选项中选择)。
a.浓度c(Z)=2c(Y2) b.容器内压强保持不变c.v逆(X2)=2v正(Y2)d.容器内的密度保持不变(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1 molY2达到平衡后,Y2的转化率将________(填“变大”“变小”或“不变”)。
ﻬ1.D[解析] 化学反应达到平衡时各物质浓度不变,而不是相等,其物质的量浓度比也不一定等于化学计量数之比,A项错误;该反应为气体体积不变的反应,无论反应是否已达平衡,压强均不变,B项错误;只要温度不变,化学平衡常数K就不变,与是否达到平衡无关,C项错误。
2.B[解析]本题考查可逆反应不能进行到底。
A项数据表明,题中0.2mol·L-1的SO3完全转化成了SO2和O2,即平衡时,c(SO3)=0,不可能;B项说明在题给浓度的基础上又有0.05mol·L-1SO2和0.025mol·L-1 O2化合生成0.05mol·L-1 SO3,可能;C项数据表明SO2、SO3的浓度都减小了0.05 mol·L-1,这违背“原子守恒”;D项数据表明SO2和O2完全转化成了SO3,这也不可能。
3.A[解析] 甲乙两容器中反应的方向相反,热效应(吸、放热)也相反,A项错误;达平衡时为等效平衡,B、D一定正确;两容器中的转化率有可能相同,C项正确。
4.A [解析] 分析图像可知,t2→t3是原平衡逆向移动后建立的平衡,SO3的百分含量降低,t3→t4和t2→t3两个时间段内,SO3的百分含量相同,t5→t6是平衡再次逆向移动后建立的平衡,SO3的百分含量再次降低,故正确答案为A。
5.A[解析]从110~240 ℃时100%转化,可知该反应不是可逆反应,A项错误;当温度超过280℃,苯的转化率迅速下降,可能是发生了副反应。