《中国药典》2015年版勘误表
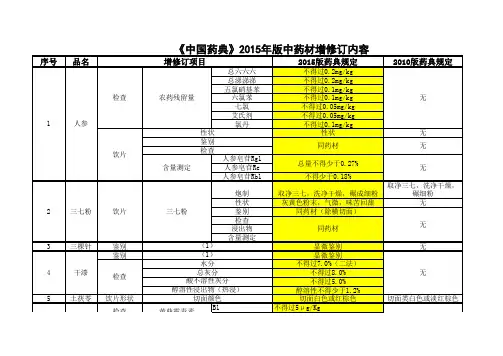
- 格式:xls
- 大小:87.50 KB
- 文档页数:11

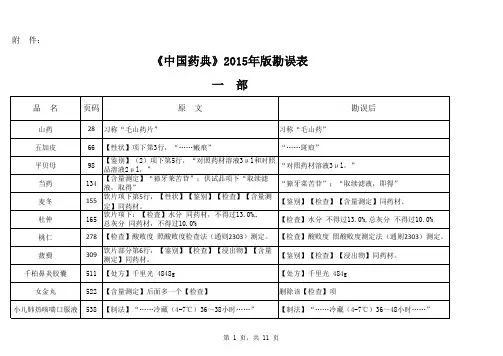
附 件:《中国药典》2015年版勘误表一 部二 部雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,【检查】溶出度 分别取出溶出杯中全部溶液并即时加入溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
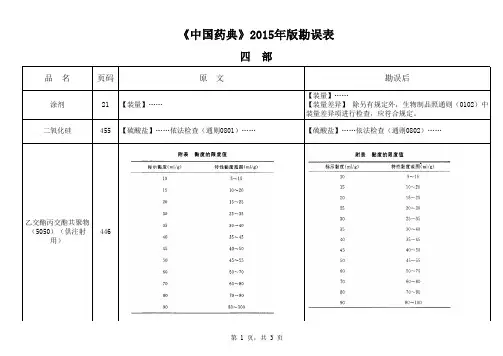
三 部四 部品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……乙交酯丙交酯共聚物(5050)(供注射用)446丁香油460【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,……【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量,……465【折光率】本品的折光率(通则0621)……【折光率】本品的折光率(通则0622)……466【脂肪酸组成】……进样口温度为206℃,……【脂肪酸组成】……进样口温度为260℃,……大豆磷脂468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……469【微生物限度】……还不得检出大肠埃希和沙门菌。
附 件:《中国药典》2015年版勘误表一 部二 部蒿甲醚1452附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8S,10R,10a R)-8-甲氧基…….附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8R,10R,10a R)-8-甲氧基…….雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,【检查】溶出度 分别取出溶出杯中全部溶液并即时加入溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……乙交酯丙交酯共聚物(5050)(供注射用)446四 部第 11 页,共 11 页。

附件:2015年版《中国药典》药用辅料标准有关问题的答复意见品种反馈问题答复意见聚山梨酯80(供注射用)【脂肪酸组成】项下对照品溶液浓度为每1ml中各含0.01mg的溶液(2015年版《中国药典》勘误第二批)认为该浓度下进样的对照品峰面积过小。
脂肪酸组成按面积归一化法计算,对照品仅仅作为定位用。
乳糖【性状】描述中白色的结晶性颗粒或粉末的理解问题。
【溶液的澄清度与颜色】溶液应澄清无色(不超过0.5号浊度标准液的浊度)。
认为标准过于严格,建议修订浊度限度为:与1号浊度液对比,不得深于对照。
【含量测定】项下以乙腈-水(70:30)为流动相基线不稳,建议以乙腈-水(61:39)为流动相。
加水溶解并稀释制成每1ml各含1mg的溶液响应值太低,导致积分不准确,重现性不好,系统适应性RSD不符合要求。
系统适用性试验理论板数以乳糖峰计算低于5000,达不到要求,建议修订为不低于4000。
1.对性状正确的理解应为:白色的结晶性颗粒,或者白色粉末。
2.乳糖作为注射剂的冻干保护剂使用,为保证药品的安全,药典标准应严格。
3.含量测定项下以乙腈-水(70:30)为流动相基线可以稳定。
每1ml各含1mg的溶液浓度合适,系统适应性RSD可以符合要求。
由于示差折光检测器需要较长时间稳定,建议增加稳定时间。
乳糖峰理论塔板数可以达到要求。
硬脂酸镁【镉盐】【镍盐】两个检测项目,照原子吸收分光光度法(通则0406第二法)测定,均未规定具体的原子化方法,建议两个检测项目标准中均加注“以石墨炉为原子化器,照原子吸收分光光度法(通则0406第二法)测定。
按照本版药典通则0406原子吸收分光光度法的规定,采用原子吸收分光光度法进行的检验,通常不指定原子化器。
检验人员应根据所测元素、仪器性能及工作经验选择相应的原子化器,即使选用了火焰原子化器,可根据被测元素及仪器性能改变燃气和助燃气的种类及比例控制火焰温度,以获得较好的火焰稳定性和测定灵敏度。

中国药典2015年版石榴皮• 91 •【检查】水分不得过13.0%(通则0832第二法)。
总灰分不得过6.0%。
(通则2302)。
【漫出物】照醇溶性浸出物测定法(通则2201)项下的 热浸法测定,用稀乙醇作溶剂,不得少于17.0%。
【含置测定】照髙效液相色谱法(通则0512)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶 为填充剂;以甲醇-水(68 : 32)为流动相;检测波长为334nm 。
理论板数按石吊兰素峰计算应不低于3000。
对照品溶液的制备取石吊兰素对照品适量,精密称定, 加甲醇制成每lml 含25网的溶液,即得。
供试品溶液的制备取本品中粉约〇.5g ,精密称定,置 具塞锥形瓶中,精密加人75%甲醇25ml ,密塞,称定重量,超 声处理(功率240W ,频率45kHz )20分钟,放冷,再称定重量, 用75%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法 '分别精密吸取对照品溶液与供试品溶液各 1(^1,注人液相色谱仪,测定,即得。
本品按干燥品计算,含石吊兰素(C 18 H 16 〇 )不得少于0.10%。
饮片【炮制】除去杂质,洗净,切段,干燥。
【性味与归经】苦,温。
归肺经。
【功能与主治】化痰止咳,软坚散结。
用于咳嗽痰多,瘰 疬痰核。
【用法与用置】9〜15g 。
外用适量,捣敷或煎水外洗。
【贮藏】置干燥处。
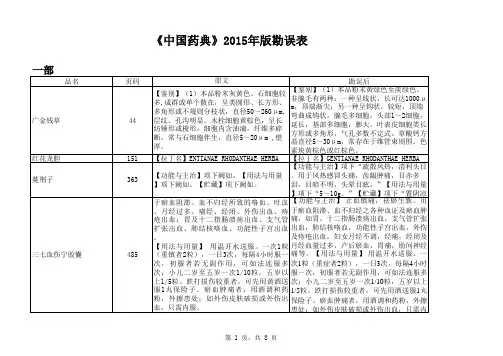
石决明ShijuemingHALIOTIDIS CONCHA本品为鲍科动物杂色鲍Haliotis diversicolor Reeve 、皱 纹盘鲍 Haliotis discus hannai Ino 、羊鲍 Haliotis ovina Gmelin 、澳洲鲍 Haliotis (Leach)、耳鲍 Haliotis asinina Linnaeus 或白鲍 Haliotis Zaen*贫 (Donovan)的贝壳。
夏、 秋二季捕捞,去肉,洗净,干燥。
品 名页码原 文勘误后涂剂21【装量】……【装量】……【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……《中国药典》2015年版勘误表四 部乙交酯丙交酯共聚物(5050)(供注射用)446丁香油460【含量测定】测定法 ......另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,......【含量测定】测定法 ......另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量, (465)【折光率】本品的折光率(通则0621)......【折光率】本品的折光率(通则0622) (466)【脂肪酸组成】……进样口温度为206℃,……【脂肪酸组成】……进样口温度为260℃,……大豆磷脂468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ......制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg 、200μg的混合溶液,......【磷脂酰胆碱、磷脂酰乙醇胺含量】 ......制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg 的混合溶液, (469)【微生物限度】……还不得检出大肠埃希和沙门菌。
【微生物限度】……不得检出大肠埃希菌;每10g供试品中不得检出沙门菌。
470【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……木糖醇479【总糖】……取5ml,作为对照品溶液;……【总糖】……取1.0ml,加水至5ml,作为对照品溶液;……正丁醇489【相对密度】 本品的相对密度(通则0612)……【相对密度】 本品的相对密度(通则0601)……交联聚维酮506【含量测定】 ……照氮测定法(通则0704第二法)测定,……【含量测定】 ……照氮测定法(通则0704第一法)测定,……阿拉伯胶516【鉴别】……供试品溶液所显斑点的位置与颜色应与乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。

2015年版《中国药典》中有关问题的探讨
2015年版《中国药典》中有关问题的探讨
________________________________
2015年版《中国药典》是我国药典编纂和修订的重要一环,它不仅收录了药物本身的各种性质,而且还收录了一些与药物有关的问题。
在本文中,我们将从三个方面对2015年版《中国药典》中有关问题的探讨进行详细的分析。
#### 一、药物名称
2015年版《中国药典》对药物名称的规定是,在列入药典中的药物,应当有一个完整的、可靠的名称,以便消费者和消费者可以更加清楚地了解该药物。
同时,药物名称中不得出现不正确、模糊或引人误解的词语,以及不符合国家相关法律法规的词语。
#### 二、使用方法
2015年版《中国药典》还规定了对于使用方法有关的问题,即使用该药物时,应当遵循科学的使用方法,如选择合适的用法、用量、剂量、用药时间等,避免不必要的危害,以及不当或者错误的使用方法。
#### 三、成分含量
2015年版《中国药典》还对于成分含量有着明确的规定,即所收录的药物中,必须列明该药物中各成分的含量,以便消费者了解该药物的成分,避免使用不当。
总之,2015年版《中国药典》中有关问题的探讨,主要围绕着三个方面进行:一是药物名称;二是使用方法;三是成分含量。
这些内容都是为了保障消费者的权益,使其在使用过程中受到最小的伤害。
《中国药典》2015年版勘误表
大豆磷脂(供注射用)469【微生物限度】取本品,……每1g供试品
中除细菌、霉菌及酵母菌数不得过
100cfu,……
【微生物限度】取本品,……每1g供试品中
除需氧菌总数、霉菌及酵母菌数不得过
100cfu,……
油酸钠528【微生物限度】……,再用预热至45℃的
无菌氯化钠-蛋白胨冲洗液(pH7.0)冲洗
液冲洗二次,每次100ml,取膜,贴膜培养
检查细菌数;……
【微生物限度】……,再用预热至45℃的无
菌氯化钠-蛋白胨冲洗液(pH7.0)冲洗液冲
洗二次,每次100ml,取膜,贴膜培养检查
需养菌总数;……
粉状纤维素551
续表续表
硅化微晶纤维素559【鉴别】(3)……,缓缓加入钼酸铵溶液
(,……在搅拌下缓缓加入钼酸32ml与水
40ml的混合溶液中,……)2ml,……
【鉴别】(3)……,缓缓加入钼酸铵溶液
(,……在搅拌下缓缓加入硝酸32ml与水
40ml的混合溶液中,……)2ml,……
微晶纤维素605
续表
聚山梨酯80(供注射用)625【脂肪酸组成】……。
分别取肉豆蔻酸甲
酯、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸
甲酯、亚油酸甲酯、亚麻酸甲酯以及油酸
甲酯对照品适量,加正庚烷溶解并制成每
1ml中各含0.1g的溶液,……
【脂肪酸组成】……。
分别取肉豆蔻酸甲酯
、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸甲酯
、亚油酸甲酯、亚麻酸甲酯以及油酸甲酯对
照品适量,加正庚烷溶解并制成每1ml中各
含0.01mg的溶液,……。


2015版《中国药典》纠错集锦(一)汇总:北重楼1.2015版药典一部保和丸纠错(论坛ID:海纳百川369 )2015版药典一部,保和丸(水丸)的标准中,(性状)项下是“大蜜丸”/thread-283108-1-1.html2.白色念珠菌液制备条件疑似错误(论坛ID:红茶)1101 无菌检查法1105非无菌产品微生物限度检查四部,1101,无菌检查法,137页,写着是20-25℃下培养24-48小时。
而1105,非无菌产品微生物限度检查:微生物计数法,141页,写着的是20-25℃下培养2-3天。
这里不明白到底是写错了,还是两种方法下,制备时间的确有区别?2010版下,时间是一样的,当然培养基换掉了。
/thread-283109-1-1.html3.黑曲霉菌液制备疑似有问题(论坛ID:红茶)1101,无菌检查法1105,非无菌产品微生物限度检查:微生物计数法四部,1101,无菌检查法,137页,黑曲霉菌液的制备使用的是沙氏葡萄糖琼脂斜面培养基。
而1105,非无菌产品微生物限度检查:微生物计数法,141页,写着的是多了一种培养基:马铃薯葡萄糖琼脂培养基。
这里是不是也有潜在的错误,或者的确是有实际意义上的区别?马铃薯葡萄糖琼脂培养基到底能不能用于无菌检查法中的菌液制备?如果不能,两种培养基究竟有什么区别?如果有,那逻辑上推导出,1105里,沙氏葡萄糖琼脂和马铃薯葡萄糖琼脂培养基也产生某些区别咯?这种“区别”在1105微生物限度计数法里面则无影响,但到了1101就不可接受了?PS: 如果的确没有错误的,出于工作效率和节约的成本的角度来说,我会只选择沙氏葡萄糖琼脂斜面培养基,这样两边都能用,而且只用制备一次,还不用担心做实验的时候拿错菌液。
/thread-283111-1-1.html4.一部药典的通窍鼻炎颗粒(论坛ID:红花鼠尾草 )检查应符合胶囊剂项下有关的各项规定。
增补本就错了,这次还是错了/thread-283071-1-1.html5.2015版药典一部中:这个应该不是“毛山药片”,而是“毛山药”吧?(论坛ID:孙药师 )如题,应该是明显的文字输入错误。
2015版《中国药典》一部修订情况解读朱晓静第一部分2015版《中国药典》概况根据国家食品药品监督管理总局2015年第67号令,《中华人民共和国药典》2015年版于2015年12月1日起实施。
作为从事药品领域的相关人员,有必要对2015版《中国药典》的修订情况进行深入了解,以便更好地实施药典相关规定。
一、2015版《中国药典》修订概况《中国药典》由国家药品监督管理部门颁布,是国家为保证药品质量、保证人民用药安全有效、质量可控而制定的药品法典。
《中国药典》对于保证药品质量,维护和保障公众身体健康及用药的合法权益,促进我国医药产业健康发展,具有十分重要的作用。
中国药典是药品行业的最重要的文件之一,其修订一直备受瞩目。
2015版《中国药典》是继我国1953年第一版药典以来的第十版药典。
2015版药典共分为四部出版,其中一部为中药;二部为化学药;三部为生物制药;四部为药典通则、药用辅料。
药典委员会副主任委员、国家食品药品监管总局吴浈副局长指出,2015年版药典无论是在药典品种收载、标准增修订幅度、检验方法完善、检测限度设定,还是在标准体系的系统完善、质控水平的整体提升都上了一个新的台阶。
二、2015版《中国药典》的主要变化2015版《中国药典》的主要变化包括以下七个方面。
(一)收载品种大幅增加2015版药典收载品种5924个,与2010版药典相比新增品种1125个,修订品种1201个。
新版药典收录药品数量达5608个,比2010年版药典新增1082个,覆盖基本药物目录和医疗保险目录的大部分品种,更加适应临床用药。
(二)药典标准更加系统化、规范化通过药典凡例、通则、总论的全面增修订,从整体上进一步提升了对药品质量控制的要求,完善了药典标准的技术规定,使药典标准更加系统化、规范化。
(三)健全了药品标准体系药用辅料品种增加至270个,新增相关指导原则;标准物质新增相关通则和指导原则;药包材新增相关指导原则;在归纳、验证和规范的基础上实现了《中国药典》各部共性检测方法的协调统一。
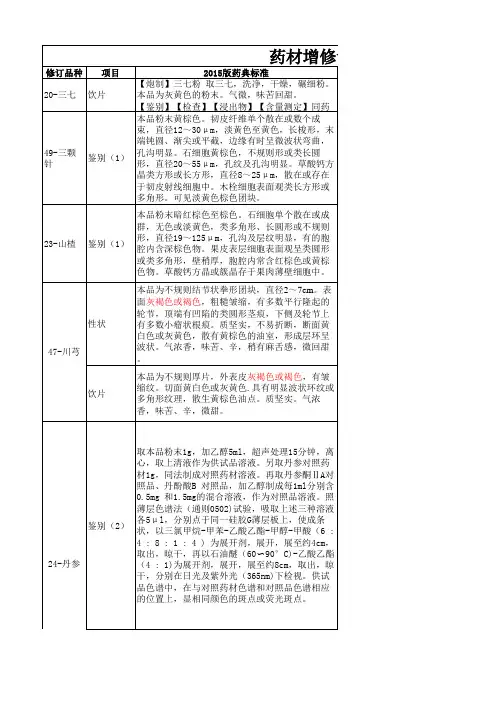
2015版《药典》中药材标准的变化情况2015-12-07山西-琥珀中药饮片真伪优劣鉴别新药典变化概述:1. 药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
2. 重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。
3. 完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。
4. 制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。
5. 中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。
6. 不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。
历届药典中药收载数量对比:新药典增减药材情况:新增:新药典“来源”修订情况:新药典“性状”修订情况新药典“显微鉴别”增加品种三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、稀莶草、暴马子皮、薤白、瞿麦、翻白草新药典“检查”修订情况二氧化硫残留量通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量«总六六六(a -BHC、3 -BHC、丫-BHC、S -BHC 之和)不得过0.2mg/kg ;*总滴滴涕(pp〔DDE、pp〔DDD op〔DDT、pp-DDT 之和)不得过0.2mg/kg ;*五氯硝基苯不得过0.1mg/kg ;«六氯苯不得过0.1mg/kg ;«七氯(七氯、环氧七氯之和)不得过0.05mg/kg ;*艾氏剂不得过0.05mg/kg ;*氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。
附件:2015年版《中国药典》药用辅料标准有关问题的答复意见品种反馈问题答复意见聚山梨酯80(供注射用)【脂肪酸组成】项下对照品溶液浓度为每1ml中各含0.01mg的溶液(2015年版《中国药典》勘误第二批)认为该浓度下进样的对照品峰面积过小。
脂肪酸组成按面积归一化法计算,对照品仅仅作为定位用。
乳糖【性状】描述中白色的结晶性颗粒或粉末的理解问题。
【溶液的澄清度与颜色】溶液应澄清无色(不超过0.5号浊度标准液的浊度)。
认为标准过于严格,建议修订浊度限度为:与1号浊度液对比,不得深于对照。
【含量测定】项下以乙腈-水(70:30)为流动相基线不稳,建议以乙腈-水(61:39)为流动相。
加水溶解并稀释制成每1ml各含1mg的溶液响应值太低,导致积分不准确,重现性不好,系统适应性RSD不符合要求。
系统适用性试验理论板数以乳糖峰计算低于5000,达不到要求,建议修订为不低于4000。
1.对性状正确的理解应为:白色的结晶性颗粒,或者白色粉末。
2.乳糖作为注射剂的冻干保护剂使用,为保证药品的安全,药典标准应严格。
3.含量测定项下以乙腈-水(70:30)为流动相基线可以稳定。
每1ml各含1mg的溶液浓度合适,系统适应性RSD可以符合要求。
由于示差折光检测器需要较长时间稳定,建议增加稳定时间。
乳糖峰理论塔板数可以达到要求。
硬脂酸镁【镉盐】【镍盐】两个检测项目,照原子吸收分光光度法(通则0406第二法)测定,均未规定具体的原子化方法,建议两个检测项目标准中均加注“以石墨炉为原子化器,照原子吸收分光光度法(通则0406第二法)测定。
按照本版药典通则0406原子吸收分光光度法的规定,采用原子吸收分光光度法进行的检验,通常不指定原子化器。
检验人员应根据所测元素、仪器性能及工作经验选择相应的原子化器,即使选用了火焰原子化器,可根据被测元素及仪器性能改变燃气和助燃气的种类及比例控制火焰温度,以获得较好的火焰稳定性和测定灵敏度。
附 件:
《中国药典》2015年版勘误表
一 部
二 部
蒿甲醚1452附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8S,10R,10a R)-8-甲
氧基…….
附:杂质Ⅰ 化学名:(3a S,4R,6a S,7R,8R,10R,10a R)
-8-甲氧基…….
雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules英文名:Rabeprazole Sodium Enteric Capsules
磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸
钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分
装用)。
异常毒性 取本品,用注射用水溶解并制成每1ml中含磷
酸肌酸钠60mg的溶液,依法检查(通则1141),按静脉注
射法缓慢给药,应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定
(通则0101)。
【检查】其他 应符合片剂项下有关的各项规定(通则
0101)。
依托度酸666
【检查】有关物质【检查】有关物质
雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为
37.0℃±0.5℃的溶出介质1000ml,
【检查】溶出度 分别取出溶出杯中全部溶液并即时加入
溶出介质1000ml,
水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积
(0.2%)。
【检查】有关物质各杂质的和不得大于0.2%。
三 部
品 名页码原 文勘误后
涂剂21【装量】……【装量】……
【装量差异】 除另有规定外,生物制品照通则(0102)中装量差异项进行检查,应符合规定。
二氧化硅455【硫酸盐】……依法检查(通则0801)……【硫酸盐】……依法检查(通则0802)……
四 部
乙交酯丙交酯共聚物
(5050)(供注射
用)
446
丁香油460
【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,……【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚酯对照品适量,……
465【折光率】本品的折光率(通则0621)……
【折光率】本品的折光率(通则0622)……466【脂肪酸组成】……进样口温度为206℃,……
【脂肪酸组成】……进样口温度为260℃,……
大豆磷脂
468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μ
g的混合溶液,……469【微生物限度】……还不得检出大肠埃希和沙门菌。
【微生物限度】……不得检出大肠埃希菌;每10g供试品
中不得检出沙门菌。
470【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、
100μg、200μg、200μg、200μg的混合溶液,……【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg的混合溶液,……木糖醇479【总糖】……取5ml,作为对照品溶液;……【总糖】……取1.0ml,加水至5ml,作为对照品溶液;……
正丁醇489【相对密度】 本品的相对密度(通则0612)……
【相对密度】 本品的相对密度(通则0601)……交联聚维酮506【含量测定】 ……照氮测定法(通则0704第二法)测定,……【含量测定】 ……照氮测定法(通则0704第一法)测定,……
阿拉伯胶516【鉴别】……供试品溶液所显斑点的位置与颜色应与乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
【鉴别】……供试品溶液所显斑点的位置与颜色应与半乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
苯甲醇
519
【细菌内毒素(供注射用)】 ……每1g苯甲醇中含内毒素的量应小于0.1EU。
【细菌内毒素(供注射用)】 ……每1mg苯甲醇中含内毒素的量应小于0.1EU。
活性炭(供注射用)
541【氰化物】……放冷,加盐酸试液1ml……
【氰化物】……放冷,加盐酸1ml……
大豆油
大豆磷脂(供注射
用)
第 11 页,共 11 页。