晶体密度的计算
- 格式:ppt
- 大小:1.27 MB
- 文档页数:11


物质的密度与比重的计算方法密度和比重是物质特性的重要参数,它们在物理学、化学以及其他科学领域中广泛应用。
本文将介绍物质的密度和比重的计算方法。
一、密度的计算方法密度是指物质单位体积所包含的质量,用公式表示为:密度 = 质量/ 体积。
常用的密度单位为克/立方厘米(g/cm³)或千克/立方米(kg/m³)。
1. 实验法计算密度实验法是一种直接测量物质质量和体积的方法,常用于固体和液体的密度测量。
下面分别介绍固体和液体的实验法计算密度。
(1) 固体的实验法计算密度:首先称取一定质量的固体,记录其质量(单位为克,记作m1)。
然后用天平测量固体的体积,可以使用直尺测量固体的边长(单位为厘米,记作a)或者是使用密度瓶测量固体的体积。
最后计算密度的公式为:密度 = m1 / V,其中V为固体的体积。
(2) 液体的实验法计算密度:通过实验室常用的密度瓶,测量液体的质量和体积。
首先称取一个干净的密度瓶的质量(单位为克,记作m1),然后向密度瓶中加入一定体积的液体,再称重(单位为克,记作m2)得到含液体的密度瓶质量。
计算液体的质量为:质量 = m2 - m1,最后计算密度的公式为:密度 = 质量 / V,其中V为液体的体积。
2. 计算法计算密度对于某些无法直接测量质量和体积的物质,可以通过计算法来估算其密度。
下面介绍几个常用的计算法计算密度的例子。
(1) 晶体的计算法:对于晶体物质,可以通过计算晶胞中原子的质量和数量来估算其密度。
首先确定晶胞中原子的质量总和(质量记作m)以及晶胞的体积(体积记作V)。
最后计算密度的公式为:密度 = m / V。
(2) 混合物的计算法:对于多组分混合物,可以通过计算各组分质量所占的比例以及各组分的密度来估算整体混合物的密度。
首先计算各组分质量所占的比例(记作Wi,i为组分编号),然后将各组分密度乘以相应的比例后相加。
最后计算密度的公式为:密度= Σ(Wi * ρi),其中Σ表示求和,ρi 表示各组分的密度。


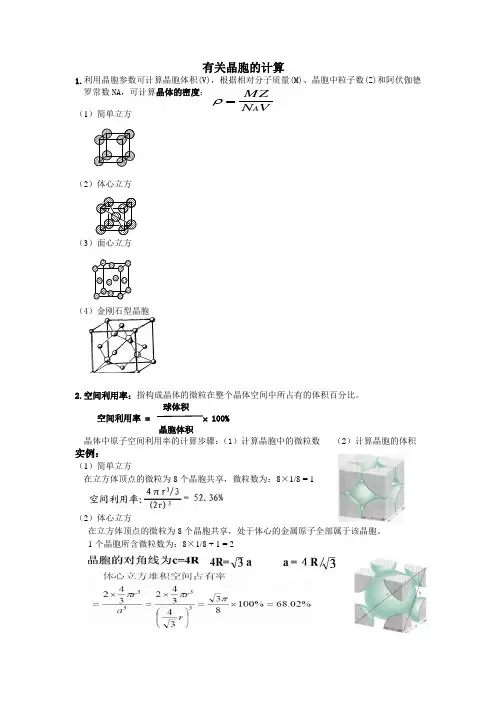
有关晶胞的计算
1.利用晶胞参数可计算晶胞体积(V),根据相对分子质量(M)、晶胞中粒子数(Z)和阿伏伽德罗常数NA,可计算晶体的密度:
(1)简单立方
(2)体心立方
(3)面心立方
(4)金刚石型晶胞
球体积
空间利用率 = 100%
晶胞体积
晶体中原子空间利用率的计算步骤:
(1)计算晶胞中的微粒数(2)计算晶胞的体积
实例:
(1)简单立方
在立方体顶点的微粒为8个晶胞共享,微粒数为:8×1/8 = 1
(2)体心立方
在立方体顶点的微粒为8个晶胞共享,处于体心的金属原子全部属于该晶胞。
1个晶胞所含微粒数为:8×1/8 + 1 = 2
晶胞的对角线为C=4R
V
N
MZ
A
=
ρ
(3)面心立方
在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有。
1个晶胞所含微粒数为:8×1/8 + 6×1/2 = 4
空间占有率为
(4)金刚石型晶胞
金刚石晶胞是面心立方堆完之后还在四个四面体里有原子
原子半径和晶胞边长的契合点在于体对角线上连着排了四个原子,所以是8个半径等于根号3个边长
所以a:r=8:根号3。
有关晶胞的计算1.利用晶胞参数可计算晶胞体积(V),根据相对分子质量(M)、晶胞中粒子数(Z)和阿伏伽德罗常数NA,可计算晶体的密度:(1)简单立方(2)体心立方(3)面心立方(4)金刚石型晶胞2.球体积空间利用率 = ⨯ 100%晶胞体积晶体中原子空间利用率的计算步骤:(1)计算晶胞中的微粒数(2)计算晶胞的体积实例:(1)简单立方在立方体顶点的微粒为8个晶胞共享,微粒数为:8×1/8 = 1(2)体心立方在立方体顶点的微粒为8个晶胞共享,处于体心的金属原子全部属于该晶胞。
1个晶胞所含微粒数为:8×1/8 + 1 = 2VNMZA=ρ(3)面心立方在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有。
1个晶胞所含微粒数为:8×1/8 + 6×1/2 = 4【练习】1.CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag·cm-3,N A表示阿伏加德罗常数,则CaO晶胞体积为__________cm32.金属钨晶体为体心立方晶格,实验测得钨的密度为19.30 g・cm-3,原子的相对质量为183假定金属钨原子为等径的刚性球。
(1)试计算晶胞的边长;(2)试计算钨原子的半径。
3. ZnS晶体结构如下图所示,其晶胞边长为540.0pm,其密度为g·cm-3,a位置S2-离子与b位置Zn2+离子之间的距离为 pm。
4.已知铜晶胞是面心立方晶胞,铜原子的半径为 3.62⨯10-7cm,每一个铜原子的质量为1.055⨯10-23g(1)利用以上结果计算金属铜的密度(g·cm-3)。
(2)计算空间利用率。

晶胞密度练习题晶胞密度是描述晶体结构的重要物理量之一,用以描述晶体内原子或离子的排列紧密程度。
在晶体学中,晶胞密度通常以每个晶胞中的原子或离子数量来表示。
本文将通过一系列练习题来帮助读者加深对晶胞密度的理解,并提供解答和详细计算步骤。
练习题一:立方晶系晶胞密度计算已知立方晶系晶体的晶格常数a为4 Å,晶胞中有4个原子,请计算该晶体的晶胞密度。
解答与计算步骤:晶胞密度公式为:晶胞密度 = (N * M) / V,其中N为晶胞中原子数,M为单个原子的摩尔质量,V为晶胞体积。
首先计算晶胞体积V:由于立方晶体具有相等的边长,晶胞体积可以表示为V = a^3,代入a = 4 Å,即可得到晶胞体积V = (4 Å)^3 = 64 Å^3。
原子的摩尔质量M需要通过化学元素数据表取得。
假设该晶体中的原子是氧原子,根据化学元素数据表可得氧的摩尔质量为16 g/mol。
将N = 4和M = 16 g/mol代入晶胞密度公式,即可计算得到晶胞密度:晶胞密度 = (4 * 16 g/mol) / 64 Å^3 = 1 g/cm^3。
练习题二:体心立方晶系晶胞密度计算已知体心立方晶系晶体的晶格常数a为3 Å,晶胞中有2个原子,请计算该晶体的晶胞密度。
解答与计算步骤:体心立方晶体的晶胞中除了8个角上的原子外,还有一个位于体心的原子。
因此晶胞中的原子数N为3个。
同样地,我们先计算晶胞体积V:对于体心立方晶体,晶胞体积可以表示为V = (a / 2)^3。
代入a = 3 Å,即可得到晶胞体积V = (3 Å / 2)^3 = 6.75 Å^3。
假设该晶体中的原子是铁原子,根据化学元素数据表可得铁的摩尔质量为55.845 g/mol。
将N = 3和M = 55.845 g/mol代入晶胞密度公式,即可计算得到晶胞密度:晶胞密度= (3 * 55.845 g/mol) / 6.75 Å^3 ≈ 155.99 g/cm^3。


氯化钠晶体密度计算
氯化钠晶体的密度是由它的原子量和单位体积的原子或分子的数目
共同决定的。
氯化钠是一种常见的工业盐,由单质氯和单质钠构成。
体积中每个分子的质量为23克/摩尔(二元分子的分子式:NaCl)。
氯化钠晶体的密度可以用公式:ρ=MW/V(克/立方厘米)计算,其中
MW为分子质量,V是体积。
因此,氯化钠晶体的密度计算结果为每
立方厘米约有2.17克。
氯化钠晶体由NaCl分子构成,其中每个NaCl分子重量为58.44克/摩尔,而该晶体的密度则可以用下面的公式计算出来:ρ=均重/体积,其中,均重为NaCl分子重量,也就是58.44克/摩尔,而体积则涉及到晶
体结构。
从固溶体学的角度考虑,氯化钠晶体由Na+和Cl-离子构成,形成八面体晶格,且有双列晶体结构,其晶胞体积为V = (19.2)^3Å^3 (Å为牛顿),所以氯化钠晶体密度计算结果为每立方厘米约有2.16克。
此外,氯化钠晶体可以在高温环境中显示出不同的性质。
当温度升高
到1000℃或更高时,当它处于液体状态时,晶体的体积会减小,从而
使其密度急剧升高。
基于热力学的规律,当温度升高至1000℃时,每
立方厘米的密度可能会增加至2.19克或更高。
因此,氯化钠晶体的密度既取决于 NaCl分子重量,又受体积和温度的
影响。
从上述可以看出,晶体的密度一般比液体高出许多,可以达到
2.17-2.19克/立方厘米。

nacl晶体密度晶体是一种具有规则、周期性排列的原子、离子或分子结构的固体物质。
晶体密度是指晶体单位体积内所含质量的大小,通常以克/立方厘米(g/cm³)或千克/立方米(kg/m³)来表示。
本文将探讨和介绍NaCl(氯化钠)晶体的密度。
NaCl是一种常见的无机盐,是氯离子(Cl-)和钠离子(Na+)形成的化合物。
它具有离子晶体的特点,晶体中的阳离子和阴离子以离子键相互吸引而形成结晶格子。
NaCl晶体的密度是通过实验测量得到的。
实验中,可以采用容积测定法或质量测定法来测量NaCl晶体的密度。
下面将介绍两种常用的实验方法。
一、容积测定法容积测定法是通过测量晶体的容积来计算其密度。
首先,我们需要准备一个刻度好的量筒、NaCl晶体和精确的天平。
1. 用天平将一定质量的NaCl晶体称取出来,记录下质量。
2. 将NaCl晶体 carefully carefully place into the graduated cylinder filled with a known volume of water. 记录容积。
3. 利用密度公式ρ = m/V,计算NaCl晶体的密度。
其中,ρ表示密度,m表示质量,V表示容积。
二、质量测定法质量测定法是通过测量晶体的质量来计算其密度。
同样地,我们需要准备一个精确的天平。
1. 用天平将一定体积的NaCl晶体称取出来,记录下质量。
2. 利用密度公式ρ = m/V,计算NaCl晶体的密度。
其中,ρ表示密度,m表示质量,V表示体积。
需要注意的是,在实验过程中,应该注意以下几个问题:1. 实验室温度和湿度会对测量结果产生影响。
因此,测量前应确保实验室温度稳定,并记录实验温度。
2. 实验中所使用的仪器应精密并准确校准。
3. 通过重复实验取平均值可以提高测量精度。
以NaCl为例,根据实验数据得知,NaCl的密度约为 2.16 每立方厘米。
总结:本文简要介绍了测量NaCl晶体密度的两种常用实验方法:容积测定法和质量测定法。

晶胞密度计算公式是MZ/NAV,利用晶胞参数可计算晶胞体积(V),根据相对分子质量(M)、晶胞中粒子数(Z)和阿伏伽德罗常数NA,可计算晶体的密度。
晶胞是能完整反映晶体内部原子或离子在三维空间分布之化学-结构特征的平行六面体最小单元。
其中既能够保持晶体结构的对称性而体积又最基本特称“单位晶胞”,但亦常简称晶胞。
例题
.干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子,实验测得-25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,则该干冰晶体的密度为(单位:g/cm3)()
干冰晶胞是面心立方晶胞,所以每个晶胞中含有二氧化碳分子个数=8×1818+6×1212=4,晶胞边长为acm,则体积为a3cm3,晶胞密度=MNA×4V MNA×4V.解答解:干冰晶胞是面心立方晶胞,所以每个晶胞中含有二氧化碳分子个数=8×1818+6×1212=4,晶胞边长为acm,则体积为a3cm3,晶胞密度=MNA×4V MNA ×4V=MNA×4a3MNA×4a3g/cm3=4Ma3N A4Ma3NA g/cm3,故选D.
点评本题考查晶胞计算,侧重考查分析计算及空间想象能力,利用均摊法计算晶胞中二氧化碳分子个数,知道密度公式中各个字母含义,题目难度不大.。

晶体密度计算
《晶体密度计算》
随着科技的发展,互联网技术的普及,许多领域的应用,如科技数据的处理,越来越受到人们的关注。
其中,晶体密度计算是一项技术领域,它是基于数据统计理论把非晶体变换为晶体的一项技术。
晶体密度计算,在物理学和化学领域具有重要作用,它可以用来确定一种物质或混合物的结构。
它可以帮助人们更好地理解晶体的结构,更好的应用物理和化学的原理。
它使得物理和化学的科研者,可以进一步证实和验证符号合成原理等等。
在晶体密度计算中,通常需要计算和分析晶体的多个数据,包括:比容系数、外力点数、晶体总块数、点数等。
此外,还需要计算结构里面实际存在的原子数。
根据这些数据,研究者可以进行计算,并得出晶体的结构及其密度。
晶体密度计算,以日益普及的互联网技术为依托,可以更高效的实现对晶体的结构分析,为有效的涉及到晶体的研究和应用奠定基础。
通过晶体密度计算,为化学和物理的研究提供支持,为物质结构分析提供有效的工具,使科学技术取得更大的突破。
孪晶的晶体密度
晶体密度是指单位体积内晶体所包含的质量。
对于孪晶来说,由于其由两个晶体组成,因此其晶体密度也会受到影响。
孪晶的晶体密度可以通过测量其晶胞参数和化学组成来计算。
晶体密度的计算公式为:晶体密度 = 分子量 / 晶胞体积。
而孪晶的晶胞体积可以通过计算其两个晶体的晶胞体积之和来得到。
值得注意的是,孪晶的晶体密度可能会略微偏离其组成晶体的晶体密度。
这是由于孪晶在形成过程中可能会发生微小的结构改变,从而影响其晶体密度的计算。
总之,孪晶的晶体密度与其组成晶体的晶体密度有一定的关联,需要通过测量晶胞参数和化学组成来计算。
- 1 -。