第八章 分光光度法
- 格式:doc
- 大小:35.50 KB
- 文档页数:2

分光光度法
与不同波长相对应的吸收强度。
如以波长(λ)为横坐标,吸收强度(A)为纵坐标,就可绘出该物质的吸收光谱曲线。
利用该曲线进行物质定性、定量的分析方法,称为分光光度法,也称为吸收光谱法。
用紫外光源测定无色物质的方法,称为紫外分光光度法;用可见光光源测定有色物质的方法,称为可见光光度法。
它们与比色法一样,都以Beer-Lambert定律为基础。
上述的紫外光区与可见光区是常用的。
但分光光度法的应用光区包括紫外光区,可见光区,红外光区。
波长范围(1)200~400nm的紫外光区,(2)400~760nm的可见光区,(3)2.5~25μm(按波数计为4000cm<-1>~400cm<-1>)的红外光区。
、红外分光光度计或原子吸收分光光度计。
为保证测量的精密度和准确度,所有仪器应按照国家计量检定规程或本附录规定,定期进行校正检定。
基本原理当一束强度为I0的单色光垂直照射某物质的溶液后,由于一部分光被体系吸
收,因此透射光的强度降至I,则溶液的透光率T为:。

分光度光度法分光光度法学习资料一、分光光度法的基本概念1. 定义- 分光光度法是通过测定被测物质在特定波长处或一定波长范围内光的吸收度,对该物质进行定性和定量分析的方法。
它利用物质对光的选择性吸收特性,不同的物质由于其分子结构不同,对不同波长的光有不同程度的吸收。
2. 原理基础- 朗伯 - 比尔定律(Lambert - Beer law)是分光光度法的基本定律。
- 朗伯定律指出:当一束平行单色光垂直通过某一均匀非散射的吸光物质时,其吸光度与光通过的路径长度成正比,即A = k_1b(其中A为吸光度,b为光程长度,k_1为比例常数)。
- 比尔定律指出:当一束平行单色光垂直通过某一均匀非散射的吸光物质时,其吸光度与吸光物质的浓度成正比,即A = k_2c(其中c为吸光物质的浓度,k_2为比例常数)。
- 合并朗伯定律和比尔定律得到朗伯 - 比尔定律:A=varepsilon bc,其中varepsilon为摩尔吸光系数,单位为L/(mol· cm),它表示物质对某一特定波长光的吸收能力,varepsilon越大,表明该物质对该波长光的吸收能力越强。
二、分光光度计的结构与组成1. 光源- 提供足够强度和稳定的连续光谱。
在可见光区常用钨灯或卤钨灯,其发射光的波长范围为320 - 2500nm;在紫外光区常用氢灯或氘灯,发射光的波长范围为180 - 375nm。
2. 单色器- 它的作用是将光源发出的复合光分解为单色光。
主要部件包括狭缝、准直镜和色散元件(如棱镜或光栅)。
通过调节狭缝宽度可以控制出射光的带宽和光强。
3. 样品池- 用于盛放被测溶液。
在可见光区可以使用玻璃样品池,而在紫外光区则需使用石英样品池,因为玻璃对紫外光有吸收。
4. 检测器- 检测透过样品池后的光强,并将光信号转换为电信号。
常见的检测器有光电管和光电倍增管等。
光电倍增管具有更高的灵敏度,可检测微弱的光信号。
5. 信号显示与处理系统- 将检测器输出的电信号进行放大、处理,并以吸光度或透光率等形式显示出来。





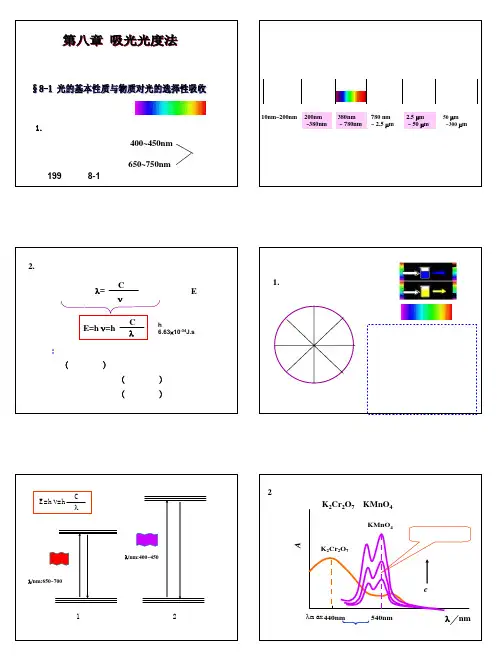
1.电磁波谱紫光波长:400~450nm红光650~750nm一、光的基本性质吸光光度法(分光光度法):根据物质对光的选择性吸收来进行测定的一种方法可见光教材:199页,表8-1光学光谱区(真空紫外)远红外中红外近红外可见近紫外远紫外10nm~200nm200nm ~380nm 380nm ~780nm 780 nm ~2.5 µm 2.5 µm ~50 µm 50 µm ~300 µm2. 光的波粒二象性波动性:λ=νC 粒子性:E波粒二象性:λC E=h ν=h结论:一定波长的光具有一定的能量,波长越长(频率越低),光量子的能量越低。
单色光:具有相同能量(相同波长)的光。
混合光:具有不同能量(不同波长)的光复合在一起,例如白光。
h 为普朗克常数:6.63×10-34J.s二、物质对光的选择性吸收1.物质对光的选择性吸收青(蓝绿)红橙黄绿绿蓝蓝紫物质的分子具有一系列不连续的特征能级,通常分子处于能量最低的基态,吸收了一定入射光的能量后产生能级跃迁,进入能量较高的激发态,当入射光的能量与物质分子的某一能级差恰好相等时,才有可能发生能级跃迁(1)(2)基态第一激发态第一激发态λC E=h ν=hλ/nm:650~700λ/nm:400~450λmax 440nm540nmAλnmK 2Cr 2O 7KMnO 4K 2Cr 2O 7和KMnO 4的吸收曲线定量分析基础定性分析基础c增大2.吸收曲线三、吸光光度法的特点1.灵敏度高(0.01克黄金/吨矿石)2.操作简便,测定速度快3.应用广泛,几乎可测所有无机离子,广泛应用于冶金,环境,生物,医学等领域吸收光谱峰的位置(λmax )定性峰的高矮(吸收程度的大小)定量I a =I 0 -I一、朗伯-比尔定律I oIbSdx I a当一束平行单色光垂直照到某均匀溶液时,假设:液层厚度b ,截面积为s ,溶液浓度为c ,入射光强度为I 0,该溶液吸收光的强度为I a ,透过光的强度为I将b 切割为dx ,薄层中所含吸光质点数为dN ,入射光强度为I b ,穿过薄层后光的强度减弱了dI b-dI b = K 1I b dN dN = 6.02×1023cSdx -dI b = K 16.02×1023S cI b dx 令:K 2= 6.02×1023K 1S ∴-dI b = K 2I b cdx ,cdx K I dI 2b b =−∫∫=−bI I b b cdx K I dI20cb K I I20ln=−Kcb I I=−∴0lg303.22K K =令:液层厚度b ,截面积S ,吸光物质浓度c ,薄层中所含吸光质点数为dNI 0dx bII bI t根据光的量子理论:透光率或透射比T (0~1, 0~100%)定义透光率:I I T =定义吸光度:有意义的取值范围为∞-0KbcI I T A =−=−=0lglg 透过光强度入射光的强度朗伯-比尔定律的数学表达式Kcb I I=−0lgI II I A 00lg lg =−=朗伯-比尔定律朗伯-比耳定律是吸光光度法的理论基础,是用光度法进行定量测定的依据朗伯-比耳定律的物理意义:当一束平行单色光垂直通过某均匀溶液时,溶液的吸光度A 与液层厚度b 及吸光物质的浓度c 成正比:A= Kbc单色平行光均匀溶液注意:A=-lg= KcbI I 0吸光度与光程的关系A = K b c0.10b0.202b0.00光源检测器显示器参比吸光度与浓度的关系A = Kb c0.10c0.202c0.00光源检测器显示器参比二、光度法的灵敏度1.吸光系数a (吸收系数)当液层厚度b 以cm ,吸光物质的浓度c 以g/L 为单位时,朗伯-比尔定律表示为A = abca 称为吸光系数,单位为L/(g ⋅cm)在朗伯-比尔定律A = Kbc 中,系数K 在一定条件下是常数,表明用光度法进行测定的灵敏度KλT吸光物质性质K=cbA 2.摩尔吸光系数εc mol/L b cm εL/(mol.cm)A= bcεε吸光物质的灵敏度吸光物质对光的吸收能力ε=cbA 当液层厚度b 以cm ,吸光物质浓度c 以mol/L 为单位时,朗伯-比尔定律表示为二乙基胺二硫代甲酸钠(铜试剂,DDTC )双硫腙ε436=12800 L/(mol.cm)CuCuε495=158000 L/(mol.cm)<ελT吸光物质性质λmaxεmaxA= -lgT = -lg0.603 = 0.220c=140×10-6112.4=1.25 ×10-6mol/Lε=bcA =2 ×1.25 ×10-60.220= 8.8×104 L/(mol.cm)例1 (203页,8-1),利用双硫腙光度法测Cd 2+,已知Cd 2+的质量浓度为140µg/L,比色皿厚度为2cm,在520nm 处测得透光率为0.603,求吸光度A 及摩尔吸光系数ε(M cd =112.4g/mol)解:A= εbcε=bc A A= εbc c mol/Lbcmmol/1000cm 3bc/1000mol/cm 2bcM ×1061000S(µg/cm 2)∴S=bcM ×103将代入得bc=εAS=εAM ×103µg/cm 23.桑德尔灵敏度SA=0.001时(检测极限),单位截面积光程内所能检出吸光物质的最低含量µg/cm 2bc →单位截面积光程所能检出吸光物质的最低含量因为:A=0.001,代入上式:S 灵敏度ε灵敏度S=εM ∴例2(205页,8-2)、已知双硫腙光度法测定Cd 2+时ε520nm =8.8×104L/(mol ·cm),求桑德尔灵敏度S.A=0.001时,单位截面积光程内所能检出吸光物质的最低含量µg/cm 2解,S=εM cd =8.8×104112.4=1.3 ×10-3µg/cm 2A= εbcS=εAM ×103例3,Fe 2+用邻二氮菲显色,当c=0.76 µg/ml,于波长λ510nm,吸收池厚度b=2.0cm 时,测得T%=50.2,求摩尔吸光系数和桑德尔灵敏度各为多少?(M Fe =55.85 g/mol)c= 0.76 µg/ml=7.6 ×10-4g/L=1.36 ×10-5mol/L由A=εbc 得:解:A=-lgT=-lg0.502=0.299ε=A bc =0.2992.0×1.36 ×10-5=1.1 ×104L/(cm.mol)S=εM Fe =1.1×10455.85= 5.1 ×10-3µg/cm 2三、利用朗伯-比尔定律进行定量分析A= εbc b 一定, λmax 一定,同一种物质,ε一定配制一系列标准溶液,由标准溶液:c 1, c 2, c 3……测得吸光度:A 1, A 2, A 3…...A 对c 作图工作曲线1.工作曲线法(标准曲线法)c (mg/ml)c 1c 2c 3c 4c 5A.....A xc x 工作曲线(标准曲线)A 1A 2A 3A 4A 5A 标A x=ε标b c 标εx b c x2.比较法:四、对朗伯-比尔定律偏离.工作曲线(标准曲线)A= εbccc 1c 2c 3c 4c 5A..原因:仪器或溶液的实际条件与朗伯-比尔定律所要求的前提条件不一致..A 总=-lg I t1+I t2I o1+I o2=-lgI o110-ε1bc +I o210-ε2bc I o1+I o2(一)、由于非单色光引起的偏移∴I t =I o 10-εbcA= εbc =-lgII o假设:入射光I oλ2I o2I t2A 2λ1I o1I t1A 1A 总=-lg10-εbc (I o1+I o2)I o1+I o2= εbc 造成偏离A 总= εbc若λ1与λ2相差很大,ε1= ε2=ε如果λ1和λ2相差不大,即∆λ= |λ1-λ2|很小,可以近似认为ε1= ε2= εA 总=-lg I t1+I t2I o1+I o2=-lgI o110-ε1bc +I o210-ε2bcI o1+I o2克服由非单色光所造成的偏离¾选择单色器(单色性能较好)¾选择入射光波长(λmax )¾选择适当的浓度范围(不应过高)浓度及非单色光的影响λ1λ2abA 5A 1A 4A 2λ3λ/nmA浓度: b>a波长: λ3>λ2>λ1A 3A 6(二)、由于溶液本身的化学和物理性质所引起的偏离1.由于介质不均匀所引起的偏离bI oI I a 发生散射:T 实I o -I a -I r=I o=II o2.由于溶液的化学反应所引起的偏离分析浓度或总浓度C 总吸光质点浓度C 质C工作曲线A=Kcb I r因为:T 实<T 理∴A 实>A 理T 理I o -I a =I o =I I o 吸光物质因解离、络合、缔合等化学变化而改变浓度如:Cr 2O 72-+H 2O 2CrO 42-+2H +λ=375nmλ=350nm单体:SNH +(CH 3)2NN(CH 3)22SNH +(CH 3)2NN(CH 3)22λmax = 660 nm 二聚体:λmax = 610 nmAcλmax = 660 nmAλ660 nm 610 nm亚甲基蓝阳离子(MB )方便、较灵敏,准确度差(半定量)一、光度分析的几种方法1.目视比色法观察方向空白c 1c 2c 3c 4c x1).可以任意选择某种波长的单色光2).扩大入射光波长的范围3)灵敏度、准确度高2.光电比色法和吸光光度法:共同点:以朗伯-比尔定律为基础的仪器分析方法主要区别:获得单色光的手段不同光电比色法以滤光片为单色器,谱带宽度约有几十纳米吸光光度法以棱镜或光栅为单色器,谱带宽度约有几纳米光源单色器狭缝样品室检测器二、紫外-可见分光光度计氙灯氢灯钨灯1.光源卤钨灯。


—填空题1. 可见分光光度法主要应用于测定样品中的微量组分,其特点是、、和。
2. 朗伯-比耳定律表达式,A =KCL,其中符号C代表,单位;L代表,单位;K称为,当C 等于,L等于时,则K 以符号表示,并称为摩尔吸光系数。
3. 偏离朗伯-比耳定律的主要因素有和,减少偏离现象的最常用措施为和。
4. 当光照射到物质上时,光与物质之间便产生光的, , ,等现象,分光光度法主要是利用了现象。
5. 有色物质氧络血红阮可透过450—495nm波长范围内的光,它本身显, 另一有色物质二苯硫踪的CCl4溶液可吸收580—620nm波长的光,它本身显。
7. 吸光光度法对显色反应的要求是:, , , 。
9. 邻菲罗啉分光光度法测定微量铁时,加入盐酸羟胺的作用是,加入HAC-NaAc 缓冲溶液的目的是, 加入邻菲罗咻溶液的作用是。
10、分光光度法定性分析的理论基础是基于各物质的最大________________不同11.白光是一种_____光,它是由______________等各种色光按一定比例混合而成12.KMnO4溶液的颜色为_______色,该有色化合物最易吸收_________色光。
13.在分光光度分析中,一般选择波长为__________的单色光作为入射光进行测定,该波长是通过实验绘制_______________来得到的。
14,朗伯-比尔定律中,当溶液的浓度单位用_______,液层厚度单位用_______时,其比例常数叫“摩尔吸光系数”,常用符号_______表示,因此朗伯-比尔定律的表达式可写为__________15.分光光度分析时,待测溶液一般注到比色皿高度的________16.摩尔吸光系数越大,表示该物质对某波长光的吸收能力________,比色测定的灵敏度就____________17.朗伯定律是说明在______________________,光的吸收与________成正比;比尔定律是说明在一定条件下,光的吸收与______________成正比,两者合为一体称为朗伯-比尔定律,其数学表达式为_____________18.分光光度计一般由___________,____________,____________,____________及___________五部分组成。
第六章 吸光光度法
一、问答题
1. 摩尔吸收系数的物理意义是什么?其大小和哪些因素有关?在分析化学中κ有何意义?
2. 朗伯-比尔定律的物理意义是什么?什么是透光度?什么是吸光度?二者之间的关系是什么?
3. 为社么物质对光发生选择性吸收?
4. 分光光度计有哪些主要部件?它们各起什么作用?
5 当研究一种新的显色剂时,必须做哪些实验条件的研究?为什么?
6 什么是吸收光谱曲线?什么是标准曲线?它们有何实际意义?利用标准曲线进行定量分析时可否使用透光度T 和浓度c 为坐标?
7 测定金属钴中微量锰时在酸性液中用KIO 3将锰氧化为高锰酸根离子后进行吸光度的测定。
若用高锰酸钾配制标准系列,在测定标准系列及试液的吸光度时应选什么作参比溶液? 8 吸光度的测量条件如何选择?为什么?普通光度法与示差法有何异同?
9 光度分析法误差的主要来源有哪些?如何减免这些误差?试根据误差分类分别加以讨论。
10 常见的电子跃迁有哪几种类型?
11 在有机化合物的鉴定和结构判断上,紫外-可见吸收光谱提供信息具有什么特点? 二、计算题
1.以邻二氮菲光度法测定Fe (Ⅱ),称取试样0.500g ,经处理后,加入显色剂,最后定容为50.0mL ,用1.0 cm 吸收池在510 nm 波长下测得吸光度A =0.430,计算试样中的w (Fe)(以
百分数表示);当溶液稀释一倍后透射比是多少?(ε510=1.1×104
) 2.%0.61%10010
=⨯=-A
T 已知KMnO 4的ε
545
=2.2×103
,计算此波长下浓度为0.002%
(m/v )KMnO 4溶液在3.0cm 吸收池中的透射比。
若溶液稀释一倍后透射比是多少?
3. 以丁二酮肟光度法测定镍,若络合物NiDx 2的浓度为1.7×10-5mol ·L -1
,用2.0cm 吸收
池在470nm 波长下测得的透射比为30.0%。
计算络合物在该波长的摩尔吸光系数。
4. 根据下列数据绘制磺基水杨酸光度法测定Fe (Ⅲ)的工作曲线。
标准溶液是由0.432g
铁铵矾[NH 4Fe(SO 4)2·12H 2O]溶于水定容到500.0mL 配制成的。
取下列不同量标准溶液于50.0mL 容量瓶中,加显色剂后定容,测量其吸光度。
V (Fe(Ⅲ))(mL ) 1.00 2.00 3.00 4.00 5.00 6.00
A 0.097 0.200 0.304 0.408 0.510 0.618
测定某试液含铁量时,吸取试液5.00mL ,稀释至250.0mL ,再取此稀释溶液2.00mL 置于50.0mL 容量瓶中,与上述工作曲线相同条件下显色后定容,测得的吸光度为0.450,计算试液中Fe(Ⅲ)含量(以g/L 表示)。
5. 以PAR 光度法测定Nb ,络合物最大吸收波长为550nm ,ε=3.6×104
;以PAR 光度法测定
Pb ,络合物最大吸收波长为520nm ,ε=4.0×104。
计算并比较两者的桑德尔灵敏度。
6. 有两份不同浓度的某一有色络合物溶液,当液层厚度均为1.0cm 时,对某一波长的透射
比分别为:(a)65.0%;(b)41.8%。
求
(1)该两份溶液的吸光度A1,A2。
(2)如果溶液(a)的浓度为6.5×10-4mol·L-1,求溶液(b)的浓度。
(3)计算在该波长下有色络合物的摩尔吸光系数和桑德尔灵敏度。
(设待测物质的摩尔质量为47.9g/mol)
计算未知溶液中x和y的浓度。
8.当光度计透射比测量的读数误差ΔT=0.010时,测得不同浓度的某吸光溶液的吸光度为:
0.010、0.100、0.200、0.434、0.800、1.200。
利用吸光度与浓度成正比以及吸光度与
透光率的关系,计算由仪器读数误差引起的浓度测量的相对误差。
9.以联吡啶为显色剂,光度法测定Fe(Ⅱ),若在浓度为0.2mol·L-1,pH=5.0时的醋酸缓冲
溶液中进行显色反应。
已知过量联吡啶的浓度为1×10-3mol·L-1,lg K H(bipy)=4.4,lg K(FeAc)=1.4,lgβ3=17.6。
试问反应能否定量进行?
10.用示差光度法测量某含铁溶液, 用5.4×10-4mol·L-1Fe3+溶液作参比,在相同条件下显色,用1cm吸收池测得样品溶液和参比溶液吸光度之差为0.300。
已知 =2.8×103L·mol-1·cm-1,则样品溶液中Fe3+的浓度有多大?
11.确称取1.00mmol的指示剂于100mL容量瓶中溶解并定容。
取该溶液2.50mL5份,分别调至不同pH并定容至25.0mL,用1.0cm吸收池在650nm波长下测得如下数据:
pH 1.00 2.00 7.00 10.00 11.00
A0.00 0.00 0.588 0.840 0.840
计算在该波长下In-的摩尔吸光系数和该指示剂的p K a。