高考化学 一轮复习 第1节 化学反应速率 大纲人教版
- 格式:ppt
- 大小:1.25 MB
- 文档页数:41




第一节化学反应速率考纲定位要点网络1.了解化学反应速率的概念和定量表示方法。
能正确计算化学反应的转化率(α)。
2.了解反应活化能的概念,了解催化剂的重要作用。
3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,能用相关理论解释其一般规律。
4.了解化学反应速率的调控在生活、生产和科研领域中的重要作用。
化学反应速率的有关计算知识梳理1.化学反应速率的含义(1)表示方法通常用单位时间内反应物浓度的减少或生成物浓度的增加(均取正值)来表示。
(2)定义式:v=ΔcΔt,单位为mol·L-1·min-1或mol·L-1·s-1。
2.化学反应速率与化学计量数的关系同一反应在同一时间内,用不同物质来表示的反应速率可能不同,但反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比。
如在反应a A(g)+b B(g)c C(g)+d D(g)中,存在v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。
3.化学反应速率的有关注意事项(1)化学反应速率是一段时间内的平均速率,且无论用反应物还是用生成物表示均取正值。
(2)在一定温度下,固体和纯液体物质的浓度是常数,不能用其浓度变化表示速率。
(3)同一化学反应在相同条件下,用不同物质表示的化学反应速率,其数值可能不同,但意义可能相同。
(4)计算反应速率时,若给出的是物质的量的变化值,不要忘记转化为物质的量浓度的变化值。
(5)化学反应速率在不同的时间间隔内一般不相等。
[辨易错](1)对于任何化学反应来说,反应速率越快,反应现象就越明显。
( )(2)化学反应速率是指单位时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加。
( )(3)甲、乙两容器中分别充入2 mol NO2和4 mol NO2,5分钟后两者各反应掉NO21 mol 和2 mol,则说明二者反应速率之比为1∶2。
( )(4)对于C(s)+H2O(g)===CO(g)+H2(g)反应,在一定的时间内v(H2O)=1 mol/(L·s),可知v(C)=1 mol/(L·s)。
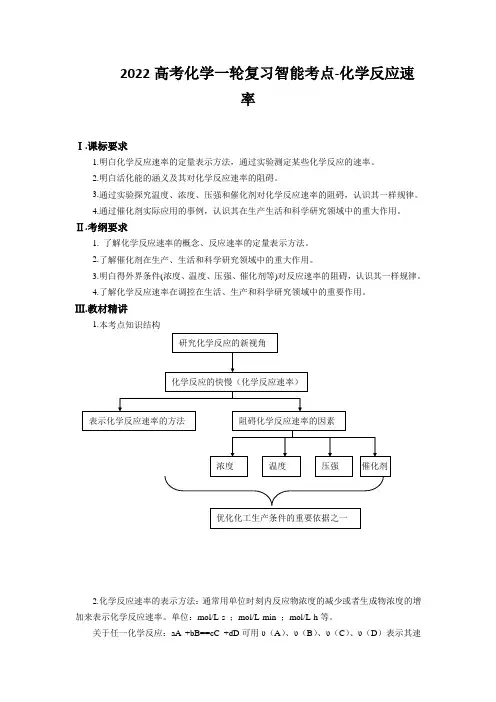
2022高考化学一轮复习智能考点-化学反应速率Ⅰ.课标要求1.明白化学反应速率的定量表示方法,通过实验测定某些化学反应的速率。
2.明白活化能的涵义及其对化学反应速率的阻碍。
3.通过实验探究温度、浓度、压强和催化剂对化学反应速率的阻碍,认识其一样规律。
4.通过催化剂实际应用的事例,认识其在生产生活和科学研究领域中的重大作用。
Ⅱ.考纲要求1. 了解化学反应速率的概念、反应速率的定量表示方法。
2.了解催化剂在生产、生活和科学研究领域中的重大作用。
3.明白得外界条件(浓度、温度、压强、催化剂等)对反应速率的阻碍,认识其一样规律。
4.了解化学反应速率在调控在生活、生产和科学研究领域中的重要作用。
Ⅲ.教材精讲1.本考点知识结构2.化学反应速率的表示方法:通常用单位时刻内反应物浓度的减少或者生成物浓度的增加来表示化学反应速率。
单位:mol/L·s ;mol/L·min ;mol/L·h等。
关于任一化学反应:aA +bB==cC +dD可用υ(A)、υ(B)、υ(C)、υ(D)表示其速率,则有υ(A):υ(B):υ(C):υ(D)== a:b:c:d,即化学反应速率之比等于化学方程式中各物质的系数之比(还可等于其学其浓度变化之比或物质的量变化之比)。
3.阻碍反应速率的因素内因:反应物的性质是反应速率大小的决定因素。
外因:要紧因素有浓度、温度、压强、催化剂等。
(1)浓度:其它条件不变时,增大反应物浓度,化学反应速率加快。
(2)温度:其它条件不变时,升高温度,化学反应速率加快。
一样来说,温度每升高10℃,反应速率增大为原先的2~4倍。
(3)压强:其它条件不变时,增大压强,关于有气体物质参加的化学反应,反应速率加快。
(4)催化剂:使用正催化剂,能加快反应速率。
未专门指明时,均指正催化剂。
4.活化能:对基元反应而言,活化分子的平均能量与一般反应物分子的平均能量之差叫该反应的活化能(用Ea表示,其单位为kJ/mol)。


高三化学一轮复习化学反应速率及其影响因素真正的失败不是你没做成事,而是你甘心于失败。
——斯坦福大学校训【考纲要求】(1)了解化学反应速率的概念、反应速率的定量表示方法。
(2)了解催化剂在生产、生活和科学研究领域中的重大作用。
(3) 理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识其一般规律。
(4)了解化学反应速率在调控在生活、生产和科学研究领域中的重要作用。
考点一 化学反应速率基本概念1.概念:化学反应速率用 来表示。
2、表示方法:通常用 内反应物 或生成物 来表示。
3.表达式:v= 单位: 4.注意:(1)一般来说,化学反应速率是指某段时间内的 速率而不是 速率。
且无论用反应物还是用生成物表示均取正值(2)同条件下,同一反应中用不同物质表示反应速率时,数值可能 ,但意义 。
即:均表示同一反应的快慢。
反应速率的数值之比等于化学方程式中各物质的___ __之比。
例如,对于反应m A(g)+n B(g)=p C(g)+q D(g),v(A)∶v(B)∶v(C)∶v(D)=__________ (3)对比同一反应在不同条件下的反应速率要 [知识运用]① 已知4NH 3+5O 2=4NO+6H 2O ,若反应速率分别为v (NH 3)、v (O 2)、v (NO)、v (H 2O)表示,则: (1)v (O 2)== ____ V(NH 3) (2)v (H 2O)== _______V(O 2)(3)v (NO)== ____ V(O 2) (4) v (NH 3)== ___ V(NO)== ___V(H 2O)② 已知aA(g)+bB(g)==cC(g)+dD(g)。
取amolA 和bmolB 置于VL 容器中,一分钟后,测得 容器内A 的浓度为Xmol/L 。
这时B 的浓度为 ,C 的浓度为 , 这段时间内以物质A 的浓度变化来表示的反应速率为 。
③ 反应A+3B==2C+2D 在四种情况的反应速率分别如下,该反应进行的快慢顺序为 (1)v (A)==0.15mol/(L •S ) (2) v (B)==0.6 mol/(L •S ) (3) v (C)==0.4 mol/(L •S ) (4)v (D)==0.45 mol/(L •S ) 考点二 影响反应速率的因素1、内因:参加反应的物质的性质。



