无机化学_晶体结构
- 格式:ppt
- 大小:1.93 MB
- 文档页数:46



无机化学第二版课后练习题含答案
第一章晶体结构与晶体化学
练习题
1.什么是晶体结构?
2.描述组成配位数和形貌相同的正交晶系、四方晶系和六方晶系的特点。
3.TaCl5的结构类型是什么?给出TaCl5的点阵参数。
4.描述共价晶体和离子晶体的结构特点并给出两个例子。
答案
1.晶体结构是指对于一种给定的化学元素或化合物,其原子或离子分别
按一定的规律有序排列,形成具有规则重复的空间排列的结构。
–正交晶系:组成配位数为8,形貌倾向于长方体或正方体,一般相互垂直,如NaCl、MgO等。
–四方晶系:组成配位数为8,形貌为正方形或长方形板状,沿着一个轴和对角线对称。
如ZnS、TiO2、CaF2等。
–六方晶系:组成配位数为12,形貌为六边形柱状或针状,有沿着一个轴对称的等边六边形截面。
如α-石墨、SiC等。
2.TaCl5的结构类型是正交晶系。
TaCl5的点阵参数为a = 5.73 Å,b
= 5.28 Å,c = 11.85 Å,α = β = γ= 90°。
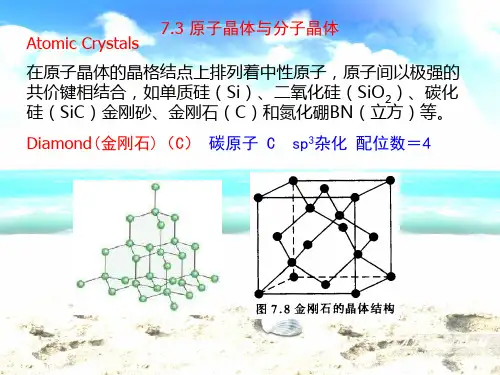
–共价晶体:由原子间较强的共价键构成,如金刚石、氧化硅(SiO2)。
–离子晶体:由阳离子和阴离子通过电滑移力相互结合而成,如NaCl、MgO。
1。



无机化学《晶体结构》教案[ 教学要求]1 .了解晶体与非晶体的区别,掌握晶体的基本类型及其性质特点。
2 .了解离子极化的基本观点及其对离子化合物的结构和性质变化的解释。
3 .了解晶体的缺陷和非整比化合物。
[ 教学重点]1 .晶胞2 .各种类型晶体的结构特征3 .离子极化[ 教学难点]晶胞的概念[ 教学时数] 4 学时[ 主要内容]1 .晶体的基本知识2 .离子键和离子晶体3 .原子晶体和分子晶体4 .金属键和金属晶体5 .晶体的缺陷和非整比化合物6 .离子极化[ 教学内容]3-1 晶体3-1-1 晶体的宏观特征晶体有一定规则的几何外形。
不论在何种条件下结晶,所得的晶体表面夹角(晶角)是一定的。
晶体有一定的熔点。
晶体在熔化时,在未熔化完之前,其体系温度不会上升。
只有熔化后温度才上升。
3-1-2 晶体的微观特征晶体有各向异性。
有些晶体,因在各个方向上排列的差异而导致各向异性。
各向异性只有在单晶中才能表现出来。
晶体的这三大特性是由晶体内部结构决定的。
晶体内部的质点以确定的位置在空间作有规则的排列,这些点本身有一定的几何形状,称结晶格子或晶格。
每个质点在晶格中所占的位置称晶体的结点。
每种晶体都可找出其具有代表性的最小重复单位,称为单元晶胞简称晶胞。
晶胞在三维空间无限重复就产生晶体。
故晶体的性质是由晶胞的大小、形状和质点的种类以及质点间的作用力所决定的。
3-2 晶胞3-2-1 晶胞的基本特征平移性3-2-2 布拉维系十四种不拉维格子类 型 说 明单斜底心格子( N ) 单位平行六面体的三对面中 有两对是矩形,另一对是非矩形 。
两对矩形平面都垂直于非矩形 平面,而它们之间的夹角为β, 但∠β≠ 90°。
a 0≠ b 0 ≠ c 0 ,α = γ =90°, β≠ 90°正交原始格子( O ) 属于正交晶系,单位平 行六面体为长、宽、高都不 等的长方体,单位平行六面 体参数为: a 0 ≠ b 0 ≠ c 0 α = β = γ =90 °正交体心格子( P ) 属于正交晶系,单位平行六 面体为长、宽、高都不等的长方 体,单位平行六面体参数为: a 0 ≠ b 0 ≠ c 0 α = β = γ =90 °正交底心格子( Q ) 属于正交晶系,单位平 行六面体为长、宽、高都不 等的长方体,单位平行六面 体参数为: a 0 ≠ b 0 ≠ c 0 α = β = γ =90 °正交面心格子( S ) 属于正交晶系,单位平 行六面体为长、宽、高都不 等的长方体,单位平行六面 体参数为: a 0 ≠ b 0 ≠ c 0 α = β = γ =90 °立方体心格子( B ) 属于等轴晶系,单位平行六 面体是一个立方体。

晶体结构总结简介无机化学中,晶体结构是研究物质的有序排列方式和性质的重要方面。
晶体结构的研究对于理解和预测物质的物理、化学性质具有重要意义。
本文将对晶体结构的基本概念、分类和研究方法进行总结。
晶体结构的基本概念晶体是由原子、离子或分子等构成的周期性有序排列的固体。
晶体结构是指晶体中原子或离子的有序排列方式,决定了物质的物理、化学性质。
晶体结构的基本概念包括晶胞、晶格和晶体面。
晶胞是指晶体中最小的重复单元,可以看作是一个几何体,它的外形和大小由晶体的结构决定。
晶格是晶体中原子或离子的有序排列方式,可以看作是晶体中的虚拟网格。
晶格中的点被称为胞内原子或离子。
晶体面则是晶胞的界面,由一组晶胞面构成。
晶体结构的分类根据晶胞的对称性,晶体结构可以分为离散晶体和连续晶体。
离散晶体是指晶胞中只有少数几个原子或离子,它们之间通过化学键或相互作用力保持结合。
离散晶体常见的结构类型包括离子晶体、共价晶体和金属晶体。
连续晶体是指晶胞中包含大量的原子、离子或分子,它们之间通过一系列规则的对称操作排列。
连续晶体常见的结构类型包括简单晶格、面心立方晶格和体心立方晶格等。
晶体结构的研究方法研究晶体结构的方法主要包括晶体衍射和晶体结构分析。
晶体衍射是通过将射线照射到晶体上,测量从晶体中射出的衍射波的方向和强度来研究晶体结构。
常用的晶体衍射方法包括X射线衍射、中子衍射和电子衍射等。
晶体结构分析是利用实验数据和计算方法确定晶体的原子或离子排列方式。
常用的晶体结构分析方法包括X射线单晶衍射、粉末衍射和电子显微镜等。
结论晶体结构是无机化学中的重要研究领域,对于理解和预测物质的性质至关重要。
通过研究晶体结构,人们可以深入揭示物质中原子、离子或分子的排列方式,从而为材料科学、催化剂设计等领域提供基础的理论支持。
参考文献1. 王道,无机化学基础,化学工业出版社,2010。
2. 高清榜,晶体学导论,科学出版社,2012。
3. 晶体结构与理论组,无机化学实验,化学工业出版社,2015。

第三章晶体结构一选择题1.下列有关离子变形性的说法中,不正确的是()。
A.8电子构型的离子的变形性小于其他电子构型的离子B.同一元素不同价态的负离子中,所带负电荷越多变形性越大C.同种原子形成的阴离子比阳离子变形性大D.离子半径大,则变形性大(其他条件相同)2.下列各组离子化合物的晶格能变化顺序中,正确的是()A、MgO> CaO> Al2O3B、LiF> NaCl >KIC、RbBr< CsI <kclD、BaS> BaO> BaCl23.Ag+的电子构型为()。
A.18B.18+2C.9~17D.84.下列各种电子构型的正离子,其极化力和变形性均较小的是()。
A.8电子构型B.9~17电子构型C.18电子构型D.18+2电子构型5.下列化合物中,熔点最低的是()。
A.BCl3 B. SiCl4C.SiCD.NaCl6.下列各晶体中,熔化时只需克服色散力的是()。
A.KB.H2OC.SiCD.SiF47.下列离子中,磁矩最大的是()。
A.Ni2+B.V2+C.Ti4+D.Mn2+8.下列各组离子中,离子的变形性最大的是()。
A.I- B.Cl- C.Br- D.F-9.下列物质中,熔点最低的是()。
A.NaFB.AlF3C.KClD.CaO10.在NaCl晶体中,Na+(或Cl-)的配位数是()。
A.4B.5C.6D.811.晶体熔化时,需破坏共价键作用的是()。
A.PH3B.AlC.KFD.SiO212.下列物质中熔点最高的是()。
A.NaClB.N2C.NaD.SiO213.关于分子晶体的叙述中,正确的是()。
A.分子晶体中只存在分子间力B.分子晶体晶格结点上排列的分子可以是极性分子或非极性分子C.分子晶体不溶于水D.分子晶体在水溶液中不导电14.离子晶体中,正、负离子配位数比不同的最主要原因是()。
A.正、负离子半径B.正、负离子的电荷C.正、负离子的电子构型D.晶格能15.对于AB型的离子晶体,若正、负离子配位数为4,则它们的半径之比r+/r-为()。

无机化学第七章晶体结构晶体结构是无机化学中一个重要的概念。
晶体是由一个或多个原子、离子或分子有序排列组成的固体,具有规则的几何形状。
晶体结构研究的是晶体中原子、离子或分子的排列方式和间距。
晶体结构的研究首先要确定晶胞的类型和晶格常数。
晶胞是晶体中基本的重复单元,可以通过晶胞的平移得到整个晶体。
晶格常数是指晶胞中原子、离子或分子的排列方式和间距。
晶体结构可以用晶胞的对称性来描述。
对称性是指晶胞的各个面和角的排列方式。
晶胞的对称性可以分为平面对称、轴对称和空间对称。
根据对称性的不同,晶体可以分为立方晶体、四方晶体、正交晶体、六方晶体、单斜晶体、三斜晶体和三角晶体等七种类型。
晶体结构中还有一些重要的概念,如晶系、空间群和点群。
晶系是指晶体结构的基本几何形状,包括立方、四方、正交、六方、单斜、三斜和三角七种类型。
空间群是指晶体结构的完整的对称操作,包括平移、旋转、反射和滑移。
点群是指晶体结构的实际的对称操作,只包括旋转和反射,不包括平移。
晶体结构的研究方法主要有X射线衍射方法、电子衍射方法和中子衍射方法等。
X射线衍射是最常用的晶体结构研究方法。
当X射线通过晶体时,会发生衍射现象。
根据衍射的图样可以确定晶体的结构。
晶体结构的研究对于了解物质的性质和应用具有重要的意义。
晶体结构可以影响物质的物理和化学性质,如硬度、透明度和导电性等。
通过了解晶体结构,可以设计和合成具有特定性能的材料,如硅和镍钴锌铁氧体等。
晶体结构的研究还可以为材料科学、能源、光电子学和生物医学等领域的研究提供指导。
总之,晶体结构是无机化学中一个重要的概念。
通过研究晶体结构,可以了解晶体的组成和排列方式,以及晶体对物质性质的影响。
安徽安徽高中化学竞赛无机化学第六章晶体结构基础6. 0. 01 晶体的四种差不多类型:依照晶体中微粒之间相互作用的性质,能够将晶体分成4种差不多类型:离子晶体、金属晶体、分子晶体和原子晶体。
6. 1. 01 分子晶体及其物理性质:分子之间以分子间作用力结合成的晶体称为分子晶体。
由于熔、沸点较低,因此分子晶体一样要在较低的温度下才能形成,而在常温时多以气体形式存在。
分子晶体的硬度较小,导电性能一样较差,因为电子从一个分子传导到另一个分子专门不容易。
6. 1. 02 极性分子:分子的正电荷重心和负电荷重心不重合,则为极性分子。
6. 1. 03 偶极矩:极性分子的极性能够用偶极矩m 来度量。
若正电荷(或负电荷)重心上的电荷量为q,正、负电荷重心之间距离即偶极长为d,则偶极矩m = q d6. 1. 04 偶极矩的单位:当d = 1.0 ´10-10 m,即d 为 1 ,q = 1.602 ´10-19 C,即q 为电子的电荷量时,偶极矩m = 4.8 D。
D 为偶极矩单位,称为德拜。
在国际单位制中,偶极矩m以C•m(库仑•米)为单位,当q = 1 C,d = 1 m时,m = 1 C•m。
C•m 与D 这两种偶极矩单位的换算关系为= 3.34 ´10-30 C•m6. 1. 05 永久偶极:极性分子的偶极矩称为永久偶极,偶极矩的矢量方向由正极指向负极。
多原子分子中的大p 键及孤电子对,有时也阻碍分子的偶极矩。
6. 1. 06 诱导偶极:非极性分子在外电场的作用下,能够变成具有一定偶极矩的极性分子,如下面左图所示。
而极性分子在外电场作用下,其偶极矩也能够增大,如下面右图所示。
在电场的阻碍下产生的偶极称为诱导偶极。
6. 1. 07 阻碍诱导偶极的因素:诱导偶极强度大小与电场强度成正比,也与分子的变形性成正比。
所谓分子的变形性,即分子的正、负电荷重心的可分程度。
分子体积越大,电子越多,变形性越大。
无机化学中的晶体结构与晶格缺陷晶体是由周期性排列的原子、离子或分子组成的固体,具有长程有序性和对称性。
在无机化学中,晶体结构是一个重要的研究对象。
对于一种物质来说,了解其晶体结构可以揭示其化学和物理性质,并且为其制备及应用提供指导。
本文将探讨无机化学中的晶体结构及其缺陷。
1. 晶体结构的分类在无机化学中,晶体结构可以根据其元素和化学键的不同而分为离子晶体、共价晶体和分子晶体。
其中,离子晶体以离子间的静电作用为主要力,具有高的熔点和硬度,例如氯化钠。
共价晶体以共价键为主要力,例如金刚石。
分子晶体以分子间的相互作用为主要力,具有低的熔点和硬度,例如硫酸甘油。
2. 晶体的晶格和晶胞晶体中原子、离子或分子的周期性排列构成了晶格结构。
晶格是由晶体单位中重复出现的空间点组成的。
晶格由三个相互垂直的轴和各自上的点阵构成。
晶格用一组指标(如a、b、c、α、β、γ)来描述。
晶胞是晶体的基本结构单元,是一系列被原子或离子占据的几何空间。
晶胞可以是立方、四方、正交、单斜、三角、六方和三斜等类型。
不同的晶胞形状影响晶体物理和热力学性质。
3. 晶体的晶格缺陷理想的晶体结构是由规律的周期排列的原子、离子或分子组成的。
然而,在实际晶体中,由于各种因素的影响,晶体结构会出现缺陷,这些缺陷被称为晶格缺陷。
这些晶格缺陷会直接影响晶体的物理和化学性质。
晶格缺陷可分为点缺陷、线缺陷和面缺陷。
点缺陷是晶体中单个原子、离子或空位的缺失或存在。
例如,氧化铝中的阳离子晶格中可能存在空位缺陷。
线缺陷是晶体中沿着一定方向具有局部偏差的缺陷。
例如,在氧化铝中,局部偏移的氧离子构成线缺陷。
面缺陷是晶体中平面上存在的缺陷,例如晶格错位或位错等。
晶格缺陷的存在可以导致物理和化学性质的改变。
例如,缩小晶胞之间距离的面缺陷催化剂可以提高反应速率。
结论在无机化学中,晶体结构和晶格缺陷是有重要意义的。
通过对晶体结构和缺陷的研究,可以深入了解物质的物理和化学性质,并指导其制备和应用。