无机化学晶体结构
- 格式:pdf
- 大小:15.37 MB
- 文档页数:113

无机化合物的结构与性质无机化合物是由无机元素组成的化合物,在自然界和工业中都广泛存在。
无机化合物的结构与性质是化学领域的重要研究内容之一。
本文将介绍无机化合物的结构及其与性质之间的关系。
一、晶体结构无机化合物的晶体结构对其性质具有重要影响。
晶体是由粒子(原子、离子或分子)按照一定的规律排列而成的有序固体。
不同的无机化合物具有不同的晶体结构,一般可归为离子晶体、共价晶体和金属晶体三种类型。
离子晶体是由正负离子通过电荷相互吸引形成的晶体。
比如氯化钠(NaCl)晶体中,钠离子和氯离子以离子键相互连接,形成六方密堆积结构。
共价晶体是由共价键连接形成的晶体。
如硅酸盐矿物中的方解石(CaCO3),其中的碳酸根离子以碳氧共价键连接,钙离子通过离子键与其连接。
金属晶体是由金属原子通过金属键相互连接形成的晶体。
金属晶体的特点是金属原子之间没有明确的离子或共价键,而是形成了一个电子海,使金属具有良好的导电性和热传导性。
二、物理性质无机化合物的结构对其物理性质具有直接影响。
以下是几个例子:1. 熔点和沸点:晶体结构的稳定性直接影响了无机化合物的熔点和沸点。
离子晶体由于离子键的强烈吸引力,导致必须克服较大的能量才能使其熔化。
共价晶体通常具有较高的熔点,因为共价键需要较高的能量才能破坏。
而金属晶体由于金属键的弱相互作用力,熔点较低。
2. 导电性:离子晶体通常是电解质,因为其具有自由移动的离子。
在溶液中或熔化状态下,离子能够自由移动,形成电解质的现象。
而共价晶体和金属晶体通常是导体,共价晶体中的电荷通过电子在键中共享的方式传递,而金属晶体则通过电子海。
3. 硬度:晶体结构影响了无机化合物的硬度。
离子晶体中离子键的强烈吸引力使得其硬度较高。
共价晶体的硬度取决于共价键的强度,而金属晶体由于金属键较弱,硬度较低。
三、化学性质无机化合物的结构决定了它的化学性质。
以下是几个例子:1. 酸碱性:离子晶体中的阳离子和阴离子能够与水中的水分子发生反应,形成酸性或碱性溶液。


无机化学基本知识点总结一、原子结构1. 原子的组成原子是由质子、中子和电子组成的。
质子和中子位于原子核中,电子围绕原子核运动。
2. 元素的原子序数和质量数原子序数表示元素的质子数,而质量数表示元素的质子数和中子数之和。
原子序数决定了元素的化学性质,而质量数决定了元素的同位素。
3. 电子结构原子的电子结构决定了元素的化学性质。
电子在原子内的分布遵循一定的规律,即电子遵循能级分布,并且填充规律是按照“2-8-18-32”规则进行填充。
二、元素周期表1. 周期表的性质元素周期表是根据元素的化学性质和原子结构而排列的。
周期表中的元素按照原子序数排列,具有周期性。
2. 元素的周期性规律元素周期表中的元素具有周期性规律,即元素的周期表现出周期性变化。
这种周期性变化可以通过元素的原子结构和电子的排布规律来解释。
三、化学键1. 化学键的形成化学键是由原子之间的相互作用形成的。
化学键的形成使得原子之间形成更加稳定的结构,从而形成化合物。
2. 化学键的类型化学键主要包括离子键、共价键和金属键。
离子键是正负离子之间的电荷吸引力,共价键是原子间电子的共享,金属键是金属原子之间的电子云共享。
3. 极性与非极性化学键化学键可以分为极性和非极性两种。
极性化学键是由于原子电负性差距所产生的电荷分布不均匀的现象,而非极性化学键则是由于原子电负性相等而产生的电荷分布均匀的现象。
四、晶体结构1. 晶体结构的定义晶体结构是指晶体中原子、离子或者分子的排列规律和空间结构。
不同的元素或化合物在晶体中具有不同的晶体结构。
2. 晶体结构的分类晶体结构主要可以分为离子晶体、共价分子晶体和金属晶体。
离子晶体是由正负离子通过离子键结合而形成的,共价分子晶体是由共价键结合而形成的,而金属晶体则是由金属键结合而形成的。
五、酸碱性质1. 酸碱的定义酸是指能够释放出H+离子的物质,而碱则是指能够释放出OH-离子的物质。
酸碱的定义主要有布朗斯特德理论和劳里亚-布隆斯特德理论。


无机化合物的结构特点无机化合物是由无机元素组成的化合物,其结构特点对于理解和应用无机化学具有重要意义。
本文将介绍无机化合物的结构特点,包括晶体结构、配位数、键长和键角等方面。
晶体结构晶体结构是无机化合物中最基本的结构特点之一。
晶体是由原子、离子或分子按照一定的规则排列而成的固体。
根据晶体中原子、离子或分子的排列方式,可以将晶体分为离子晶体、共价晶体和金属晶体等不同类型。
离子晶体是由正负离子通过离子键相互吸引而形成的晶体。
典型的离子晶体包括氯化钠、氧化铝等。
在离子晶体中,正负离子按照一定比例排列,形成紧密有序的结构。
离子晶体的结构稳定,具有高熔点和良好的导电性。
共价晶体是由共价键连接起来的原子或分子组成的晶体。
典型的共价晶体包括二氧化硅、硫化碳等。
在共价晶体中,原子或分子通过共用电子形成共价键,形成稳定的晶体结构。
共价晶体的结构多样,具有较低的熔点和较差的导电性。
金属晶体是由金属原子通过金属键相互吸引而形成的晶体。
典型的金属晶体包括铁、铜等。
在金属晶体中,金属原子通过电子云形成金属键,形成紧密堆积的结构。
金属晶体具有良好的导电性和延展性。
配位数配位数是指一个中心离子周围配位体的个数。
在无机化合物中,配位数对于化合物的性质和反应具有重要影响。
常见的配位数包括2、4、6等。
例如,四氯化钛(TiCl4)中,钛离子与四个氯离子形成四个配位键,配位数为4。
六水合硫酸铜(CuSO4·6H2O)中,铜离子与六个水分子形成六个配位键,配位数为6。
配位数的大小与中心离子的电荷、半径以及配位体的大小和电荷等因素有关。
不同的配位数会导致化合物的结构和性质的差异。
键长和键角键长和键角是无机化合物中分子或离子之间相互作用的重要参数。
它们决定了化合物的空间结构和化学性质。
键长是指两个原子之间共价键的距离。
在无机化合物中,不同类型的键具有不同的键长。
例如,单键的键长通常较长,双键的键长较短,三键的键长更短。
键长的大小与原子半径、电荷以及化学环境等因素有关。

无机化学公式总结1. 离子式无机化学研究中,离子式是一种简洁而重要的表示化学物质组成的方法。
离子式由正离子和负离子组成,它们通过电荷的吸引作用结合在一起。
下面是一些常见的离子及其化学式:•氢离子:H⁺•氧离子:O²⁻•水合离子:[M(H₂O)n]^m⁺(M为金属离子,n为水和离子结合的个数,m为电荷)2. 酸碱反应酸碱反应是无机化学中常见的反应类型,涉及到酸和碱之间的中和反应。
常见的酸和碱的化学式及反应方程式如下:•盐酸:HCl硫酸:H₂SO₄硝酸:HNO₃醋酸:CH₃COOH•氢氧化钠:NaOH氢氧化钾:KOH氢氧化铵:NH₄OH酸碱反应的一般化学方程式如下:酸 + 碱→ 盐 + 水例如:HCl + NaOH → NaCl + H₂O3. 氧化还原反应氧化还原反应是无机化学中重要且常见的反应类型。
在氧化还原反应中,电子的转移是关键步骤。
以下是一些常见的氧化还原反应及其化学式:•氧化反应:2Na + Cl₂ → 2NaCl•还原反应:PbO₂ + 4H⁺ + SO₃²⁻ → Pb²⁺ + H₂O + SO₄²⁻4. 配位化合物配位化合物是由中心金属离子与周围配体形成配位键而构成的化合物。
以下是一些常见的配位化合物及其化学式:•菌胺:[Cu(NH₃)₄]²⁺铁氰化物:[Fe(CN)₆]⁴⁻硝酸铜:[Cu(NO₃)₄]²⁻配位化合物的常见表示法是使用配位数表示。
5. 晶体结构无机化合物中的晶体结构对于了解化合物的性质和行为至关重要。
以下是一些常见的晶体结构:•立方晶系:–体心立方晶格–面心立方晶格•矩阵晶系:–简单六方晶格–单斜晶格6. 氢键氢键是无机化学中一种重要的相互作用力。
氢键是通过氢原子与电负性较高的原子之间的相互作用形成的。
以下是一些常见的氢键:•水中氢键:H₂O···H₂O•醇中氢键:R-O-H···H-O-R•酮中氢键:R₂C=O···H₂C=O-R₂7. 晶体生长晶体生长是无机化学中的一个重要研究领域。

无机化学知识点总结一、无机化学的基本原理1. 原子结构与元素周期表原子是物质的基本单位,由原子核和绕核电子组成。
原子核由质子和中子组成,质子数决定了元素的原子序数,即元素周期表中的元素编号。
而电子的排布决定了元素的化学性质。
元素周期表是基于元素的原子序数和化学性质进行排列的,它反映了元素的周期性规律和趋势。
2. 化学键与晶体结构化学键是原子之间的相互作用力。
根据原子之间的电子共享或转移,化学键可以分为共价键、离子键和金属键。
共价键是通过电子共享形成的,离子键是通过电子转移形成的,金属键是金属原子内的电子云相互重叠形成的。
这些化学键形成了物质的晶体结构,晶体结构的类型决定了物质的性质。
3. 反应平衡与化学反应化学反应是物质之间发生化学变化的过程,通常包括物质的生成和消耗。
化学反应通过反应方程式进行描述,反应平衡是指反应物和生成物的摩尔比在一定条件下保持不变的状态。
化学反应的平衡常数和动力学速率是化学反应研究的重要参数。
4. 配位化学与过渡金属化合物过渡金属化合物是指含有过渡金属元素的化合物,其中过渡金属离子通过配位基与配位子形成配合物。
配位化学研究了配位物的结构、性质和合成方法,配位物的稳定性、配位数、立体化学等是配位化学的重要内容。
二、无机化学的主要知识点1. 主族元素化合物主族元素是元素周期表中的ⅢA、ⅣA、ⅤA、ⅥA和ⅦA族元素,它们可形成氧化物、氢化物、卤化物等化合物。
主族元素的化合物具有多种性质,如ⅢA族元素具有氧化性,ⅣA族元素具有还原性等。
2. 离子化合物离子化合物是由阳离子和阴离子组成的化合物,它们通常具有良好的溶解度、导电性和晶体结构。
离子化合物的性质和结构与其离子的大小、电荷和架构有关。
3. 氧化还原反应氧化还原反应是指物质失去或获得电子,从而使氧化态发生变化的化学反应。
氧化还原反应包括氧化、还原、氧化剂和还原剂等概念,它们是化学反应中的重要参与者。
4. 配合物化学过渡金属离子通过配体与配位子形成配合物,配合物具有不同的结构、性质和应用。


大学无机化学知识点总结
一、原子结构和元素周期律
1. 原子结构概述:原子的组成、原子核和电子的性质。
2. 元素周期律:周期表的组成、周期和族的特点。
二、化学键和化合价
1. 化学键:离子键、共价键和金属键的概念和特点。
2. 化合价:原子的单、双、三、四价以及过渡元素的化合价。
三、晶体结构和晶格常数
1. 晶体结构:离子晶体和共价晶体的结构特点。
2. 晶格常数:晶体的晶胞、晶格常数和晶面的表示方法。
四、溶液与溶解度
1. 溶液的概念和组成:溶剂和溶质的概念。
2. 溶解度:溶解度与温度、压力和溶剂种类的关系。
五、配位化合物
1. 配位数和配位键的概念。
2. 配位化合物的命名规则和结构特点。
六、酸碱理论
1. 酸和碱的定义和性质。
2. 酸碱中和反应和酸碱指示剂的使用。
七、化学反应和化学平衡
1. 化学反应的速率和平衡状态。
2. 化学平衡的平衡常数和影响平衡的因素。
八、电化学
1. 电解和电解质的概念。
2. 电池的构成和电动势的计算。
以上是大学无机化学的主要知识点总结,希望对您有所帮助。
如需了解更多详细内容,请参考相关教材或课程资料。

无机化学相关理论知识梳理无机化学是研究无机物质的组成、结构、性质、合成和反应的科学分支。
它对于我们理解自然界以及在材料科学、环境科学、能源技术等领域的应用具有重要意义。
本文将对无机化学的相关理论知识进行梳理,包括元素周期表、化学键、晶体结构、配位化学等。
一、元素周期表元素周期表是无机化学的基础工具之一,它按照元素的原子编号和电子组态,将元素有序排列。
首先是氢和氦两个元素,然后是周期表中的18个周期和7个主族元素。
周期表可以帮助我们了解元素的周期性规律和元素间的相似性。
例如,同一周期元素的化学性质相似,而同一主族元素的化学性质更加相似。
二、化学键化学键是指原子间的相互作用力,可以通过损失、获得或共享电子来形成。
常见的化学键包括离子键、共价键和金属键。
离子键是由正离子和负离子之间的静电引力所形成的,如氯化钠中的钠离子和氯离子。
共价键是由电子对的共享而形成的,如氧气中的两个氧原子之间的键。
金属键是在金属中形成的,由金属原子的海洋电子共享而形成。
三、晶体结构晶体是一种有序排列的原子、离子或分子的固体物质。
它们的结构可以通过X射线衍射等方法进行研究。
晶体结构的基本单位是晶胞,晶胞可以通过平移、转动或反射来填充整个晶体。
常见的晶体结构包括离子晶体结构、共价晶体结构和金属晶体结构。
不同的晶体结构决定了不同的物理和化学性质。
四、配位化学配位化学研究的是配位化合物中配位体与中心离子之间的相互作用。
在配位化合物中,配位体通过配位键与中心离子结合,形成配位化合物。
常见的配位键包括配位体的配位键和配位体的配位键。
配位体的配位键是通过配体与中心离子之间的电子对捐赠和接受来形成的。
配位体的配位键是通过配体与中心离子之间的电子对捐赠和接受来形成的。
配合物的性质和结构可以通过配位数、配位杂化和配合物的几何构型来描述。
总结:无机化学的理论知识包括元素周期表、化学键、晶体结构和配位化学等。
元素周期表帮助我们了解元素的周期性规律和相似性。
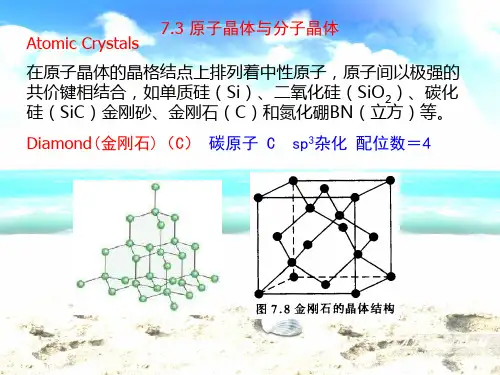
晶体结构1.分类分子晶体:分子之间以分子间作用力结合成的晶体成为分子晶体。
分子间作用力分子间作用力是一种弱相互作用,远小于化学键的结合强度。
离子晶体:由阴阳离子通过离子键结合成的晶体称为离子晶体。
离子键:阴阳离子间的静电引力叫做离子键。
特点:没有方向性;没有饱和性。
金属晶体:金属离子或原子之间以金属键结合成的晶体成为金属晶体。
原子晶体:原子之间以共价键结合成的晶体称为原子晶体。
混合晶体:一些固体但追和化合物是由共价键和其他结合方式形成的过渡性晶体,称为混合晶体。
分子晶体与分子间作用力1.分子的极性极性共价键:在共价键中,若成键原子的元素电负性之差不为零,这种共价键称为极性共价键。
非极性共价键:在共价键中,若成键原子的元素电负性之差为零,这种共价键称为非极性共价键。
极性分子:成键原子的电负性不同,对共用电子对的吸引力不同,使分子中电子云分布不均匀,整个分子的正电荷重心与负电荷重心不重合,形成正负两极,这种分子叫极性分子,分子中的键是极性共价键。
非极性分子:成键原子的电负性相同,对共用电子对的吸引力相同,分子中电子云分布均匀,整个分子的正电荷重心与负电荷重心重合,这种分子叫非极性分子,分子中的键是非极性共价键。
键的极性与电负性差有关,两个原子的电负性差值越大,键的极性越大。
分子的极性不仅与键的极性有关,而且与分子的空间构型有关。
对于双原子分子而言,键的极性影响分子的极性;对于多原子分子而言,分子的极性不仅键的极性有关,而且与分子的空间构型有关,分子的空间构型有时会导致分子的正、负电荷重心重合,使键的极性抵消;如NH 3(分子的空间构型为三角锥形,不可抵消)和BF 3(分子的空间构型为平面三角形,可抵消)。
分子的极性大小用偶极距μ来衡量,与正负电荷重心之间的距离——偶极长d 、正负电荷重心的电荷量q 有关, 分子偶极距定义为分子的偶极长与偶极一端的电荷量的成绩,即:d q ⋅=μ。
偶极距的国际单位制为C·m (库伦·米) 化学键的极性也可以用键的偶极距衡量,分子中各个化学键的偶极距的矢量和等于分子的偶极距。