干细胞基础知识
- 格式:doc
- 大小:60.00 KB
- 文档页数:10


干细胞的基础知识干细胞的基础知识干细胞的概念干细胞是一类具有自我更新和分化潜能的细胞。
它包括胚胎干细胞和成体干细胞。
干细胞的发育受多种内在机制和微环境因素的影响。
目前人类胚胎干细胞已可成功地在体外培养。
最新研究发现,成体干细胞可以横向分化为其他类型的细胞和组织,为干细胞的广泛应用提供了基础。
在胚胎的发生发育中,单个受精卵可以分裂发育为多细胞的组织或器官。
在成年动物中,正常的生理代谢或病理损伤也会引起组织或器官的修复再生。
胚胎的分化形成和成年组织的再生是干细胞进一步分化的结果。
胚胎干细胞是全能的,具有分化为几乎全部组织和器官的能力。
而成年组织或器官内的干细胞一般认为具有组织特异性,只能分化成特定的细胞或组织。
然而,这个观点目前受到了挑战。
最新的研究表明,组织特异性干细胞同样具有分化成其他细胞或组织的潜能,这为干细胞的应用开创了更广泛的空间。
干细胞具有自我更新能力(Self-renewing),能够产生高度分化的功能细胞。
干细胞按照生存阶段分为胚胎干细胞和成体干细胞。
1.1 胚胎干细胞胚胎干细胞(Embryonic Stem cell, ES细胞)当受精卵分裂发育成囊胚时,内层细胞团(Inner Cell Mass)的细胞即为胚胎干细胞。
胚胎干细胞具有全能性,可以自我更新并具有分化为体内所有组织的能力。
早在1970年Martin Evans已从小鼠中分离出胚胎干细胞并在体外进行培养。
而人的胚胎干细胞的体外培养直到最近才获得成功。
进一步说,胚胎干细胞(ES细胞)是一种高度未分化细胞。
它具有发育的全能性,能分化出成体动物的所有组织和器官,包括生殖细胞。
研究和利用ES细胞是当前生物工程领域的核心问题之一。
ES细胞的研究可追溯到上世纪五十年代,由于畸胎瘤干细胞(EC细胞)的发现开始了ES细胞的生物学研究历程。
目前许多研究工作都是以小鼠ES细胞为研究对象展开的,如:德美医学小组在去年成功的向试验鼠体内移植了由ES细胞培养出的神经胶质细胞。

造血干细胞移植适应症造血干细胞移植迄今仍然是一种高风险治疗方法,目前主要用于恶性血液疾病的治疗,也试用于非恶性疾病和非血液系统疾病,如重症难治自身免疫性疾病和实体瘤等。
〔1〕血液系统恶性肿瘤:慢性粒细胞白血病、急性髓细胞白血病、急性淋巴细胞白血病、非霍奇金淋巴瘤、霍奇金淋巴瘤、多发性骨髓瘤、骨髓增生异常综合征等。
〔2〕血液系统非恶性肿瘤:再生障碍性贫血、可尼贫血、地中海贫血、镰状细胞贫血、骨髓纤维化、重型阵发性睡眠性血红蛋白尿症、无巨核细胞性血小板减少症等。
〔3〕其它实体瘤:乳腺癌、卵巢癌、睾丸癌、神经母细胞瘤、小细胞肺癌等。
〔4〕免疫系统疾病:重症联合免疫缺陷症、严重自身免疫性疾病。
由于移植存在致命性合并症,因而非血液系统疾病的造血干细胞移植治疗还未被广泛承受。
分类〔1〕按照采集造血干细胞的来源不同分为:骨髓移植、脐血移植、外周血造血干细胞移植等。
〔2〕按照供体与受体的关系分为:自体骨髓移植/脐血移植/外周血造血干细胞移植、异体骨髓移植/脐血移植/外周血造血干细胞移植。
异体移植又称异基因移植,当供者是同卵双生供者时,又称同基因移植。
〔3〕根据供者与受者HLA配型相合程度,异体骨髓移植/脐血移植/外周血造血干细胞移植分为:HLA全相合移植、不全相合移植、单倍体相合移植。
〔4〕根据供者与受者的血缘关系分为:血缘相关移植、非血缘移植即骨髓库来源供者。
〔5〕根据移植前的预处理方案强度可分为:清髓性造血干细胞移植和非清髓性造血干细胞移植〔减低预处理剂量的造血干细胞移植〕。
一般根据患者的疾病种类、疾病状态及预后、HLA配型结果及供者年龄等因素综合考虑来选择造血干细胞移植方式。
目前异基因造血干细胞移植绝大多数为配型一样的同胞间、半相合父母与子女间、不全相合同胞间的移植,而随着全世界及我国骨髓库的增加,非血缘供者的异基因造血干细胞移植数量也在不断增加。
不同移植类型各自优劣不同,自体造血干细胞移植的优点在于不受供者的限制,移植后不发生移植物抗宿主病,不需要使用免疫抑制剂,严重并发症较少,费用较低,缺点是复发率高。
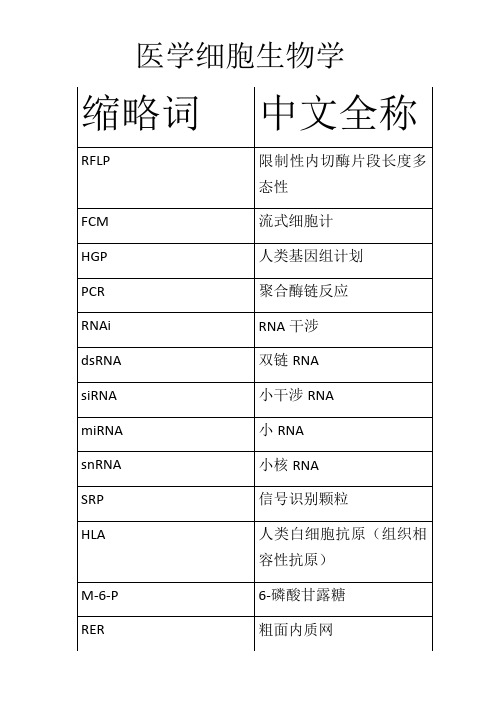
医学细胞生物学名词解释1、医学细胞生物学:医学细胞生物学是运用细胞生物学的理论和方法研究人体细胞的形态结构与功能等生命活动规律和人类疾病发生、发展及其防治的科学,时现代医学新的前沿学科,也是一门重要的基础学科。
P-12、干细胞:干细胞即起源细胞,是存在于人或动物个体发育各个阶段的组织器官中的一类未分化的、具有自我更新、高度增殖和多向分化潜能的细胞。
P-2623、真核细胞:真核细胞是由原核细胞进化而来的。
自然界中由真核细胞构成的生物称为真核生物。
真核细胞进化程度高,其结构比原核细胞更为复杂,细胞内为细胞核和细胞质两大部分。
在真核细胞之中还出现了一些具有特定结构和功能的细胞器。
P-294、原核细胞:原核细胞结构简单,仅由细胞膜包被,细胞内原生质也少分化,没有核膜,遗传物质分散在细胞质中。
在细胞膜之外有一坚韧的细胞壁。
自然界中原核细胞构成的生物成为原核生物p-285、生物大分子:细胞的大分子物质是由有机小分子聚合而成,主要包括核酸、蛋白质(生命大分子)和多糖。
其分子结构较为复杂,在细胞内执行各自他特定的功能6、蛋白质组学:一种基因组所表达的全套蛋白质。
7、单位膜:在横切面上表现为内外两层为电子密度高的暗线,中间夹一层电子密度低的明线,暗层约2nm 明层约3.5nm,膜全层厚约为7.5nm,这种“两暗夹一明”的结构被称为单位膜p-418、初级溶酶体:初级溶酶体是指由高尔基体以出芽形成的内含多种水解酶,但不含作用底物,酶无活性的小体p-99保持溶酶体的最适环境pH为5.09、次级溶酶体:是指由初级溶酶体与含底物的小泡融合而成的,含有活动性的水解酶和消化代谢产物的溶酶体,又称之为活动性溶酶体。
P -9910、氨基酸:蛋白质合成的亚单位,属两性电解质。
每一个氨基酸由一个碱性的氨基(—NH2)和一酸性的羧基(—COOH),以及结构不同的侧链(---R)。
11、蛋白质的四级结构:1.蛋白质的一级结构是指一条或几条多肽链中氨基酸的种类、数量和排列顺序。

干细胞基础知识-概述说明以及解释1.引言1.1 概述干细胞是一种具有自我更新和分化潜能的特殊细胞,具有重要的研究和应用价值。
干细胞可以分为胚胎干细胞和成体干细胞两种类型,它们在生物医学领域有着广泛的应用前景,可以用于再生医学、组织工程、药物筛选等领域。
本文将介绍干细胞的基本概念、分类和应用,希望能够为读者提供一些基础知识,并展望干细胞在未来的发展前景。
1.2 文章结构文章结构部分将主要包括引言、正文和结论三部分。
在引言部分,我们将概述干细胞的基础知识,并介绍本文的结构和目的。
在正文部分,我们将详细探讨干细胞的概念、分类和应用。
最后,在结论部分,将总结本文涉及的干细胞基础知识,展望未来的发展方向,并结束文章。
整个文章结构将围绕干细胞这一主题展开,希望能为读者提供全面、系统的干细胞知识。
1.3 目的:本文旨在介绍干细胞的基础知识,包括干细胞的概念、分类和应用等内容。
通过对干细胞的全面了解,读者可以更好地理解干细胞在生物学和医学领域的重要性,以及其潜在的应用价值。
同时,本文也旨在引发读者对干细胞研究和应用领域的兴趣,促进该领域的进一步探索和发展。
希望通过本文的阐述,读者能够对干细胞有一个清晰的认识,为未来的学习和研究打下基础。
2.正文2.1 干细胞概念:干细胞是一类具有自我更新和分化潜能的细胞,其主要特点是能够不断地进行细胞分裂产生新的干细胞,同时也可以分化为不同类型的细胞,如神经细胞、肌肉细胞、血细胞等。
干细胞在人体内起着重要的生物学作用,是维持组织器官功能和修复损伤的关键细胞之一。
根据其分化潜能和来源不同,干细胞可以分为多种类型,主要包括胚胎干细胞(ESCs)和成体干细胞(Adult stem cells)。
胚胎干细胞来源于早期胚胎,具有最广泛的分化潜能,可以分化为任何细胞类型;而成体干细胞则存在于成人组织中,其分化潜能较低,但具有自我更新和分化成多种细胞类型的能力。
此外,还有诱导多能性干细胞(iPSCs),是通过基因工程技术将成体细胞重新编程成具有胚胎干细胞样特性的细胞。


造血干细胞移植造血干细胞移植迄今仍然是一种高风险治疗方法,目前主要用于恶性血液疾病的治疗,也试用于非恶性疾病和非血液系统疾病,如重症难治自身免疫性疾病和实体瘤等。
(1)血液系统恶性肿瘤:慢性粒细胞白血病、急性髓细胞白血病、急性淋巴细胞白血病、非霍奇金淋巴瘤、霍奇金淋巴瘤、多发性骨髓瘤、骨髓增生异常综合征等。
(2)血液系统非恶性肿瘤:再生障碍性贫血、范可尼贫血、地中海贫血、镰状细胞贫血、骨髓纤维化、重型阵发性睡眠性血红蛋白尿症、无巨核细胞性血小板减少症等。
(3)其它实体瘤:乳腺癌、卵巢癌、睾丸癌、神经母细胞瘤、小细胞肺癌等。
(4)免疫系统疾病:重症联合免疫缺陷症、严重自身免疫性疾病。
由于移植存在致命性合并症,因而非血液系统疾病的造血干细胞移植治疗还未被广泛接受。
分类(1)按照采集造血干细胞的来源不同分为:骨髓移植、脐血移植、外周血造血干细胞移植等。
(2)按照供体与受体的关系分为:自体骨髓移植/脐血移植/外周血造血干细胞移植、异体骨髓移植/脐血移植/外周血造血干细胞移植。
异体移植又称异基因移植,当供者是同卵双生供者时,又称同基因移植。
(3)根据供者与受者HLA配型相合程度,异体骨髓移植/脐血移植/外周血造血干细胞移植分为:HLA全相合移植、不全相合移植、单倍体相合移植。
(4)根据供者与受者的血缘关系分为:血缘相关移植、非血缘移植即骨髓库来源供者。
(5)根据移植前的预处理方案强度可分为:清髓性造血干细胞移植和非清髓性造血干细胞移植(减低预处理剂量的造血干细胞移植)。
一般根据患者的疾病种类、疾病状态及预后、HLA配型结果及供者年龄等因素综合考虑来选择造血干细胞移植方式。
目前异基因造血干细胞移植绝大多数为配型相同的同胞间、半相合父母与子女间、不全相合同胞间的移植,而随着全世界及我国骨髓库的增加,非血缘供者的异基因造血干细胞移植数量也在不断增加。
不同移植类型各自优劣不同,自体造血干细胞移植的优点在于不受供者的限制,移植后不发生移植物抗宿主病,不需要使用免疫抑制剂,严重并发症较少,费用较低,缺点是复发率高。

干细胞技术在组织工程修复中的应用前景一、干细胞技术的基础知识和原理干细胞是指具有自我更新和多向分化能力的一类细胞,可以分为胚胎干细胞和成体干细胞两种类型。
胚胎干细胞来源于早期胚胎的内细胞团,具有多向分化潜能,可以分化为多种不同类型的细胞。
成体干细胞分布在成体组织中,具有较弱的分化潜能,但仍能分化为特定类型的细胞。
二、干细胞技术在组织工程修复中的应用1. 干细胞在组织工程中的制备和扩增在组织工程修复中,干细胞的制备和扩增是非常重要的环节。
干细胞可以通过胚胎培养和体外诱导分化的方式获得。
胚胎培养是指从早期的胚胎中分离出干细胞并进行培养和扩增,以获取更多的干细胞。
体外诱导分化则是将成体细胞重新编程为干细胞,再进行扩增。
2. 干细胞在组织工程修复中的定植和分化干细胞定植是指将制备好的干细胞移植到受损组织中,进行组织修复和再生。
干细胞的定植可以采用直接注射、人工支架培养和3D打印等方式。
在定植后,干细胞会通过分化为目标组织所需的细胞类型来进行组织修复。
例如,将干细胞定植到骨骼组织中,它们会分化为骨细胞,并促进骨骼的生长和修复。
3. 干细胞在组织工程修复中的生物材料和因子模拟为了提高干细胞在组织工程中的修复效果,研究人员结合了生物材料和生长因子的应用。
生物材料可以提供支撑和定向导向作用,帮助干细胞定植和分化。
生长因子可以模拟体内的信号分子,促进干细胞的增殖和分化。
通过将生物材料和生长因子与干细胞相结合,可以在组织工程修复中获得更好的效果。
三、干细胞技术在组织工程修复中的应用前景干细胞技术在组织工程修复中具有广阔的应用前景。
首先,干细胞具有自我更新和多向分化能力,可以成为组织修复的理想来源。
其次,干细胞可以定植到损伤组织中并分化为目标组织所需的细胞类型,实现组织修复和再生。
再次,干细胞可以与生物材料和生长因子相结合,提高组织修复的效果。
最后,干细胞技术可以应用于多种组织的修复,如骨骼、皮肤、神经和心血管等。
然而,干细胞技术在组织工程修复中还面临一些挑战和问题。

干细胞基础必学知识点
1. 干细胞的定义:干细胞是具有自我更新和分化能力的未分化细胞。
2. 干细胞的分类:根据来源不同可以分为胚胎干细胞和成体干细胞;根据分化潜能不同可以分为多能干细胞和单能干细胞。
3. 胚胎干细胞:来源于早期胚胎的内细胞团,在适当培养条件下可以分化为各种不同细胞类型。
4. 成体干细胞:存在于成体组织和器官中的未分化细胞,有限的自我更新和分化能力。
5. 多能干细胞:可以分化成三个胚层(内胚层、外胚层和中胚层)中的细胞,具有最大的分化潜能。
6. 单能干细胞:只能分化成特定细胞类型的干细胞,如造血干细胞只能分化为血细胞。
7. 干细胞的应用:干细胞疗法可以用于治疗多种疾病和损伤,如心脏病、脑损伤、骨折等。
8. 干细胞的研究挑战:干细胞研究面临伦理道德问题、有效分化和成熟、免疫排斥等挑战。
9. 干细胞疗法的风险:干细胞疗法可能存在治疗效果不明确、细胞突变和癌症转化等风险。
10. 干细胞的伦理问题:胚胎干细胞的获取和使用涉及胚胎捐赠、胚胎破坏等伦理道德问题,需要合理的伦理框架和监管机制。

乌克兰干细胞百问百答第一部分:干细胞基础知识1.什么是干细胞?答:干细胞是能够长期存活,具有不断的自我繁殖能力和多向化潜能,能分化发育成血液、肌肉、神经、心脏等不同组织和器官,是形成人体各种组织器官的原始细胞。
2.干细胞有哪些种类?答:根据个体分化潜能,干细胞分为全能干细胞,多能干细胞和单能干细胞根据发育状态,干细胞分为胚胎干细胞和成体干细胞。
3.什么是全能干细胞?答:全能干细胞具有形成完整个体的分化潜能,如胚胎干细胞。
人类的全能干细胞可以分化成人体的各种细胞,这些分化出的细胞构成人体的各种组织和器官。
4.什么是多能干细胞?答:多能干细胞具有分化出多种细胞组织的潜能。
如造血干细胞,它是一切血细胞的原始细胞,可以分化成血液中的红细胞、白细胞、血小板等,但是不能分化成为血细胞以外的其他细胞。
5.什么是单能干细胞?答:单能干细胞是只能向一种或两种密切相关的细胞类型分化的。
如脂肪干细胞,肌肉中的成肌干细胞。
6.什么是胚胎干细胞?答:人类胚胎干细胞是人类个体发育的起始细胞。
胚胎干细胞是早期胚胎中分离出来的一类细胞,它具有发育的全能性,能分化出人体的所有组织和器官。
事实上,胚胎干细胞可变成各种各样的成体干细胞,再分化成我们要的细胞。
7.胚胎是怎样形成与发育的?答:我们都知道,一个人的个体发育是由受精卵开始的。
由妈妈那里来的卵子和从爸爸那里来的精子结合后,形成一个受精卵。
受精卵一分二、二分四,以几何级数倍增,并且不断地分化、迁移,最终形成一个新的个体。
8.什么是成体干细胞?答:成体干细胞是指存在于一种已经分化组织中的未分化细胞,这种细胞能够自我更新但只能形成该类型组织的细胞。
我们的许多组织和器官,比如表皮和造血系统,具有修复和再生的能力。
9.成体干细胞的来源有哪些?答:成年人身上也有干细胞,分布于骨髓、血液、大脑、胰腺、骨骼肌、牙髓等处,其中最丰富的是骨髓和血液中的造血干细胞。
但是,与胚胎干细胞相比,成年干细胞非常稀少,难以分离和纯化。

干细胞基础知识及临床应用
1、基础知识
干细胞(stem cell,SC)的“干”,译自英文“stem”,意为“茎干”、“干”和“起源”。
干细胞群的功能即为控制和维持细胞的再生。
一般来说,在干细胞和其终末分化的子代细胞之间存在着被称为“定向祖细胞”的中间祖细胞群,它们具有有限的扩增能力和限制性分化潜能。
这些细胞群的功能是增加干细胞每次分裂后产生的分化细胞的数量。
干细胞具有自我更新的能力,但是干细胞的分裂实际上是相对不对称的。
2、临床应用
干细胞研究受到科学家和世人的广泛关注有其必然性,干细胞在生命科学的细胞修复、发育生物学、药物学等领域有着极为广阔的应用前景。
1、作为细胞治疗与组织器官替代治疗的种子细胞
2、探讨胚胎发育的调控机制
3、作为疾病基因治疗的载体
4、体外整合外源基因,研究基因功能
5、药物筛选平台的建立,药理研究与新药开发。

细胞基础知识一、人体的构成细胞是构成人体的最基本单位。
无数个细胞结合起来就构成了人体上的四种基本组织:上皮组织、结缔组织、肌肉组织和神经组织。
四种基本组织的不同配合,构成了人体的种种器官,每种器官都有自己特定的形状和功能。
一个器官只能完成一定的功能,许多器官结合起来完成某一方面的全套功能,就构成了系统。
人体共有8个系统,即:消化系统、神经系统、呼吸系统、循环系统、运动系统、内分泌系统、泌尿系统和生殖系统细胞——组织——器官——系统——人体细胞——构成人体的基本单位,人体是由细胞构成的!二、细胞细胞(英文:Cell)是一切生物体结构和功能的基本单位。
它是除了病毒之外所有具有完整生命力的生物的最小单位,也经常被称为生命的积木。
已知除病毒之外的所有生物均由细胞所组成,但病毒生命活动也必须在细胞中才能体现。
一般来说,细菌等绝大部分微生物以及原生动物由一个细胞组成,即单细胞生物;高等植物与高等动物则是多细胞生物。
细胞可分为两类:原核细胞、真核细胞。
研究细胞的学科称为细胞生物学。
按照常规的组织学分类方法,脊椎动物和人体细胞类型约有200余种。
这些细胞在人体中呈现有序的空间分布。
细胞是人体的结构和功能单位。
共约有40万--60万亿个,细胞的平均直径在10--20微米之间。
除成熟的红血球外,所有细胞都有一个细胞核,是调节细胞作用的中心。
最大的是成熟的卵细胞,直径在0.1毫米以上;最小的是血小板,直径只有约2微米。
而175000个精子细胞才抵得上一个卵细胞的重量。
肠粘膜细胞的寿命为3天,肝细胞寿命为500天,而脑与骨髓里的神经细胞的寿命有几十年,同人体寿命几乎相等。
血液中的白细胞有的只能活几小时。
三、干细胞(stem cells,SC)干细胞(stem cells,SC)即为起源细胞。
简单来讲,它是一类具有多向分化潜能和自我复制能力的原始的未分化细胞,是形成哺乳类动物的各组织器官的原始细胞,医学界称为“万用细胞”。
干细胞概述干细胞的定义干细胞(Stem cell,SC)是一类具有自我更新(self-renewing)能力的多潜能细胞,即干细胞保持未定向分化状态和具有增殖能力,在合适的条件或给予合适的信号,它可以分化成多种功能细胞或组织器官,医学界称其为“万用细胞”,也有人通俗而形象地称其为“干什么都行的细胞”。
干细胞来源于胚胎、胎儿组织和成年组织。
来自胚胎和胎儿组织的胚胎干细胞具有多潜能分化特性,可分化为成熟个体体内几乎全部200多种以上的成熟细胞类型。
而成年个体组织来源的成体干细胞(adult stem cell)有造血干细胞、神经干细胞和胰腺干细胞等。
人类很多疾病诸如心肌梗塞、糖尿病、帕金森病等,均涉及细胞(如脑细胞、心肌细胞、胰岛细胞)的死亡。
干细胞技术最显著的作用就是:能再造一种全新的、正常的甚至更年轻的细胞、组织或器官,用以治疗诸如脑瘫、中风、白血病、心肌梗塞、糖尿病、帕金森氏病等多种用传统方法难以治愈的疾病,具有不可估量的医学价值,给人们带来了希望。
干细胞的分类干细胞具有自我更新(self-renewing)的能力,在一定条件下下,它可以分化成各种功能细胞。
按分化潜能的大小,干细胞基本上可分为以下三种类型。
(1)全能性干细胞(Totipotent stem cells) 它具有形成完整个体的分化潜能。
如胚胎干细胞(Embryonic stem cells,ESC),具有与早期胚胎细胞相似的形态特征和很强的分化能力,可以无限增殖并分化成为全身200多种细胞类型,进一步形成机体的所有组织、器官。
(2)多能性干细胞(Pluripotent stem cells) 这种干细胞具有分化出多种组织细胞的潜能,但却失去了发育成完整个体的能力,发育潜能受到一定的限制。
骨髓多能造血干细胞是典型的例子,它可分化出至少12种血细胞,但不能分化出造血系统以外的其它细胞。
(3)单能干细胞也称专能或偏能干细胞(Unipotent stem cells)。
这类干细胞只能向一种类型或密切相关的两种类型的细胞分化,如上皮组织基底层的干细胞、肌肉中的成肌细胞或叫卫星细胞。
从干细胞到成熟细胞有许多分化阶段:最原始的干细胞是全能性干细胞,具有自我更新和分化为任何类型组织的能力。
迄今为止,只在受精卵才符合这样的定义,囊胚期的胚胎干细胞是否具有全能性仍存在很大争议。
分化方向已确定的干细胞叫做多能干细胞,它们将分化为特定的组织,例如造血干细胞将分化为血细胞,肝脏干细胞将分化为肝细胞。
这些多能干细胞继续向前分化则成为定向祖细胞(Committed progenitor)。
持续停留在某种组织中的干细胞被称为组织特异性干细胞,如造血干细胞(Hematopoietic stem cell,HSC)、肌肉干细胞、表皮层干细胞等都属于此类。
随着机体的发育,干细胞逐渐分化为特定类型并行使特定功能。
很多成年人组织含有干细胞,当组织受到外伤、老化、疾病等的损伤时,这些细胞就增殖分化。
产生新的组织来代替它们,以保持机体的稳态平衡。
干细胞是一类特殊的细胞,它们最显著的生物学特性是既具有自我更新的能力(Self-renewal),又具有多向分化的潜能(Multilineage differentiation)。
根据其组织发生的名称亦可进行分类。
目前,已经从许多组织或器官中成功地分离出干细胞,其中包括:胚胎干细胞、造血干细胞、骨髓间质干细胞(Mesenchymal stem cell,MSCs)、神经干细胞(Neural stem cell,NSCs)、肌肉干细胞(Muscle stem cell)、成骨干细胞(Osteogenic stem cell)、内胚层干细胞(Endodermal stem cell)、视网膜干细胞(Retinal stem cell)、胰腺干细胞等。
而随着干细胞研究的进展和深入,一些命名的含义将会更加丰富。
干细胞特征在细胞分化的过程中,细胞往往由于高度分化而完全失去了再分裂的能力,最终衰老死亡。
机体在发展适应过程中为了弥补这一不足.保留了一部分未分化的原始细胞,称之为干细胞。
一旦生理需要,这些干细胞可按照发育途径通过分裂而产生分化细胞。
干细胞有以下特点:①干细胞本身不是终末分化细胞(即干细胞不是处于分化途径的终端);②干细胞能无限增殖分裂;③干细胞可连续分裂几代,也可在较长时间内处于静止状态;④干细胞分裂产生的于细胞只能在两种途径中迭择其一——或保持亲代特征,仍作为干细胞;或不可逆地向终末分化。
由于细胞质中的调节分化蛋白不均匀地分配,使得一个子细胞不可逆地走向分化的终端成为功能专一的分化细胞;另一个保持亲代的特征,仍作为干细胞保留下来。
分化细胞的数目受分化前干细胞的数目和分裂次数的控制,可以说,干细胞是具多向潜能和自我更新特点的增殖速度较缓慢的细胞。
干细胞的可塑性可塑性(plasticity)造血干细胞、骨髓间充质干细胞、神经干细胞等成体干细胞具有一定跨系、甚至跨胚层分化的特性,称其为干细胞的“可塑性”。
干细胞可塑性的揭示具有重要的理论意义和实用价值。
①组织间叶干细胞可塑性的揭示,提示成年人组织干细胞可能存在广泛的分化潜能;人类组织工程细胞的来源除去胚胎干细胞外,还可以从自体的体细胞中获得,而且不受组织相容性和伦理方面的限制。
②造血干细胞的概念需要更新,造血干细胞不仅是CD34+/CD34-细胞,而且还应考虑来自体内其它组织的干细胞,这些细胞在体外能长期培养和扩增,增殖潜能强,因而有可能用于骨髓移植;造血干细胞和非造血干细胞共移植(Co-transplantation)有可能用于器官再生。
③成年组织干细胞可塑性的研究证明,干细胞的微环境(壁龛)对其转化具有非常重要的作用,一些内在和外在的信号调节着这些干细胞的命运,这将为干细胞定向培养和应用带来新的前景。
④干细胞的转化常发生于病理情况,向病理部位迁移,成为病理损伤的前体细胞,并分化为终末成熟细胞。
因此,不仅可利用它来修复组织的损伤,而且还可把它作为基因治疗的理想载体。
胚胎干细胞胚胎干细胞的概念当受精卵分裂发育成囊胚时,内层细胞团(Inner Cell Mass)的细胞即为胚胎干细胞。
胚胎干细胞具有全能性,可以自我更新并具有分化为体内所有组织的能力。
若在显微镜下观察,存活5-7天的胚胎由大约140个细胞所组成,看上去就像黏稠的浆果或花粉粒。
它们通体毛绒绒,相互依赖着星空心的圆球状,这被称做胚泡。
其外层组织即滋养层,由一层扁平的细胞组成,会发展成胎盘。
胚泡中心的腔称“囊胚腔”,腔内一侧的细胞群即“内细胞团”,胚胎干细胞便是由此分离培养建系的。
这时的内层细胞尚未决定今后生长发育的走向,但它们均具有“全能性”,亦即可演变为200多种构成从心脏、肝脏、肾到皮肤、神经元等人体中任何一种器官组织的组成细胞。
内层细胞团在形成人的内、中、外三个胚层时开始分化,每个胚层特分别分化形成人体的各种组织器官。
如外胚层将分化为皮肤、眼睛和神经系统等,中胚层将形成骨骼、血液和肌肉等组织,内胚层将分化为肝、肺和肠等。
由于内细胞群可以发育成完整的个体,因而这些细胞被认为具有发育全能性。
胚胎干细胞的分离建系1998年11月,J.A.汤姆森和J.吉尔哈特几乎同时宣布,他们已独立培养出采集自人体胚胎的干细胞,特别是在维系人体胚胎细胞的“多能性”和遏制其异化发展上取得了重大突破。
在随后的几个月里.汤姆森领先于其他人促使上述脆弱的人细胞在培养液中持续生长,并证实上述细胞实际上就是胚胎干细胞。
有关人胚胎干细胞的建系方法有多种。
研究最多的是从胚胎的囊胚期内细胞群中直接分离胚胎干细胞。
1995年J.A.汤姆森等从恒河猴的囊胚中分离建立了世界上第一株灵长类动物的胚胎干细胞。
1998年,他们在建立灵长类胚胎干细胞取得的成功经验基础上,参照恒河猴胚胎干细胞分离法,从接受不孕症治疗的夫妇所捐献的处于囊胚阶段的早期胚胎中分离人的胚胎干细胞。
继汤姆森以后,世界上第二篇关于利用体外受精废弃受精卵进行人胚胎干细胞建系的文章是2000年澳大利亚的B.E.Reubinoff等和新加坡的体外受精专家合作完成的,他们成功地从人囊胚建立了两株未分化的人胚胎干细胞系。
该文更为详尽地讨论了人胚胎干细胞建系过程中的一系列细节,并且在体外分化试验中成功地得到了神经祖细胞。
另一种建系方法则是从终止妊娠的胎儿组织中分离出胚胎干细胞。
2001年马萨诸塞州的科学家则宣布他们利用克隆技术制造出人体胚胎,并从中摘取出了干细胞。
具体做法是提取某个卵子,去除其中的核子和基因物质,即将人卵细胞脱核,再将含有成年人基因物质的皮肤细胞的核转移到去核卵细胞内;然后通过电击手段诱导卵子加以复制,体外培养,待囊胚形成后取其内细胞团;经适当处理,几天后便可培育出供医疗使用的干细胞。
胚胎干细胞的生物特性1.胚胎干细胞来源于胚胎早期的胚泡中的内细胞群,保持未分化状态,具有自我复制的能力,具有向胚胎三个胚层来源的所有细胞分化的潜能。
2.胚胎干细胞可通过单细胞克隆建立有相同遗传特性的胚胎干细胞系。
建立的胚胎干细胞系有与亲代细胞相同的特征。
3.胚胎干细胞具有正常、完整(双倍体)及稳定的染色体核型。
4.胚胎干细胞缺乏细胞周期中G1期的限制点(chechpoint),胚胎干细胞大部分时间都处于细胞周期的S期,在此期进行DNA合成。
胚胎干细胞不需外源信号刺激启动DNA的复制。
5.胚胎干细胞表达三种特异性标志分子:细胞内的转录因子(intrinsic transcription factor,Oct4)、白血病抑制因子(leukemia inhibitory factor,LIF)和碱性磷酸酶(Alkaline phosphatase,AP)。
6.雌性哺乳动物来源的胚胎干细胞内,不存在X染色体失活现象。
7.胚胎干细胞端粒酶活性呈阳性,具有维持端粒长度,保持干细胞增殖能力的重要作用。
8.胚胎干细胞裸鼠皮下或肾包囊接种,可形成畸胎瘤。
胚胎干细胞的应用前景1999年12月,Science杂志公布了当今世界科学发展的评定结果,干细胞的研究成果名列十大科学进展榜首。
胚胎干细胞研究的科学价值在于其诱人的应用前景。
如果最终能够成功诱导和调控胚胎干细胞的分化与增殖,将对胚胎干细胞的基础研究和临床应用带来积极的影响,使之有可能在以下领域发挥重要作用。
1.揭示人及动物的发育机制及影响因素生命最大的奥秘便是人是如何从一个细胞发展为复杂得不可思议的生物体的。
人胚胎细胞系的建立及人胚胎干细胞研究,可以帮助我们理解人类发育过程中的复杂事件,使人深刻认识数十年来困扰着胚胎学家的一些基本问题,促进对人胚胎发育细节的基础研究。
人胚胎干细胞的体外可操作性,可以一种伦理上可接受的方式,提供在细胞和分子水平上研究人体发育过程中极早期事件的方法。