典型还原反应及机理2
- 格式:ppt
- 大小:2.88 MB
- 文档页数:8

还原反应的机理探索还原反应是化学中常见的一种反应类型,它指的是物质从氧化态转变为还原态的过程。
在该过程中,电子会从氧化剂转移到还原剂上,从而使还原剂发生还原反应。
本文将探索还原反应的机理,从宏观层面到微观层面,详细解释还原反应发生的原因和过程。
一、还原反应的概述还原反应是指发生氧化还原反应时,电子从氧化剂转移到还原剂上的过程。
在还原反应中,氧化剂接受了电子,而还原剂失去了电子。
还原反应不仅存在于化学实验中,也广泛应用于工业生产和自然界中。
例如,金属与非金属离子的反应以及氧气与金属的反应都属于还原反应。
二、还原反应的机理1. 电子转移理论还原反应中电子的转移是关键步骤之一。
根据电子转移的理论,氧化剂具有较高的氧化态,能够吸引和接受电子,而还原剂具有较低的氧化态,能够失去电子。
当还原剂与氧化剂接触时,电子从还原剂转移到氧化剂上,从而完成还原反应。
2. 过渡态与活化能在还原反应中,物质从氧化态到还原态的过程包括多个中间步骤,其中存在着反应物到产物的过渡态。
过渡态的形成需要克服活化能障碍,只有克服了活化能障碍,才能实现反应的进行。
因此,还原反应的速率取决于活化能的大小。
三、还原反应的实例分析1. 金属与非金属反应金属与非金属之间的反应是还原反应中常见的一种类型。
例如,氧气与铁反应产生氧化铁的过程即为还原反应。
在该反应中,铁失去了电子,被氧气氧化为氧化铁,而氧气则接受了电子,被还原为氧化铁。
2. 还原剂的应用还原剂在化学实验和工业生产中有着广泛的应用。
例如,亚硫酸氢钠常被用作还原剂。
它能将某些物质中的氧化剂还原为非氧化剂的形式,起到去除氧化剂的作用。
四、还原反应的微观机制1. 电子转移的研究从微观层面上观察,还原反应的机理主要包括电子的转移过程。
现代化学研究技术,如红外光谱和质谱等,可以帮助我们更加深入地理解电子转移的机制。
2. 中间物的形成还原反应发生时,常常会形成一些中间物。
这些中间物在反应前后扮演着重要的角色。


二硝基还原成环反应机理
二硝基还原成环反应机理主要有两种:
1.电化学还原反应机理:当二硝基物质在电解质溶液中受到还原电位的作用时,发生电化学还原反应。
具体机理如下:
先是在阳极上发生氧化反应:
NO2⁻ → NO3⁻ + e⁻
然后在阴极上发生还原反应:
NO3⁻ + 4H⁺ + 3e⁻ → HNO2 + 2H2O
最后通过质子转移,生成一元亚硝胺(HNO):
HNO2 + H⁺ → HNO + H2O
2.热反应机理:当二硝基物质受到高温作用时,发生热反应,生成环状化合物。
具体机理如下:
首先,二硝基物质发生裂解,生成游离的亚硝基自由基(NO):
R-NO2 → R-NO + NO
然后,亚硝基自由基进一步反应,生成氮气(N2)和有机物自由基:
R-NO + NO → R-NO2 + N2
最后,有机物自由基在高温条件下进行环合反应,生成环状化合物:
R-NO2 + R' → 五元环
这些机理是二硝基还原成环的主要反应路径,具体反应条件和产物会根据具体的二硝基物质而有所不同。

化学氧化还原反应的机理化学氧化还原反应是化学反应的一种重要类型,其机理涉及物质间电子的转移。
本文将深入探讨化学氧化还原反应的机理,并阐述其在化学领域的重要性。
一、氧化还原反应的基本概念氧化还原反应是指在化学反应中,某个物质失去电子而被氧化,同时另一物质获得同等数量的电子而被还原的过程。
在这类反应中,电子转移是至关重要的。
二、氧化还原反应的机理氧化还原反应的机理可以通过以下几个步骤来说明:1. 氧化剂和还原剂的反应在氧化还原反应中,通常会有一个物质起到氧化剂的角色,而另一个物质则扮演还原剂的角色。
氧化剂可以接受电子,而还原剂则可以捐赠电子。
这种电子的转移导致物质的氧化与还原。
2. 电子的转移氧化还原反应中,电子的转移是至关重要的。
当氧化剂与还原剂反应时,氧化剂会接受还原剂的电子,而对应的还原剂则会失去电子。
这种电子的转移可以通过电子传递过程或离子传递过程来实现。
3. 形成新的化学键在氧化还原反应中,电子的转移会导致化学键的形成或断裂。
当氧化剂接受电子时,它的氧化态会减少,形成新的化学键。
与此同时,还原剂失去电子,其还原态会增加,也形成新的化学键。
4. 反应的平衡氧化还原反应的机理中,为了保持原子总数和电荷守恒,氧化剂和还原剂之间的电子转移必须满足酸碱中子数平衡。
因此,氧化还原反应常会伴随着其他类型的反应,如酸碱中和反应等。
三、化学氧化还原反应的重要性化学氧化还原反应在化学领域具有广泛的应用和重要性,其主要体现在以下几个方面:1. 能源转化许多重要的能源转化过程都涉及氧化还原反应,如燃烧、电池反应等。
通过氧化还原反应,化学能转化为电能或其他形式的能量,为人类提供了便捷的能源来源。
2. 化学分析许多化学分析方法都利用了氧化还原反应的原理。
例如,氧化还原滴定法可以用于测定溶液中某种物质的含量,从而实现定量分析。
3. 金属和非金属的提取氧化还原反应在金属和非金属的提取过程中发挥重要作用。
例如,冶金过程中的还原反应可以将金属氧化物还原为相应的金属,从而实现金属的提取。


丙烯酸乙酯加氢还原反应
1. 反应方程式:
丙烯酸乙酯 + 氢气→ 乙醇。
2. 反应条件:
通常情况下,丙烯酸乙酯加氢还原反应需要在催化剂存在的条件下进行。
常用的催化剂有铂、钯等贵金属催化剂。
反应温度一般在50-100摄氏度之间,压力一般在1-10兆帕之间。
3. 反应机理:
丙烯酸乙酯加氢还原反应是一个催化加氢反应。
在催化剂的作用下,氢气分子被活化,吸附在催化剂表面上。
丙烯酸乙酯分子中的双键被氢气分子断裂,生成乙醇分子。
催化剂在反应过程中起到促进反应速率的作用。
4. 反应特点:
丙烯酸乙酯加氢还原反应是一种选择性较好的反应,通常可以
得到较高纯度的乙醇产物。
反应过程中,丙烯酸乙酯的双键被氢气
加成,生成乙醇,不会产生副产物。
这使得该反应在工业上具有重
要的应用价值。
5. 应用:
丙烯酸乙酯加氢还原反应在化工工业中有广泛的应用。
乙醇是
一种重要的溶剂和化工原料,广泛用于制药、化妆品、涂料、塑料、橡胶等行业。
丙烯酸乙酯加氢还原反应是生产乙醇的主要工艺之一。
综上所述,丙烯酸乙酯加氢还原反应是一种通过加氢作用将丙
烯酸乙酯转化为乙醇的化学反应。
该反应需要催化剂存在,并在一
定的温度和压力条件下进行。
该反应具有高选择性和重要的应用价值。

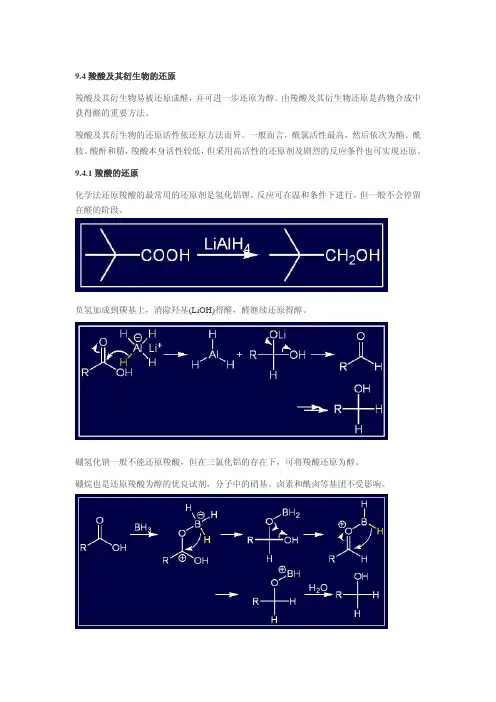
9.4 羧酸及其衍生物的还原羧酸及其衍生物易被还原成醛,并可进一步还原为醇。
由羧酸及其衍生物还原是药物合成中获得醛的重要方法。
羧酸及其衍生物的还原活性依还原方法而异。
一般而言,酰氯活性最高,然后依次为酯、酰胺、酸酐和腈,羧酸本身活性较低,但采用高活性的还原剂及剧烈的反应条件也可实现还原。
9.4.1 羧酸的还原化学法还原羧酸的最常用的还原剂是氢化铝锂,反应可在温和条件下进行,但一般不会停留在醛的阶段。
负氢加成到羰基上,消除羟基(LiOH)得醛,醛继续还原得醇。
硼氢化钠一般不能还原羧酸,但在三氯化铝的存在下,可将羧酸还原为醇。
硼烷也是还原羧酸为醇的优良试剂,分子中的硝基、卤素和酰卤等基团不受影响。
硼烷还原羧基的速度比还原其它基团快,因此,控制硼烷的用量及反应温度,可以在底物分子中含氰基、酯基或醛、酮羰基时还原羧基。
硼烷还原羧基的反应速度,脂肪酸大于芳香酸,位阻小的酸大于位阻大的酸。
脂肪酸酯反应速度很慢,芳香酸酯几乎不反应。
9.4.2 酰卤的还原化学法还原酰卤为醛的最常用的还原剂是金属氢化合物,如三叔丁氧基氢化铝锂或三丁基锡氢。
在低温下,还原芳酰卤和杂环酰卤的收率较高,而且不影响底物分子中的硝基、氰基、酯基、双键和醚键等。
负氢加成到羰基上、消除卤素(卤化锂)得醛。
9.4.3 酯和酰胺的还原依反应条件的不同,酯可被还原为醇、醛和双分子偶联反应。
(1) 酯还原为醇已有多种化学方法可将酯还原为醇,其中应用最为广泛的是金属氢化合物,其中又以氢化铝锂为最。
①金属氢化合物作还原剂酯用0.5eq.的氢化铝锂还原,可得伯醇。
负氢加成到羰基上,消除烷氧基(烷氧基锂)得醛,醛继续还原得醇。
在氢化铝锂还原时加入三氯化铝或定量的乙醇(用氯或烷氧基替换其1~3个氢原子),可以提高其还原的选择性。
如以下alpha,beta-不饱和酯的还原,若单用氢化铝锂还原,则生成饱和醇。
②金属钠/醇作还原剂:Bouveault-Blanc反应高级脂肪酸酯用金属钠和无水醇直接还原生成相应的伯醇的反应,称为Bouveault-Blanc反应。


还原反应第九章还原反应在还原剂的作用下使有机物分子中增加氢原子或减少氧原子,或者两者兼而有之的反应称为还原反应。
而将硝基、亚硝基、羟氨基、等含碳—氮键的化合物在还原剂作用下制得胺类的方法是还原反应中重要的一类。
同时,不饱和烃的还原、芳烃的还原、羰基的还原、羧酸及其衍生物的还原在药物合成中也有很重要的作用。
还原反应根据所用还原剂及操作方法不同,基本上可分为三类。
凡是使用化学物质包括元素、化合物等作还原剂所进行的还原反应称为化学还原反应,其中包括电化学还原反应。
化学还原反应按机理分主要分为负氢离子转移还原反应和电子转移还原反应。
另一种在催化剂存在下,借助于分子氢进行的还原反应称为催化氢化还原或催化加氢还原。
还有一种利用微生物发酵或活性酶进行的还原反应称为生物还原反应,这里不介绍。
9。
1化学还原反应化学还原反应常有的还原剂有无机和有机还原剂,前者应用更广泛。
9。
1、1金属还原剂1、底物与进攻试剂金属还原剂包括活泼金属、它们的合金及其盐类。
一般用于还原反应的活泼金属有碱金属、碱土金属、以及铝、锡、铁等。
合金包括钠汞齐、锌汞齐、铝汞齐、镁汞齐等。
金属盐有硫酸亚铁、氯化亚锡等。
金属还原剂在不同的条件下可还原一系列物质,不同的金属还原的应用场合有所差别。
2、反应机理及影响因素金属还原剂在进行还原时均有电子得失的过程,且同时产生质子的转移。
金属是电子的供给者,而质子供给者是水、醇、酸等化合物。
其还原机理是电子-质子的转移过程。
如羰基化合物用金属还原为差羟基化合物的过程中,是羰基首先自金属原子得到一个电子,五项原则负离子自由基,后者再由金属得到一个电子,形成二价负离子,二价负离子由质子供给者提供质子生成羟基化合物:CO+MCOMM-eCOMHCHOH(1)铁和低价铁盐为还原剂铁屑在酸性条件下为强还原剂,可将芳香族硝基、脂肪族硝基以及其它含氮氧功能团(亚硝基、羟氨基等)还原成氨基,将偶氮化合物还原成两个胺,将磺酰氯还原成巯基。

化学反应中的还原反应机理化学反应是物质转化的过程,其中还原反应是一种重要的反应类型。
还原反应发生时,原本被氧化的化合物会接受电子从而还原。
本文将探讨还原反应的机理以及一些常见的还原反应类型。
1. 还原反应的机理还原反应中涉及到电子转移的过程。
当一种物质失去电子,它被氧化;而当一种物质获得电子,它被还原。
在还原反应中,存在还原剂和氧化剂两种物质。
还原剂是指通过给予电子而将其他物质还原的物质;而氧化剂则是通过接受电子而将其他物质氧化的物质。
还原反应的机理可以通过半反应方程式来描述。
例如,对于锌和硫酸反应生成氢气的反应:Zn + H2SO4 → ZnSO4 + H2↑可以分解为两个半反应:还原反应半反应:Zn → Zn2+ + 2e^-氧化反应半反应:H2SO4 + 2e^- → H2↑ + SO42-在上述反应中,锌为还原剂,它被氧化为离子形式,而硫酸则为氧化剂,它接受锌释放的电子从而被还原为硫酸根离子。
2. 还原反应的类型还原反应可以分为多种类型,下面介绍其中几种常见的类型。
2.1 金属的还原反应金属的还原反应是最常见的还原反应类型之一。
在金属与非金属或金属离子发生反应时,金属往往会失去电子被氧化,同时非金属或金属离子会接受电子被还原。
例如,铜与硝酸反应生成亚硝酸盐和氮气的反应:3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O其中铜被氧化为铜离子,而硝酸则被还原为亚硝酸盐和氮气。
2.2 氧化物的还原反应氧化物的还原反应是指氧化物与还原剂发生反应,氧化物被还原为它们的原始形式。
例如,二氧化锰与盐酸反应生成氯化锰和水:MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑在这个反应中,二氧化锰作为还原剂,它被还原为氯化锰和水。
2.3 有机化合物的还原反应除了无机化合物,有机化合物也可以参与还原反应。
例如,酮类化合物可以被还原为相应的醇。
这种还原反应通常采用氢气和催化剂作为还原剂,如下所示:R2C=O + H2 → R2CHOH在这个反应中,酮被氢气还原为醇。
有机化学基础知识点还原反应的机理和规律有机化学是研究有机物(含碳元素的化合物)的合成、结构、性质以及反应机理的学科。
在有机化学中,还原反应是一类重要的反应类型。
本文将探讨有机化学基础知识点还原反应的机理和规律。
一、还原反应的基本概念还原反应是指有机化合物中含有高价态的碳、氮、氧等元素与还原剂作用,使其氧化数降低的反应。
还原反应中的还原剂一般是能够提供电子的化合物。
在有机化学中,还原反应常见的有氢化反应、金属还原、氢化铝锂还原等多种反应。
下面我们将逐个介绍这些还原反应的机理和规律。
二、氢化反应的机理和规律氢化反应是指有机化合物与氢气作用,将其中的氧化数降低,形成对应的氢化物的反应。
氢化反应常用催化剂如铂、钯等金属催化剂催化进行。
氢化反应的机理是通过催化剂提供的氢气分子中的氢原子与有机化合物中的氧化剂发生直接的氢原子迁移反应。
氢化反应的规律是氧化数越高的化合物,其对应的氢化反应越容易发生。
三、金属还原的机理和规律金属还原是指有机化合物中的氧化剂与金属反应,形成金属与对应的氧化物的反应。
金属还原常用的金属有锌、铝等。
金属还原的机理是通过金属作为还原剂,被氧化剂氧化形成阳离子,然后与有机化合物发生反应。
金属还原的规律是氧化剂的氧化能力越强,其与金属的反应越容易发生。
四、氢化铝锂还原的机理和规律氢化铝锂还原是指有机化合物中的氧化剂与氢化铝锂反应,形成对应的氢化物和铝锂氧化物的反应。
氢化铝锂还原是一种常用的有机合成方法。
氢化铝锂还原的机理是通过氢化铝锂作为强还原剂,提供电子给有机化合物的氧化剂,从而实现氧化数的降低。
氢化铝锂还原的规律是氧化剂的氧化能力越强,其与氢化铝锂的反应越容易发生。
五、还原反应的应用还原反应在有机化学中有着广泛的应用。
它可用于有机物的合成、功能团的转化以及化学反应的控制等方面。
通过了解还原反应的机理和规律,可以帮助化学家设计和优化合成路线,提高反应的选择性和效率。
六、结语还原反应是有机化学中的重要反应类型,具有广泛的应用价值。
有机氧化还原反应有机氧化还原反应是有机化学中的重要反应类型之一,它涉及有机物分子中氧化还原的过程。
有机氧化还原反应在合成有机化合物、药物研发、材料科学等领域具有广泛的应用。
本文将对有机氧化还原反应的基本概念、机理、应用和实例进行详细介绍。
一、有机氧化还原反应的基本概念与定义有机氧化还原反应是指有机化合物中某个原子的氧化态或还原态发生变化的化学反应。
在有机氧化还原反应中,通常涉及有机化合物中的碳、氧、氮、硫等元素的氧化还原。
1. 氧化反应氧化反应是指有机化合物中某个原子的氧化态发生变化的反应。
在氧化反应中,有机物中的某个原子失去电子,氧化态增加。
常见的氧化反应有氧化烯烃生成环氧化合物、氧化醇生成酮或醛等。
2. 还原反应还原反应是指有机化合物中某个原子的氧化态发生变化的反应。
在还原反应中,有机物中的某个原子获得电子,氧化态减少。
常见的还原反应有酮或醛还原生成醇、脱氧还原生成烯烃等。
二、有机氧化还原反应的机理有机氧化还原反应的机理多样,下面以几种常见的有机氧化还原反应为例进行介绍。
1. 环氧化合物的合成环氧化合物是一类重要的有机化合物,具有广泛的应用价值。
环氧化合物的合成通常通过烯烃的氧化反应实现。
以环戊烯为例,其氧化反应机理如下:首先,环戊烯与过氧化氢发生加成反应,生成过氧化环戊烷。
然后,过氧化环戊烷分解,生成环氧戊烷。
这个过程中,环戊烯的碳原子的氧化态从-1变为+1,实现了有机氧化还原反应。
2. 酮或醛的还原酮或醛的还原是有机氧化还原反应中的一类重要反应。
以醛的还原为例,其机理如下:首先,醛与还原剂(如氢气)发生加成反应,生成醇。
这个过程中,醛中的碳原子的氧化态从+1变为-1,实现了有机氧化还原反应。
三、有机氧化还原反应的应用有机氧化还原反应在有机合成、药物研发和材料科学等领域具有广泛的应用。
下面介绍几个有机氧化还原反应的应用实例。
1. 合成药物有机氧化还原反应在合成药物中起到关键作用。
例如,氧化还原反应可以用于合成多肽类药物中的二硫键,从而实现药物的抗氧化性能。
氧化还原反应的化学机理氧化还原反应,简称氧化反应和还原反应,是化学反应中最为重要的一种反应类型。
它是指某一种化学物质失去电子,同时另一种化学物质获得电子的反应,通常称作氧化剂和还原剂之间的反应。
当一个原子或离子失去电子时,其电量变得更加正电化;相反地,当一个原子或离子获得电子时,其电量变得更加负电化。
换言之,氧化是指一个原子或离子失去电子,而还原是指一个原子或离子获得电子。
因此,氧化还原反应可以描述为氧化剂使得还原剂电子失去或被转移,并同时使其本身电子获得或吸收的过程。
下面我们从分子和原子两个角度,来探讨氧化还原反应的化学机理。
一、分子机理去电子。
同时,它也将失去一些正电荷,从而形成一个更加败坏状况的分子。
正是由于这些变化,这一过程通常被称为氧化反应。
例如,氢气和氧气可以反应生成水:2H2 + O2 → 2H2O在这个化学反应中,氢气和氧气分别被视为还原剂和氧化剂。
氢气被氧化成水分子,同时趋向更高的电子松弛度和更高的电位能。
氧气则被还原成两个离子,同时趋向更加负电化和更低的电位能。
同样地,燃烧是一个氧化还原反应的经典示例。
在燃烧反应中,物质被氧化,同时产生水和二氧化碳等副产物。
当木头燃烧时,木材中的炭和碳被氧气氧化,从而生成二氧化碳。
同时,其余木质部分被转化为灰烬。
二、原子机理去电子。
这些电子通常来自于作为氧化剂的原子或离子,例如:Cu2+ + Fe → Cu + Fe2+在这个反应中,铁被氧化成铁离子,同时铜离子被还原成原子铜。
铁离子失去了电子,同时铜离子获得了电子。
三、氧化还原反应的应用氧化还原反应的应用在许多方面都是非常重要的。
例如,我们经常会用氧化反应来处理二氧化碳的生成。
这是因为氧化反应是生成化学键的过程,可以吸收或释放热量,从而改变反应的温度和压力。
此外,氧化还原反应也可以用于燃料电池和化学电池等能源装置中。
在燃料电池中,化学反应提供电子,从而生成电能。
这些电子可以用于升华或还原某些化合物,并产生化学反应。
一、概述一氧化碳还原氧化铜生成氧化亚铜是一种重要的化学反应。
在这个反应过程中,一氧化碳(CO)作为还原剂,将氧化铜(CuO)还原为氧化亚铜(Cu2O)。
这个过程不仅在实验室中得到广泛应用,也在工业生产中具有重要意义。
本文将深入探讨这一反应的机理、应用和意义,帮助读者全面了解该主题。
二、反应机理1. 反应方程式在一氧化碳还原氧化铜生成氧化亚铜的反应方程式为:2CO + CuO -> Cu2O + CO2这个方程式表明,在一氧化碳的作用下,氧化铜发生还原,生成氧化亚铜,同时一氧化碳氧化成二氧化碳。
2. 反应过程在实验室条件下,可以通过加热固体氧化铜和一氧化碳气体进行这一反应。
一氧化碳在高温条件下具有较强的还原性,能够将氧化铜分子中的氧原子还原成氧化亚铜。
三、应用和意义1. 实验室应用这一反应在实验室中得到广泛应用,可以用于合成氧化亚铜,也可以作为一种实验教学案例,帮助学生理解还原反应的原理和过程。
2. 工业应用氧化亚铜作为一种重要的无机化合物,在工业生产中具有广泛应用。
它可以用于催化剂的制备、颜料的生产等领域,因此对于氧化亚铜的合成反应具有重要的工业意义。
四、个人观点和理解一氧化碳还原氧化铜生成氧化亚铜这一反应,体现了化学反应原理中的还原和氧化过程。
通过深入研究这一反应的机理和意义,可以帮助我们更好地理解化学领域的知识,同时也为工业生产提供了重要的化学基础。
在撰写这篇文章的过程中,我对一氧化碳还原氧化铜生成氧化亚铜的反应有了更深入的了解。
这不仅加深了我对这一化学反应的认识,也让我认识到了它在实验室和工业生产中的重要应用价值。
总结回顾通过本文的深入探讨,我们对一氧化碳还原氧化铜生成氧化亚铜的反应有了全面、深刻和灵活的理解。
我们了解了这一反应的机理、应用和意义,也共享了个人对这一主题的观点和理解。
希望通过这篇文章的阅读,读者也能对这一化学反应有更深入的认识。
一氧化碳还原氧化铜生成氧化亚铜反应是一种具有重要意义的化学反应。