还原反应机理40页
- 格式:ppt
- 大小:537.00 KB
- 文档页数:40

还原反应的机理探索还原反应是化学中常见的一种反应类型,它指的是物质从氧化态转变为还原态的过程。
在该过程中,电子会从氧化剂转移到还原剂上,从而使还原剂发生还原反应。
本文将探索还原反应的机理,从宏观层面到微观层面,详细解释还原反应发生的原因和过程。
一、还原反应的概述还原反应是指发生氧化还原反应时,电子从氧化剂转移到还原剂上的过程。
在还原反应中,氧化剂接受了电子,而还原剂失去了电子。
还原反应不仅存在于化学实验中,也广泛应用于工业生产和自然界中。
例如,金属与非金属离子的反应以及氧气与金属的反应都属于还原反应。
二、还原反应的机理1. 电子转移理论还原反应中电子的转移是关键步骤之一。
根据电子转移的理论,氧化剂具有较高的氧化态,能够吸引和接受电子,而还原剂具有较低的氧化态,能够失去电子。
当还原剂与氧化剂接触时,电子从还原剂转移到氧化剂上,从而完成还原反应。
2. 过渡态与活化能在还原反应中,物质从氧化态到还原态的过程包括多个中间步骤,其中存在着反应物到产物的过渡态。
过渡态的形成需要克服活化能障碍,只有克服了活化能障碍,才能实现反应的进行。
因此,还原反应的速率取决于活化能的大小。
三、还原反应的实例分析1. 金属与非金属反应金属与非金属之间的反应是还原反应中常见的一种类型。
例如,氧气与铁反应产生氧化铁的过程即为还原反应。
在该反应中,铁失去了电子,被氧气氧化为氧化铁,而氧气则接受了电子,被还原为氧化铁。
2. 还原剂的应用还原剂在化学实验和工业生产中有着广泛的应用。
例如,亚硫酸氢钠常被用作还原剂。
它能将某些物质中的氧化剂还原为非氧化剂的形式,起到去除氧化剂的作用。
四、还原反应的微观机制1. 电子转移的研究从微观层面上观察,还原反应的机理主要包括电子的转移过程。
现代化学研究技术,如红外光谱和质谱等,可以帮助我们更加深入地理解电子转移的机制。
2. 中间物的形成还原反应发生时,常常会形成一些中间物。
这些中间物在反应前后扮演着重要的角色。



化学氧化还原反应的机理化学氧化还原反应是化学反应的一种重要类型,其机理涉及物质间电子的转移。
本文将深入探讨化学氧化还原反应的机理,并阐述其在化学领域的重要性。
一、氧化还原反应的基本概念氧化还原反应是指在化学反应中,某个物质失去电子而被氧化,同时另一物质获得同等数量的电子而被还原的过程。
在这类反应中,电子转移是至关重要的。
二、氧化还原反应的机理氧化还原反应的机理可以通过以下几个步骤来说明:1. 氧化剂和还原剂的反应在氧化还原反应中,通常会有一个物质起到氧化剂的角色,而另一个物质则扮演还原剂的角色。
氧化剂可以接受电子,而还原剂则可以捐赠电子。
这种电子的转移导致物质的氧化与还原。
2. 电子的转移氧化还原反应中,电子的转移是至关重要的。
当氧化剂与还原剂反应时,氧化剂会接受还原剂的电子,而对应的还原剂则会失去电子。
这种电子的转移可以通过电子传递过程或离子传递过程来实现。
3. 形成新的化学键在氧化还原反应中,电子的转移会导致化学键的形成或断裂。
当氧化剂接受电子时,它的氧化态会减少,形成新的化学键。
与此同时,还原剂失去电子,其还原态会增加,也形成新的化学键。
4. 反应的平衡氧化还原反应的机理中,为了保持原子总数和电荷守恒,氧化剂和还原剂之间的电子转移必须满足酸碱中子数平衡。
因此,氧化还原反应常会伴随着其他类型的反应,如酸碱中和反应等。
三、化学氧化还原反应的重要性化学氧化还原反应在化学领域具有广泛的应用和重要性,其主要体现在以下几个方面:1. 能源转化许多重要的能源转化过程都涉及氧化还原反应,如燃烧、电池反应等。
通过氧化还原反应,化学能转化为电能或其他形式的能量,为人类提供了便捷的能源来源。
2. 化学分析许多化学分析方法都利用了氧化还原反应的原理。
例如,氧化还原滴定法可以用于测定溶液中某种物质的含量,从而实现定量分析。
3. 金属和非金属的提取氧化还原反应在金属和非金属的提取过程中发挥重要作用。
例如,冶金过程中的还原反应可以将金属氧化物还原为相应的金属,从而实现金属的提取。


化学反应中的氧化还原反应机理氧化还原反应(简称氧化反应和还原反应)是化学反应中最重要的一类反应。
它涉及到电子的转移过程,其中一个物质失去电子而被氧化,而另一个物质获得电子而被还原。
本文将针对氧化还原反应的机理进行讨论。
一、氧化还原反应的基本概念在化学反应中,氧化还原反应是指电子从一个物质转移到另一个物质的过程。
其中一个物质的氧化态增加,称为被氧化剂或氧化剂,它接受了另一个物质失去的电子;而另一个物质的氧化态降低,称为被还原剂或还原剂,它失去了电子。
在氧化还原反应中,电子的转移伴随着氧化剂和还原剂之间的化学键的形成和断裂。
氧化反应和还原反应总是同时进行,即使在方程式中只显示其中一个反应。
例如,当铜与氧气发生反应生成氧化亚铜(Cu2O)时,铜被氧化,氧气被还原。
反之,当焦炭还原二氧化锰时,焦炭被氧化,二氧化锰被还原。
二、氧化还原反应机理的描述氧化还原反应机理可以通过电子转移的过程来描述。
在氧化反应中,氧化剂从被氧化剂中接受电子,被氧化剂失去电子的同时转变为了其高一级的氧化态。
相反,在还原反应中,还原剂向氧化剂传递电子,还原剂的氧化态降低。
以铜和氧气的反应为例,可以描述其氧化还原反应机理如下:1. 氧气分子(O2)接受两个来自铜原子的电子,转变为氧化亚铜(Cu2O)。
这是氧化剂接受电子的过程。
2. 铜原子失去两个电子,转变为Cu2+离子。
这是被氧化剂失去电子的过程。
三、氧化还原反应的影响因素氧化还原反应的进行受到多种因素的影响,以下是几个常见的影响因素:1. 温度:通常情况下,随着温度的升高,氧化还原反应的速率也会增加,这是因为高温下分子的活动性增强,有利于电子的转移。
2. 浓度:反应物的浓度越高,反应速率越快。
这是因为更高的浓度意味着更多的分子之间碰撞的机会,进而促进反应的进行。
3. 催化剂:某些物质可以加速氧化还原反应,这些物质被称为催化剂。
催化剂通过提供反应物之间的新途径,降低了反应的活化能,从而加速了反应速率。

化学反应中的还原反应机理化学反应是物质转化的过程,其中还原反应是一种重要的反应类型。
还原反应发生时,原本被氧化的化合物会接受电子从而还原。
本文将探讨还原反应的机理以及一些常见的还原反应类型。
1. 还原反应的机理还原反应中涉及到电子转移的过程。
当一种物质失去电子,它被氧化;而当一种物质获得电子,它被还原。
在还原反应中,存在还原剂和氧化剂两种物质。
还原剂是指通过给予电子而将其他物质还原的物质;而氧化剂则是通过接受电子而将其他物质氧化的物质。
还原反应的机理可以通过半反应方程式来描述。
例如,对于锌和硫酸反应生成氢气的反应:Zn + H2SO4 → ZnSO4 + H2↑可以分解为两个半反应:还原反应半反应:Zn → Zn2+ + 2e^-氧化反应半反应:H2SO4 + 2e^- → H2↑ + SO42-在上述反应中,锌为还原剂,它被氧化为离子形式,而硫酸则为氧化剂,它接受锌释放的电子从而被还原为硫酸根离子。
2. 还原反应的类型还原反应可以分为多种类型,下面介绍其中几种常见的类型。
2.1 金属的还原反应金属的还原反应是最常见的还原反应类型之一。
在金属与非金属或金属离子发生反应时,金属往往会失去电子被氧化,同时非金属或金属离子会接受电子被还原。
例如,铜与硝酸反应生成亚硝酸盐和氮气的反应:3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O其中铜被氧化为铜离子,而硝酸则被还原为亚硝酸盐和氮气。
2.2 氧化物的还原反应氧化物的还原反应是指氧化物与还原剂发生反应,氧化物被还原为它们的原始形式。
例如,二氧化锰与盐酸反应生成氯化锰和水:MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑在这个反应中,二氧化锰作为还原剂,它被还原为氯化锰和水。
2.3 有机化合物的还原反应除了无机化合物,有机化合物也可以参与还原反应。
例如,酮类化合物可以被还原为相应的醇。
这种还原反应通常采用氢气和催化剂作为还原剂,如下所示:R2C=O + H2 → R2CHOH在这个反应中,酮被氢气还原为醇。

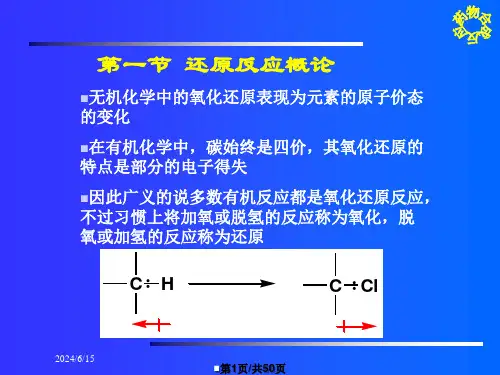
有机化学基础知识点还原反应的机理和规律有机化学是研究有机物(含碳元素的化合物)的合成、结构、性质以及反应机理的学科。
在有机化学中,还原反应是一类重要的反应类型。
本文将探讨有机化学基础知识点还原反应的机理和规律。
一、还原反应的基本概念还原反应是指有机化合物中含有高价态的碳、氮、氧等元素与还原剂作用,使其氧化数降低的反应。
还原反应中的还原剂一般是能够提供电子的化合物。
在有机化学中,还原反应常见的有氢化反应、金属还原、氢化铝锂还原等多种反应。
下面我们将逐个介绍这些还原反应的机理和规律。
二、氢化反应的机理和规律氢化反应是指有机化合物与氢气作用,将其中的氧化数降低,形成对应的氢化物的反应。
氢化反应常用催化剂如铂、钯等金属催化剂催化进行。
氢化反应的机理是通过催化剂提供的氢气分子中的氢原子与有机化合物中的氧化剂发生直接的氢原子迁移反应。
氢化反应的规律是氧化数越高的化合物,其对应的氢化反应越容易发生。
三、金属还原的机理和规律金属还原是指有机化合物中的氧化剂与金属反应,形成金属与对应的氧化物的反应。
金属还原常用的金属有锌、铝等。
金属还原的机理是通过金属作为还原剂,被氧化剂氧化形成阳离子,然后与有机化合物发生反应。
金属还原的规律是氧化剂的氧化能力越强,其与金属的反应越容易发生。
四、氢化铝锂还原的机理和规律氢化铝锂还原是指有机化合物中的氧化剂与氢化铝锂反应,形成对应的氢化物和铝锂氧化物的反应。
氢化铝锂还原是一种常用的有机合成方法。
氢化铝锂还原的机理是通过氢化铝锂作为强还原剂,提供电子给有机化合物的氧化剂,从而实现氧化数的降低。
氢化铝锂还原的规律是氧化剂的氧化能力越强,其与氢化铝锂的反应越容易发生。
五、还原反应的应用还原反应在有机化学中有着广泛的应用。
它可用于有机物的合成、功能团的转化以及化学反应的控制等方面。
通过了解还原反应的机理和规律,可以帮助化学家设计和优化合成路线,提高反应的选择性和效率。
六、结语还原反应是有机化学中的重要反应类型,具有广泛的应用价值。


化学反应的还原机理在化学领域中,我们经常会遇到各种各样的反应,其中包括氧化和还原反应。
还原反应是指物质在某些条件下获得电子,减少其价态的过程。
本文将探讨化学反应的还原机理,并解释为什么某些物质能够发生还原反应。
一、还原反应的定义和基本概念在化学中,还原是指某个物质失去氧化态以获得更多电子的过程。
还原的过程涉及到两个关键概念:氧化态和还原态。
氧化态是指物质中的原子所能得到的电子数,而还原态则是相反的过程,即物质中原子所能失去的电子数。
二、还原反应的发生条件还原反应的发生需要满足以下几个条件:1.有足够的还原剂:还原反应中的物质称为还原剂,它能够提供所需的电子以实现还原。
常见的还原剂包括金属、还原性非金属和亚稳态化合物等。
2.存在氧化剂:氧化剂是能够接受还原剂提供的电子的物质。
在还原反应中,氧化剂得到了电子,它本身被还原,从而促进了还原反应的进行。
三、还原机理还原反应的机理主要涉及电子转移和氧化态的变化。
在还原反应中,还原剂失去电子,其氧化态减小,而氧化剂获得电子,其氧化态增加。
还原反应可以通过两种方式进行:直接还原和间接还原。
1.直接还原:直接还原是指还原剂直接给予氧化剂电子,使其发生氧化,还原剂本身则发生了还原。
这种反应常见于某些金属的腐蚀、还原性非金属与氧化物的反应等。
例如,金属铁在湿气中会发生腐蚀反应,即Fe + O2 -> Fe2O3,铁失去电子被氧化成了三价铁离子,而氧气则被还原成了氧化物。
2.间接还原:间接还原是指还原剂先与氧化剂反应生成复合物,然后再释放出电子给予氧化剂。
这种反应常见于有机化合物的还原反应中。
例如,酮类化合物可以通过还原剂氢气在催化剂的作用下发生还原反应。
反应方程式为R-C=O + H2 -> R-CHO,在此反应中,酮被还原成醛,而氢气则是还原剂。
通过以上例子可以看出,化学反应的还原机理是基于物质之间电子转移和氧化态的变化。
还原反应的机理不仅适用于单个反应,也适用于复杂的化学反应过程。
1. 1,4还原和1,2还原反应的概念在化学领域,还原和氧化是非常重要的概念。
还原反应指的是一种化学反应,其中某个物质失去氧化态,而另一个物质在同一时间获得了氧化态。
相反,氧化反应是指发生氧化作用的化学反应,其中某个物质获得了氧化态,而另一个物质在同一时间失去了氧化态。
2. 1,4还原反应机理1,4还原反应指的是一种有机化学反应,其中含有碳-碳双键的α, β-不饱和酮或羰基化合物与某些还原剂反应,发生亲核加成反应,形成相邻两个碳原子之间的醇类产物。
1,4还原反应的机理主要分为三个步骤:步骤1:亲核加成亲核加成是指有亲核试剂攻击不饱和键,形成新的化学键。
在1,4还原反应中,亲核试剂通常为硫醇、硒醇、酚类或亚砜。
这些亲核试剂中的亲核试剂会攻击不饱和键上的碳原子,形成一个中间体离子。
步骤2:质子转移在亲核试剂攻击不饱和键后,会形成一个中间体离子。
接下来,质子(H+)会从某个位置转移到另一个位置,形成一个新的离子。
步骤3:质子脱除在1,4还原反应的最后一个步骤中,水分子或其他质子脱除剂会去除中间体离子中的质子,形成最终的醇类产物。
3. 1,2还原反应机理1,2还原反应是另一种有机化学反应,指的是α, β-不饱和酮或羰基化合物在某些还原剂作用下,发生亲电加成反应,生成相邻两个碳原子之间的醇类产物。
1,2还原反应的机理和1,4还原反应类似,也可以分为亲核加成、质子转移和质子脱除三个步骤。
4. 1,4还原和1,2还原反应的应用1,4还原和1,2还原反应都是有机合成中常用的重要反应,可以制备出各种醇类化合物。
这些醇类化合物在药物、香料、杀虫剂等化工领域具有重要的应用价值。
这些反应也在食品工业中用于酮类化合物的还原制备过程中。
5. 结语在有机化学中,1,4还原和1,2还原反应是非常重要的反应,对于合成醇类化合物具有重要的意义。
深入理解这些反应的机理和应用,有利于进一步探索有机合成的新方法和新领域。
希望本文对读者有所帮助,欢迎探讨和交流。