无机化学-配合物基础
- 格式:docx
- 大小:180.31 KB
- 文档页数:22


有环状结构,被称为螯合物或内配合物。
2+同一配体的两个或两个以上的配位原子间有一个原子,这样才能形成比较配位化合物金属有机配合物SO4科学家鲍林CN -为强配体,使Co 3个d 电子重排中心采取d 2sp 3 杂化,配离子Co(CN)为正八面体构型。
3d4s4p d 2sp 3杂化过渡金属Ni 的d轨道与CO的π*能量相近,对称性一致,可以成键。
按重叠后的(C2H4) ]·H2Oσ配键d-pπ配键在八面体场中,六个配体沿x,y,z轴的个方向分布,以形成八面体场。
正八面体场中配体与d z2 轨道的相对位置,轨道的波瓣与六个配体正相对,d x 2-y 2d z 2球形场正八面体场中配体与d xy 轨道的相对位置,,轨道的波瓣不与配体相对,能量升高的少,低于球形场。
d xy d xz d yz 球形场坐标原点为正六面体的中心,三轴分别沿与三边平行的方向伸展。
4 个配体的位置如图所示,形成四面体场。
正四面体场中配体与d x 2-y 2 轨道的相对位置正四面体场中配体与d xy 轨道的相对位置d d d 球形场(d )球形场(d )坐标原点位于正方形中心,坐标轴沿正方形对角线方向伸展。
4个配位原子位于正方形的顶点,形成正方形电场。
yx-++--y 2d x 2-y 2轨道的波瓣与配体一一相对,受电场作用最大,能量最高。
d xy 轨道处于y 平面内,受电场作用较大,能量居第二位。
++--d xy yx轨道的环形波瓣在x O y 平面内,列第三位。
d z 2yx能量最低的是轨道和轨道d xz d yz ++--z d yzyz++--d xzxz2.影响分裂能大小的因素弱场强场 小大-----光谱化学序列弱场强场 小大X -,OH -等弱场配体△小,常有△< P ,取高自旋光谱化学序列中NO 2-,CN -,CO 等强场配体△大,常导致△> P ,取低自旋方式,强场低自旋。
高自旋排布(dε)4 (dγ)2 低自旋排布(dε)6 (dγ)05个d轨道的能量为零点。




无机化学《配合物》教案配合物是指由配位原子(或离子)与另一部分(配位体)通过化学键连接而成的化合物。
配合物具有许多独特的化学和物理性质,并广泛应用于催化剂、药物、颜料和材料等领域。
本教案旨在介绍配合物的定义、结构以及配位键的形成机制和性质。
一、配合物的定义1.配合物是指由配位原子(或离子)与另一部分(配位体)通过化学键连接而成的化合物。
2.配位原子(或离子)是通常为过渡金属离子,但也可以是其他元素或离子。
3.配位体是指可以通过配位键与配位原子(或离子)形成配合物的分子或离子。
二、配合物的结构1.配位原子(或离子)和配位体通过配位键相连。
2.配位键的形成使得配位体围绕着配位原子(或离子)形成一个立体结构,称为配位球。
3.配合物的结构可以是一维、二维或三维的,具有不同的形态和几何构型。
4.配位原子(或离子)的电子层配置决定了配合物的稳定性和反应性。
三、配位键的形成机制和性质1.配位键的形成是通过配位体的配位原子与配位原子(或离子)的空位或配对电子形成配位键。
2.配位键可以是共价键、离子键或金属键。
3.配位键的形成能力受到配位原子(或离子)的电子能级和配位体的配位能力的影响。
4.配位键的性质包括键长、键能、键角和配位度等。
这些性质决定了配合物的化学和物理性质。
四、配合物的化学性质1.配合物可以发生配位键的断裂和配位体的替换反应,产生新的配合物。
2.配合物的稳定性受到配位原子(或离子)的电荷、原子半径和配位体的配位能力的影响。
3.配合物的溶解度和酸碱性常常与配位体的配位能力和配位度有关。
4.配合物的光谱性质(如吸收光谱、荧光光谱等)可以用来确定配位原子(或离子)和配位体的结构和环境。
五、配合物的应用1.配合物常用作催化剂,参与有机合成和化学反应。
2.配合物可用于制备药物,具有生物活性和药效。
3.配合物可以用作颜料和染料的原料,提供不同颜色和稳定性。
4.配合物可用于制备材料,具有特殊的磁性、光学和电学性质。


第 4 章配合物[ 教学要求]1 .掌握配位化合物的基本概念,组成,命名,分类。
2 .掌握配位化合物价键理论和晶体场理论的基本内容。
[ 教学重点]1 .配合物的异构问题2 .配合物的价键理论[ 教学难点]配合物的几何异构和对映异构[ 教学时数] 4 学时[ 主要内容]1 .配位化合物的基本概念:什么叫配合物,组成,命名。
2 .配合物的价键理论:配合物的立体结构和几何异构,配合物类型简介(简单配离子、螯合物、多核配合物)。
3 .晶体场理论要点:简介d 轨道的能级分裂和晶体场效应:八面体场的分裂、四面体场的分裂、平面四边形场的分裂;分裂能和影响分裂能的因素,稳定化能;晶体场理论对配合物性质的解释(颜色、磁性)。
[ 教学内容]4-1 配合物的基本概念“科学的发生和发展一开始就是由生产所决定的”。
配合物这门科学的诞生和发展,也是人类通长期过生产活动,逐渐地了解到某些自然现象和规律,加以总结发展的结果。
历史上有记载的最早发现的第一个配合物就是我们很熟悉的亚铁氰化铁Fe4[Fe(CN)6]3 ( 普鲁士蓝) 。
它是在1704 年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸纳在铁锅中强烈地煮沸而得到的。
后经研究确定其化学式为Fe4[Fe(CN)6]3。
近代的配合物化学所以能迅速地发展也正是生产实际需要的推动结果。
如原子能、半导体、火箭等尖端工业生产中金属的分离楼术、新材料的制取和分析;50 年代开展的配位催比,以及60 年代蓬勃发展的生物无机化学等都对配位化学的发展起了促进作用。
目前配合物化学已成为无机化学中很活跃的一个领域。
今后配合物发展的特点是更加定向综合,它将广泛地渗透到有机化学、生物化学、分析化学以及物理化学、量子化学等领域中去。
如生物固氮的研究就是突出的一例。
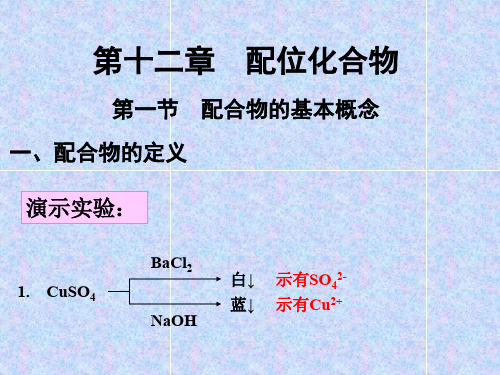
4-1-1 配合物的定义当将过量的氨水加入硫酸铜溶液中,溶液逐渐变为深蓝色,用酒精处理后,还可以得到深蓝色的晶体,经分析证明为[Cu(NH3)4]SO4。





第十六章配位化合物Chapter 16 The Coordination Compounds最早的配合物是偶然、孤立地发现的,它可以追溯到1693年发现的铜氨配合物,1704年发现的普鲁士蓝以及1760年发现的氯铂酸钾等配合物。
配位化学作为化学学科的一个重要分支是从1793年法国化学家Tassaert无意中发现CoCl·6NH3开始的。
B.M.Tassaert是一位分析化学家。
他在从事钴的重量分析的研究过程中,偶因NaOH用完而用NH3·H2O代替加入到CoCl2(aq)中。
他本想用NH3·H2O沉淀Co2+,再灼烧得到CoO,恒重后测定钴的含量。
但结果发现加入过量氨水后,得不到Co(OH)2沉淀,因而无法称重,次日又析出了橙黄色晶体。
分析其组成为:CoCl3·6NH3。
配位化学的近代研究始于两位精明的化学家−− A. Werner 和 S. M. Jogensen。
他们不仅有精湛的实验技术,而且有厚实的理论基础。
特别是从1891年开始,时年25岁在瑞士苏黎士大学学习的Werner提出的配合物理论:1.提出主价(primary valence)和副价(second valence),相当于现代术语的氧化数和配位数;又指出了配合物有内界(inner)和外界(outer)。
2.在任何直接测定分子结构的实验方法发明之前很长一段时间,他指出了一些配合物的正确的几何构型。
其方法是沿用有机化学家计算苯取代物的同分异构体数目来推测结构。
例:W erner 认为[Co(NH3)4Cl2]+的构型及其异构体的关系如下:化学式平面六边形三角棱柱八面体实验[Co(NH3)4Cl2]+ 3 3 2 2 Werner合成出[Co(NH3)4Cl2]Cl的异构体只有两种,而仅有八面体才是两种几何异构体,故[Co(NH3)4Cl2]+的几何构型构是八面体。
由于Werner在配合物理论方面的贡献,获得1913年诺贝尔化学奖。


无机化学的基础无机化学是研究无机物质的组成、性质、合成和反应的科学领域。
它作为化学学科的重要分支,对于理解和应用现代化学具有至关重要的作用。
本文将介绍无机化学的基本概念和原理,帮助读者建立起对无机化学的基础认识。
1. 原子结构和元素周期表无机化学的基础从原子结构开始。
原子是构成物质的基本粒子,由质子、中子和电子组成。
质子和中子位于原子的核心,而电子则绕核心运动。
元素周期表是无机化学中最重要的工具之一,它将所有已知元素按照一定的规律排列,使我们能够更好地了解元素的性质和特点。
2. 化学键和化学反应化学键是连接原子的力,常见的化学键有共价键、离子键和金属键。
共价键是通过共享电子来连接原子的,离子键是由电子的转移形成的,而金属键则是由金属中的自由电子共享形成的。
化学反应是发生在化学键中的变化,它包括各种物质之间的转化、合成和分解等过程。
3. 配位化学和配合物配位化学研究的是过渡金属元素和配体之间的相互作用。
过渡金属元素通常具有多个化合价和复杂的电子结构,它们可以与不同种类的配体形成配合物。
配合物是由中心金属离子和周围配体团结合形成的化合物,具有重要的应用价值,如催化剂、生物活性分子等。
4. 酸碱理论和溶液化学酸碱理论是无机化学中的重要内容之一,目前常用的酸碱理论有Arrhenius理论、Brønsted-Lowry理论和Lewis理论。
溶液化学研究的是物质在溶液中的行为,包括溶解度、溶液浓度、酸碱中和等内容。
5. 物质的性质与应用无机化学研究物质的性质,涉及领域广泛。
例如,金属与非金属之间的性质差异,金属的导电性和导热性使其在电子、电器、材料等方面有广泛应用;非金属的特殊性质使其在陶瓷、电子元器件等领域得到应用。
此外,无机化学还研究了无机晶体的光学性质、催化剂的活性和选择性等。
结语无机化学是化学学科中不可或缺的一部分,对于理解和应用现代科学技术具有重要意义。
本文简要介绍了无机化学的基本概念和原理,希望读者能够通过学习无机化学的基础知识,进一步了解和应用无机化学的知识。

第4章配合物4.1 复习笔记一、配合物的基本概念1.配合物的定义配位化合物简称配合物,又称络合物,是一大类化合物的总称。
2.配合物的组成(1)形成体①中心离子(或中心原子)称为配合物的形成体;②中心离子大多数是带正电荷的金属阳离子,以过渡金属离子居多,如Mn2+、Fe3+、Co2+、Ni2+、Cu2+、Ag+等;少数高氧化态的非金属元素也可作中心离子,如[BF4]-、[SiF6]2-中的B(Ⅲ)、Si(Ⅳ)等;③中心原子如[Ni(CO)4]、[Fe(CO)5]中的Ni、Fe原子。
(2)配位个体、配体及配位原子①由形成体结合一定数目的配体所形成的结构单元称为配位个体,即配合物的核心部分;②在配合物中与形成体结合的离子或中性分子称为配体;③在配体中提供孤电子对与形成体形成配位键的原子称为配位原子。
(3)配体分类根据配体中所含配位原子数目的不同,可分为单齿配体和多齿配体。
①单齿配体:一个配体中只有一个配位原子,如NH3、OH-、X-、CN-、SCN-等;②多齿配体:一个配体中有两个或两个以上的配位原子。
(4)配位数①定义配位数是指在配位个体中与一个形成体形成配位键的配位原子的总数。
②配位数与配体的关系a.由单齿配体形成的配合物,中心离子的配位数等于配体的数目;b.若配体是多齿的,那么配体的数目不等于中心离子的配位数。
③形成体和配体的性质对配位数的影响a.中心离子正电荷越多,配位数越大;b.中心离子半径较大时,其周围可容纳较多的配体,易形成高配位的配合物,但是中心离子半径若过大时,有时配位数反而减小;c.配体的负电荷越多,配位数减小;d.配体的半径增大时,中心离子周围可容纳的配体数减少,配位数减小;e.配体浓度大、反应温度低,易形成高配位配合物。
(5)配离子的电荷配离子的电荷为形成体和配体电荷的代数和。
3.配合物的化学式及命名(1)配合物的化学式①含配离子的配合物,其化学式中阳离子写在前,阴离子写在后;②配位个体中,先列出形成体的元素符号,再依次列出阴离子和中性配体;③无机配体列在前面,有机配体列在后面,将整个配位个体的化学式括在方括号内;④在括号内同类配体的次序,以配位原子元素符号的英文字母次序为准。
配合物基础纲要:1.配位化合物的基本概念配位化合物配合物的命名异构现象2.配位化合物的稳定性酸碱的软硬分类影响配位单元稳定的因素3.配合平衡配合-解离配合配合平衡的移动4.配位化合物的价键理论配合物的构型与中心的杂化方式中心杂化轨道的形成价键理论中的能量问题价键理论的实验根据5.配合物的晶体场理论晶体场中的 d 轨道过渡金属化合物的颜色晶体场稳定化能(CFSE) Jahn -Teller 效应§1.配位化合物的基本概念一.配位化合物1 定义由中心原子( 或离子) 和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。
凡是含有配位单元的化合物都称做配位化合物,简称配合物,也叫络合物。
, Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
[ Co(NH3)6]Cl3 , K3[Cr(CN)6], Ni(CO)4都是配位化合物。
[Co(NH3)6] [Cr(CN)6] 也是配位化合物。
判断的关键在于是否含有配位单元。
2 构成内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6] 之中,内界,外界是K+。
可以无外界,如Ni(CO)4。
但不能没有内界。
内外界之间是完全电离的。
内界配位单元又由中心和配体构成。
中心:又称为配合物的形成体,多为金属离子,尤其是过渡金属离子。
配体:经常是阴离子或分子。
3 配位原子和配位数配体中给出孤对电子与中心直接形成配位键的原子,叫配位原子。
配位单元中,中心周围与中心直接成键的配位原子的个数,叫配位数。
配位化合物[Co(NH3)6]Cl3的内界为,中心的周围有6 个配体NH3,每个NH3中有1 个N 原子与配位。
N 是配位原子,Co 的配位数是6 。
注意:配体的个数与配位数不是同一个概念。
若中心的电荷高,半径大,则利于形成高配位数的配位单元;而配体的电荷高,半径大,利于低配位数。
4 多基配体和螯合物乙二胺H2N- CH2 - CH2 - NH2(表示为en ),其中两个氮原子经常和同一个中心配位。
象这种有两个配位原子的配体通常称双基配体( 或双齿配体) 。
而乙二胺四乙酸( EDTA ) ,其中2 个N ,4 个-OH 中的O 均可配位,称多基配体。
负离子多基配体和正离子中心形成的中性配位单元,称为内盐。
例如:二配合物的命名[Co(NH3)5H2O]Cl3三氯化五氨·水合钴( III )Cu2[SiF6] 六氟合硅( IV ) 酸亚铜1 在配合物中先阴离子,后阳离子,阴阳离子之间加‘化’字或‘酸’字,配阴离子看成是酸根。
2 在配位单元中1°先配体后中心,配体与中心之间加‘合’字。
2°配体前面用二、三、四……表示该配体个数。
3°几种不同的配体之间加‘·’隔开。
4°中心后面加(),内写罗马数字表示中心的价态。
3 配体的名称4 配体的先后顺序下述的每条规定均在其前一条的基础上1°先无机配体后有机配体PtCl2( Ph3P)2二氯·二(三苯基膦)合铂(II)2°先阴离子类配体,后阳离子类配体,最后分子类配体。
K [ PtCl3(NH3)] 三氯·氨合铂( II ) 酸钾3°同类配体中,按配位原子的元素符号在英文字母表中的次序分出先后。
[Co(NH3)5H2O ] Cl3三氯化五氨·水合钴( III )4°配位原子相同,配体中原子个数少的在前。
[ Pt(Py)( NH3)(NO2)(NH2OH)] Cl氯化硝基·氨·羟氨·吡啶合钴( II )5°配体中原子个数相同,则按和配位原子直接相连的配体中的其它原子的元素符号的英文字母表次序,如和,则在前。
三异构现象1 结构异构(构造异构)键联关系不同,是结构异构的特点。
以前学习的有机物异构体,多属此类。
1°电离异构内外界之间是完全电离的。
内外界之间交换成份得到的配合物,与原来的配合物互为电离异构。
它们电离出的离子种类不同,如[ CoBr(NH3)5]SO4和[CoSO4(NH3)5]Br ,前者可以使沉淀,后者则使Ag+沉淀。
H2O 经常做为配体,也经常在外界。
由于H2O 分子在内外界不同造成的电离异构,称为水合异构。
如[Cr(H2O)6]Cl3和[CrCl(H2O)5]Cl2·H2O 。
2°配位异构内界之间交换配体,得配位异构。
如[Co(NH3)6][Cr(CN)6] 和[Cr(NH3)6] [Co(CN)6]3°键合异构组成相同,但配位原子不同的配体,称两可配体,如-NO2-和-ONO-。
[Co(NO2)(NH3)5]Cl2和[ Co(ONO)(NH3)5]Cl2则互为键合异构。
2 空间异构(立体异构)键联关系相同,但配体相互位置不同,是空间异构的特点。
1°几何异构(顺反异构)配位数为 4 的平面正方形结构顺式称顺铂,是抗癌药物,反式则无药效。
正方形的配合物M2a 2b,有顺反异构,M a 3b,不会有顺反异构。
正四面体结构,不会有顺反异构。
配为数为6 的正八面体结构总之,配体数目越多,种类越多,异构现象则越复杂。
2°旋光异构配体的相互位置关系不一致形成几何异构,当相互位置的关系亦一致时,也可能不重合。
比如人的两只手,互为镜像,各手指、手掌、手背的相互位置关系也一致,但不能重合。
互为镜像的两个几何体可能重合,但只要能重合则是一种。
若两者互为镜像但又不能重合,则互为旋光异构。
旋光异构体的熔点相同,但光学性质不同。
互为旋光异构体的两种物质,使偏振光偏转的方向不同。
按一系列的规定,定义为左旋、右旋。
不同的旋光异构体在生物体内的作用不同。
§2.配位化合物的稳定性一.酸碱的软硬分类在路易斯酸碱的基础上,进行酸碱的软硬分类。
总之电子云的变形性小,谓之硬。
软酸:体积大,半径大,电荷低,易变形。
交界酸:等,其变形性介于硬酸和软酸之间。
硬碱:给电子原子的电负性大,不易失去电子,不变形。
等软碱:给电原子的电负性小,易给出电子,易变形。
等交界碱:等同类酸碱相结合形成的物质稳定,软硬不同的酸碱不是不能结合,但不稳定。
软亲软、硬亲硬,解释问题方便,尤其是解释元素在自然界的存在状态。
这种原则不能定量,例外也很多。
二影响配位单元稳定的因素1 中心与配体的关系2 螯合效应螯合物稳定,以 5 元环、6 元环螯合物最为稳定。
一般不形成配合物,但可以与乙二胺四乙酸(EDTA)形成螯合物。
六配位,2个N,4个O为配位原子,形成五个5元环,正八面体。
螯合物获得特殊稳定性的热力学原因:[L-M-L] + L-L = [M=L2] + 2L从简单配合物向螯合物转变过程中: 由反应前的两个分子生成产物的3个分子.即这种螯合物的成环作用, 使体系的反应熵加大了, 正是这种成环后体系分子数增多而引起的熵增加, 增强了螯合物的稳定性.§3.配合平衡一.配合-解离平衡这个常数的值越大,表示配合反应进行得越彻底,配合物越稳定,故称之为K稳稳定得多。
K不稳越大,离解反应越彻底,配离子越不稳定,配位单元的形成可以认为是分步进行的,如:K1、K2、K3、K4称为逐级稳定常数。
反应(1) 最易进行,反应(2)中的NH3受到第一个NH3的斥力,同时也有空间位阻,故难些。
(3)、(4)更难些。
这可从K1 > K2 > K3 > K4看出。
Kn 逐级减小,尤其是带电荷的配体。
在络合平衡的体系中,哪种络离子多?设平衡时[NH3]=1. 根据各步的平衡方程式, 由所以,是体系中占主导多数的离子。
例1将0.2 的AgNO3溶液和2的NH3·H2O 等体积混合,求平衡后体系中的[ Ag+ ] 。
解: 由于体积变化,Ag+的起始浓度是0.1,而NH3的起始浓度是1。
而消耗NH3的浓度为0.1 x 2 = 0.2,故平衡时[ NH3 ] = ( 1 - 0.2 ),而设[ Ag+ ] = x, 则有:在这个体系中加入0.01 mol NaCl , 也难生成AgCl 沉淀.二配合平衡的移动1 与酸碱电离平衡的关系以(a) 为例讨论。
若pH 值增大,一方面由于[OH-] 增大,使反应进行,从而[ Ag+ ] 减小,导致(a) 左移;另一方面由于[ OH- ] 增大,反应逆向进行,从而[NH3] 增大,使(a) 右移。
可见,pH 的影响是很复杂的,因此酸碱电离平衡对配合-离解平衡的影响在分析化学中讲授。
2. 和沉淀-溶解平衡的关系络合剂、沉淀剂都可以和结合,生成配合物、沉淀物,故两种平衡的关系实质是络合剂与沉淀剂争夺的问题,当然要和Ksp、K稳的值有关。
例2计算AgCl 在NH3·H2O 中( 6 ) 的溶解度,已知解:反应为:总反应为:Ksp 很小,K稳很大,Ag+不是结合成AgCl, 就是络合成,故游离的Ag+ 浓度极小. 可以认为从AgCl 中溶解下来的Ag+, 完全变成,故[Cl-] =,设其为x ,则消耗掉[NH3 ] 为2 x ,则[NH3]平= 6 - 2xAgCl 的,计算表明, AgCl可溶于6的NH3·H2O 中。
但AgI 的,在 6 的NH3·H2O 中,其溶解度为,即AgI 不溶于NH3·H2O.3. 和氧化-还原反应的关系这种关系体现在半反应的值和值上。
氧化型+z e ——还原型,若氧化型被络合,值减小;还原型被络合,值增大。
若氧化型和还原型同时被络合,则计算更复杂些。
例 3 = 0.34V的解法1: 将/ Cu 的看作Cu2+/ Cu 的非标准值,即[NH3] = [] = 1时的值.解法2: 将各反应视为独立反应, 用热力学函数(Gibss函数)和K稳以及半反应的相联系, 可达到同样的计算目的.等式两侧同时除以-2F, 得:§4.配位化合物的价键理论一.配合物的构型与中心的杂化方式二中心杂化轨道的形成1. ns np nd 杂化1 个4s 空轨道,3 个4p 空轨道和2 个4d 空轨道形成sp3d2杂化轨道,正八面体分布。
6 个F-的6 对孤对电子配入sp3d2空轨道中,形成正八面体构型的配合单元。
例 2 Ni(CO)4的成键情况在配体CO 的作用下,Ni 的价层电子重排成3d104s0形成sp3杂化轨道,正四面体分布,4 个CO 配体与sp3杂化轨道成配键,形成的Ni(CO)4构型为正四面体。
例 1 和例 2 的相同点是,配体的孤对电子配入中心的外层空轨道, 即ns np nd 杂化轨道, 形成的配合物称外轨型配合物. 所成的键称为电价配键. 电价配键不是很强.例 1 和例 2 的不同点是,CO 配体使中心的价电子发生重排,这样的配体称为强配体。