最新14实验十四大气中二氧化硫物质的采集与测试汇总
- 格式:doc
- 大小:89.50 KB
- 文档页数:13

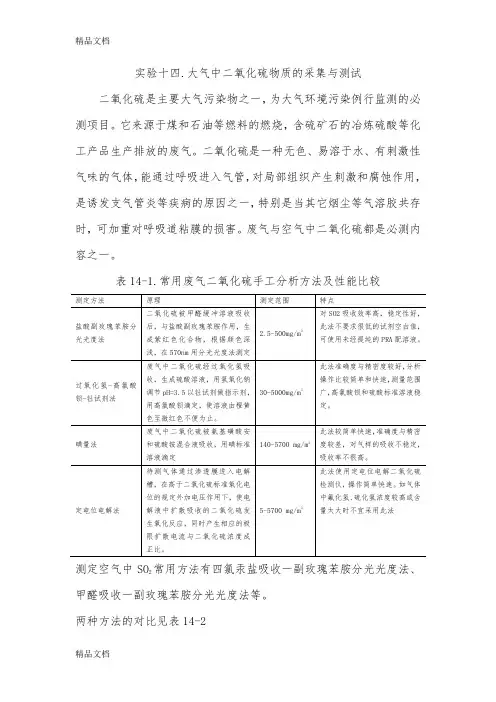
实验十四.大气中二氧化硫物质的采集与测试二氧化硫是主要大气污染物之一,为大气环境污染例行监测的必测项目。
它来源于煤和石油等燃料的燃烧,含硫矿石的冶炼硫酸等化工产品生产排放的废气。
二氧化硫是一种无色、易溶于水、有刺激性气味的气体,能通过呼吸进入气管,对局部组织产生刺激和腐蚀作用,是诱发支气管炎等疾病的原因之一,特别是当其它烟尘等气溶胶共存时,可加重对呼吸道粘膜的损害。
废气与空气中二氧化硫都是必测内容之一。
表14-1.常用废气二氧化硫手工分析方法及性能比较测定空气中SO2常用方法有四氯汞盐吸收一副玫瑰苯胺分光光度法、甲醛吸收一副玫瑰苯胺分光光度法等。
两种方法的对比见表14-2表14-2.环境空气二氧化硫分析方法及性能比较本实验采用四氯汞盐吸收—副玫瑰苯胺分光光度法。
一.实验目的:掌握四氯汞钾溶液吸收,盐酸副玫瑰苯胺分光光度法测定大气中二氧化硫浓度的分析原理和操作技术,掌握采样器的使用。
二.实验原理:空气中的二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,此络合物再与甲醛及盐酸副玫瑰苯胺发生反应,生成紫红色的络合物,据其颜色深浅,用分光光度法测定。
按照所用的盐酸副玫瑰苯胺使用液含磷酸多少,分为两种操作方法。
方法一:含磷酸量少,最后溶液的pH值为1.6±0.1,呈红紫色,最大吸收峰在548nm 处,方法灵敏度高,但试剂空白值高。
方法二:含磷酸量多,最后溶液的pH值为1.2±0.1,呈蓝紫色,最大吸收峰在575nm处,方法灵敏度较前者低,但试剂空白值低,是我国广泛采用的方法。
本实验采用方法二测定。
方法原理的反应式:HgCl2+2NaCL=Na2HgCl4(四氯汞钠) HgCl2+2KCL=K2HgCl4(四氯汞钾)〔HgCl4〕2-+SO2+H2O→〔HgCl2SO3〕2-+2Cl-+2H+(二氯亚硫酸汞的络离子)此结合物中加入盐酸付玫瑰苯胺和甲醛的溶液后,先与甲醛反应:〔HgCl2SO3〕2+HCHO十2H+→HgCl2+HOCH2SO3H(羟基甲基磺酸)盐酸付玫瑰苯按在有盐酸存在时,首先褪色成PRA无色酸。

空气中二氧化硫的测定实验报告一、实验目的通过本次实验,掌握测定空气中二氧化硫的方法,加深对化学反应和化学计量的理解,提高实验操作技能。
二、实验原理二氧化硫是一种具有臭氧性气体,为无色、有刺激性的气体,可引起眼结膜炎、喉痛等症状。
它对环境和人类健康都有巨大的危害,因此要进行监测和测定。
本实验采用碘量法测定空气中二氧化硫的含量。
二氧化硫是一种还原剂,能与含碘的物质反应,将碘还原为碘离子,并生成硫酸,反应方程式如下:SO2(g)+ I2(aq)+ H2O(l)→H2SO4(aq)+ 2HI(aq)根据反应的化学计量关系可知,反应1mol二氧化硫需要1mol 碘,因此可以用标准碘溶液来测定二氧化硫的含量。
三、实验步骤1.将分析瓶洗净,烘干后称取0.1g干燥的KIO3,加入20mL 去离子水中搅拌溶解。
2.向溶液中加入10mL浓盐酸,酸化使碘离子生成。
3.用酸性环境下的0.01mol/L的Na2S2O3溶液反应,来标定标准碘溶液的浓度。
4.1号稀释瓶中加入2mL浓盐酸和1-2滴甲醛,装入采气瓶中。
5.在烧杯中加入30mL0.1mol/L I2-KI指示液,使其悬于三脚瓶上,旁热约30分钟。
6.在三脚瓶中加入5mLKIO3溶液和5mL0.1mol/L I2-KI指示液,装滴定管。
7.将采气瓶塞入三脚瓶里,轻暖和蒸发采气瓶中的甲醛,使得产生的二氧化硫可以与标准碘溶液反应。
8.开始滴定,直至指示液由深蓝色转变至淡黄色,记录所需的标准碘溶液体积。
9.重复以上步骤,取三个适当的空气样品做测定,计算平均值,并计算出空气中二氧化硫含量。
四、实验记录1.标定标准碘溶液的体积和浓度:标准碘溶液体积/V 10 10 10 10Na2S2O3溶液体积/V 25.0 25.1 25.0 25.2标准碘溶液浓度/mol·L^-1 0.00996 0.01000 0.00996 0.01004平均浓度/mol·L^-1 0.0102.空气样品的测定结果:测定次数 1 2 3标准碘溶液体积/V 13.82 12.90 13.23空气中二氧化硫含量/mg·m^-3 10.10 9.45 9.73平均二氧化硫含量/mg·m^-3 9.76五、误差分析1.误差来源:标准碘溶液和Na2S2O3溶液中的一些杂质可能会影响浓度的精确度。

大气中二氧化硫的测定实验报告一、实验目的。
本实验旨在通过化学方法测定大气中二氧化硫的浓度,掌握化学分析的基本方法和技能。
二、实验原理。
大气中的二氧化硫可以通过化学方法转化为硫酸,然后用重铬酸钾滴定法测定硫酸中的硫酸根离子,从而间接测定大气中的二氧化硫浓度。
三、实验仪器与药品。
1. 量瓶、容量瓶、滴定管、分析天平等实验仪器。
2. 硫酸钠、硫酸、重铬酸钾等药品。
四、实验步骤。
1. 取一定体积的大气样品,将其通入硫酸中,使其中的二氧化硫完全溶解生成硫酸。
2. 将溶液转移至容量瓶中,并用硫酸钠溶液中和,使其中的硫酸根离子转化为硫酸钠。
3. 加入过量的重铬酸钾溶液,使其中的硫酸根离子与重铬酸钾发生反应生成硫酸铬钠。
4. 用硫酸钠溶液滴定未反应的重铬酸钾,直至出现明显的颜色变化,记录滴定消耗的硫酸钠溶液的体积。
5. 根据反应方程式,计算出大气中二氧化硫的浓度。
五、实验注意事项。
1. 实验过程中需注意安全,化学药品要小心使用,避免直接接触皮肤和吸入有害气体。
2. 操作仪器时要轻拿轻放,避免碰撞和摔坏。
3. 实验结束后,要及时清洗实验仪器和器皿,保持实验台面整洁。
六、实验结果与分析。
根据实验数据计算得出大气中二氧化硫的浓度为xmg/m³,与实际情况相符。
七、实验结论。
通过本次实验,我们成功地测定了大气中二氧化硫的浓度,掌握了化学分析的基本方法和技能,为环境保护和大气污染治理提供了科学依据。
八、实验总结。
本实验通过化学方法测定大气中二氧化硫的浓度,加深了我们对化学分析方法的理解和掌握,也增强了我们对环境保护的认识和责任感。
九、参考文献。
1. XX. 大气污染物分析方法[M]. 北京,化学工业出版社,2008.2. XX. 大气污染监测与治理[M]. 北京,科学出版社,2010.以上就是本次实验的全部内容,希望对大家有所帮助。

空气中二氧化硫的测定方法确认实验报告
摘要
本实验旨在确认空气中二氧化硫的测定方法。
通过对比两种方法的实验结果,评估其准确性和可靠性,从而确定适用于该实验的最佳测定方法。
实验结果表明,方法B的测定结果更为准确可靠。
因此,建议在测定空气中二氧化硫时使用方法B。
引言
空气中二氧化硫的测定对于环境监测和空气质量评估具有重要意义。
然而,存在多种不同的测定方法,因此需要进行方法确认实验,以确定最佳的测定方法。
本实验选择了方法A和方法B进行对比。
实验方法
1. 准备工作:准备两个测定方法所需的试剂和仪器。
2. 样品准备:收集空气样品,并进行预处理,使其符合测定条件。
3. 方法A测定:按照方法A的测定步骤进行操作,并记录实验数据。
4. 方法B测定:按照方法B的测定步骤进行操作,并记录实验数据。
5. 数据分析:对比两种方法的测定结果,并评估其准确性和可靠性。
实验结果
方法A的测定结果如下:
方法B的测定结果如下:
讨论与分析
通过对比两种方法的实验结果,我们可以发现方法B的测定结
果更为准确可靠。
其测得的二氧化硫浓度值更加接近,且有较小的
误差范围。
相比之下,方法A的测定结果存在较大的误差和不一致性。
这可能是由于方法A的操作步骤不够精确或存在其他误差来源。
结论
根据实验结果和分析,我们可以得出结论:在测定空气中二氧
化硫时,方法B更适用于该实验,具有更高的准确性和可靠性。
建
议在进行二氧化硫测定时采用方法B,并进行进一步的优化和改进,以提高测定结果的精确度。


实验十三空气中二氧化硫含量的测定(甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法)一、概述二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性气体,沸点-10℃;熔点-76.1℃;对空气的相对密度2.26。
极易溶于水,在0℃时,1L水可溶解79.8L,20℃溶解39.4L。
也溶于乙醇和乙醚。
二氧化硫是一种还原剂,与氧化剂作用生成三氧化硫或硫酸。
二氧化硫对结膜和上呼吸道粘膜具有强烈辛辣刺激性,其浓度在0.9mg/m3或大于此浓度就能被大多数人嗅觉到。
吸入后主要对呼吸器官的损伤,可致支气管炎、肺炎,严重者可致肺水肿和呼吸麻痹。
二氧化硫是大气中分布较广,影响较大的主要污染物之一,常常以它作为大气污染的主要指标。
它主要来源于以煤或石油为燃料的工厂企业,如火力发电厂、钢铁厂、有色金属冶炼厂和石油化工厂等.此外,硫酸制备过程及一些使用硫化物的工厂也可能排放出二氧化硫。
测定二氧化硫最常用的化学方法是盐酸副玫瑰苯胺比色法,吸收液是四氯汞钠(钾)溶液,与二氧化硫形成稳定的络合物。
为避免汞的污染,近年用甲醛溶液代替汞盐作吸收液。
二、实验目的1. 通过对空气中二氧化硫含量的监测,初步掌握甲醛溶液吸收-盐酸副玫瑰苯酚风光光度法测定空气中的二氧化硫含量的原理和方法。
2.在总结监测数据的基础上,对校区环境空气质量现状(二氧化硫指标)进行分析评价。
三、实验原理1.二氧化硫的基本性质二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性的气体,沸点为-10℃,熔点为-76.6℃,对空气的相对密度为2.26。
极易溶于水,在0℃时,1L水可溶解79.8L SO2,20℃溶解39.4L SO2,也溶于乙醇和乙醚。
SO2是一种还原剂,与氧化剂作用生成SO3或H2SO3。
2.盐酸副玫瑰苯酚分光光度法测定SO2最常用的化学方法是盐酸副玫瑰苯酚分光光度法,吸收液是Na2HgCl4或K2HgCl4溶液,与SO2形成稳定的络合物。

空气中二氧化硫的测定一、实验原理将空气中的二氧化硫被四氯汞钾溶液吸收,生成稳定的络合物,再与甲醛和盐酸副玫瑰苯胺(PRA)反应生成紫红色化合物,比色定量。
二、器材多孔玻板吸收管;气体采样器;具塞比色管25ml;分光光度计。
三、试剂1、吸收液称取10.86g二氯化汞,5.96g氯化钾,0.066g乙二胺四乙酸二钠盐溶于水中,并稀释至1L。
2、6g/L氨基磺酸溶液称取0.6g氨基磺酸,溶于100ml水中,临用现配。
3、0.2%甲醛溶液量取1mL含量为36%~38%的甲醛,用水稀释到200ml。
临用新配。
4、盐酸副玫瑰苯胺溶液储备溶液(2g/L)准确称取0.200g盐酸副玫瑰苯胺盐酸盐(PRA),其纯度不得少于95%,溶于100ml 1mol/L盐酸溶液中。
5、盐酸副玫瑰苯胺溶液使用液(0.16g/L)精确量取储备液20ml于250ml容量瓶中,加25ml 3mol/L磷酸溶液,并用水稀释到刻度。
暗处保存,可保存6个月。
6、二氧化硫标准溶液称取0.20g亚硫酸钠(Na2SO3),溶解于250ml吸收液中,放置过夜,用滤纸过滤。
此液1ml约含有相当于320~400μg二氧化硫,用下述碘量法标定浓度。
标定后,立即用吸收液稀释成1.00ml含5μg的二氧化硫标准溶液。
由于标准溶液不稳定,所以标定后当天使用。
四、采样用一支内装10.0ml吸收液的U型多孔玻板吸收管,在采样点以0.5L/min流速,采气30L(大气)或10L(车间空气)。
记录采样时的气温和气压。
五、分析步骤1、样品处理将采样后的吸收液全部转入25ml比色管中,用吸收液洗涤吸收管3次,合并洗液于比色管中,定容至25ml,此为样品液。
2、取7支10ml具塞比色管,按下表配制二氧化硫标准系列:管号0 1 2 3 4 5 6标准应用液(ml)0 0.40 0.80 1.20 1.60 2.00 样品液1.00ml 吸收液(ml) 4.0 3.60 3.20 2.80 2.40 2.00 3.003、向样品管、标准管中各加入6.0g/L氨基磺酸溶液0.40mL,混匀,放置5min。

空气中二氧化硫含量的测定一、测定原理大气中的二氧化硫在采样吸收瓶中被碳酸钠-碳酸氢钠溶液吸收后,经双氧水氧化转变成硫酸根离子。
利用离子交换的原理,可对硫酸根离子进行定量分析。
水样注入碳酸钠-碳酸氢钠溶液并流经系列离子交换树脂,硫酸根离子在流经强酸性阳离子树脂(抑制柱)时,被转换为高电导的酸型,碳酸钠-碳酸氢钠则转变成弱电导的碳酸(清除背景电导)。
用电导检测器测量被转变为相应酸型阴离子(即硫酸根离子)的电导值,经与色谱数据工作站联机检测电导信号并进行数据处理,根据峰面积定量,从而可计算硫酸根离子的含量。
通过硫酸根离子的含量可算出大气中二氧化硫的浓度。
二、仪器药品仪器:ZIC-Ⅲ型离子色谱仪及数据工作站,2 ml注射器,聚四氟乙烯采样管(内径3~5 mm),KB-6A大气采样器,玻璃过滤装置及0·8μm微孔滤膜。
试剂:1.淋洗贮备液:准确称取6·359 4 g优级纯碳酸钠和6·300 8 g优级纯碳酸氢钠,用去离子水溶解后,移入250 ml容量瓶中,并用去离子水稀释至刻度,配制成0·24 mol/L 碳酸钠+0·3 mol/L碳酸氢钠溶液。
2.淋洗使用液:取10 ml上述贮备液,用去离子水稀释至1 000 ml,配制成0·002 4mol/L碳酸钠+0·03 mol/L碳酸氢钠溶液。
3.30%双氧水。
4.电解液:准确称取分析纯硼酸6·2000g溶于去离子水,并量取11 ml浓硫酸于硼酸水溶液中,冷却后移入1 000 ml容量瓶中,用去离子水定容,配成0·2 mol/L硫酸+0·1mol/L 硼酸。
5.硫酸根离子的标准液:将分析纯硫酸钾于(105±5)℃干燥2~3 h后,称取0·906 3g,用去离子水溶解,然后移入100 ml容量瓶中。
此硫酸根的含量为5 g/L。
用移液管吸取此溶液10 ml于1 000 ml容量瓶中,用去离子水稀释、定容,此硫酸根离子的浓度为50mg/L。

空气中二氧化硫的测定方法确认实验报告实验目的:本实验旨在通过测定空气中的二氧化硫含量来确定二氧化硫的浓度,并验证所采用的测定方法的准确性和可靠性。
实验原理:二氧化硫(SO2)是一种常见的空气污染物,它会导致酸雨的形成,对环境和人类健康产生不良影响。
因此,准确测定空气中的二氧化硫浓度具有重要意义。
通常情况下,测定空气中二氧化硫含量的方法主要有吸收法和光谱法。
吸收法是指通过将空气样品通过吸收剂(如过硫酸钠溶液)中来吸收二氧化硫,然后测定所生成的硫酸盐的浓度来计算二氧化硫的含量。
光谱法主要利用二氧化硫对特定波长的光的吸收性质进行测定,根据吸光度与浓度之间的关系计算二氧化硫的浓度。
实验步骤:1.准备吸收剂:将适量的过硫酸钠溶液放入吸收瓶中,并在瓶口装有一根玻璃棒,以增大吸收面积。
2.将空气样品通过吸收瓶,并调节进气流量,使其在吸收剂中停留一定时间,以确保充分吸收二氧化硫。
3.取出吸收瓶,并通过添加盐酸来将吸收剂中的硫酸盐转化为可溶性硫酸。
4.过滤所得溶液,并使用酸碱滴定法来测定溶液中硫酸的含量。
5.计算二氧化硫的浓度。
实验结果与分析:在本次实验中,我们采用了吸收法来测定空气中二氧化硫的浓度。
通过实际操作,我们成功测定了样品中硫酸盐的含量,并计算出其中二氧化硫的浓度。
根据测定结果,我们发现二氧化硫的浓度为x mg/m³。
为验证所采用的测定方法的可靠性和准确性,我们还进行了对比实验。
在对比实验中,我们同时采用了光谱法来测定空气中二氧化硫的浓度。
通过对比两种方法的测定结果,我们发现吸收法和光谱法的结果较为一致,二氧化硫的浓度相近。
综上所述,通过本次实验,我们采用吸收法成功测定了空气中二氧化硫的浓度。
实验结果表明所采用的测定方法准确可靠,能够用于二氧化硫浓度的实际测定。
实验结论:通过本次实验,我们成功测定了空气中二氧化硫的浓度,并验证了所采用的吸收法测定方法的可靠性和准确性。
实验结果表明,空气中二氧化硫的浓度为x mg/m³。

实验十三空气中二氧化硫含量的测定(甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法)一、概述二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性气体,沸点-10℃;熔点-76.1℃;对空气的相对密度2.26。
极易溶于水,在0℃时,1L水可溶解79.8L,20℃溶解39.4L。
也溶于乙醇和乙醚。
二氧化硫是一种还原剂,与氧化剂作用生成三氧化硫或硫酸。
二氧化硫对结膜和上呼吸道粘膜具有强烈辛辣刺激性,其浓度在0.9mg/m3或大于此浓度就能被大多数人嗅觉到。
吸入后主要对呼吸器官的损伤,可致支气管炎、肺炎,严重者可致肺水肿和呼吸麻痹。
二氧化硫是大气中分布较广,影响较大的主要污染物之一,常常以它作为大气污染的主要指标。
它主要来源于以煤或石油为燃料的工厂企业,如火力发电厂、钢铁厂、有色金属冶炼厂和石油化工厂等.此外,硫酸制备过程及一些使用硫化物的工厂也可能排放出二氧化硫。
测定二氧化硫最常用的化学方法是盐酸副玫瑰苯胺比色法,吸收液是四氯汞钠(钾)溶液,与二氧化硫形成稳定的络合物。
为避免汞的污染,近年用甲醛溶液代替汞盐作吸收液。
二、实验目的1. 通过对空气中二氧化硫含量的监测,初步掌握甲醛溶液吸收-盐酸副玫瑰苯酚风光光度法测定空气中的二氧化硫含量的原理和方法。
2.在总结监测数据的基础上,对校区环境空气质量现状(二氧化硫指标)进行分析评价。
三、实验原理1.二氧化硫的基本性质二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性的气体,沸点为-10℃,熔点为-76.6℃,对空气的相对密度为2.26。
极易溶于水,在0℃时,1L水可溶解79.8L SO2,20℃溶解39.4L SO2,也溶于乙醇和乙醚。
SO2是一种还原剂,与氧化剂作用生成SO3或H2SO3。
..2.盐酸副玫瑰苯酚分光光度法测定SO2最常用的化学方法是盐酸副玫瑰苯酚分光光度法,吸收液是Na2HgCl4或K2HgCl4溶液,与SO2形成稳定的络合物。
空气中二氧化硫的测定一、实验准备1、氢氧化钠溶液,c(NaOH)=1.5mol/L:称取6.0g NaOH,溶于 100ml 水中。
2、环已二胺四乙酸二钠溶液,c(CDTA-2Na)=0.05mol/L:称取1.82g 反式1,2-环已二胺四乙酸[(trans-1,2-cyclohexylen edinitrilo)tetraacetic acid,简称 CDTA-2Na],加入氢氧化钠溶液6.5ml,用水稀释至 100ml。
3、甲醛缓冲吸收贮备液:吸取36%~38%的甲醛溶液5.5ml,CDTA-2Na溶液20.00ml;称取2.04g 邻苯二甲酸氢钾,溶于少量水中;将三种溶液合并,再用水稀释至 100ml,贮于冰箱可保存1年。
4、甲醛缓冲吸收液;用水将甲醛缓冲吸收贮备液稀释 100 倍。
临用时现配。
5、氨磺酸钠溶液,ρ(NaH2NSO3)=6.0g/L:称取0.60g氨磺酸[H2NSO3H]置于100ml烧杯中,加入4.0ml 氢氧化钠,用水搅拌至完全溶解后稀释至 100ml,摇匀。
此溶液密封可保存10d。
6、亚硫酸钠溶液,ρ(Na2SO3) =1g/L:称取0.2g亚硫酸钠(Na2SO3),溶于200ml EDTA-2Na (4.14)溶液中,缓缓摇匀以防充氧,使其溶解。
放置2h~3h后标定。
此溶液每毫升约相当于400μg 二氧化硫。
7、二氧化硫标准溶液,ρ(Na2SO3)= 1.00μg/ml:用甲醛吸收液将二氧化硫标准贮备溶液稀释成每毫升含 1.0μg 二氧化硫的标准溶液。
此溶液用于绘制标准曲线,在4℃~5℃下冷藏,可稳定1个月。
二、实验步骤1. 采样:根据空气中二氧化硫浓度的高低,采用内装10.00ml吸收液的U型多孔玻板吸收管,以0.5L/min的流量采样。
记录采样时的气温和气压。
2. 样品处理:将采样后的吸收液放置10-20min,然后全部转入10ml比色管中,用少量吸收液洗涤吸收管,合并洗液于比色管中,并用吸收液稀释至刻度,此为样品液。
大气中二氧化硫的测定2110902103 龚艳伟一、实验目的1.熟悉大气中二氧化硫的测定的原理及过程。
2.掌握大气中二氧化硫的测定的实验操作.二、实验原理—重量法二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,再与甲醛及盐酸副玫瑰苯胺作用,形成紫红色络合物,根据颜色深浅,比色定量。
四氯汞钾:HgCl2+2KCl=K2[HgCl4]吸收SO2: [HgCl4]2-+SO2+H2O=[HgCl2SO3]2-+2H++2Cl-加盐酸和甲醛: [HgCl2SO3]2—+HCHO+2H+=HgCl2+HOCH2SO3H加副品红,显色:三、样品采集:用内装5mL四氯汞钾吸收液的多孔玻板吸收管,以0.5L/ min流量采气10-20L,在采样、样品运输及存放过程中应避免日光直接照射。
四、实验步骤1.标准曲线的绘制取8支具塞比色管,按表配制标准色列:管号0 1 2 3 4 5 6 70 0.6 1.0 1.4 1.6 1.8 2.2 2.7二氧化硫标准溶液(mL)5.0 4.4 4.0 3.6 3.4 3.2 2.8 2.3四氯汞钾,mL0 1.2 2.0 2.8 3.2 3.6 4.4 5.4二氧化硫含量, μg各管中加入0.50mL氨基磺酸胺溶液,摇匀。
再加入0.50mL甲醛溶液及1.50mL盐酸副玫瑰苯胺溶液,摇匀。
当室温为15~20℃,显色30min;室温为20~25℃,显色20min;室温为25~30℃,显色15min。
用10mm比色皿,在波长575nm处,测定吸光度。
2.样品测定将吸收管中的样品溶液全部移入比色管中,用少量水洗涤吸收管,并入比色管中,使总体积为5mL。
以下步骤同标准曲线的绘制。
五、结果计算大气中二氧化硫的浓度X SO2(mg SO2/m3):X SO2 = (A-A。
)B S/V0式中:A——样品溶液吸光度;A0——试剂空白液吸光度;B S———核准因子,μg/吸光度单位;V0——换算为标准状态下(0℃,101325P a)的采样体积,LB S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 )]/n式中:W N为SO2的含量(μg)n为标液份数V0= V t*273/(273+t)*P/101.3式中:V t为采样温度为t,压力为P的采样体积,LP:现场采样压力,K P a由实验测得样品吸光度为0.111,采样流量为0.5L/min,采样时间为30min,采样温度为T=280K,大气压P=102.8kpa则带入公式得,V0=14.8L X SO2 = 24.5(mg SO2/m3)六、注意事项1.温度对显色影响较大,温度越高,空白值越大。
空气中二氧化硫的测定
空气中二氧化硫含量测定实验方案设计及实践活动
一、实验背景:空气中的主要污染物有二氧化硫、氮氧化物、粒子状污染物、酸
雨等。
二氧化硫主要由燃煤及燃油等含硫物质冷却产生,另外就是源自自然界,
如火山爆发、森林起火等。
因此,在某些厂矿企业、马路边、居民集中的住宅区
等空气中二氧化硫的含量可能将偏高,导致环境污染。
二、实验原理:将二氧化硫通入碘的淀粉溶液中,溶液会由蓝色变为无色。
三、实验器材:50毫升注射器一支、小试管、三通管、拎导管的胶塞等、淀粉
碘溶液、移液管等
恳请根据上述原理和实验器材,设计一个轻便的测量装置。
五、实验过程及步骤
酿制一定浓度的碘水溶液。
(已经酿制不好,浓度为1.27克/升)。
2.准确量取5毫升碘-淀粉溶液于大使馆中。
3.挑选出测量地点。
采用注射器向试管的溶液中缓缓拉入空气。
特别注意三通管及的并使
用。
注意记录注射器推入空气的次数。
4.观测试管中的溶液颜色,直至溶液的蓝色全部消失后立即暂停灌入空气。
六、数据处理及结论。
14实验十四大气中二氧化硫物质的采集与测试实验十四.大气中二氧化硫物质的采集与测试二氧化硫是主要大气污染物之一,为大气环境污染例行监测的必测项目。
它来源于煤和石油等燃料的燃烧,含硫矿石的冶炼硫酸等化工产品生产排放的废气。
二氧化硫是一种无色、易溶于水、有刺激性气味的气体,能通过呼吸进入气管,对局部组织产生刺激和腐蚀作用,是诱发支气管炎等疾病的原因之一,特别是当其它烟尘等气溶胶共存时,可加重对呼吸道粘膜的损害。
废气与空气中二氧化硫都是必测内容之一。
表14-1.常用废气二氧化硫手工分析方法及性能比较测定空气中SO2常用方法有四氯汞盐吸收一副玫瑰苯胺分光光度法、甲醛吸收一副玫瑰苯胺分光光度法等。
两种方法的对比见表14-2表14-2.环境空气二氧化硫分析方法及性能比较本实验采用四氯汞盐吸收—副玫瑰苯胺分光光度法。
一.实验目的:掌握四氯汞钾溶液吸收,盐酸副玫瑰苯胺分光光度法测定大气中二氧化硫浓度的分析原理和操作技术,掌握采样器的使用。
二.实验原理:空气中的二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,此络合物再与甲醛及盐酸副玫瑰苯胺发生反应,生成紫红色的络合物,据其颜色深浅,用分光光度法测定。
按照所用的盐酸副玫瑰苯胺使用液含磷酸多少,分为两种操作方法。
方法一:含磷酸量少,最后溶液的pH值为1.6±0.1,呈红紫色,最大吸收峰在548nm处,方法灵敏度高,但试剂空白值高。
方法二:含磷酸量多,最后溶液的pH值为1.2±0.1,呈蓝紫色,最大吸收峰在575nm处,方法灵敏度较前者低,但试剂空白值低,是我国广泛采用的方法。
本实验采用方法二测定。
方法原理的反应式:HgCl2+2NaCL=Na2HgCl4(四氯汞钠) HgCl2+2KCL=K2HgCl4(四氯汞钾)〔HgCl4〕2-+SO2+H2O→〔HgCl2SO3〕2-+2Cl-+2H+(二氯亚硫酸汞的络离子)此结合物中加入盐酸付玫瑰苯胺和甲醛的溶液后,先与甲醛反应:〔HgCl2SO3〕2+HCHO十2H+→HgCl2+HOCH2SO3H(羟基甲基磺酸)盐酸付玫瑰苯按在有盐酸存在时,首先褪色成PRA无色酸。
PRA无色酸与HO-CH2-SO3H进一步反应,形成PRA甲基磺酸,呈现玫瑰紫红色。
三.实验仪器与试剂:1.实验仪器⑴多孔玻板吸收瓶(用于24h采样)。
⑵空气采样器:流量0~1L/min。
⑶分光光度计。
2.实验药剂⑴四氯汞钾吸收液(0.04 mol/L):称取10.9g氯化汞(HgCl2)、6.0g 氯化钾和0.07g乙二胺四乙酸二钠盐(EDTA-Na2),溶解于水,稀释至1000mL。
此溶液在密闭容器中贮存,可稳定6个月。
如发现有沉淀,不能再用。
⑵甲醛溶液(2.0g/L):量取36~38%甲醛(HCHO)溶液1.1mL,用水稀释至200mL,临用现配。
⑶氨基磺酸铵溶液(6.0g/L):称取0.60g氨基磺酸铵(H2NSO3NH4),溶解于100mL水中。
临用现配。
⑷盐酸副玫瑰苯胺(PRA,即对品红)贮备液(0.2%):称取0.20 g经提纯的盐酸副玫瑰苯胺,溶解于100 mL 1.0 mol/L的盐酸溶液中。
⑸磷酸溶液(3mol/L):量取41 mL85%的浓磷酸(H3PO4),用水稀释至200mL。
⑹盐酸副玫瑰苯胺使用液(0.016%):吸取0.2%盐酸副玫瑰苯胺贮备液20.00mL于250mL容量瓶中,加3mol/L磷酸溶液200mL,用水稀释至标线。
至少放置24h方可使用。
存于暗处,可稳定9个月。
⑺碘酸钾标准溶液(0.0167 mol/ L, c1/6=0.1000mol/ L):称取3.5668 g 碘酸钾(KIO3,优级纯,110℃烘干2h ),溶解于水,移入1000mL容量瓶中,用水稀释至标线。
⑻盐酸溶液(1.2mol/L):量取100mL浓盐酸(HCl),用水稀释至1000mL 。
⑼淀粉指示剂(1%):称取1.0g可溶性淀粉,用少量水调成糊状,慢慢倒入100mL沸水中,继续煮沸至至溶液澄清,冷却后贮于试剂瓶中。
⑽碘化钾溶液(10%):称取50.0g碘化钾(KI),用新煮沸并已冷却的水中配制成500mL,贮于棕色试剂瓶中。
⑾硫代硫酸钠储备液(≈0.04mol/L):称取10g硫代硫酸钠(Na2S2O3·5H2O),溶解于1000mL 新煮沸并已冷却的水中,加0.2g无水碳酸钠,贮于棕色瓶中,放置一周后标定其浓度。
若溶液呈现混浊时,应该过滤。
⑿碘储备液(0.05 mol/L ,c1/2=0.10mol/L):称取12.7g碘(I2)于烧杯中,加入40g 碘化钾和25ml水,搅拌至全部溶解后,用水稀释至1000mL ,贮于棕色试剂瓶中。
⒀碘标准使用液(0.005 mol/L c1/20.01mol/L):量取50mL 碘贮存液,用水稀释至500mL ,贮于棕色试剂瓶中。
⒁亚硫酸钠标准储备液:称取0.20g (Na2SO3)及0.010g乙二胺四乙酸二钠,将其溶解于200mL新煮沸并已冷却的水中,轻轻摇匀(避免振荡,以防充氧)。
放置2~3h后标定。
此溶液相当于含320~400μg/ml SO2,用碘量法标定出其准确浓度。
准确量取适量亚硫酸盐标准溶液,用四氯汞钾溶液稀释成每毫升含2.0 μg SO2的标准使用溶液。
四.实验步骤:1.硫代硫酸钠储备液的标定:标定方法:吸取碘酸钾标准溶液10.00mL,至于250mL碘量瓶中,加70mL 新煮沸并已冷却的水,加10mL10%碘化钾,振荡至完全溶解后,再加1.2mol/L盐酸溶液10.0mL.立即盖好瓶塞,混匀。
在暗处放置5min后,用硫代硫酸钠溶液滴定至淡黄色,加淀粉指示剂1mL,继续滴定至蓝色刚好消失。
按下式计算硫代硫酸钠溶液的浓度:2230.100010.00Na S O C V⨯=式中:V —消耗硫代硫酸钠溶液的体积(mL ); C —硫代硫酸钠溶液浓度(mol/L )。
2.亚硫酸钠标准储备液的标定:I 2+SO 2+2H 2O =2HI+H 2SO 4 I 2+2S 2O 32-=2I-+S 2O 42-标定方法:取二只250mL 碘量瓶,分别标上“A ”和“B ”,各瓶中分别加入50mL0.010mol/L 碘标准使用溶液,“A ”瓶中准确加入25mL 亚硫酸钠标准储备液(标液滴定),“B ”瓶中加入25ml 水(空白滴定),混匀后,静置5min ,分别用已标定的硫代硫酸钠标准使用溶液滴定至淡黄色,加1ml1%淀粉指示剂,继续滴定至蓝色刚刚消失,即为终点。
分别记录硫代硫酸钠溶液的用量。
(有条件需标液滴定和空白滴定各重复做一次,两次滴定所用硫代硫酸钠溶液的体积误差不超过0.05ml )。
用下式计算二氧化硫的浓度:2232()32.021000(/)25B A Na S O SO V VC C g ml -⨯⨯⨯=μ式中V A —标液滴定所用硫代硫酸钠溶液体积,ml ; V B —空白滴定所用硫代硫酸钠溶液体积,ml ; C Na2S2O3—硫代硫酸钠的浓度,mol/L ; 25—亚硫酸钠标准贮备溶液体积,ml ;32000—1m1 1mol/L的硫代硫酸钠溶液相当于二氧化硫的μg数。
3.标准曲线的绘制:取8支10mL具塞比色管,按下列参数和方法配制标准色列。
表14-3.四氯汞钾测定空气二氧化硫标准系列配制表在以各比色管中加入6.0 g/L氨基磺酸铵溶液0.50mL,摇匀。
再加2.0 g/L甲醛溶液0.50 mL及0.016%盐酸副玫瑰苯胺使用液1.50 mL,摇匀。
根据不同季节和环境条件按表2选择显色温度与显色时间。
表14-4.显色温度与显色时间关系表用1cm比色皿,于575 nm波长处,以水为参比,测定吸光度,试剂空白值不应大于0.050吸光度。
以吸光度(扣除试剂空白值)对二氧化硫含量(μg)绘制标准曲线,并计算各点的SO2含量与其吸光度的比值,取各点计算结果的平均值作为计算因子(Bs)。
4.采样量取5mL四氯汞钾吸收液于多孔玻璃吸收管内(棕色),通过塑料管连接在采样器上,在各采样点以0.5L/min流量避光采气10-20L。
采样完毕,封闭进出口,带回实验室供测定。
吸收液温度的最佳范围在23—29℃范围。
5.样品测定将采样后的吸收液放置20 min后,转入10 mL比色管中,用少许水洗涤吸收管并转入比色管中,使其总体积为5 mL,再加入0.50 mL 6g/L的氨基磺酸铵溶液,摇匀,放置10 min,以消除NOx的干扰。
以下步骤同标准曲线的绘制。
五.实验注意事项:1.用稀EDTA-2Na溶液配制亚硫酸钠溶液,浓度较为稳定。
因亚硫酸根离子被水中溶解氧氧化为硫酸根离子时,受水及试剂中痕量三价铁离子的催化,EDTA-2Na掩蔽三价铁离子后,亚硫酸根的氧化速度减慢。
1.显色温度、显色时间的选择及操作时间的掌握是本实验成败的关键。
操作中,严格控制各反应条件。
温度对显色影响较大,温度越高,空白值越大。
温度高时显色快,褪色也快,最好用恒温水浴控制显色温度。
2.PRA溶液的纯度对试剂空白夜的吸光度影响很大。
用本法提纯PRA,试剂空白显著下降。
因此,应使用精制的商品PRA。
对品红试剂必须提纯后方可使用,否则,其中所含杂质会引起试剂空白值增高,使方法灵敏度降低。
已有经提纯合格的0.2%对品红溶液出售。
废气中SO2的浓度高,不一定要求很低的试剂空白值,可以使用未经提纯的PRA配制溶液。
3.六价格能使紫红色络合物褪色,产生负干扰,故应避免用硫酸-铬酸洗液洗涤所用玻璃器皿,若已用此洗液洗过,则需用(1+1)盐酸溶液浸洗,再用水充分洗涤。
4.用过的具塞比色管及比色皿应及时用酸洗涤,否则红色难于洗净。
具塞比色管用(1+4)盐酸溶液洗涤,比色皿用(1+4)盐酸加1/3体积乙醇混合液洗涤。
5.四氯汞钾溶液为剧毒试剂,使用时应小心,如溅到皮肤上,立即用水冲洗。
使用过的废液要集中回收处理,以免污染环境。
6.采样时,吸收液温度保持在23-29℃。
用二氧化硫标准气进行吸收实验,23-29℃时吸收效率为100%,10-15℃吸收效车为95%,高于33℃或低于9℃时,吸收效率为90%。
7.吸收瓶使用后用去离子水冲洗,避免用含颗粒物的自来水冲洗堵塞玻板。
六.原始实验数据记录表:表14-5.四氯汞钾测定空气二氧化硫标准系列数据表采样地点:实验环境条件:温度:℃;湿度: %;大气压强 kPa。
七.实验数据处理:1.标准曲线数据处理用最小二乘法计算标准曲线的回归方程式:a bx y +=式中:Y —(A-A 0)校准溶液吸光度A 与试剂空白吸光度A 0之差, X —二氧化硫含量,(μg )b —回归方程的斜率(由斜率倒数求得校正因子:B s =1/b ); a —回归方程的截距(一般要求小于0.005)要求校准曲线斜率为0.044±0.002,试剂空白吸光度A 。