内部质量管理体系审核(doc 61页)
- 格式:doc
- 大小:717.50 KB
- 文档页数:62
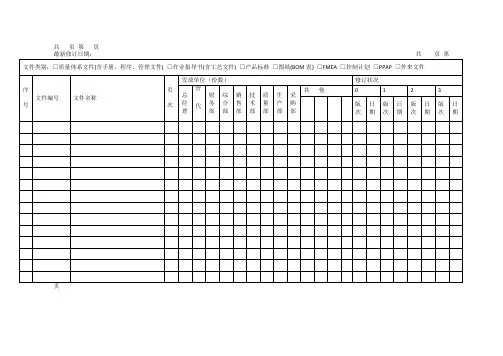
共页第页最新修订日期:共页第文件控制流程图1. 目的对质量管理体系中的文件进行规范和控制,确保文件的充分性与适宜性,确保各相关场所使用有效文件。
2. 适用范围适用于与质量管理体系有关的文件和资料的控制。
3. 职责质量部负责编制质量手册,管理者代表审核,总经理批准。
各相关业务主管部门负责编制相关的质量管理体系程序文件,相关部门主管审核、签字,质量部审定,管理者代表批准。
各相关业务主管部门负责编制其他管理性文件,相关部门主管审核、签字,综合部审定,管理者代表批准。
技术部和相关部门负责编制主管的技术文件、支持性文件,包括《工序标准操作卡》、《作业指导书》、《设备操作规程》、《检验指导书》等,并由部门主管领导审核批准。
各部门设兼职文件管理员,负责本部门文件和资料的管理工作。
4. 工作程序和要求文件的分类受控文件凡质量管理体系运行的部门(含提供认证机构)、场所、班次,使用的文件均为受控文件,包括:质量体系文件:如质量手册、程序文件和其它质量文件(表格、报告等)。
管理文件:如制度等。
技术、支持性文件:如工程图样、工程标准、数据资料、检验指导书、试验程序等。
外来文件:国家标准、行业标准、法律法规、顾客工程规范、供方记录等。
非受控文件凡于质量管理体系运行无关联的文件属于非受控文件,如行政任命、事务性通知等。
盖“非受控”章的文件为非受控文件,供有关人员参考用。
因评审、考察等用的,向上级机关或顾客提供的质量体系文件,均为非受控文件。
“非受控”文件,更改不通知,作废不回收。
文件管理质量体系文件、管理性文件由综合部归档、控制、分发和回收。
技术文件由技术部归档、控制、分发和回收。
外来文件由各相关部门接受后进行识别,对需执行的文件按受控文件进行控制和管理。
各相关部门文件由各部门进行控制和管理。
文件编号质量手册XC版文件顺序号文件代号组织简称-WI;外来文件-WL。
9等十位阿拉伯数字顺序表示,初始为0,中间不允许有空号。
(技术文件按技术文件管理规定执行)文件版本用A,B,……,Z等二十六位英文大写字母顺序表示,初始为A,中间不能有间隔。

内部质量体系审核(简体版)
内部质量体系审核是企业内部管理的一种重要工作,通过对企业内部各项质量
管理制度的审核,评估其执行情况和效果,发现问题并提出改进建议,从而提高企业整体运营效率和产品质量。
内部质量体系审核通常包括文件审核、过程审核和定期核查。
下面将分别介绍这三种审核方式的具体内容。
文件审核
文件审核是对企业内部的质量管理文件、制度以及各项质量管理相关资料的审核。
包括但不限于:质量手册、程序文件、记录表、规范标准等。
文件审核的目的是检查文件内容是否符合相关标准要求,是否与实际操作相符,是否能够有效指导、规范和保证企业内部管理的质量。
过程审核
过程审核是对企业内部各项操作过程的审核,包括但不限于原材料采购、生产
加工、产品检测、包装运输等各个环节。
过程审核的目的是检查各个环节是否按照相关的质量管理要求进行操作,是否能够有效地控制和保证产品质量,是否存在潜在风险和问题。
定期核查
定期核查是对企业内部质量体系的全面检查和评估,通常由内部质量管理团队
或者外部专业机构进行。
定期核查的主要内容包括对质量体系的组织结构、人员配备、制度执行、内部流程等方面进行全面评估,发现潜在问题并提出改进建议,以确保企业内部质量体系的有效运行。
综上所述,内部质量体系审核是企业内部管理中不可或缺的一环,通过文件审核、过程审核和定期核查等方式,可以全面评估企业内部质量管理情况,发现问题并及时改进,从而提高企业的竞争力和产品质量,推动企业的持续发展。

中国认证认可协会质量管理体系审核员注册准则(GB/T 27024认可项目)第2版文件编号:CCAA-108发布日期:2007年1月18 日实施日期:2007年6月1日©版权2007-中国认证认可协会质量管理体系审核员注册准则类别本准则为中国认证认可协会(CCAA)人员注册规范类文件。
本准则规定了中国认证认可协会运作其质量管理体系审核员注册项目时遵循的原则。
本准则经国家认证认可监督管理委员会(CNCA)同意,中国认证认可协会批准发布。
批准编制:CCAA 日期:2006年10月25日批准:CCAA 日期:2007年1月18日实施:CCAA 日期:2007年6月1 日信息所有CCAA文件都用中文发布。
标有最近发布日期的中文版CCAA文件是有效的版本。
CCAA将在CCAA网站上公布所有CCAA相关准则的最新版本。
关于CCAA和CCAA审核员注册的更多信息,请与CCAA人员注册部联系,联络地址如下:地址:北京市朝阳区朝外大街甲10号中认大厦13层邮编:100020email:pcc@版权©版权2007-中国认证认可协会前言中国认证认可协会(CCAA)是国家认证认可监督管理委员会唯一授权的依法从事认证人员认证(注册)的机构,开展管理体系审核员、认证咨询师、产品认证检查员和认证培训教师等的认证(注册)工作。
CCAA是国际人员认证协会(IPC)的全权成员,加入了IPC-QMS/EMS审核员培训与注册国际互认协议,人员注册结果在世界范围内得到普遍承认。
本准则由CCAA依据《中华人民共和国认证认可条例》、国家质量监督检验检疫总局《认证及认证培训、咨询人员管理办法》(质检总局令第61号)制定,遵循了IPC《QMS和EMS 审核员认证制度开发规范第四版》(BD-05-007)、GB/T 27024-2004《合格评定人员认证机构通用要求》和GB/T 19011-2003《质量和(或)环境管理体系审核指南》,是建立质量管理体系(GB/T19001)审核员国家注册制度的基础性文件。
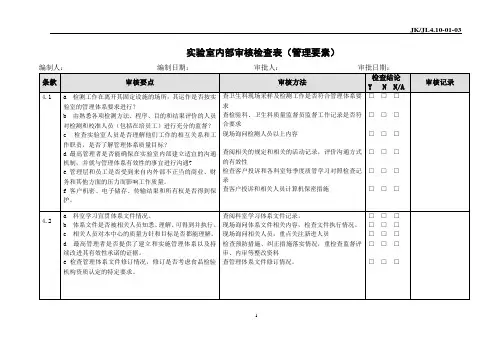
实验室内部审核检查表(管理要素)
1
2
3
注:应逐个条款进行审核打“√”;“Y”表示符合,“N”表示不符合,“N/A”表示某条款不适用,并在“审核记录”中作简要描述。
被审核部门:被审核部门负责人:
内审组长/内审员签字:审核日期:
4
实验室内部审核检查表(技术要素)
5
6
7
注:应逐个条款进行审核打“√”;“Y”表示符合,“N”表示不符合,“N/A”表示某条款不适用,并在“审核记录”中作简要描述。
被审核部门:被审核部门负责人:
内审组长/内审员签字:审核日期:
8
食品检验机构内部审核检查表
9
10
11
注:应逐个条款进行审核打“√”;“Y”表示符合,“N”表示不符合,“N/A”表示某条款不适用,并在“审核记录”中作简要描述。
被审核部门:被审核部门负责人:
12
内审组长/内审员签字:审核日期:
13。
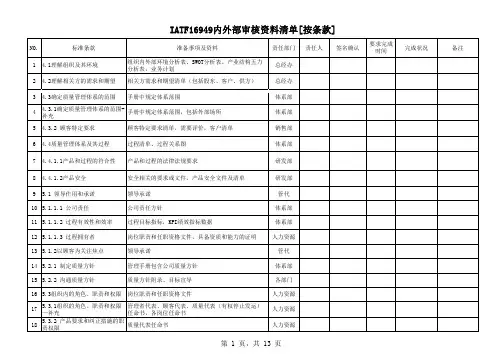
NO.标准条款准备事项及资料责任部门责任人签名确认要求完成时间完成状况备注1 4.1理解组织及其环境组织内外部环境分析表、SWOT分析表、产业结构五力分析表,业务计划总经办2 4.2理解相关方的需求和期望相关方需求和期望清单(包括股东、客户、供方)总经办3 4.3确定质量管理体系的范围手册中规定体系范围体系部44.3.1确定质量管理体系的范围-补充手册中规定体系范围,包括外部场所体系部5 4.3.2 顾客特定要求顾客特定要求清单,需要评价,客户清单销售部6 4.4质量管理体系及其过程过程清单、过程关系图体系部7 4.4.1.1产品和过程的符合性产品和过程的法律法规要求研发部8 4.4.1.2产品安全安全相关的要求或文件,产品安全文件及清单研发部9 5.1 领导作用和承诺领导承诺管代10 5.1.1.1 公司责任公司责任方针体系部11 5.1.1.2 过程有效性和效率过程目标指标,KPI绩效指标数据体系部12 5.1.1.3 过程拥有者岗位职责和任职资格文件,具备资质和能力的证明人力资源13 5.1.2以顾客为关注焦点领导承诺管代14 5.2.1 制定质量方针管理手册包含公司质量方针体系部15 5.2.2 沟通质量方针质量方针附录、目标宣导各部门16 5.3组织内的角色、职责和权限岗位职责和任职资格文件人力资源175.3.1组织的角色、职责和权限—补充管理者代表、顾客代表、质量代表(有权停止发运)任命书,各岗位任命书人力资源185.3.2 产品要求和纠正措施的职责权限质量代表任命书人力资源IATF16949内外部审核资料清单[按条款]557.5.1.1 质量管理体系文件质量体系文件[一、二、三级文件,四级表单]体系部567.5.2创建和更新7.5.3形成文件的信息的控制文件控制程序,文件清单、发放、回收记录文控部577.5.3.2.1 记录保存记录控制程序,记录清单,记录保存查阅文控部587.5.3.2.2 工程规范工程标准/规范及相关修订的评审、分发和实施等研发部598.1运行策划和控制运行控制程序,变更管理确认书研发部608.1.1 运行策划和控制——补充产品实现策划研发部618.1.2 保密正在开发的顾客签约产品和项目及有关产品信息的保密研发部628.2.1 顾客沟通书面或口头沟通销售部638.2.1.1 顾客沟通——补充书面或口头沟通,口头沟通应形成记录销售部648.2.2 与产品和服务有关的要求的确定客户输入要求清单,包括ROHS和环境等法律法规要求销售部658.2.3 与产品和服务有关的要求的评审合同评审文件及记录销售部668.2.3.1.1产品和服务要求的评审—补充顾客输入评审,包括ROHS和环境等法律法规要求研发部678.2.3.1.2 顾客指定的特殊特性特殊特性清单研发部688.2.3.1.3 组织制造可行性制造可行性分析研发部698.2.4产品和服务要求的更改客户要求更改[如有]研发部708.3.1 产品和服务的设计和开发总则制定设计和开发流程文件研发部718.3.1.1产品和服务的设计和开发——补充产品和过程开发文件,着重于错误预防(如防错作业指导书、样件清单、防错点检表)研发部728.3.2设计和开发策划产品质量先期策划控制程序研发部738.3.2.1设计和开发策划——补充项目管理,项目资料【套】研发部项目部748.3.2.2 产品设计技能设计人员技能矩阵表或资质证明等研发部项目部758.3.2.3 带有嵌入式软件的产品的开发不适用768.3.3设计和开发输入设计开发输入资料研发部项目部778.3.3.1 产品设计输入APQP先期策划成套资料(包括可靠性分析、替代选择、人体工学要求、FTA故障分析、特殊特性清单、CMK设备能力指数、产能分析等)研发部项目部788.3.3.2 制造过程设计输入APQP先期策划成套项目资料(包括可靠性分析、替代选择、人体工学要求、FTA故障分析、特殊特性清单、CMK设备能力指数、产能分析等)研发部项目部798.3.3.3 特殊特性特殊特性清单,评审等研发部项目部808.3.4设计和开发控制产品质量要求、评审、验证和确认记录研发部项目部818.3.4.1 监视产品开发质量目标研发部品质部828.3.4.2 设计和开发确认APQP先期策划成套资料(包括可靠性分析、替代选择、人体工学要求、FTA故障分析、特殊特性清单、CMK设备能力指数、产能分析等)研发部项目部838.3.4.3 原型样件方案APQP先期策划成套资料(包括可靠性分析、替代选择、人体工学要求、FTA故障分析、特殊特性清单、CMK设备能力指数、产能分析等)研发部项目部848.3.4.4 产品批准过程项目资料,PPAP生产件批准研发部项目部1118.4.3外部供方的信息IQC检验报告对环保的确认品质部1128.4.3外部供方的信息原材料限用物质含量调查表品质部1138.4.3外部供方的信息应急措施采购部1148.4.3.1 外部供方的信息——补充传递特性、法律法规要求采购部品质部1158.5.1生产和服务提供的控制防错案例研发部1168.5.1生产和服务提供的控制生产记录、点检表等生产部门1178.5.1生产和服务提供的控制首未件记录、巡检记录、SPC报告等品质部1188.5.1.1 控制计划现场各过程须有受控发行的控制计划各部门1198.5.1.2 标准化作业—操作指导书和目视标准作业SOP,实际作业与SOP一致生产部门1208.5.1.3 作业准备的验证首末件验证记录,外观样件[包括标准样件、限度样等/不良样件等]品质部1218.5.1.4 停工后的验证重新开机须再次做首件确认品质部1228.5.1.5 全面生产维护 设备台帐,设备维护保养流程、保养记录,备品备件清单,库存库存,OEE(全局设备效率 )、MTBF(平均故障间隔时间 和 MTTR(平均维修时间)企划部1238.5.1.6 生产工装及制造、试验、检验工装和设备的管理工装易损件更换计划及更换、模具履历表、模具维护计划及相关记录,工装模具台帐、标识,设备检修计划及相关记录,备品备件清单,备品库存管理,报废处置记录设备工装17610.2.5 保修管理体系/17710.3 持续改进请各部门提供本年度的持续改进实施情况以及下一年度的持续改进计划各部门17810.3.1 持续改进——补充持续改进计划表,持续改进验证表,持续改善课题登记表,QCC,六西格玛、品管圈各部门179其它员工激励文件及记录人力资源180其它新产品项目清单项目部181其它往年外审不符合项的改善情况体系部182其它压力容器校验(储气罐3年/次,安全阀1年/次,压力表1年/次)总经办183其它压力管道校验3年/次,阀门、压力表半年/次总经办184其它公司消防设施的日常点检、更换及年度检测总经办185其它特种作业人员名单(电工、叉车等)人力资源186其它特殊作业人员体检资料人力资源187其它质量成本分析,不良质量成本财务部188其它业务计划销售部。

质量体系程序文件目录01 DL—QP 401—2011《文件控制程序》02 DL - QP402-2011《质量记录控制程序》03 DL - QP 601—2011《人力资源控制程序》04 DL —QP701-2011《与顾客有关过程的控制程序》05 DL —QP702-2011《采购控制程序》06 DL - QP703—2011《生产与服务运作控制程序》07 DL —QP 801-2011《顾客满意度控制程序》08 DL - QP802—2011《内部质量管理体系审核控制程序》09 DL - QP803-2011《过程和产品的监视和测量程序》10 DL - QP804-2011《不合格品控制程序》11 DL —QP805-2011《纠正和预防措施控制程序》文件控制程序DL—QP401—20111 目的对质量管理体系中的管理性、技术性文件和资料,包括外来文件进行控制,确保对质量有影响的场所均能得到和使用有效版本的文件和资料。
2 适用范围本程序适用于与质量管理体系和产品质量有关的文件和资料的控制.3 职责3。
1总经理负责质量手册的批准和发布;3.2管理者代表负责程序文件的批准和发布;3.3相关部门主管负责第三层次文件的批准和发布;3。
4办公室负责文件和资料的统一归档、借阅和保存等管理工作,有关人员配合执行。
4 工作程序4.1 文件和资料的范围a)质量管理体系管理性文件:包括质量手册、程序文件和各类管理办法、制度等与质量管理有关的文件和资料;b) 质量管理体系技术性文件: 包括监视和测量规范/规程、技术规范、技术图纸等;c) 外来文件和资料:顾客或供方提供的文件和资料;监视、测量装置和产品销售以及服务所用设备的有关技术资料;本公司采用的有关国家标准、行业标准、法律、法规等。
4.2 文件和资料的标识4.2.1质量管理体系管理性文件的标识由管理者代表负责按本程序要求实施;外来文件和资料的编号沿用原有编号。

《质量管理体系(qms)审核员注册准则》实施说明《质量治理体系(QMS)审核员注册准则(第2版)》实施讲明第1版(第1次修订)编号:CNAT-313公布日期:2005年02月03日《质量治理体系(QMS )审核员注册准则(第2版)》实施讲明CNAT 《质量治理体系审核员注册准则(第2版)》已于2004年10月26日公布,于2005年1月1日起实施。
为便于第二版QMS 审核员注册准则的明白得和实施,制定本指南性文件。
为了便于对比和明白得,本文件将第二版QMS 审核员注册准则中需要讲明的有关条款原文摘录,再加以讲明,在条款号前加字母“G ”作为标识。
本文件将及时更新。
G0.1申请人若所有的审核经历均为2004年12月31日前获得,应于2005年3月31日前提交申请,CNAT 可依据第一版QMS 审核员注册准则的要求实施评判和注册。
凡2005年4月1日(含4月1日)以后提交申请的,均按照CNAT 第二版QMS 审核员注册准则实施评判和注册。
G0.2申请人提交的审核经历中既有2004年12月31日往常获得的,又有2005年1月1日以后获得的,则按照CNAT 第二版QMS 审核员注册准则实施评判和注册。
其中2004年12月31日前的经历应符合CNAT 第一版准则的要求。
第一章G1.1.4应专门关注国家认证认可方面的法律法规,要紧包括:《中华人民共和国认证认可条例》;国家质检总局2004年61号令《认证及认证培训、咨询人员治理方法》;国认可〔2004〕60号《关于留存具有认证资格的国家公务员认证注册档案有关咨询题的通知》国认可〔2004〕70号《关于认证及认证培训、咨询人员注册有关咨询题的通知》1.2.5. CNAT QMS审核员注册应遵守逐级晋升的原则。
G1.2.5.1 升级注册的申请人需提供其前一级不(实习审核员/审核员)注册证书原件或复印件。
G1.2.5.2 再注册的申请人需提供其前一轮次(审核员/高级审核员)注册证书原件或复印件。
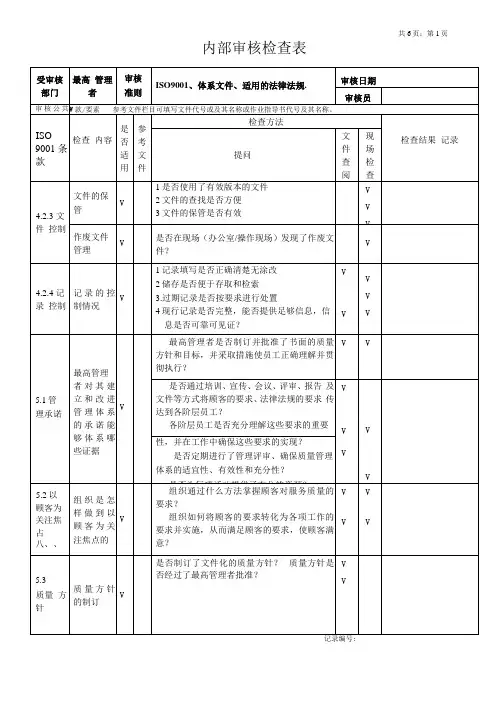
文件发放清单QSR0401-01共 3 页第 1 页编制/日期:/2002年7月28日审批/日期:/2002年7月28日文件发放清单QSR0401-01 共 3 页第 2 页编制/日期:/2002年7月28日审批/日期:/2002年7月28日文件发放清单QSR0401-01 共 3 页第 3 页编制/日期:/2002年7月28日审批/日期:/2002年7月28技术类文件更改通知单QSR0402-01 NO:文件发放/回收记录QSR0401-02塑胶制品有限公司文件反馈单QSR0401-03 NO:文件更改申请单塑胶制品有限公司文件最新状况一览表编制:审批:塑胶制品有限公司文件最新状况一览表编制:审批:塑胶制品有限公司文件复印申请单QSR0401-06技术类文件一览表QSR0402-02 共页第页编制:审核:QSR0403-01 质量记录一览表编制:审批:QSR0403-01 质量记录一览表编制:审批:QSR0403-01 质量记录一览表第3页共4页编制:审批:QSR0403-01 质量记录一览表编制:审批:QSR0501-01 质量方针、目标展开表质量方针:质量超越满意,产品持续改精修订状态:0 二0 0 二年度编制/日期:审核/日期:批准/日期:QSR0502-01产品清单NO:QSR0502-01 外贸产品清单NO:QSR0502-01江阴亚成产品清单NO:QSR0502-01惠兰灯饰产品清单NO:QSR0502-01 乐斯博产品清单NO:QSR0502-01北大方正产品清单NO:QSR0502-01沈阳华润产品清单NO:QSR0502-01八方机械厂产品清单NO:塑胶制品有限公司生产计划单QSR0502-02车间:年月日编制/日期:批准/日期:QSR0502-04要货通知单单位名称:订单号码:发货时间:年月日编制/日期:审批/日期:批准/日期:信息传递单QSR0502-05 NO:管理评审会议通知QCR0503-01 NO:会议记录塑胶制品有限公司QSR0503-03 管理评审报告共页第页生产指令表年度培训计划编制: 审核: 批准:2002 年度培训计划编制: 审核: 批准:培训效果调查表员工登记台帐员工培训记录表QSR0601-06培训需求申请单部门:NO:QSR0601-07人员上岗资格审查表培训效果考核表QSR0601-08员工培训档案QSR0601-09 NO:制表人/日期:设备维护、保养记录QSR0602-03 NO:注:1、保养结果可在相应栏目内打“√”。

国家海洋局第二海洋研究所检测中心实验室资质认定质量管理体系文件SIOSOA.Q/B程序文件(第 C/01版)编制人:冯旭文秦鹏朱德弟审核人:吕海燕批准人:沈家法受控印章:2010-09-16颁布2010-10-08 实施国家海洋局第二海洋研究所检测中心第1页共1页目录版次:第 C/01 版发布日期:2010年9月16日序号标题页码1 文件控制程序 22 检测分包管理程序 63 服务和供应品的采购管理程序 84 合同评审程序 105 申诉和投诉处理程序 126 检测偏离控制程序 147 纠正措施、预防措施及改进管理程序 178 记录控制程序 199 内部质量审核控制程序 2210 管理评审控制程序 2511 人力资源控制程序 2712 设施和环境控制程序 2913 实验室安全作业管理程序 3214 实验室环境保护管理程序 3915 检测方法控制程序 4116 检测用计算机、软件及自动观测网络控制程序 4417 仪器设备控制程序 4618 仪器运行检查程序 5119 标准物质管理程序 5220 量值溯源和校准程序 5321 样品的管理与处置程序 5522 检测数据质量控制程序 5823 质量计划编制程序 5924 检测报告控制程序 6025 开展新项目管理程序 6226 保密和保护所有权(知识产权)程序 64第1页共4页第C版第0次修订1.文件控制程序颁布日期:2010年9月16日1 目的对与质量管理体系运行有关的文件进行控制,确保各个相关场所使用的文件为有效版本。
2 适用范围适用于质量管理体系运行中有关质量活动文件(包括外来文件)的控制和管理。
3 职责3.1 中心主任负责质量手册和程序文件的批准;3.2 中心副主任负责组织质量手册和程序文件的编制和修订;3.3 中心质量总负责人负责质量手册和程序文件的审核;3.4 各部门负责人负责本部门作业文件的编制、修订和批准;3.5 各部门的专用文件及其资料由部门自行控制保管;3.6 管理小组为文件控制归口管理部门。

昆山彩德塑胶有限公司
内部审核资料
2013年第一次审核
品管课
2013.6.26.
昆山彩德塑胶有限公司
内部质量及HSF体系审核实施计划
编号:2013—1 第 2 页共 4 页
内审首次会议记录第 3 页共 4页
内审末次会议记录第 4 页共 4 页
昆山彩德塑膠有限公司
内部审核查检表
昆山彩德塑膠有限公司
内部审核查检表
昆山彩德塑膠有限公司
内部审核查检表
昆山彩德塑有限公司
Kunshan Colortek Plastic Co., Ltd
不合格項報告
昆山彩德塑有限公司
Kunshan Colortek Plastic Co., Ltd
不合格項報告
Kunshan Colortek Plastic Co., Ltd
不合格項報告
Kunshan Colortek Plastic Co., Ltd
不合格項報告
昆山彩德塑料有限公司
Kunshan Colortek Plastic Co., Ltd.
编号:2013-01。
××汽车电器有限公司质量手册文件编号:QM-A-2004版本号: A /00受控状态:发放号码:200×年12月25日发布 200%年 1月 1日实施质量手册会签名录销售副厂长生产副厂长技术副厂长审核:常务副厂长(管理者代表)日期批准:厂长日期章节号标题页码Ⅰ质量手册会前、批准页2Ⅱ质量手册更改记录31 目录42 工厂简介53 绪论64 质量管理体系84. 1 目的和目标94. 2 工作和责任94.3 过程识别和管理94. 4 文件要求124. 5 记录控制144. 6 相关文件145 管理职责155. 1 目的和目标155. 2 工作和责任155. 3 管理承诺155. 4 过程效率165.5 以顾客为关注焦点165. 6 策划165.7 职责、权限和沟通175.8 管理评审215.9 经营计划225.10 相关文件236 资源管理246. 1 目的和目标246. 2 工作和责任246. 3 资源提供24章节号标题页码6. 4 人力资源246. 5 基础设施256. 6 工作环境266.7 相关文件267 产品实现277. 1 目的和目标277. 2 工作和责任277. 3 产品实现策划287. 4 顾客有关过程297. 5 设计和开发317. 6 采购347.7 生产和服务提供357.8 监视和测量装置的控制387.9 相关文件408 测量、分析和改进418. 1 目的和目标418. 2 工作和责任418. 3 总则418. 4 监测和测量418.5 不合格品的控制438. 6 数据分析448.7 改进448.8 相关文件46附录 A 术语和定义47附录 B 控制计划54附录 C 参考文献55附录 D 文件清单57××市汽车电器有限公司始建于1982年,经过二十多年的创业、拼搏现已发展成为目前国内机动车用电器线路插接器品种规格最齐全的专业生产厂家,现有品种规格6000多种,是一汽集团、东风汽车集团、北汽福田、沈阳金杯、东南汽车、长安汽车、安汽、奇瑞、江淮汽车等汽车厂的定点配套供应商。
受控文件清单部门:编号:JL-4.2.3-1序号:编制:文件收文、发文记录部门:编号:JL-4.2.3-3序号:编制:审批:外来文件清单文件更改单文件销毁记录文件借阅单文件评审单记录清单部门:编号:JL-4.2.4-1序号:编制:审批:日期:管理评审计划管理评审记录注:若记录纸张不够,可另附记录纸。
管理评审报告培训需求单______年培训计划培训记录部门:JL-6.2-3 序号:员工档案考试、考核效果记录部门:编号:JL—6.2—5 序号:编制:日期:特殊工种人员统计表设备台帐部门:编号:JL—6.3—1 序号:编制:日期:设备检修计划部门:编号:JL—6.3—2 序号:编制:审批:设备检修单部门:编号:JL—6.3—3 序号:编制:日期:设备保养单部门:编号:JL—6.3—4设施名称:设施编号:使用部门:保养人:月:序号:注:保养后,用“V”表示日保,“△”为周保,“O”为月保,“×”表示有异常情况,应在异常情况记录栏予以记录。
产品要求评审表部门:编号:JL—7.2—1 序号:编制:日期:订货清单部门:编号:JL—7.2—2 序号:编制:审批:日期:合同修订单部门:编号:JL—7.2—3 序号:编制:顾客反馈记录供方评价记录部门:编号:JL—7.4—1 序号:编制:日期:种植户评价及合格种植户名录部门:编号:JL—7.4—2 序号:编制:日期:供方业绩评定表部门:编号:JL—7.4—3 序号:编制:日期:采购计划部门:编号:JL—7.4—4 序号:编制:审批:日期进货验证记录部门:编号:JL—7.4—5 序号:编制:评审记录部门:JL-7.3-1序号:水稻施肥记录部门:JL-7.5-3序号:水稻本田灭草施药记录部门:JL-7.5-4序号:标识卡部门:JL-7.5-2序号:标识卡部门:JL-7.5-2序号:测量装置台帐部门: JL—7.6—1 序号:编制:审批:日期:测量装置校准计划部门:编号:JL—7.6—2 序号:编制:审批:日期:内校记录表部门:编号JL—7.6—3 序号:编制:日期:顾客满意度调查表部门:编号:JL—8.2.1—1 序号:经办人:日期:调查结果及分析报告部门:编号:JL—8.2.1—2 序号:编制:日期:年度内审计划部门:编号:JL—8.2.2—1 序号:编制:审批:日期:内审实施计划内审检查表部门:编号:JL—8.2.2—3 序号:注:合格不做标记、严重不合格打×,一般不合格作√不符合报告部门:编号:JL—8.2.2—4 序号:编制:日期:内审报告部门:编号:JL—8.2.2—7 序号:编制:审批:日期:首/末次会议签到表部门编号:JL—8.2.2—8 序号:编制日期ISO19001不符合项分布表种子检验记录(半)成品检验记录不合格品报告单部门:编号:JL—8.3—1 序号:编制: 日期质量目标测评表部门:编号:JL—8.4—1 序号:编制:时间:。
第八章? 质量管理体系标准第一节概??? 述1987年ISO/TCl76发布了举世瞩目的ISO 9000系列标准,我国于1988年发布了与之相应的GB/T 10300系列标准,并“等效采用”。
为了更好地与国际接轨,又于1992年10月发布了GB/T 19000系列标准,并“等同采用ISO 9000族标准”。
1994年国际标准化组织发布了修订后的ISO 9000族标准后,我国及时将其等同转化为国家标准。
??? 为了更好地发挥ISO 9000族标准的作用,使其具有更好的适用性和可操作性,2000年12月15日ISO正式发布新的ISO 9000、ISO 9001和ISO 9004国际标准。
2000年12月28日国家质量技术监督局正式发布GB/T 19000—2000(idt ISO 9000:2000),GB/T19001— 2000(idt IS0 9001:2000),GB/T 19004--2000(idt ISO 9004:2000)三个国家标准。
?? ?一、标准的基本概念?????? 国际标准化组织(ISO)在ISO/IEC指南2—1991《标准化和有关领域的通用术语及其定义》中对标准的定义如下:标准:为在一定的范围内获得最佳秩序,对活动和其结果规定共同的和重复使用的规则、指导原则或特性文件。
该文件经协商一致制订并经一个公认机构的批准。
我国的国家标准GB 3935.1—1996中对标准的定义采用了上述的定义。
????? 显然,标准的基本含义就是“规定”,就是在特定的地域和年限里对其对象做出“一致性”的规定。
但标准的规定与其他规定有所不同,标准的制定和贯彻以科学技术和实践经验的综合成果为基础,标准是“协商一致”的结果,标准的颁布具有特定的过程和形式。
标准的特性表现为科学性与时效性,其本质是“统一”。
标准的这一本质赋予标准具有强制性、约束性和法规性。
?? ?二、GB/T 19000--2000族核心标准的构成和特点??? 1.GB/T 19000 —2000族核心标准的构成???GB/T 19000—2000族核心标准由下列四部分组成:??????(1)GB/T 19000—2000质量管理体系——基础和术语?????? GB/T 19000—2000表述质量管理体系并规定质量管理体系术语??? (2)GB/T 1 9001--2000质量管理体系——要求??????? GB/T 19001—2000规定质量管理体系要求,用于组织证实其具有提供满足顾客要求和适用的法规要求的产品的能力。
质量手册QUALITY MANUAL(依据GB/T19001-2015 idt ISO9001:2015标准)文件编号:QM01--2018受控状态:发布日期:2018年1月12日实施日期:2018年1月12日总目录0批准令0.1发布令0.2任命书1范围2引用标准和术语2.1引用标准2.2通用术语和定义2.3专用术语3概况3.1公司概况3.2手册管理4 公司的背景4.1 理解公司及其背景4.2 理解相关方的需求和期望4.3 质量管理体系范围的确定4.4 质量管理体系及其过程5 领导作用5.1 领导作用和承诺5.2 质量方针5.3 公司的角色、职责和权限6 策划6.1 风险和机遇的应对措施6.2 质量目标及其实施的策划6.3 变更的策划7 支持7.1 资源7.2 能力7.3 意识7.4 沟通7.5 形成文件的信息8 运行8.1 运行的策划和控制8.2产品和服务的要求8.3 产品和服务的设计和开发8.4 外部提供过程、产品和服务的控制8.5 生产和服务的提供8.6 产品和服务放行8.7 不合格输出的控制9 绩效评价9.1 监视、测量、分析和评价9.2 内部审核9.3 管理评审10 持续改进10.1 总则10.2不合格和纠正措施10.2 持续改进11 附录:附录1:生产工艺流程图0 批准令0.1发布令为规范公司行为,保证产品质量满足顾客和法定要求,提高公司信誉和产品竞争能力,增强顾客满意,公司建立了系统化、文件化的质量管理体系。
该体系符合GB/T19001-2015 idt ISO9001:2015标准的要求,编制了《质量手册》,规定了质量管理体系的组织结构、管理职责和质量管理体系过程的控制要求。
根据公司发展和管理提升的需要,结合2015版标准等要求,经领导层决策,发布本《质量手册》。
《质量手册》阐述了我公司新阶段的质量方针和质量目标,是实施、保持公司质量管理体系的纲领性文件和进行质量管理的公司法规,也是向顾客提供质量保证的证实文件,并作为第三方质量管理体系认证的依据,要求全体员工必须严格贯彻执行。
质量管理体系汇编目录一、连锁总部质量管理制度···················第4 页1、文件体系的管理规定·第4 页2、质量管理工作检查考核制度·第5 页3、质量方针和目标管理制度·第6 页4、质量管理体系审核制度·第8 页23、卫生和人员健康状况的管理制度··第30页24、计量管理制度··第31页25、质量教育培训及考核管理制度··第32页26、中药饮片购、存、配发管理制度··第33页27 中药临方炮制管理制度··第34页二、连锁门店质量管理制度 (38)1、质量管理工作检查考核制度·第38页2、连锁门店进货管理制度··第39页3、门店进货验收管理制度··第39页4、门店药品陈列管理制度··第40页5、门店药品养护检查管理制度··第41页6、门店处方药销售管理制度··第42页7、门店药品拆零销售管理制度··第44页8、门店卫生和人员健康状况管理制度··第44页9、门店服务质量管理制度··第45页10、门店中药饮片购、存、销管理制度··第46页52页四、连锁门店质量职责 (61)1、门店负责人岗位质量职责··第61页2、门店质量管理人员质量职责··第61页3、门店营业员质量职责··第62页4、门店养护员质量职责··第63页五、工作程序 (67)1、质量管理文件系统管理程序··第67页2、药品购进管理程序··第70页3、药品质量检查验收程序··第73页4、药品入库储存程序··第76页5、药品在库养护程序··第78页6、药品出库复核程序··第80页7、药品销后退回处理程序··第81页8、不合格药品控制性管理程序··第82页9、药品拆零和拼装发货程序··第86页10、药品配送程序··第87页●质量管理文件包括法规性文件和见证性文件两类。
内部质量管理体系的审核7.1 质量管理体系审核的分类7.1.1 质量管理体系审核的分类质量管理体系审核分为:(1) 内部质量管理体系审核,也称第一方审核,是组织的自我审核。
(2) 外部质量管理体系审核,包括第二方和第三方审核。
第二方审核是顾客对组织的审核,第三方审核是第三方性质的认证机构对申请认证组织的审核。
7.1.2 各类质量管理体系审核的区别内部质量管理体系审核与外部质量管理体系审核从审核的目的、审核方组成、审核依据、审核人员以及审核后的处理不同。
表7-1列出了它们的区别。
第二方审核,以ISO9001标准为依据,但标准中所列的条款可以剪裁,这些都应在合同中明确规定。
第三方审核,标准中所列条款一个也不能少,除非申请认证的组织有充分的理由说明可以剪裁某些条款。
7.2 质量管理体系内部审核员7.2.1 内审员的条件内审员的注册不是强制性的,企业可以自己任命内审员,内审员一般应具备下列条件:(1) 教育程度具有中专以上学历(2) 培训需接受有内审员培训资格的机构的培训,并取得培训合格证书。
(3) 工作经历三年以上工作经验,至少有一年质量管理和企业管理的经验。
(4) 个人素质思路开阔,成熟,很强的判断和分析能力,看问题客观公正,坚持原则等。
(5) 基本能力了解审核程序,方法和技巧;熟悉组织情况、管理体系文件;掌握基本的法律法规知识等。
(6) 专业能力对质量管理的原则和技术熟练,了解作业过程、产品和服务。
7.2.2 内审员的个人素质(1) 开放式思维。
愿意考虑不同的想法和观点。
(2) 善于交往。
与人交往的能力与技巧。
(3) 觉察能力。
视觉、嗅觉和听觉等感觉的应用。
(4) 反应能力。
对外界的直觉反应能力。
(5) 执着。
坚持不懈,不受外界干扰及追求目标的能力。
(6) 决定能力。
基于逻辑推理和分析技能作出决定的能力。
(7) 自信。
在与其他人开展有效交往时,坚持自身独立性的能力。
(8) 正直。
真实、真诚、诚实、慎重。
(9) 合作的能力。
(10) 行政管理能力。
保存记录、报告、策划、预算、人事管理等。
(11) 良好的心态,细心坦诚。
(12) 稳定的情绪。
感情稳定、冷静、顽强、坚韧、工作为重。
(13) 良好品德。
忠实可靠、积极、乐于助人。
(14) 良好的外在形象。
7.2.3 内审员的作用(1) ISO9000标准的宣传员。
(2) 质量工作的推动者。
(3) 质量管理体系的诊断师。
7.2.4 内审员应知应会要求(1) 应知:a. 企业产品形成的全过程。
b. 企业的质量管理体系及其文件、企业的组织结构、职能和相互关系、企业的基本业务过程和有关术语。
c. ISO9000标准ISO9000标准起着确定理论基础、统一术语和明确指导思想的作用,其中的八项质量管理原则是非常重要的内容。
d. ISO9000标准2000版ISO9001标准规定了质量管理体系的要求,既适用于组织的质量管理,也适用于对外质量保证,是证明企业能力和外部对其评价的依据。
e. ISO19011《质量和环境审核指南》阐述了审核过程、审核员的审核管理要求。
f. 相关的其他ISO9000族国际标准。
g. 必要的法律法规基础知识。
比如:产品设计中应遵循的法律法规。
(2) 应会:a. 审核方案策划,审核实施计划的编制。
b. 组成审核组。
c. 编制审核检查表。
d. 审核的方法、技巧。
e. 不合格项的确定与不合格报告的编写。
f. 审核结果的汇总分析。
g. 审核报告的编写。
h. 纠正措施的验证。
i. 组织首、未次会议。
7.2.5 内审员的工作方法和技巧(1) 正确使用检查表审核时注意不要轻易偏离检查表,以保证审核工作有序地按计划进行,但同时要注意灵活应用,不要过多的受检查表的束缚,必要时要调整检查表。
(2) 少讲、多看、多问、多听信息是通过看、问、听获得的,不能从讲话中获得。
内审员不要作任何咨询(仅可就方向性意见提出建议,但最好在不合格报告后再提出)。
不要去做裁判,受审核方内部发生争执,内审员不要扮演裁判的角色。
不要重复阐述。
有的受审部门负责人未参加首次会议,或参加了未注意听,对审核工作模糊不清,会发生临时请教内审员的情况,此时内审员不必重复阐述审核组长的讲话,应请他学习文件或向公司的总联系人了解。
(3) 选择正确的提问对象(4) 正确地提出问题,集中精力处理主要问题(5) 封闭式和开启问题相结合封闭式问题,可以用“是”、“否”、“有”、“无”等简单的词来回答,可得出明确无误的答案,但信息量少。
开启式问题,需对方作详细的解释或说明,信息量大,但占用时间较多。
审核时,一般以封闭式问题开始,再提出开启问题,最后以一两个封闭式问题结束。
开启式问题可以分为以下几类:a. 主题式问题,如:“请谈一谈文件的控制,你是如何做的?”b. 扩展式问题,如:“你认为有必要修改这个程序吗?”、“了解这类程序的重要性有什么作用?”。
c. 征求意见式问题,如:“你认为什么是最有效的方法?”d. 设想式问题,当要了解体系的应变能力或异常情况下怎样处理时,可提出设想式问题。
如:“如果供应商不能及时供货怎么办?”(6) 提问与索看相结合提问中常问及文件及其实施情况,因此在提问的同时要索看文件及观察现场。
使用此方法时,应注意避免受审核部门出示文件后,内审员只埋头细读文件而中止提问。
文件宜带回去细读。
(7) 联想与追溯如从顾客抱怨产品外表受损,就应联想到产品的包装、交付过程有无问题。
(8) 注意观察易被遗忘的角落如在某些角落,常可发现作废文件等不应存在的东西。
(9) 创造一个良好的审核气氛审核员应平等、和气待人;注意听人讲话,认真作记录;不时用点头、注视、附和等方式表示对谈话感兴趣。
索看文件、找人谈话应征求对方领导同意,发现了不合格要对方领导签字时,应耐心说明理由。
不要采用争吵的方式等等。
7.2.6 有利与有害审核的特性7.2.7 应克服的不良习惯(1) 吹毛求疵。
突出细小的缺点并喜欢深入无关紧要的细节。
(2) “逮住你了”。
千方百计寻找问题,非要找出问题不可。
(3) 傲慢。
试图证明自己胜过其他审核员。
(4) 躲避生产车间,呆在办公室里审核。
(5) 冲突。
什么事都要争个你输我赢。
(6) 过多发表个人意见。
(7) 工作计划过多改动。
7.3 内部质量管理体系审核的策划7.3.1 内审的总体安排与组织管理(1) 领导重视。
(2) 指定管理者代表亲自抓。
(3) 对于大企业,最好指定专职部门从事内部审核工作。
(4) 建立一支合格内审员队伍。
(5) 编制一份“内部质量管理体系审核程序”。
(6) 建立质量管理体系时,就应考虑内审工作。
7.3.2 审核方案的策划组织要进行内部审核方案的策划,策划时要考虑拟审核的区域和过程的状况、重要性、以及以往审核的结果。
审核方案的内容包括审核准则、审核范围、审核方法、审核方法、审核时间、资源需求等。
审核方案的安排应确保审核过程的客观与公正(包括审核员的选择、审核的实施),应保证审核人员不审核自己的工作。
对企业而言,一般一年策划一次审核方案,策划的输出为“年度内部质量管理体系审核方案”。
审核方案一般由管理者代表编制,总经理批准。
经下是策划时注意的几个问题:(1) 审核的范围审核的范围包括:质量管理体系涉及的所有部门。
质量管理体系涉及的IS9001的所有过程。
(2) 审核的频次与时机内部质量管理体系审核分为例行的常规审核和特殊情况下的追加审核。
例行的常规审核按预先编制的年度审核方案进行。
质量管理体系建立之初,频次可以多一些。
至于各部门、ISO9001各过程(条款)的审核频次,可以根据审核中发现问题的大小、多寡以及部门的重要程度来决定。
在一年的审核中,应确保所有的部门、ISO9001的所有过程至少被审核一次。
在下列特殊情况下,应追加进行内部质量管理体系审核。
a. 发生严重质量问题或用户有严重投诉。
b. 组织结构、质量方针和目标、产品、生产技术等有较大改变。
c. 将进行第二、三方审核或法律法规规定的审核。
d. 注册证书即将到期。
(3) 审核方法a. 自上而下或自下而上的审核自上而下:先到信息比较集中的部门了解总的情况,然后在此部门选择一批样本到使用样本的各部门去调查。
如对“文件控制”条款进行审核,可先到文控中心去查阅“受控文件分发清单”,选择其中的若干样本,到使用部门去核查使用现场是否有有效版本等等。
自下而上:先在许多部门调查研究,选择一批样本再到集中管理部门去核查,如对“监视和测量装置”的审核,可先在车间、质检等部门进行调查,选择一批设备作为样本,再到计量室去了解这些设备的原始档案及校准情况。
自上而下和自下而上的方法可分别采用,也可结合进行。
b. 正向和逆向的审核方法正向审核:按产品的形成过程,即从合同签定到售后服务这一全过程的顺序进行。
逆向审核:从售后服务追溯到合同签定。
此种方法特别适用于第二方审核。
c. 按ISO9001要求的过程和按部门审核按ISO9001的过程审核时,要考虑过程涉及的所有部门。
按部门审核时,要考虑部门涉及的所有ISO9001的过程。
内审一般采用按部门审核的方法。
按此法进行的审核,最后要按ISO9001的条款把各个部门的审核结果汇总整理,并得出总的结论。
(4) 日程计划a. 集中式年度审核日程计划特点:①审核在计划的某段限定的时间内进行。
②每次审核可针对ISO9001全部适用的条款(过程)及相关部门,也可针对某些条款或部门。
③审核后的纠正行动及跟踪在限定时间完成。
④适用于中、小型企业、无专职机构及人员的情况。
b. 滚动式年度审核日程计划特点:①审核持续时间较长。
②审核和审核后的纠正行动及其跟踪措施陆续展开。
③在一个审核周期内应保证所有ISO9001适用条款(过程)及相关部门得到审核。
④重要的条款(过程)和部门可安排多频次审核。
⑤适用于大、中型企业,设有专门内部审核机构或专职人员的情况。
年度审核方案案例案例7-1:集中式年度审核方案案例7-2:滚动式年度审核方案7.4 审核工作的时间分配7.4.1 审核各阶段的工作量对某一具体的审核而言,主要有四个阶段,各阶段工作量分配大致如下:(1) 审核准备40%(2) 现场审核40%(3) 审核报告的编写10%(4) 纠正措施的跟踪10%7.4.2 现场审核的工作量(仅供参考)集中式年度审核方案2002年度内部质量管理体系审核方案编号:NS20021. 审核目的(1) 第一次审核的目的:检查质量体系是否有效运行,能否正式申请认证。
(2) 第二次审核的目的:检查质量管理体系是否正常运行,评价质量管理体系的有效性和符合性。
2. 审核范围质量管理体系涉及的所有部门。
质量管理体系涉及的ISO9001的所有过程。
3. 审核准则:(1) ISO9001:2000标准(2) 质量手册、程序文件计划 审核已进行正措施已制定 纠正措施已验证编制/日期: 审核/日期: 批准/日期:滚动式年度审核方案 2003年度内部质量管理体系审核方案编号:NS20031. 审核目的检查质量体系是否正常运行,评价质量体系的有效性和符合性。