漂白剂种类和漂白原理
- 格式:doc
- 大小:140.50 KB
- 文档页数:13

漂白剂的种类及其漂白原理***化学化工学院化学教育专业06级指导教师:杨延民教授摘要 : 物质的漂白脱色是化工生产中经常遇到的问题。
根据化工产品呈色的原因不同,对不同物质采取不同的漂白方法。
我们通常使用活性炭等物理吸附剂漂白因含有色素而显色的物质。
而对因含有生色团而显色的物质漂白,一般都是使用漂白剂与其发生化学反应,我们称它为化学漂白。
根据发生化学反应机理的不同,将化学漂白剂分为氧化型漂白剂和还原型漂白剂。
本文将对一些常见的漂白剂种类及其漂白的原理进行阐述。
关键词:漂白剂;原理;氧化;还原;二氧化硫;臭氧;氯气The Type of Bleach and the Principle of BlechingWu XuemeiCollege of Chmistry and Chemical Engineering Grade2006 Instructor:Yang YanminAbstract:Many chemical products has color that we do not want, bleaching material is frequently encountered in chemical production problems. Chemical coloration for many reasons, the coloration of different products for different reasons .We use different bleach method according to the different color material. We use charcoal to bleach substances which contains the color pigments by physical adsorption. bleching stances mainly by physical adsorption and chemical reaction, bleaching agents are chemical bleach. In this paper, some common bleaching agents and the principle of bleaching are expounded.Key words : bleaching ;principle ;oxidation ;reduction;sulfu r;dioxide;ozone;chlorine引言很多物质都带有我们不希望见到的颜色,我们要使物质失去这种颜色,这就是我们通常所说的漂白。

漂白剂的工作原理和分类参考资料:中国环保网/trade/supply/index--1000100310021008--.htm吸收液用氯化汞与氯化钠作用生成四氯汞钠,当样品中的SO2与吸收液作用之后,生成一种稳定的络合物(可防止SO2的损失),这种络合物与甲醛及盐酸副玫瑰苯胺作用生成紫红色络合物,颜色的深浅与SO2浓度成正比,可在580nm下比色测定。
常用的氧化漂白剂有两种:一种是含氯漂白剂,另一种是含氧漂白剂。
一、含氯漂白剂,简称氯漂,是能释放活性氯的氧化剂,通常有氯漂水和氯漂粉。
作为漂白剂,它的漂白去污能力比氧漂强,使用氯漂可使布草白度保持及表面净化程度较好,但织物纤维在漂白过程中受到的损伤也比氧漂要大。
为此,在漂白过程中对pH 值、温度、时间和浓度要进行严格的控制,以减少织物受到的损伤。
其中温度对氯漂漂白有显著影响,提高温度,能加快漂白反应速度,缩短漂白时间。
在一定温度下,温度增加7℃左右,漂白速度可增加一倍,温度增加10℃左右漂白速度增加两倍。
专业洗涤工作量大,并希望迅速完成,因此在使用氯漂漂白织物时,通常通过适当升高温度,以提高漂白和洗涤速度。
但洗涤过程中并不是温度越高越好,要注意的是温度过高会使纤维聚合度降低。
一般建议使用氯漂的温度在60-70℃左右,时间为10-15分钟。
二、含氧漂白剂,简称氧漂,通常有氧漂剂和彩漂粉。
它对织物的漂白较温和,一般不会损伤织物,可令白色或有色织物漂白后色泽更亮丽。
常用的含氧漂白剂主要是双氧水和彩漂粉,有较好的漂白作用和杀菌作用。
氧漂是通过在水溶液中经过过羟离子游离出活性氧而产生漂白作用,在常温下,它的漂白速度比较缓慢,为了提高洗涤速率,一般在高温条件下进行漂白,既提高了漂白速度,也增加了织物的的去污力和白度。
因此通常使用双氧水洗涤漂白温度控制在80~90℃,漂白时间在10~15min。
在洗衣業上,一般使用的漂白剂,大致可分为二大类:一为氧化漂白剂,一为还原漂白剂。

各类漂白剂的漂白原理
各类漂白剂的漂白原理可以归纳为以下几种:
1. 氧漂剂:例如过氧化氢、漂白粉等。
氧漂剂可以通过释放氧气来漂白物质。
这种漂白剂会和污渍中的有机物质发生化学反应,将其氧化分解为无色或带有光泽的物质。
2. 氧化漂剂:例如酸性漂白液等。
氧化漂剂通过向物质中引入氧气或其他氧化剂,使其发生氧化反应而漂白。
氧化剂可以将有色物质中的电子转移给自身,从而使有色物质变为无色或色泽淡化。
3. 还原漂剂:例如亚硫酸盐、亚硝酸盐等。
还原漂剂通过向物质中引入电子,还原有色物质的色团,使其失去吸收光的能力而实现漂白。
这种漂白剂的漂白原理是将有色物质中的某些化学键还原断裂,从而破坏其吸收光的特性。
4. 酶类漂白剂:例如含有过氧化酶的洗衣粉。
酶类漂白剂通过特定的酶与污渍中的有机物质发生化学反应,使其分解为无色或较浅色的物质。
这种漂白剂的漂白原理是利用酶的催化作用,加速有机物质的降解反应。
除了以上的漂白原理,不同的漂白剂还可能涉及其他的成分和反应机制。
在使用漂白剂时,应根据具体的材料和污渍特性选择合适的漂白剂,遵循正确的使
用方法和注意事项,以确保安全和有效的漂白效果。

高中漂白性的原理
高中漂白性的原理是通过化学反应将染料分子转化为无色或低色度的物质,从而实现去除染料的效果。
漂白剂一般是一种强氧化剂,例如氧气、过氧化氢(H2O2)或次氯酸盐等。
漂白剂可以在一定的反应条件下与染料分子发生氧化反应,将染料分子中的色团断裂,使其失去颜色。
具体漂白过程中的一些原理如下:
1. 氧化反应:漂白剂通常是氧化剂,能够与染料中的化合物发生氧化反应。
例如,某些染料分子中的花色基团(有色团)可以通过氧化反应失去双键,从而降低或消失颜色。
2. 破坏结构:漂白剂可以改变染料分子的结构,使其失去吸收可见光的能力。
例如,过氧化氢可以与具有醛或甲醇基团的染料反应,从而使其结构发生改变,降低或消除颜色。
3. 氧化还原反应:漂白剂可以通过氧化还原反应改变染料分子的电荷状态,使其失去颜色。
在这种反应中,漂白剂捐赠电子给染料分子,从而使染料分子的电子结构发生改变,失去色彩。
4. 分解化合物:漂白剂可以将染料分子分解为无色或低色度的化合物,例如通过断裂染料分子中的化学键,使其变为无色或低色度的物质。
综上所述,高中漂白性的原理是通过化学反应改变染料分子的结构、电荷状态或分解染料分子,从而去除染料的颜色。

漂白液漂白的原理
漂白液是一种常用的清洁剂,常用于去除衣物、家具和其他物品表面的污渍和污垢。
而漂白的原理是通过漂白剂中的活性氧化剂,如次氯酸钠(NaClO)、过氧化氢(H2O2)或过硫酸钠(Na2S2O8),与被漂白物表面的有色物质发生化学反应。
在漂白剂作用下,活性氧化剂释放出氧气,氧气和有色物质发生反应,将其氧化分解成无色物质。
这些活性氧化剂能够破坏有色物质中的化学键,使其失去吸收和反射光线的能力,从而使被漂白物呈现出明亮、无色的外观。
漂白液中的活性氧化剂还可以对有机物进行氧化,将有机物中的双键、羟基、酮基等纳入反应,断裂有机物内部的化学键,使其变成无色物质。
此外,漂白还可通过活性氧化剂与有色物质中的色素分子之间的物理吸附作用,将有色分子从被漂白物表面解离、分散或溶解,以达到漂白的效果。
综上所述,漂白液漂白的原理是通过漂白剂中的活性氧化剂与有色物质发生化学反应,或物理吸附作用,将有色物质分解、氧化或去除,从而使被漂白物呈现出明亮、无色的外观。

各种漂白剂的漂白原理漂白剂是一种可以去除物体表面颜色的化学物质。
不同种类的漂白剂具有各自的漂白原理。
下面我将介绍几种常见的漂白剂的漂白原理。
1. 氯漂白剂:氯漂白剂是一种常用的漂白剂,其主要成分是含氯化合物,如次氯酸钠。
氯漂白剂的漂白原理是通过氧化反应去除颜色。
在碱性条件下,次氯酸离解为次氯酸根离子和氧气。
次氯酸根离子具有强氧化性,能够与有机色素发生氧化反应,将其还原为无色或淡色物质,从而达到漂白的效果。
2. 过氧化氢漂白剂:过氧化氢漂白剂的主要成分是过氧化氢。
过氧化氢漂白剂的漂白原理是通过氧化反应去除颜色。
过氧化氢能够释放出活性氧,从而导致有机物发生氧化反应,使其颜色褪去。
过氧化氢漂白剂在酸性条件下更容易分解,释放出氧气,因此酸性的过氧化氢漂白剂更容易起到漂白的效果。
3. 硫代硫酸盐漂白剂:硫代硫酸盐漂白剂的主要成分是亚硫酸盐或硫代硫酸盐。
硫酸亚硫酸盐可通过氧化反应发生氧化还原反应,将有机物的色素分子还原为无色物质。
硫代硫酸盐漂白剂的漂白原理可通过亚硫酸根离子(SO3^2-)或硫酸酸根离子(S2O3^2-)对有机物色素产生还原作用,去除颜色。
4. 臭氧漂白剂:臭氧漂白剂的主要成分是臭氧。
臭氧漂白剂的漂白原理是通过氧化反应去除颜色。
臭氧是一种强氧化剂,能够与有机物发生氧化反应,将其颜色褪去。
臭氧漂白剂常常用于漂白纸浆和纺织品等领域。
需要注意的是,不同种类的漂白剂具有不同的适用范围和使用条件。
在使用漂白剂时,需要根据被处理物体的特性选择合适的漂白剂,并按照使用说明正确使用,以避免产生不良反应或危害人体健康。
此外,漂白剂的使用也应遵循环保原则,减少对环境的污染。
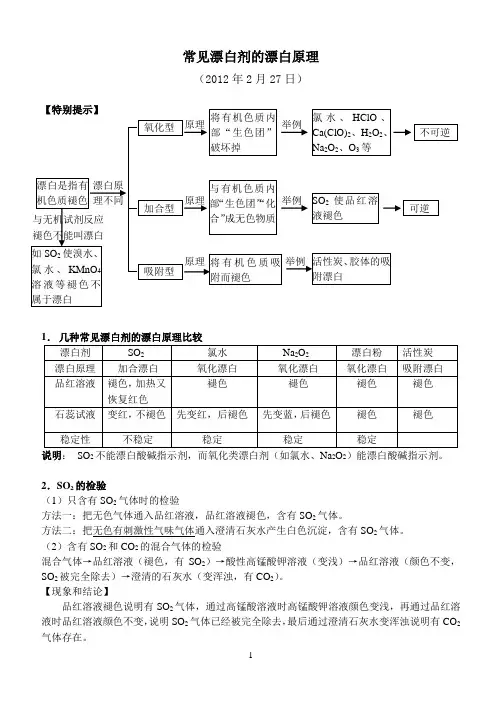
常见漂白剂的漂白原理(2012年2月27日)说明:SO2不能漂白酸碱指示剂,而氧化类漂白剂(如氯水、Na2O2)能漂白酸碱指示剂。
2.SO2的检验(1)只含有SO2气体时的检验方法一:把无色气体通入品红溶液,品红溶液褪色,含有SO2气体。
方法二:把无色有刺激性气味气体通入澄清石灰水产生白色沉淀,含有SO2气体。
(2)含有SO2和CO2的混合气体的检验混合气体→品红溶液(褪色,有SO2)→酸性高锰酸钾溶液(变浅)→品红溶液(颜色不变,SO2被完全除去)→澄清的石灰水(变浑浊,有CO2)。
【现象和结论】品红溶液褪色说明有SO2气体,通过高锰酸溶液时高锰酸钾溶液颜色变浅,再通过品红溶液时品红溶液颜色不变,说明SO2气体已经被完全除去,最后通过澄清石灰水变浑浊说明有CO2气体存在。
【发散思维】常用来鉴别和分离SO2与CO2的装置上述装置中各部分的作用:A.检验SO2的存在B.除去SO2气体C.检验SO2气体是否除去,并进一步吸收SO2D.检验CO2气体并吸收3.SO2与CO2的鉴别方法品红溶液溴水酸性KMnO4溶液FeCl3溶液氢硫酸溶液SO2褪色褪色紫色褪去黄色变为浅绿色淡黄色混浊CO2不褪色无明显现象无明显现象无明显现象无明显现象叠加化学反应方程式的计算技巧有些反应体系不只涉及一个反应,且不同的反应之间存在着某种联系,对于这样的反应体系,叠加化学反应方程式可使要解决的问题简便、明了。
叠加化学反应方程式的关键是量的关系的衔接和确定,确定量的关系常用待定系数法,它的理论依据是质量守恒。
例1:用1 L 1.0mol/L的NaOH溶液吸收0.8 mol的SO2,所得溶液中的SO32-和HSO3-的物质的量的浓度之比最接近于()A.2:1 B.1:3 C.3:2 D.2:3解析:评注:(1)若不用叠加方程式解题,则可根据SO2+2NaOH==Na2SO2+H2O和SO2+NaOH==NaHSO3两个化学反应方程式,通过列方程组求解。

常见漂白剂的漂白原理常见的漂白剂包括氯漂白剂、氧漂白剂和氨基气体漂白剂。
它们的漂白原理各不相同,下面将分别对这些漂白剂的原理进行详细介绍。
1.氯漂白剂氯漂白剂是指含有活性氯离子(Cl-)的化合物。
常见的氯漂白剂有氯气、次氯酸钠等。
氯漂白剂的漂白原理主要是氯离子对色素分子的氧化作用。
当氯气或次氯酸钠溶液中的氯离子接触到色素分子时,氯离子通过受体的氧化作用,从而将色素分子中的不饱和双键断裂,还原为无色或淡色的物质。
氯离子还可以与水分子中的氢离子结合,生成次氯酸根离子和盐酸。
次氯酸根离子以活性的形式与色素反应,实现漂白效果。
2.氧漂白剂氧漂白剂是指含有活性氧离子(O2-)的化合物,常见的氧漂白剂有过氧化氢、过硫酸盐等。
氧漂白剂的漂白原理是通过活性氧离子的氧化反应将有色物质转化为无色物质。
活性氧离子具有强氧化能力,可以直接与有机色素分子中的双键、芳环等化学结构发生反应,使其发生断裂或改变结构,从而使有色物质失去吸收光的能力,达到漂白的效果。
3.氨基气体漂白剂氨基气体漂白剂是指含有氨基气体的化合物,如氨气等。
氨基气体漂白剂的漂白原理是通过氨基分子的变化来实现漂白效果。
在碱性条件下,氨气可以与色素分子中的酮基、亚胺基等进行反应,形成新的氨基化合物。
这些新的氨基化合物具有较高的亲水性,并且没有吸收光的能力,因此呈现无色的状态,实现漂白的效果。
总结起来,常见漂白剂的漂白原理主要包括氯漂白剂的氧化反应、氧漂白剂的氧化反应和氨基气体漂白剂的化学反应。
这些化学反应都会导致有色物质的结构发生改变或破坏,使其失去吸收光的能力,从而实现漂白的效果。
漂白剂在漂白过程中需要注意使用方法和配比,以避免对被漂物质造成损害。

相互补充中能归纳漂白物质的原理
漂白物质的原理主要是通过氧化或还原过程来去除或减少物质的颜色。
漂白物质可以分为化学漂白和物理漂白两种类型。
化学漂白是指利用化学氧化剂或还原剂来改变染料或色素的结构,使其失去颜色或变得不可见。
常见的氧化漂白剂包括过氧化氢和次氯酸钠,它们能够氧化染料分子中的双键或芳香环结构,从而破坏颜色分子的结构,使其失去颜色。
而还原漂白剂则通过还原染料分子中的色基团或使其转化为无色物质来达到漂白的效果。
物理漂白是指利用物理手段如紫外线、高温或高压等来破坏染料或色素的结构,使其失去颜色。
紫外线漂白是通过紫外线的能量破坏染料或色素的结构,使其褪色。
高温漂白则是利用高温加速染料分子的分解和褪色过程。
总的来说,漂白物质的原理主要是通过化学氧化还原或物理手段来改变染料或色素的结构,使其失去颜色或变得不可见。
不同的漂白物质有不同的原理和适用范围,选择合适的漂白物质需要根据具体的应用需求和处理对象来进行综合考虑。

漂白剂的原理
漂白剂是一种常见的清洁剂,它可以有效去除衣物、餐具等物品上的污渍,使
其恢复洁净。
那么,漂白剂的原理是什么呢?下面我们来详细介绍一下。
首先,漂白剂的主要成分是氯漂白剂,它的化学名称是次氯酸钠。
次氯酸钠是
一种强氧化剂,具有很强的氧化性。
在漂白剂的使用过程中,次氯酸钠会释放出活性氧,这种活性氧可以与有机物发生化学反应,使其分子结构发生改变,从而去除污渍。
其次,漂白剂的原理是利用次氯酸钠对有机物的氧化作用。
有机物是由碳、氢、氧等元素组成的化合物,而次氯酸钠可以与有机物中的双键、三键等进行氧化反应,使其分解成低分子化合物,从而起到漂白的作用。
此外,漂白剂还可以通过漂白过程中释放出的氯气进行漂白。
氯气是一种强氧
化剂,可以与有机物发生氧化反应,使其分子结构发生改变,从而达到漂白的效果。
总的来说,漂白剂的原理是利用次氯酸钠的氧化性质,通过释放活性氧或氯气
与有机物发生化学反应,使其分子结构发生改变,从而达到漂白的效果。
在使用漂白剂时,需要注意控制使用浓度和时间,避免对物品造成损坏。
同时,漂白剂在使用过程中会释放出有害气体,因此需要在通风良好的环境下使用,并注意保护好自己的皮肤和呼吸道。
总之,漂白剂的原理是利用次氯酸钠的氧化性质,通过释放活性氧或氯气与有
机物发生化学反应,使其分子结构发生改变,从而达到漂白的效果。
希望本文能帮助大家更好地理解漂白剂的原理,正确合理地使用漂白剂,让我们的生活更加清洁、整洁。

漂白剂的种类和漂白原理漂白剂是一种化学物质,可以将物体上的色素或杂质去除,使物体变得更加白净。
常见的漂白剂有氯漂白剂、过氧化氢、过氧化物等。
漂白剂常用于清洁和美白纺织品、纸张和其他物品。
1.氯漂白剂:氯漂白剂是最常见、最广泛使用的漂白剂。
氯漂白剂通常以含氯化合物形式存在,如次氯酸钠、次氯酸钙等。
在水中溶解后,氯漂白剂会释放出氯离子,氯离子与物体表面的色素或杂质反应,将其氧化分解,从而起到漂白的效果。
2.过氧化氢:过氧化氢漂白剂也常被称为氧漂白剂。
过氧化氢溶液可以直接用于漂白,也可以作为其他漂白剂的成分之一、过氧化氢通过释放氧气来漂白物体表面的色素或杂质。
过氧化氢也常用于医疗和消毒领域。
3.过氧化物:过氧化物是一类化学物质,包括过硫酸盐和过氧化物。
过氧化物可以被用作漂白剂,并且在一些特殊的应用中拥有较高的效果。
过硫酸盐和过氧化物在水中溶解后会释放活性氧,从而氧化漂白物体表面的色素或杂质。
漂白剂的原理:漂白剂的原理可以归结为两个主要的化学反应:氧化和光解。
1.氧化反应:漂白剂通过释放氧气氧化漂白物体上的色素或杂质。
这种氧化反应会分解色素分子的结构,破坏其对可见光的吸收,从而达到漂白的效果。
氯漂白剂、过氧化氢和过氧化物都能通过氧化反应来起到漂白的作用。
2.光解反应:漂白剂中的一些化学物质在受到光照时,会发生光解反应,产生氢氧根离子(OH-)。
氢氧根离子具有强氧化性,可以进一步氧化色素分子或杂质,从而实现漂白的效果。
光解反应常见于过氧化氢和过氧化物等漂白剂中。
此外,漂白剂还可通过其他方式起到漂白的效果,如与漂白物体上的色素形成不溶的复合物,从而使色素离开物体表面,达到漂白的目的。
总结起来,漂白剂通过氧化或光解等化学反应,能够分解漂白物体表面的色素或杂质,使物体变得更加白净。
不同的漂白剂根据原理不同,具有不同的适用性和漂白效果。
在使用漂白剂时,需要注意其使用方法和浓度,以免造成不必要的伤害。
⾐物洗涤知识:漂⽩的类型与原理详解对于⾊织物表⾯⽩度的提⾼和对颜⾊织物表⾯鲜艳度的保持和促进,必须经过良好合理的主洗过程,漂⽩只是⼀个辅助的⼿段。
氧化——氧化或新⽣氧和别的物质所起的化学反应叫氧化。
还原——氢或新⽣氢和别的物质所起的化学反应叫还原。
氧化剂——凡能供给氧的物质叫氧化剂。
还原剂——凡能供给氢的物质叫还原剂。
氧化漂⽩的原理:⾊素为⼀极复杂的有机质当受到氧化作⽤时,⾊素分⼦⽴即分裂,变成其他物质,⾊素因⽽消去,变成可溶物被⽔洗去。
(因此,氧化剂漂⽩会使⽩⾊织物⽩度能保持相对长久,不易泛黄)还原漂⽩的原理:⾊素受到还原作⽤产⽣氢使⾊素还原或隐⾊体化合物,实现对⾊到素消⾊的⽬的。
(因此,还原剂漂⽩的交果不稳定,当隐⾊体化合物遇到氧时,会被重新氧化⽽变⾊)氧化漂⽩剂:(1)氧化性含氯漂⽩剂;次氯酸钙、次氯酸钠。
(2)氧化性⽆氯漂⽩剂;过氧化氢、过硼酸钠还原漂⽩剂:低亚硫酸钠。
次氯酸钠(Nac130)是⼀种⽩⾊粉末,易溶于⽔;⽆⾊或淡黄⾊并带有氯⽓味的液体,它的⽔溶液就是漂⽩⽔,它的⽔溶液在中性或酸性时,都是不稳定的。
应保持溶液有⾜够的碱度PH值在12左右。
当pH在于4.6以下时,主要成份为Nac130、Hock的cl2当pH值在4.6-8.4时,主要成份为Nac130、Nac1和Hock当pH值在8.4以上时,主要成份为Noah、Nalco和Nalco次氯酸钠是由强碱和弱酸所⽣成,在⽔溶液中能发⽣⽔解,⽣成烧碱和次氯酸,溶液呈碱性;Nac130+H2O=Noah+Chloe(次氯酸钠)(⽔)(烧碱)(次氯酸)次氯酸进⼀步分解;Chloe→Hl+〔O〕(氯化氢)(新⽣氧)次氯酸钠的漂⽩作⽤:是依赖于这种氧化能⼒极强的新⽣氧,把⾊素中的发⾊基因破坏⽽消⾊,达到漂⽩的⽬的。
影响漂⽩⼯艺因素⼀pH值、温度、浓度和时间。
漂浴的pH值:次氯酸钠溶液是⼀种不稳定的复杂化合物。
当漂浴pH值为7时,棉织物纤维经漂⽩后,聚合度会下降到70%以下,损伤⼗分严重。
重难点6 常见漂白性物质及漂白原理1、漂白剂的类型及漂白原理类型原理特点举例氧化型漂白剂本身是氧化剂,利用其氧化性氧化有色物质,使之失去原有的颜色加热时不能恢复原有的颜色NaClO、Ca(ClO)2、HClO、H2O2、O3等化合型漂白剂与有色物质结合生成新的无色物质,使之失去原来的颜色加热时能恢复原来的颜色二氧化硫等吸附型有些固体物质疏松、多孔,具有较大的比表面积,可以吸附无色物质使之失去原来的颜色部分吸附剂可以重复使用活性炭、胶体等2、SO2和Cl2漂白比较(1)(2)特别提醒(1)二氧化硫的三种“褪色”:①二氧化硫能使品红褪色表现漂白性;②使溴水、氯水及酸性高锰酸钾溶液褪色体现还原性;③使滴有酚酞的氢氧化钠溶液褪色说明其水溶液呈酸性。
(2)SO2不能漂白紫色石蕊溶液、含酚酞的NaOH溶液,而氯水能漂白。
(3)检验SO2气体的方法是将气体通入品红溶液,溶液褪色后加热又恢复到红色。
★★★【重难点考向一】二氧化硫的漂白性【例1】能证明SO2具有漂白性的是( )A.酸性KMnO4溶液中通入SO2气体后,紫色消失B.显红色的酚酞通入SO2后,红色消失C.品红溶液中通入SO2后,红色消失D.溴水中通入SO2后,橙色消失【答案】C【重难点考向二】氯气与SO2漂白原理的区分【例2】下列说法正确的是( )A.SO2能使品红溶液、溴水和酸性KMnO4溶液褪色,是因为SO2具有漂白性B.SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白效果C.活性炭使有色物质褪色是利用了碳单质的还原性D.SO2使品红溶液褪色后,将褪色后的溶液加热,溶液重新变为红色【答案】D【解析】SO2能使品红溶液褪色,表现SO2的漂白性,SO2能使溴水和酸性KMnO4溶液褪色表现SO2的还原性,A项不正确;当SO2、Cl2等物质的量同时作用于潮湿的有色物质时,发生以下反应:Cl2+SO2+2H2O=2HCl+H2SO4,失去漂白作用,B项不正确;活性炭使有机物褪色利用了碳的吸附性,C项不正确;SO2与品红结合成不稳定的无色物质,加热后又分解成原来的品红,故D项正确。
漂白液漂白原理漂白液,作为一种常见的清洁用品,被广泛应用于家庭和工业领域。
它的主要作用是去除物体表面的污渍和色斑,使物体恢复原有的洁净和明亮。
那么,漂白液是如何实现漂白的呢?接下来,我们将深入探讨漂白液的漂白原理。
漂白液的主要成分是含氯漂白剂,常见的漂白液成分包括次氯酸钠、次氯酸钙等。
漂白液的漂白原理是利用含氯漂白剂的氧化性能,将有色物质氧化分解,从而去除物体表面的污渍和色斑。
具体来说,漂白液中的次氯酸离子(ClO-)能够与有机染料分子发生氧化反应,将其分解为无色的低分子化合物,从而实现漂白的效果。
漂白液的漂白原理还涉及到漂白剂与有机物之间的化学反应。
当漂白液中的次氯酸离子与有机物接触时,会发生氧化还原反应,有机物中的双键、三键等易受氧化的化学键被氧化分解,使有机物失去色彩。
此外,漂白液中的次氯酸离子还能与有机物中的含氮化合物发生氯胺反应,进一步去除有机物表面的色斑。
漂白液在漂白过程中还会释放出氯气,氯气对有机物具有强氧化作用,能够氧化分解有机物中的双键、三键等,从而去除有机物表面的色斑。
此外,漂白液中的次氯酸离子还能与水中的有机物发生氧化反应,去除水中的有机色素,使水变得清澈透明。
总的来说,漂白液的漂白原理是利用含氯漂白剂的氧化性能,将有色物质氧化分解,从而去除物体表面的污渍和色斑。
漂白液中的次氯酸离子与有机物发生氧化还原反应,释放出氯气对有机物进行氧化分解,同时与水中的有机物发生氧化反应,去除水中的有机色素。
这些化学反应共同作用,实现了漂白液的漂白效果。
总结一下,漂白液的漂白原理是基于含氯漂白剂的氧化性能,利用氧化还原反应和氯气的氧化作用,去除物体表面的污渍和色斑。
通过深入了解漂白液的漂白原理,我们可以更好地使用漂白液,让物体恢复原有的洁净和明亮。
高中化学中具有漂白性的物质归纳常用的漂白剂有活性炭、氯水、na2o2、o3、h2o2、so2、hclo、naclo、ca(clo)2(漂白粉的有效成分)等。
吸附型漂白:活性炭、氢氧化铝胶体吸附有色物质,起到漂白作用,是物理变化。
弱水解性染料:氯水、漂白粉ca(clo)2、na2o2、o3、h2o2、naclo,具备染料性是因为它们存有弱水解性,能够将有色物质水解成无色物质。
一旦水解后就无法恢复正常原来的颜色了,因此它们的染料促进作用就是永久性的。
化合型漂白:so2有漂白作用是因为它溶于水后生成了h2so3,h2so3能够和有色有机物(如品红)结合,形成不稳定的无色化合物,无色化合物在一定条件(如加热)下,又可以恢复原来的颜色,这种漂白是暂时性漂白。
so2的漂白作用具有特殊性。
请思考以下几个问题:一.以下退色现象就是so2的染料性吗?(1)so2并使橙色溴水退色(2)so2使紫色kmno4酸性溶液褪色(3)so2使红色酚酞褪色解析:以上退色现象都不是so2的染料性所致。
(1)、(2)退色的原因就是so2的还原性。
分别出现水解还原成反应so2+br2+2h2o=h2so4+2hbr5so2+2kmno4+2h2o=k2so4+2mnso4+2h2so4(3)褪色的原因是so2溶于h2o后生成了h2so3,h2so3是酸可以使红色酚酞变为无色。
二.氯水和so2分别使紫色石蕊产生什么现象?解析:氯水中的hclo先并使紫色石蕊变白,而后因为它存有弱水解性并使红色显露。
so2溶h2o后分解成了h2so3,h2so3就是酸可以并使紫色石蕊变成红色。
而h2so3不具备弱水解性,所以红色不能显露。
三.so2和cl2混合后能否增强漂白效果?解析:无法。
因为so2和cl2混合后可以出现水解还原成反应so2+cl2+2h2o=h2so4+2hcl生成物h2so4和hcl都没有漂白作用,所以漂白效果会减弱。
当n(so2):n(cl2)=1:1时,完全失去漂白作用。
漂白剂的原理
漂白剂是一种能够去除污渍、漂白颜色的化学物质。
它的原理主要涉及两个方面:氧化和断链。
首先,漂白剂可以发生氧化反应。
漂白剂中常见的成分是含氯化合物,例如氯和次氯酸钠。
这些含氯离子在与水接触时会快速分解,释放出次氯酸根离子(ClO-)。
次氯酸根离子具有较强的氧化性,能够与许多物质中的有色物质进行氧化反应,使其失去颜色。
在这个过程中,次氯酸根离子接收了被氧化物质中的电子,从而氧化了颜色物质。
其次,漂白剂还能够断裂有机颜色物质的化学键,进一步消除颜色。
有机颜料通常由多个分子组成,这些分子通过共享一对或多对电子而形成化学键。
漂白剂的氧化性质可以破坏这些键,导致颜色化合物的分解。
通过断链反应,有机颜色物质的分子结构被破坏,使其失去颜色。
综上所述,漂白剂的原理主要是通过氧化和断链反应去除物质中的颜色。
漂白剂中的次氯酸根离子可以与有色物质中的电子发生氧化反应,使其失去颜色。
同时,漂白剂还可以破坏有机颜色物质的化学键,进一步消除颜色。
制取漂白液的原理
制取漂白液的原理是利用漂白剂的氧化性能将有机物质分解或转化为无色或不溶于水的物质。
漂白剂主要是氧化剂,常用的漂白剂有次氯酸钠(NaClO)和过氧化氢(H2O2)等。
其中,次氯酸钠是最常用的漂白剂。
次氯酸钠(NaClO)在水中被分解成次氯酸(HClO),次氯酸是一种强氧化剂,能与有机物质发生氧化反应。
次氯酸通过从有机物质中抽取氢原子或电子,将有机物质分解为无色或不溶于水的物质,从而实现漂白的效果。
漂白液的制取主要是将次氯酸钠加入适量的水中,通过混合和搅拌,使次氯酸钠分解成次氯酸,最终得到漂白液。
漂白剂的种类及其漂白原理***化学化工学院化学教育专业06级指导教师:杨延民教授摘要 : 物质的漂白脱色是化工生产中经常遇到的问题。
根据化工产品呈色的原因不同,对不同物质采取不同的漂白方法。
我们通常使用活性炭等物理吸附剂漂白因含有色素而显色的物质。
而对因含有生色团而显色的物质漂白,一般都是使用漂白剂和其发生化学反应,我们称它为化学漂白。
根据发生化学反应机理的不同,将化学漂白剂分为氧化型漂白剂和还原型漂白剂。
本文将对一些常见的漂白剂种类及其漂白的原理进行阐述。
关键词:漂白剂;原理;氧化;还原;二氧化硫;臭氧;氯气College Chmistry 2006:, . , . . , . , .: ;;;;;;;引言很多物质都带有我们不希望见到的颜色,我们要使物质失去这种颜色,这就是我们通常所说的漂白。
但是物质显色的原因是不同的,因此我们漂白不同物质必须采用不同的方法。
像含有色素或杂质而显色的物质我们一般使用活性炭等脱色剂进行物理吸附,但是像品红等物质由于自身官能团对光的选择性吸收而显色,那就需要使用化学试剂和其发生化学反应,我们通常称其为化学漂白剂,化学漂白剂在工业漂白上得到广泛应用。
而对于本身是白色的物质,为增加其白度、亮度而使用的物质叫做增白剂。
总的来说,脱色剂、增白剂也属于漂白剂这一大类。
现代漂白工业迅速发展,但漂白剂滥用的问题也随之出现,特别是食品脱色,许多不法商家用工业漂白剂,如吊白块对食物进行漂白,严重危害人们的身体健康。
本文对如今的漂白剂种类及其漂白原理进行详细论述,使大家了解生活中常见漂白剂的种类及漂白原理,增强自我保护意识。
1 物质的显色原理不同物质显色的原因不尽相同。
比如说有很多物质由于含有色素而显色,或含有杂质而显示颜色。
但大多数物质由于本身对光的选择性吸收而显示颜色,其原理是物质的显色源对光的的选择性吸收。
物质组成中的价电子在光的作用下发生跃迁,所吸收的光要满足公式:△(激) ̶- E(基)= hᴠ= λ。
不同物质价电子的基态不同,跃迁吸收的则不同,吸收光的频率和波长也不同。
当价电子跃迁能量E(基)能量差△4.97×10-19 ~ 2.74×10-19J,即吸收光波长在400~730时,物质则因吸收可见光而显色[1]。
所以说物质要显色必须发生电子跃迁。
对于有机物来讲,如果含有Π键,由于共轭效应和超共轭效应,激发组成Π键的Π电子所需的能量较低,具有这种能量的光波处于紫外及可见光区内。
像含有、、、等Π键的不饱和基团我们称之为生色团。
2 漂白剂的种类对于漂白剂其实我们并不陌生,我们常接触到一些漂白剂。
例如漂白粉、过氧化氢、二氧化硫等等。
根据其漂白机理的不同我们将漂白剂分为物理漂白剂和化学漂白剂,而化学漂白剂又根据其反应机理不同分为氧化型漂白剂、还原型漂白剂和其它类型漂白剂。
2.1 物理漂白剂物理漂白剂是指不和有色物质发生化学反应, 只是对有色物质发生物理附的物质。
当然具有这种性质的物质除了能吸附有色、有毒物质之外, 对所有物质基本都具有吸附性,这就要求此类物质具有足够大的表面积, 活性炭和白土就是最常见的此类物质,所以这类物质叫做脱色剂更为合适,即有色物质被吸附到多孔物质的孔隙内。
(1)活性炭将木炭在1200K的水蒸气中进行加热,即可得到活性炭,活性炭具有物理吸附作用。
常见的易被活性炭吸附的物质如下:①吸附色素。
通常用于溶液脱色( 漂白),如制造白糖工业中可用活性炭做脱色剂。
②吸附有毒的气体( 或蒸气):如、2、2、2、C6H6都能被活性炭吸附,因此活性炭也常用于去毒、防毒、冰箱除臭等。
③吸附水中有臭味的物质,如用于水的除臭净化。
另外活性炭也常用来吸附水中的汞、铬的重金属离子等等。
(2)活性白土活性白土是膨润土的一种深加工产品,它由膨润土脱水、粉碎, 加硫酸活化,经水洗、分离、干燥而得。
分子式为H22(3)42O ,主要成分是2O3和2的混合物, 外观为灰白、粉红或白色粉末, 表观密度0.6~0.8 g 3,相对密度2.5,不溶于水和有机溶剂。
活性白土主要用于矿物油、植物油、动物油、石蜡、脂肪酸及有机化学物品的脱色精制。
2.2 化学漂白剂相对于物理漂白剂而言,化学漂白剂是漂白剂和被漂白的物质发生化学反应,使其生色团被破坏而不能显示颜色的物质。
又根据漂白剂在化学反应中所起的作用不同而分为氧化型漂白剂、还原型漂白剂和其它类型的漂白剂。
2.2.1 氧化型漂白剂氧化型漂白剂都具有强氧化性,能够将物质的生色团氧化,使其不能再显示颜色。
一般分为过氧化氢类、次氯酸类、二氧化氯、臭氧等。
(1)过氧化物类过氧化氢类漂白剂是指过氧化氢或在一定条件下可以生成过氧跟的漂白剂,过氧化氢类漂白剂漂白物质主要是发挥过氧化氢的氧化性。
一般作为织物、丝稠、麦秆等的漂白剂,其漂白作用持续永久,其副产物是水,对环境无污染,是一类环保高效的漂白剂。
过氧化氢过氧化氢化学式为H2O2,可和水以任何比例混合,水溶液俗称双氧水。
双氧水作为漂白剂由于其反应时间短、白度高、放置久不返黄、对环境污染小、废水便于处理等优点而广泛用于涤棉、丝绸、棉、麻织物、纸浆及油画等的漂白。
过氧化钠过氧化钠(2O2)粉末呈黄色, 易吸潮, 和水或稀酸作用生成过氧化氢, 并猛烈放热。
过碳酸钠过碳酸钠(或称过氧化氢碳酸钠)是碳酸钠和过氧化氢的加合物,化学式为223·3H2O2。
过碳酸钠漂白剂和污染环境的氯漂白剂相比,对环境无不良影响, 当它和含水的介质接触的时候,分解成氧气,水和天然的纯碱. 含有过碳酸钠的洗涤剂和漂白剂具有较强的去污能力,尤其对于用来预浸沾有重污的衣物非常有效. 值得称道的是, 过碳酸钠具有保色增艳作用,不会损伤织物的颜色,并且防止织物变黄或者变暗.过碳酸钠主要用于各类固体洗涤剂和彩漂粉, 也可以制成安全环保的释氧剂、消毒剂,此外,过碳酸钠也可以应用于个人护理品, 食物漂白,纸浆漂白和织物漂白中。
过硼酸钠过硼酸钠是无味的白色固体,可溶于水,化学式为32O,过硼酸钠一般作为洗衣粉的添加剂,能提高洗涤物的白度,且不损害洗涤物原来的颜色。
过氧乙酸过氧乙酸又名过乙酸(,简称)、过氧酸、过氧化乙酸, 过氧乙酸溶液为无色透明液体。
过氧化苯甲酰过氧化苯甲酰是较常用的一种氧化型漂白剂,通常用作面粉的增白剂,可以氧化小麦粉内的类胡萝卜素,适量添加不但可以改善面粉的色泽,提高面粉白度,还能改变面团筋。
(2)次氯酸类次氯酸类漂白剂是指在一定条件下可以生成次氯酸的漂白剂。
此类漂白剂漂白物质主要是的氧化作用,比如说新制氯水,漂白粉或84消毒液等。
具有强氧化性,可将有色的有机物中的发色基团氧化或和其不饱和键发生加成反应,从而使之变成较稳定的无色物质。
次氯酸的漂白是彻底的、不可逆的,有机色素褪色后不能恢复到原有的颜色。
可用作棉、麻、纸张等的漂白。
氯水氯气的水溶液叫氯水。
常温下,1m3水中可溶解约2.5 m3的氯气。
溶解的部分氯气能和水反应生成次氯酸,次氯酸是新制氯水的主要成分。
漂白粉,84消毒液漂白粉,84消毒液是目前市面上常见的漂白剂。
漂白粉是将2的通入石灰乳中而制得,其主要成分是次氯酸钙。
而84消毒液得主要成分为次氯酸钠。
(3)二氧化氯二氧化氯是一种重要的漂白剂,由于其漂白效果显著,绿色无污染,是国际公认的最新一代高效、广谱、安全的漂白剂,在世界发达国家已得到广泛的应用。
二氧化氯的化学式为2,是一种水溶性的强氧化剂,在常温常压下是黄绿色有类似氯气的刺激性气味的气体。
其分子量为67.45,沸点11 ℃,熔点-59 ℃。
气体2密度为3. 09g/ L (11 ℃),液体2的密度为1.64。
2在水中以2单体存在,不聚合生成 2气体,在20 ℃和4 压力下,溶解度为2.9 g 。
在水中不和有机物结合,不生成三氯甲烷致癌物,因此被称为不致癌的漂白剂。
(4)臭氧臭氧(O 3)为淡蓝色有特殊臭味的气体。
常温常压下臭氧不稳定, 具有较强的氧化性和漂白性。
臭氧作为漂白剂无副产物产生,是理想的漂白剂,但由于其成本高昂,未得到广泛应用。
2.2.2 还原型漂白剂还原型漂白剂都具有还原性,能够将物质的生色团还原,使其不能再显示颜色。
(1)连二亚硫酸钠连二亚硫酸钠俗称“保险粉”,化学式为2S 2O 4,白色砂状晶体或淡黄色粉末,连二亚硫酸钠的结构式可表示为:连二亚硫酸钠在纸浆漂白中,是有代表性的还原剂。
为了提高漂白效率,一般配合其他助剂一起使用。
连二亚硫酸钠能漂白多种染料,是良好的漂白剂,可以用来漂白彩色办公废纸脱墨浆。
又因是还原漂白,所以对纸浆得率没什么损失。
研究和生产实践表明,用保险粉漂白,提高纸浆白度的同时,对纸浆纤维强度和成纸的不透明度没有什么负作用,而H 202或含氯漂白剂都会存在不同程度的负作用。
(2)吊白块吊白块又称雕白粉(或印染助剂雕白块)。
化学名称为次硫酸氢钠甲醛或甲醛合次硫酸氢钠。
化学式为2—2 + ,也写做—2··2H 2O 它是连二亚硫酸钠和甲醛的加成化合物,加和过程如下:2S 2O 4 + 2 + 4H 2O = 2 ··2H 2O + 3··H 2O 半透明白色结晶或小块,易溶于水。
2.2.3 其它类型 (1)二氧化硫二氧化硫是最常见的硫氧化物。
无色气体,有强烈刺激性气味。
化学式为2,V形极性分子,易溶于水,密度为2.55g,比空气密度大。
二氧化硫的漂白作用不持久,是暂时性漂白剂。
(2)二氧化硫脲二氧化硫脲又称为甲脒亚磺酸()及还原剂,分子量:108.12,化学式为2()2,为无毒无味白色粉末状结晶颗粒,还原电位高(一1230),还原性强,热稳定性好,溶解度低(309/L.20℃).上世纪90年代开始探索高白度漂白废纸原料中较丰富的废报纸来代替漂白硫酸盐浆(),于是出现了H2O2—两段漂白,成为现代废报纸高白度漂白的标准方法 [11]。
3 各种漂白剂的漂白原理3.1 物理漂白剂的漂白原理(1)活性炭活性炭内部有大量的孔隙,孔内有许多约10~1大小的毛细管。
所以活性炭内部的表面积很大。
1g活性炭内部的表面积约为300~2500m2。
这些孔隙和毛细管使活性炭具有很强的吸附性。
活性炭属于非极性吸附剂,因此易吸附非极性或弱极性物质。
(2)活性白土活性白土在水中和油中膨胀极小,有滑腻感,湿润时有玻璃光泽。
分子间为层状结构,表面有许多不规则的孔穴,加热至300℃以上脱去层间水,具有独特的吸附性能,易吸潮,水分过高时影响脱色效果。
3.2 化学漂白剂的漂白原理3.2.1 氧化型漂白剂的漂白原理(1)过氧化氢类漂白剂的漂白原理过氧化氢类漂白剂是典型的氧化型漂白剂,起漂白作用主要是H2O2分解生成的活性氧[O]和·,[O] 有强氧化性,能将物质的生色团氧化,使Π键断裂。