腐蚀电化学理论基础
- 格式:pdf
- 大小:2.58 MB
- 文档页数:1



第二章电化学腐蚀理论基础金属腐蚀从腐蚀历程上分为电化学腐蚀和高温腐蚀两大类,电化学腐蚀是金属腐蚀的主要形式,因此本章内容是本门课程的重要理论基础。
本节课要求掌握:电化学腐蚀的定义;腐蚀原电池的特点和分类。
电化学腐蚀的定义:金属材料与电解质溶液相接触时,在界面上将发生有自由电子参加的氧化和还原反应,从而破坏了金属材料的特性。
这个过程称为电化学腐蚀。
电化学腐蚀现象极为常见在潮湿的大气中,桥梁钢结构的腐蚀;海水中船体的腐蚀;土壤中输油输气管道的腐蚀;在含酸、碱、盐等工业介质中的腐蚀,一般均属于此类。
•第一节腐蚀原电池过程用腐蚀原电池模型来解释电化学腐蚀原因及过程。
一、腐蚀原电池1.原电池例如:Zn片和Cu片放入稀盐酸溶液中,用导线通过电流表把它们连接起来(电流表指针转动)就构成了原电池装置。
阳极Zn:Zn →Zn2++2e (氧化反应)阴极Cu:2H++2e →H2 ↑(还原反应)2. 腐蚀原电池的定义及特点阳极Zn:Zn →Zn2++2e (氧化反应)阴极Cu:2H++2e →H2 ↑(还原反应)(1)腐蚀原电池的定义:只能导致金属材料破坏而不能对外界作功的短路原电池。
(2)腐蚀原电池的特点:1. 电池的阳极反应是金属的氧化反应,结果造成金属材料的破坏。
2. 电池的阴、阳极短路,产生的电流全部消耗在内部,转变为热,不对外做功。
电化学腐蚀的实质是以金属为阳极的腐蚀原电池过程,在绝大多数情况下,这种电池是短路了的原电池。
3.腐蚀原电池的工作过程:阳极过程Me →Men++ne阴极过程 D + ne →Dne-电化学腐蚀过程可分成阴极和阳极两个在相当程度上独立进行的过程,这是区分电化学腐蚀和化学腐蚀的重要标志。
二. 腐蚀电池的分类从热力学角度来讲,在金属材料/腐蚀介质构成的体系中,如果存在着电位差,且金属的电位较低,则将发生金属腐蚀。
根据腐蚀电池电极尺寸的大小,腐蚀电池分为:宏观电池和微观电池.1、宏观电池通常指肉眼可分辨电极极性的电池。

什么是电化学腐蚀电化学腐蚀(electrochemical corrosion)是材料在电化学条件下由于化学反应而引起的腐蚀现象。
它是一种普遍存在于自然和工业环境中的腐蚀方式,对于金属、合金、涂层和其他材料的腐蚀速率都产生重要影响。
本文将介绍电化学腐蚀的基本原理、机理和控制方法,以及它在实际应用中的重要性。
一、电化学腐蚀的基本原理电化学腐蚀是在电解质溶液中金属或合金表面发生的氧化还原反应,其基本原理可以由著名的离子传导电子理论解释。
金属表面存在着不规则的微观结构,并且在自然环境中常常出现多种金属离子溶解在水中形成电解质溶液。
当这种电解质溶液与金属或合金接触时,电子从金属表面迁移到电解质中的离子,称为氧化反应;同时,电解质中的离子也可还原成金属,称为还原反应。
这个过程涉及了电子和离子在金属和电解质之间的传输,从而形成了电流。
二、电化学腐蚀的机理电化学腐蚀的机理包括两个基本过程:阳极溶解(anodic dissolution)和阴极还原(cathodic reduction)。
阳极溶解是指金属或合金表面的金属原子氧化成阳离子溶解到电解质溶液中的过程,而阴极还原则是指电解质溶液中的还原剂接受电子,从而还原成金属。
在电化学腐蚀过程中,阳极和阴极通常不在同一位置,形成了电化学腐蚀电池。
阳极是电极的溶解或腐蚀的区域,而阴极则是电极的保护或减缓腐蚀的区域。
阳极和阴极之间通过电解质中的离子迁移形成电流。
这种电流导致阳极发生氧化反应,从而导致金属或合金的溶解。
同时,阴极上的还原反应消耗了电流,起到减缓或保护金属的作用。
三、电化学腐蚀的控制方法为了控制电化学腐蚀并降低材料的腐蚀速率,需要采取一系列措施。
以下是几种常见的控制方法:1. 阴极保护:通过给金属施加外加电流或安装保护层,使其成为阴极,从而减缓金属的腐蚀速率。
常见的阴极保护方法包括阳极保护、阴极保护和牺牲阳极法。
2. 隔离:将金属或合金与容易引起腐蚀的电解质隔离开来,避免其接触,减少腐蚀的发生。


第三章电化学腐蚀基础金属材料与电解质溶液接触时,会发生电化学腐蚀或称湿腐蚀,它是以金属为阳极的腐蚀原电池过程。
工业用金属一般都是还有杂质的,当其浸在电解质溶液中时,发生电化学腐蚀的实质就是在金属表面上形成了许多以金属为阳极,以杂质为阴极的腐蚀电池。
它的工作特点是只能导致金属材料的破坏而不能对外做有用电功的短路原电池。
§3-1 腐蚀原电池一、原电池P33图1是一个最常见的原电池。
中心碳棒是电池的正极,外围的锌皮是负极。
电解质是NH4Cl溶液。
当外电路接通时,灯泡亮。
电极反应为:阳极锌皮上发生氧化反应(使锌原子离子化):Zn→Zn2++2e阴极碳棒是发生还原反应:2H++2e→H2电池总反应为:Zn+2H+→Zn2++H2在反应过程中,电池的锌皮不断被离子化,并放出电子,在外电路中形成电流。
金属锌的离子化结果就是腐蚀破坏。
一个腐蚀电池必须包括阳极、阴极、电解质溶液和外电路四个部分,缺一不可。
这四个组成部分构成腐蚀电池工作的三个必需的环节。
1 阳极过程金属进行阳极溶解,以金属离子或水化离子形式转入溶液,同时将等量电子留在金属上。
2 阴极过程从阳极通过外电路流过来的电子被来自电解质溶液且吸附于阴极表面能够接受电子的物质,即氧化性物质所吸收,在金属腐蚀中将溶液中的电子接受体称为阴极去极化剂。
3 电流的流动电流的流动在金属中依靠电子从阳极经导线流向阴极,在电解质溶液中则是依靠离子的迁移。
腐蚀电池的三个环节既相互独立又彼此紧密联系和相互依存。
只要其中一个环节受阻或停止工作,则整个腐蚀过程也就停止。
电池中离子的迁移和电子流动的驱动力是电极电位差——电池电动势。
在电化学作用下,单位时间,单位面积上发生变化的物质量称腐蚀速度。
可以证明,腐蚀速度V与腐蚀电流密度i呈正比。
因此可用腐蚀电流密度i来表示腐蚀速度大小。
二、腐蚀原电池腐蚀原电池实质上是一个短路的原电池。
如P33图2,将锌与铜接触并置于盐酸水溶液中,就构成了以锌为阳极,铜为阴极的原电池。



§ 2-5 极化与去极化以上几节我们讲述的是有关金属发生电化学腐蚀的倾向问题,并没有涉及到腐蚀速度和影响腐蚀速度的因素等一些实际中人们普遍关注的问题。
电化学过程中的极化和去极化是影响腐蚀速度的最重要的因素,认清极化和去极化规律对研究金属的电化学腐蚀与防护有着重要的现实意义。
一、 极化现象电化学腐蚀通常是按腐蚀原电池的历程进行的,腐蚀着的金属作为腐蚀电池的阳极发生氧化(溶解)反应,因此电化学腐蚀速度可用阳极电流密度表示。
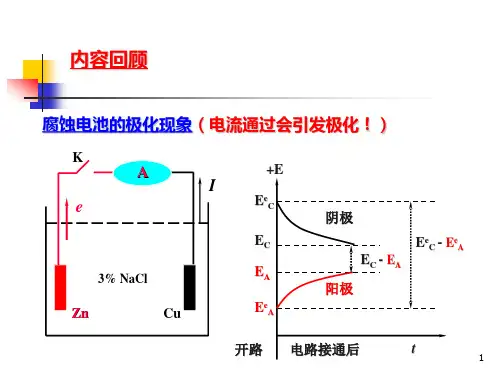
下面我们来考察铜-铁浸入电解质溶液中构成的组成的宏观腐蚀电池(图2-16),当电池回路未接通时,阳极(铁)的开路电极电位为0A V ,阴极(铜)的开路电极电位为0k V ,腐蚀体系的电阻为R (包括外线路电阻及溶液的内阻)。
电池的回路接通以后,根据欧姆定律,这时腐蚀体系的电流应为:R V V I A K 000-=图2-16 极化现象观测图图2-17 极化引起的电流变化《化工机械材料腐蚀与防护》P15 图1-7、8 实验发现,仅仅在电池回路刚接通的瞬间,电流表上指示出相当大的0I 值,之后的电流迅速下降,逐渐稳定到I 值,I <<I 0,如图2-17所示。
腐蚀电池工作后,电路中的欧姆电阻在短时间内不会发生变化,电流的减小只能是电池的电动势降低所致。
这可能是阴极的电极电位降低了,也可能是阳极的电极电位升高了,或者是两者都发生了变化。
实验证明,在有电流流动时,0A V 和0k V 都改变了,如图2-18所示。
图2-18 腐蚀控制程度示意图 教材P33图2-10我们把腐蚀电池工作过程中由于电流流动而引起电极电位发生变化的现象称为极化现象,简称极化。
阳极通过电流以后电极电位向正的方向变化叫做阳极极化。
阴极通过电流以后电极电位向负的方向变化叫做阴极极化。
极化现象的存在将使腐蚀电池的工作强度大为降低,因此了解极化作用的原因及其影响因素有着重要的意义。
二、极化曲线表示极化电位与电流或极化电流密度之间关系的曲线,称为极化曲线。

第二章 电化学腐蚀的理论基础金属的电化学腐蚀是指金属与介质发生电化学反应而引起的变质和损坏的现象。
在自然界和工业生产中电化学腐蚀比化学腐蚀危害更严重且更普遍。
例如,在潮湿的大气中,桥梁、钢结构的腐蚀;在海水中海洋采油平台、舰船壳体的腐蚀;土壤中的地下输油、输气管线的腐蚀以及在含酸、含盐、含碱的水溶液等工业介质中金属的腐蚀,都属于电化学腐蚀的类型。
由于与化学腐蚀的基本原理不同,所以电化学腐蚀与化学腐蚀又存在以下几点区别:1. 电化学腐蚀介质为能电离、可导电的电解质,且大多为水溶液。
2. 电化学腐蚀中,金属失去电子的氧化反应和介质中的氧化剂得到电子的还原反应在不同的部位相对独立地进行,而不是直接地进行电子交换。
3. 电化学反应的阴、阳极之间有腐蚀电流产生,腐蚀电流的大小与腐蚀速度的快慢有直接关系。
4. 电化学腐蚀与电极电位的关系密切。
可以利用此特点实施电化学保护。
5. 电化学腐蚀具有次生过程,使得腐蚀产物最终离开发生腐蚀的原始部位。
§ 2-1 电极与电极电位一、金属的电化学腐蚀现象我们知道金属在电解质中的腐蚀是一个电化学腐蚀过程,它具有一般电化学反应的特征。
如果我们将一块工业纯锌放在稀硫酸溶液中,可以发现锌片逐渐被溶解(腐蚀),并且锌的表面上有氢气析出(如图2-1)。
图2-1锌在稀硫酸中的溶解《金属腐蚀学》P48图3-1上述过程的反应方程式如下:↑+→+2442H ZnSO SO H Zn (3-1)图2-2 不均一金属锌在稀硫酸中的溶解《金属腐蚀理论及应用》P33图2-3 Zn-Cu 腐蚀电池《金属腐蚀理论及应用》P33 图1-21若把锌片与铜片相接触并浸入稀硫酸中(图2-2),我们可以看到锌片溶解(腐蚀)速度加快,同时在铜片上逸出了大量的氢气泡,而铜片却没有发生溶解现象,表明锌因铜的存在而加快溶解。
为什么铜能够加速锌与稀硫酸的作用呢?我们可以用一个简单的实验进一步说明。
当我们把锌片与铜片置入上述稀硫酸溶液中并在它们之间用导线通过毫安表连接起来时(图2-3),这时我们发现毫安表的指针发生了偏转,说明有电流通过。