腐蚀电化学第一讲(03)
- 格式:ppt
- 大小:464.50 KB
- 文档页数:36
[组织教学] [复习][引入][板书] [讲解]师生互相问好,教师清点人数。
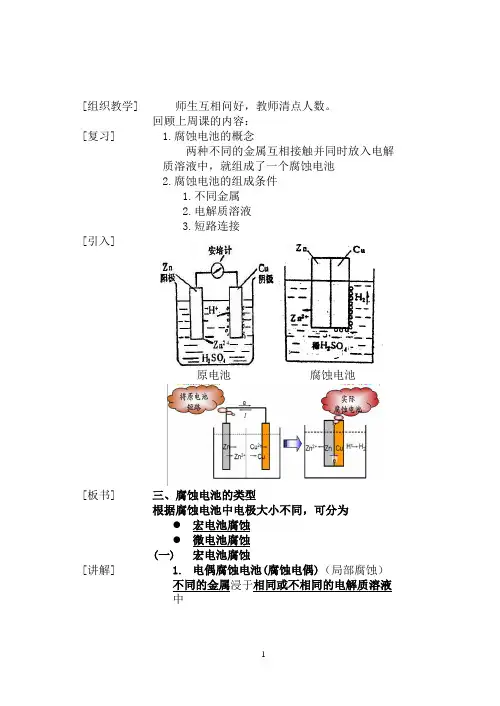
回顾上周课的内容:1.腐蚀电池的概念两种不同的金属互相接触并同时放入电解质溶液中,就组成了一个腐蚀电池2.腐蚀电池的组成条件1.不同金属2.电解质溶液3.短路连接原电池腐蚀电池三、腐蚀电池的类型根据腐蚀电池中电极大小不同,可分为●宏电池腐蚀●微电池腐蚀(一)宏电池腐蚀1.电偶腐蚀电池(腐蚀电偶)(局部腐蚀)不同的金属浸于相同或不相同的电解质溶液中[举例][板书] [讲解][举例][板书] [讲解][举例]轮船船尾部分结构1-船壳(钢板) 2- 推进器(青铜)2.浓差电池1)金属离子浓差电池(铜):同一金属与不同金属离子浓度的电解质溶液相接触金属离子浓差电池Cu在稀溶液中易失电子。
溶液中金属离子浓度越稀,电极电位越低;浓度越大,电极电位越高电子由金属离子的低浓度区(阳极)流向高浓度区(阴极)。
2)氧浓差电池(铁):同一金属与不同含氧量的电解质溶液相接触→形成缝隙腐蚀或水线腐蚀.[板书] [讲解][举例][板书] [讲解][举例] 造成缝隙腐蚀的主要因素,危害性大。
O2+2H2O+4e → 4OH- (阴极反应)氧的分压越高,电极电位越高。
介质中溶解氧浓度越大,氧电极电位越高;而氧浓度较小处则电极电位较低称为腐蚀电池的阳极。
(一)微电池腐蚀金属表面的电化学的不均匀性形成的自发而又均匀的腐蚀。
1)金属化学成分的不均匀性(Fe3C和石墨;FeZn7)例如,工业生产中,纯锌-FeZn7、碳钢- Fe3C、铸铁-石墨等杂质,在腐蚀介质中,金属表面就会形成许多微阴极、微阳极,因此导致腐蚀。
2)组织结构的不均匀性(金属或合金组织内晶粒与晶界的电极电位不同)比如,金属表面存在裂纹的情况[板书] [讲解][举例][板书] [讲解][举例] [课堂小结] [作业] 例如:晶粒-晶界腐蚀微电池,晶界作为阳极而优先发生腐蚀<缝隙腐蚀>3)金属物理状态的不均匀性各部分应力分布不均匀或形变不均匀,钢板弯曲处、铆钉头部区域容易发生腐蚀。



电化学腐蚀编辑电化学腐蚀就就是金属与电解质组成两个电极,组成腐蚀原电池。
例如铁与氧,因为铁的电极电位总比氧的电极电位低,所以铁就是阳极,遭到腐蚀。
特征就是在发生氧腐蚀的表面会形成许多直径不等的小鼓包,次层就是黑色粉末状溃疡腐蚀坑陷。
1基本介绍2相关原理3方程式4现象危害5解决办法6电化学7除氧方法▪热力除氧▪真空除氧▪铁屑除氧▪解吸除氧▪树脂除氧▪化学药剂除氧基本介绍编辑不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。
钢铁在潮湿的空气中所发生的腐蚀就是电化学腐蚀最突出的例子。
我们知道,钢铁在干燥的空气里长时间不易腐蚀,但潮湿的空气中却很快就会腐蚀。
原来,在潮湿的空气里,钢铁的表面吸附了一层薄薄的水膜,这层水膜里含有少量的氢离子与氢氧根离子,还溶解了氧气等气体,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁与少量的碳恰好形成无数微小的原电池。
在这些原电池里,铁就是负极,碳就是正极。
铁失去电子而被氧化、电化学腐蚀就是造成钢铁腐蚀的主要原因。
金属材料与电解质溶液接触, 通过电极反应产生的腐蚀。
电化学腐蚀反应就是一种氧化还原反应。
在反应中,金属失去电子而被氧化,其反应过程称为阳极反应过程,反应产物就是进入介质中的金属离子或覆盖在金属表面上的金属氧化物(或金属难溶盐);介质中的物质从金属表面获得电子而被还原,其反应过程称为阴极反应过程。
在阴极反应过程中,获得电子而被还原的物质习惯上称为去极化剂。
在均匀腐蚀时,金属表面上各处进行阳极反应与阴极反应的概率没有显著差别,进行两种反应的表面位置不断地随机变动。
如果金属表面有某些区域主要进行阳极反应,其余表面区域主要进行阴极反应,则称前者为阳极区,后者为阴极区,阳极区与阴极区组成了腐蚀电池。
直接造成金属材料破坏的就是阳极反应,故常采用外接电源或用导线将被保护金属与另一块电极电位较低的金属相联接,以使腐蚀发生在电位较低的金属上。




金属是最重要的工业材料。
但是,金属在外界环境影响下常遭受化学和电化学的作用而引起腐蚀失效。
从热力学的观点来看,除少数的贵金属(如金、铂)外,各种金属都有与周围介质发生作用而转变成离子的倾向。
也就是说,金属受腐蚀是自然趋势。
因此,腐蚀失效现象是普遍存在的。
电化学腐蚀金属表面与周围介质发生电化学作用而引起的破坏。
其特点是介质中有能导电的电解质溶液存在,腐蚀过程中有电流产生。
这类腐蚀最普遍,包括:大气腐蚀、土壤腐蚀、海水腐蚀、电解质溶液腐蚀和熔融盐腐蚀。
金属防腐的方法一般有以下几种:一是合理选材和发展耐蚀材料,如发展耐蚀合金、非金属材料;二是在金属表面覆盖保护层;三是电化学保护;四是缓蚀剂缓蚀;五是金属表面改性。
有机涂层防护是将耐蚀有机涂料涂覆在金属表面,经固化成膜后具有屏蔽、耐蚀和电化学等作用。
实践证明:有机涂层防腐是最经济、最有效、应用最普遍的金属防腐方法。
1.金属镀层用电镀法在金属的表面涂一层别的金属或合金作为保护层。
例如自行车上镀铜锡合金当底,然后镀铬,铁制自来水管镀锌以及某些机电产品镀银或金等都可以达到防腐蚀目的。
电镀是借助于电解作用,在金属制件表面上沉积一薄层其他金属的方法。
包括镀前处理(除油、去锈)、镀上金属层和镀后处理(钝化、去氢)等过程。
电镀时,将金属制件作为阴极,所镀金属作为阳极,浸人含有镀层成分的电解液中,并通人直流电,经过一段时间即得沉积镀层。
2.阳极保护它是指用阳极极化的方法使金属钝化,并用微弱电流维持钝化状态,从而保护金属。
此法是基于对金属钝化现象的研究提出的。
因此,要弄清阳极保护的原理,首先要明白金属钝化的原理。
金属阳极溶解时,在一般情况下,电极电势愈正,阳极溶解速度愈大。
但在有些情况下,当正向极化超过一定数值后,由于表面某种吸附层或新的成相层的形成,金属的溶解速度非但不增加,反而急剧下降。
在金属被化学溶解时也有类似情形。
例如铁浸在硝酸溶液中,随着硝酸浓度的升高,铁的溶解速度加快。