板蓝根检验标准操作规程
- 格式:doc
- 大小:38.50 KB
- 文档页数:6
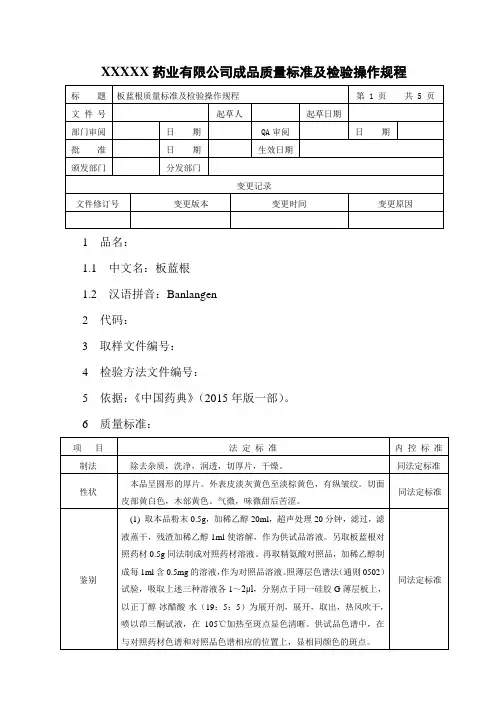
XXXXX药业有限公司成品质量标准及检验操作规程1 品名:1.1 中文名:板蓝根1.2 汉语拼音:Banlangen2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2015年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:稀乙醇、板蓝根对照药材、(R-S)-告依春对照品、甲醇、石油醚(60~90℃)、乙酸乙酯、盐酸、精氨酸对照品、羧甲基纤维素钠、正丁醇、冰醋酸、茚三酮试液、水、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
7.2 仪器与用具:显微镜、电子天平、紫外光灯、超声波清洗器、水浴锅、硅胶G薄层板、硅胶GF254薄层板、烘箱、二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材0.5g 同法制成对照药材溶液。
再取精氨酸对照品,加稀乙醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各1~2μl,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
7.4.2取本品粉末1g,加80%甲醇20ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材1g同法制成对照药材溶液。
再取(R-S)-告依春对照品,加甲醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各5~10μl,分别点于同一硅胶GF254薄层板上,以石油醚(60~90℃)-乙酸乙酯(1:1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
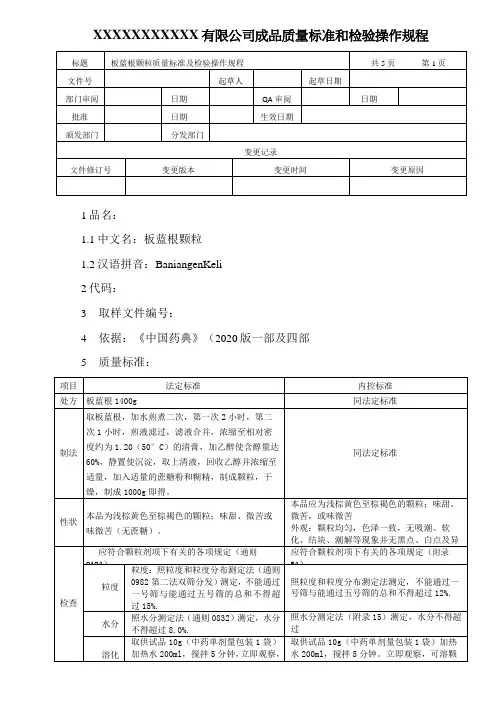
XXXXXXXXXXX 有限公司成品质量标准和检验操作规程1品名:1.1中文名:板蓝根颗粒 1.2汉语拼音:BaniangenKeli 2代码:3 取样文件编号:4依据:《中国药典》(2020版一部及四部 5 质量标准:6检验操作规程:6.1试药与试剂:十八烷基硅烷键合硅胶、甲醇、正丁醇、冰醋酸、水、茚三酮试液、板蓝根对照药材、L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品、尿苷对照品、鸟苷对照品及腺苷对照品。
6.2仪器与用具:电子天平、水浴锅、干燥箱、超声波清洗器、硅胶G薄层板。
6.3性状:取本品适量,在自然光下目测形态和色泽,尝味,并记录结果。
6.4鉴别:(1)取本品适量2g(相当于饮片2.8g),研细,加乙醇10ml,超声处理30分钟,滤过,滤液浓缩至2ml,作为供试品溶液。
另取板蓝根对照药材0.5g,加乙醉20ml,同法制成对照药材溶液,再取L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品,分别加乙醇制成每lml各含1mg的溶液,作为对照品溶液。
照薄层色谱法(通则0502)试验,吸取上述五种溶液各2〜5u l,分别点于同一硅胶G薄层板上,以正丁醇一冰醋酸一水(19:5:5)为展开剂,展开,取出,晾干,喷以茚三酮试液,在105r加热至斑点显色清晰,置日光下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
(2)取尿苷对照品、鸟苷对照品、(R,S)-告依春对照品及腺苷对照品,加5%甲醇制成每1ml含尿苷、鸟苷、(R,S)-告依春各20u g及腺苷25u g的混合溶液,作为对照品溶液,照<含量测定>项下的方法试验,吸取上述对照品溶液及<含量测定〉项下的供试品溶液各5-10u l,注入液相色谱仪,记录色谱图。
供试品色谱中,应呈现与对照品色谱峰保留时间相对应的色谱峰。
6.5检查:应符合颗粒剂项下有关的各项规定(附录54)。
6.6含量测定:6.6.1对照品溶液的制备取尿苷对照品、鸟苷对照品及腺苷对照品适量,精密称定,加5%甲醇制成每1ml含尿苷20u g,鸟苷20u g及腺苷25u g的混合溶液,即得。

板蓝根颗粒溶化性和粒度的检查一、实训目的1.掌握中药制剂溶解度试验的一般操作步骤和技巧。
2.掌握中药制剂粒度检查(筛选法)的一般操作步骤和技能。
2、检查依据1.板蓝根颗粒药品标准[《中国药典》2021年版(一部)正文部分487页]【处方】板蓝根1400g【检验】应符合《颗粒》(附录IC)的相关规定[粒度]除另有规定外,照粒度测定法(附录xib第二法双筛分法)测定,不能通过一号筛与能通过五号筛的总和,不得过15%。
【溶解度】取一袋供试品(多剂量包装10g),加热200ml水,搅拌5分钟,立即观察。
应完全溶解或悬浮。
所有可溶颗粒均应溶解,允许有轻微浑浊;悬浮颗粒应能均匀悬浮。
2.粒度测定法[《中国药典》2021年版(一部)附录xib第二法双筛分法]三、检查原则本品为板蓝根加工制成的颗粒,为了保证药品的质量,最大程度的发挥其疗效,《中国药典》制剂通则中要求检查颗粒剂的溶化性和粒度,从而对本品进行质量控制。
四、仪器和用具天平(感量0.1g或0.01g)、药筛(一号筛和五号筛,并备有筛盖和密合的接受容器,用前应干燥)、250ml烧杯、玻璃棒等。
五、实验步骤和内容(一)溶解度检测1制备热水。
2.取板蓝根颗粒1袋,将其内容物置250ml烧杯中。
3.加热水200ml,搅拌5分钟,立即观察现象。
4.记录观察到的板蓝根颗粒溶化现象。
(二)粒度检查1.将1号筛放在5号筛上,并在5号筛下安装一个密封的接收容器。
2.取板蓝根颗粒5袋,称其含量,放入上药筛(1号筛)中,盖上盖子。
3.保持水平状态过筛,左右往返,边筛动边拍打3分钟。
4.取不能通过一号筛和能通过五号筛的颗粒及粉末,称定重量。
5.记录与计算(1)记录实验环境的相对湿度和每个称重数据(取三个有效数字)。
(2)计算出的粒度分布比例(%)比例(%)=(未通过一号筛和通过五号筛的颗粒和粉末的总重量)/供试品重量×100%[操作要点]①溶化性检查时,热水温度按《中国药典》凡例中规定应为70~80℃。
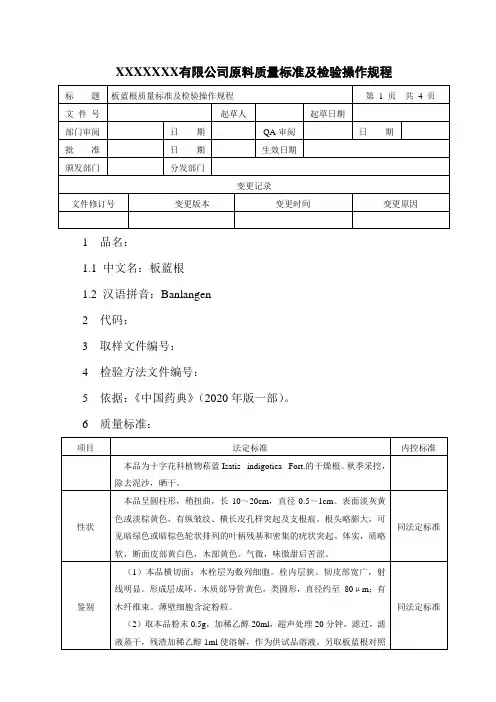
XXXXXXX有限公司原料质量标准及检验操作规程1 品名:1.1 中文名:板蓝根1.2 汉语拼音:Banlangen2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1试药与试剂:稀乙醇、板蓝根对照药材、(R-S)-告依春对照品、甲醇、石油醚(60~90℃)、乙酸乙酯、盐酸、精氨酸对照品、羧甲基纤维素钠、正丁醇、冰醋酸、茚三酮试液、水。
7.2仪器与用具:显微镜、电子天平、三用紫外分析仪、恒温鼓风干燥箱、超声波清洗器、水浴锅、硅胶G薄层板、硅胶GF254薄层板。
7.3性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4鉴别:7.4.1取本品横切面制片显微镜(10×10)观察组织结构特征。
7.4.2取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材0.5g 同法制成对照药材溶液。
再取精氨酸对照品,加稀乙醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各1~2μl,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
7.4.3取本品粉末1g,加80%甲醇20ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材1g同法制成对照药材溶液。
再取(R-S)-告依春对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各5~10μl,分别点于同一硅胶GF254薄层板上,以石油醚(60~90℃)-乙酸乙酯(1:1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
XXXXXXXXX 有限公司
一、目的:建立板蓝根片提取物的质量标准,确保所用提取物的质量。
二、范围:本规定适用于板蓝根片提取物的质量控制。
三、责任: 四、内容: 1.标准来源
WS 3-B-0564-91或WS 3-B-0564-91-1及2015年版《中国药典》四部 2. 技术要求
3.贮存条件:冷库保存。
4.相关标准操作规程:板蓝根片提取物检验操作规程(SOP-ZL-JG(ZJP)-105)、物料取样操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:板蓝根片提取物。
6.内部使用的物料代码:无此项内容。
7.经批准的供应商:无此项内容。
8.包装形式:塑料桶装。
板蓝根片提取物质量标准版本号:
9.注意事项:无此项内容。
10.贮存期:9个月。
11.文件附件:共0份。
12.修订及变更历史:。
XXXXXXXX有限公司原料质量标准及检验操作规程
1 品名:
1.1 中文名:南板蓝根
1.2 汉语拼音:Nanbanlangen
2 代码:
3 取样文件编号:
4 检验方法文件编号:
5 依据:《中国药典》(2020年版一部)。
6 质量标准:
7 检验操作规程:
7.1 试药与试剂:三氯甲烷、靛蓝对照品、靛玉红对照品、石油醚、乙酸乙酯、乙醇。
7.2 仪器与用具:显微镜、硅胶G板、烘箱、马弗炉。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:
7.4.1取本品制片置10×10显微镜下做显微观察。
7.4.2取本品粉末2g,加三氯甲烷20ml,加热回流1小时,滤过,滤液浓縮至2ml,作为供试品溶液。
另取靛蓝对照品、靛玉红对照品,加三氯甲烷制成每lml各含0.lmg的混合溶液,作为对照品溶液。
照薄层色谱法(附录7)
试验,吸取上述两种溶液各20µl,分别点于同一硅胶G薄层板上,以石油醚(60~90℃)三氯甲烷-乙酸乙酯(1 :8 :1)为展开剂,展开,取出,晾干,立即检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同的蓝色和紫红色斑点。
7.5 检查:
7.5.1 水分不得过12.0%(附录15第二法)。
7.5.2总灰分不得过10.0%(附录17)。
7.5.3二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6 浸出物:照醇溶性浸出物测定法(附录19 ) 项下的热浸法测定,用稀乙醇作溶剂,不得少于13.0%。
XXXXXXXXXXX有限公司成品质量标准和检验操作规程1 品名:1.1 中文名:板蓝根颗粒1.2 汉语拼音:Banlangen Keli2 代码:3 取样文件编号:4 依据:《中国药典》(2020版一部及四部)5 质量标准:6 检验操作规程:6.1 试药与试剂:十八烷基硅烷键合硅胶、甲醇、正丁醇、冰醋酸、水、茚三酮试液、板蓝根对照药材、L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品、尿苷对照品、鸟苷对照品及腺苷对照品。
6.2 仪器与用具:电子天平、水浴锅、干燥箱、超声波清洗器、硅胶G薄层板。
6.3 性状:取本品适量,在自然光下目测形态和色泽,尝味,并记录结果。
6.4 鉴别:(1)取本品适量2g(相当于饮片2.8g),研细,加乙醇10ml,超声处理30分钟,滤过,滤液浓缩至2ml,作为供试品溶液。
另取板蓝根对照药材0.5g,加乙醉20ml,同法制成对照药材溶液,再取L-脯氨酸对照品、精氨酸对照品、亮氨酸对照品,分别加乙醇制成每lml各含1mg的溶液,作为对照品溶液。
照薄层色谱法(通则0502)试验,吸取上述五种溶液各2~5μl,分别点于同一硅胶G薄层板上,以正丁醇一冰醋酸—水(19:5:5)为展开剂,展开,取出,晾干,喷以茚三酮试液,在105℃加热至斑点显色清晰,置日光下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
(2)取尿苷对照品、鸟苷对照品、(R,S)-告依春对照品及腺苷对照品,加5%甲醇制成每1ml含尿苷、鸟苷、(R,S)-告依春各20μg及腺苷25μg的混合溶液,作为对照品溶液,照<含量测定>项下的方法试验,吸取上述对照品溶液及<含量测定>项下的供试品溶液各5-10μl,注入液相色谱仪,记录色谱图。
供试品色谱中,应呈现与对照品色谱峰保留时间相对应的色谱峰。
6.5 检查:应符合颗粒剂项下有关的各项规定(附录54)。
6.6 含量测定:6.6.1 对照品溶液的制备取尿苷对照品、鸟苷对照品及腺苷对照品适量,精密称定,加5%甲醇制成每1ml含尿苷20μg,鸟苷20μg及腺苷25μg的混合溶液,即得。
范围:板蓝根检验。
责任:质检员、QA监控员、质检科长、质保科长、质量总监。
内容:[性状]板蓝根呈圆柱形,稍扭曲,长10~20cm,直径0.5~1cm,表面淡灰色或淡棕黄色,有纵皱纹及支根痕,皮孔横长,根头略膨大,可见暗绿色或暗棕色较大排列的叶柄残其和密集的的疣状突起。
体实,质略软,断面皮部黄白色,木部黄色。
气微,味微甜后带苦涩。
[鉴别]1仪器设备:载玻片、盖玻片、酒精灯、显微镜、烧杯、紫外分析暗箱、量筒、具塞锥形瓶、超声波处理器,漏斗、电子天平、毛细管、羧甲基纤维素钠为黏合剂的硅胶G薄层板,展开缸、热风机、显色喷瓶、烘箱。
2试剂溶液:水合氯醛、甘油、稀乙醇、精氨酸对照品,正丁醇-冰醋酸-水(19:5:5)茚三酮试液。
3操作方法:3.1取本品制片置显微镜下观察:木栓层为数列细胞。
皮层狭。
韧皮部宽广,射线明显,形成层成环。
木质部导管黄色,类圆形,直径约至8μm;有木纤维束。
薄壁细胞含淀粉粒。
3.2取本品水煎液,置紫外光灯(365nm)观察,显蓝色荧光。
3.3取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取精氨酸对照品,加稀乙醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各1~2μl,分别点于同一羧甲基纤维素钠为黏合剂的硅胶G薄板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点,显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
[检查]水分:照“水分测定法操作规程”第一法测定,除另有规定外,不得过15.0%。
W2-W0公式:――――――×100%W1-W0W0-称量瓶的重量W2-干燥后的总重量W1-供试品和瓶的总重量[浸出物]1仪器设备:电子天平、锥形瓶、移液管、回流冷凝管、水浴锅、干燥滤器、蒸发皿、干燥器。
GMP管理文件1、名称:南板蓝根冲剂Nanbanlangen Chongji2、代号或编号:C—0013、引用标准:部颁药品标准中药成方制剂第九册(WS3-B-1774-94)。
4、检验操作规程(本规程所用试剂,除另有规定外,均为分析纯)。
4.1性状:本品为黄褐色颗粒,或长方形块状冲剂;味甘、微苦。
4.1.1操作方法:取本品,置亮处观察其颜色。
4.1.2记录:记录所观察到的现象。
4.1.3结果判定:若本品符合上述“4.1性状”的描述,则可判为符合规定。
4.2.检查4.2.1水分4.2.1.1仪器与设备:电子天平、恒温干燥箱、称量瓶4.2.1.2操作方法:取本品2~5g,照《水分测定法标准操作规程(附录ⅨH)》测定。
4.2.1.3记录与计算:记录并按《水分测定法标准操作规程》(文件编号:ZG-JB-041-2011)计算。
4.2.1.4结果判定:若含水分不超过6.0%,则判为符合规定4.2.2粒度:4.2.2.1仪器与设备: 标准药筛(一号筛、五号筛)、电子天平。
4.2.2.2操作方法:取一号筛置于五号筛之上,并于五号筛下配以密合的接受容器,保持水平壮态过筛,左右往返,约3分钟,取不能通过一号筛和能通过五号筛的颗粒,精密称定重量。
4.2.2.3计算公式:不能通过一号筛和能通过五号筛的颗粒的重量,除以供试品的取用量,计算百分率。
4.2.2.4结果判定:不得过13%。
则可判为符合规定。
4.2.3溶化性4.2.3.1仪器与设备:电炉、烧杯4.2.3.2操作方法:取本品1袋,加热水200ml,搅拌5分钟,立即观察。
4.2.3.3记录:记录观察到的现象。
4.2.3.4结果判定:,应全部溶化,允许有轻微浑浊。
则判为符合规定。
4.2.4装量差异4.2.4.1 仪器与用具:电子天平。
4.2.4.2 操作方法:取本品10袋,照《装量差异检查法标准操作规程》(文件编号:ZL-J B-080-2014)检查。
4.2.4.3记录:记录检查结果。
XXXXXXX有限公司原料质量标准及检验操作规程1品名:1.1中文名:板蓝根1.2 汉语拼音:Baniangen2代码:3取样文件编号:4检验方法文件编号:5依据:《中国药典》(2020年版一部)6质量标准:7检验操作规程:7.1试药与试剂:稀乙醇、板蓝根对照药材、(R-S)-告依春对照品、甲醇、石油醚(60〜90C)、乙酸乙酯、盐酸、精氨酸对照品、羧甲基纤维素钠、正丁醇、冰醋酸、茚三酮试液、水。
7.2仪器与用具:显微镜、电子天平、三用紫外分析仪、恒温鼓风干燥箱、超声波清洗器、水浴锅、硅胶G薄层板、硅胶GF254薄层板。
7.3性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4鉴别:7.4.1取本品横切面制片显微镜(10X10)观察组织结构特征。
7.4.2取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材0.5g 同法制成对照药材溶液。
再取精氨酸对照品,加稀乙醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各1〜2门分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105 C加热至斑点显色清晰。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
7.4.3取本品粉末1g,加80%甲醇20ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材1g同法制成对照药材溶液。
再取(R-S)-告依春对照品,加甲醇制成每1ml含0.5mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各5~10卩」分别点于同一硅胶GF254薄层板上,以石油醚(60~90C)-乙酸乙酯(1:1 )为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
XXXXXXXXX有限公司中间体质量标准和检验操作规程1 品名:1.1 中文名:板蓝根颗粒中间体1.2 汉语拼音:Banlangen Keli Zhongjianti2 代码:ZJ1013 取样文件编号:4 检验方法:5 依据:《中国药典》2020年版一部6 质量标准:7 检验操作规程7.1仪器与用具:一号筛、五号筛、电子天平、烘箱、称量瓶。
7.2检查:7.2.1板蓝根颗粒中间体:7.2.1.1性状:取本品,在自然光下目测颜色及形态、尝味,并记录结果。
7.2.1.2 外观:颗粒均匀,色泽一致,无吸潮、软化、结块、潮解等现象并无黑点、白点及异物。
7.2.1.2粒度:照粒度测定法(附录52)第二法,双筛分法测定,不能通过一号筛与能通过五号筛的总和,不得过10%。
7.2.1.3溶化性:取本品10g,加热水200ml,搅拌5分钟,立即观察,应全部溶化或轻微浑浊。
(附录54)7.2.1.4水分:照水分测定法(附录15)测定,不得过5.0%。
7.3 含量测定:7.3.1 对照品溶液的制备取尿苷对照品、鸟苷对照品及腺苷对照品适量,精密称定,加5%甲醇制成每1ml含尿苷20μg,鸟苷20μg及腺苷25μg的混合溶液,即得。
7.3.2 供试品溶液的制备取装量差异项下的本品,研细,取适量(约相当于饮片1.4g),精密称定,置具塞锥形瓶中,精密加入5%甲醇10ml,密塞,称定重量,超声处理(功率500W,频率40kHz)5分钟,放冷,再称定重量,用5%甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
7.3.3 测定法分别精密吸取对照品溶液与供试品溶液各5~10μl,注入液相色谱仪,测定,即得。
本品每袋含板蓝根以尿苷(C9H12N2O6)、鸟苷(C10H13N5O5)、腺苷(C10H13N5O4)总量计不得少于0.80mg。
一、实验目的1. 了解板蓝根中有效成分的含量测定方法。
2. 掌握紫外-可见分光光度法在中药分析中的应用。
3. 提高实验操作技能,培养严谨的科学态度。
二、实验原理板蓝根中含有多种有效成分,如靛蓝、靛玉红等。
本实验采用紫外-可见分光光度法测定板蓝根中靛蓝的含量。
靛蓝在特定波长下有较强的吸收,通过测定其吸光度,可以计算出样品中靛蓝的含量。
三、实验仪器与试剂1. 仪器:紫外-可见分光光度计、电子分析天平、容量瓶、移液管、烧杯、玻璃棒等。
2. 试剂:板蓝根提取物、无水乙醇、氢氧化钠溶液、盐酸溶液、靛蓝标准品、蒸馏水等。
四、实验步骤1. 准备标准溶液:准确称取一定量的靛蓝标准品,用无水乙醇溶解,配制成一定浓度的标准溶液。
2. 配制样品溶液:准确称取一定量的板蓝根提取物,用无水乙醇溶解,配制成一定浓度的样品溶液。
3. 标准曲线绘制:分别取标准溶液0.1ml、0.2ml、0.3ml、0.4ml、0.5ml,置于10ml容量瓶中,加入一定量的氢氧化钠溶液,用蒸馏水定容至刻度,摇匀。
以蒸馏水为参比,在510nm波长下测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
4. 样品测定:取一定量的样品溶液,按照标准曲线绘制的方法进行测定,得到样品溶液的吸光度。
5. 计算样品中靛蓝的含量:根据标准曲线,计算样品溶液中靛蓝的浓度,再根据样品溶液的浓度和样品量,计算出样品中靛蓝的含量。
五、实验结果与分析1. 标准曲线:以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
结果表明,在0.1-0.5mg/ml范围内,吸光度与浓度呈线性关系,相关系数R²=0.999。
2. 样品测定:取一定量的样品溶液,在510nm波长下测定吸光度,得到样品溶液的吸光度为A。
3. 样品中靛蓝的含量计算:根据标准曲线,查得样品溶液中靛蓝的浓度为C (mg/ml),再根据样品溶液的浓度和样品量,计算出样品中靛蓝的含量为X (mg)。
六、实验结论本实验采用紫外-可见分光光度法测定板蓝根中靛蓝的含量,结果表明,该方法具有操作简便、快速、准确的特点,可用于板蓝根中靛蓝含量的测定。
1.概述1.1板蓝根颗粒是《中国药典》2015年版一部品种,批准文号:国药准字Z42020660,其处方由板蓝根组成,具有清热解毒,凉血利咽之功效,用于肺胃热盛所致的咽喉肿痛、口咽干燥、腮部肿胀;急性扁桃体炎、腮腺炎见上述证候者。
有效期:18个月。
1.2根据剂型与产品处方判断,板蓝根颗粒的微生物限度检查内容应包括需氧菌总数计数、霉菌和酵母菌总数计数、大肠埃希菌检查;根据板蓝根颗粒的成分和历史验证数据分析,该产品无明显的抑菌活性,拟采用“平皿法”进行微生物限度检查,采用“常规法”进行控制菌检查。
2.目的确认所采用的方法适用于该产品的微生物计数,以确保测定方法的可靠性,确保检验结果的准确可靠。
若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
3.依据《中国药典》2015年版四部“非无菌产品微生物限度检查:微生物计数法”、“非无菌产品微生物限度检查:控制菌检查法”、“非无菌产品微生物限度标准”。
4.范围本验证方案适用于公司板蓝根颗粒微生物限度检查检验方法的适用性试验。
5.职责5.1验证领导小组5.1.1负责验证方案的审批。
5.1.2负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
5.1.3负责验证数据及结果的审核。
5.1.4负责验证报告的审批。
5.1.5负责发放验证证书。
5.2质量部5.2.1负责验证所需的培养基、样品、菌液、缓冲液等的准备。
5.2.2负责取样及对样品的检验。
5.3项目验证小组5.3.1负责拟订验证方案。
5.3.2负责验证方案的实施和收集各项验证试验记录,并对试验结果进行分析后,起草验证报告,报验证领导小组。
6.验证实施条件6.1验证方案培训:在验证实施前,应对参与验证的人员进行验证方案以及与验证相关的文件进行培训,确保相关人员掌握了验证的相关要求与知识。
6.2微生物限度检测室:检验所使用的检测室应经过HVAC系统确认,并符合要求。
6.3检验用水:验证过程使用的纯化水其制备系统应经过确认并符合要求,纯化水质量应经过检验并符合《中国药典》2015年版二部的要求。
甘肃亚兰药业有限公司成品质量标准及检验操作规程
1 品名:
1.1 中文名:南板蓝根
1.2 汉语拼音:Nanbanlangen
2 代码:
3 取样文件编号:
4 检验方法文件编号:
5 依据:《中国药典》(2020年版一部)。
6 质量标准:
7 检验操作规程:
7.1 试药与试剂:三氯甲烷、靛蓝对照品、靛玉红对照品、石油醚、乙酸乙酯、乙醇、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
7.2 仪器与用具:显微镜、硅胶G板、烘箱、马弗炉、中药二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:
7.4.1取本品制片置10×10显微镜下,做显微观察。
7.4.2取本品粉末2g,加三氯甲烷20ml,加热回流1小时,滤过,滤液浓縮至2ml,作为供试品溶液。
另取靛蓝对照品、靛玉红对照品,加三氯甲烷制成每lml各含0.lmg的混合溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各20µl,分别点于同一硅胶G薄层板上,以石油醚(60~90℃)三氯甲烷-乙酸乙酯(1:8:1)为展开剂,展开,取出,晾干,立即检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同的蓝色和
紫红色斑点。
7.5 检查:
7.5.1水分:不得过12.0%(附录15第二法)。
7.5.2总灰分:不得过10.0%(附录17)。
7.5.3二氧化硫残留量:照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6 浸出物:照醇溶性浸出物测定法(附录19)项下的热浸法测定,用稀乙醇作溶剂,不得少于13.0%。
板蓝根原料检验标准操作规程文件编号:LT0xx00山西振东道地药材部门:质量管理部题目:板蓝根原料检验标准操作规程第1 页共2 页起草人:日期:审核人:日期:批准人:日期:生效日期:颁发部门:分发部门:变更记载:修订号:修订日期:批准日期:变更原因及目的:标准依据:《中华人民共和国药典》xx 年版一部1 仪器设备显微镜.恒温干燥箱.恒重蒸发皿.万分之一天平.万分之一天平.高温炉.高效液相色谱仪.紫外灯2 试剂与试药乙醇.正丁醇.冰醋酸.茚三酮试液.甲醇.石油醚(60~90℃).乙酸乙酯.精氨酸(对照品) .(R,S)-告依春(对照品)3 取样3.1 按“药材取样法”的原则取样。
3.2 取样标记清楚.明白.以供检验。
4 检测4.1 性状本品呈圆柱形,稍扭曲,长10~20cm,直径 0.5~1cm.。
表面淡灰黄色或淡棕黄色,有纵皱纹.横长皮孔样突起及支根痕。
根头略膨大,可见暗绿色或暗棕色轮状排列的叶柄残基和密集的疣状突起。
体实,质略软,断面皮部黄白色,木部黄色。
气微,味微甜后苦涩。
4.2 鉴别(1)本品横切面:木栓层为数列细胞。
栓内层狭。
韧皮部宽广,射线明显。
形成层成环。
木质部导管黄色,类圆形,直径约至80μm;有木纤维束。
薄壁细胞含淀粉粒。
(2)取本品粉末 0.5g,加稀乙醇20ml,超声处理20 分钟,滤过,滤液蒸于,残渣加稀乙醇 l ml 使溶解,作为供试品溶液。
另取板蓝根对照药材 0.5g,同法制成对照药材溶液。
再取精氨酸对照品,加稀乙醇制成每1ml 含 0.5mg 的溶液,作为对照品溶液。
照《薄层色谱法检文件编号:LT0xx00部门:质量管理部题目:板蓝根原料检验标准操作规程第2 页共2 页验标准操作程序》(附录ⅥB)试验,吸取上述三种溶液各1~2μl,分别点于同一硅胶 G 薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹于,喷以茚三酮试液,在105℃加热至斑点显色清晰。
49板蓝根检验标准操作规程文件编号:LT0204900山西振东道地药材部门:质量管理部题目:板蓝根成品检验标准操作规程第1 页共2 页起草人:日期:审核人:日期:批准人:日期:生效日期:颁发部门:分发部门:变更记载:修订号:修订日期:批准日期:变更原因及目的:标准依据:《中华人民共和国药典》xx 年版一部1 仪器设备显微镜.恒温干燥箱.恒重蒸发皿.万分之一天平.万分之一天平.高温炉.高效液相色谱仪.紫外灯2 试剂与试药乙醇.正丁醇.冰醋酸.茚三酮试液.甲醇.石油醚(60~90℃).乙酸乙酯.精氨酸(对照品) .(R,S)-告依春(对照品)3 取样3.1 按“药材取样法”的原则取样。
3.2 取样标记清楚.明白.以供检验。
4 检测4.1 性状从所取样品观察与其质量标准对照,是否相符。
4.2 鉴别取本品粉末1g,加80%甲醇20ml,超声处理30 分钟,滤过,滤液蒸干,残渣加甲醇1ml 使溶解,作为供试品溶液。
另取板蓝根对照药材1g,同法制成对照药材溶液。
再取(R,S)-告依春对照品,加甲醇制成每1ml 含 0.5mg 的溶液,作为对照品的溶液。
照《薄层色谱法检验标准操作程序》(附录ⅥB)试验,吸取上述三种溶液各5~10μl,分别点于同一硅胶GF254 薄层板上,以石油醚(60 ~90℃)-乙酸乙酯(1 :1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
文件编号:LT0204900部门:质量管理部题目:板蓝根成品检验标准操作规程第2 页共2 页4.3 水分照《中国药典》xx 年版一部附录ⅨH第一法检测,不得过13.0%。
4.4 总灰分照《中国药典》xx 年版一部附录ⅨK 检测,不得过8.0%。
4.5 酸不溶性灰分照《中国药典》xx 年版一部附录ⅨK 检测,不得过2.0%。
4.6 浸出物照《中国药典》xx 年版一部醇溶性浸出物测定法项下的热浸法测定,用45%乙醇作溶剂,不得少于25.0%。
原药材检验标准操作规程
目的:建立一个中药饮片原药材检验标准操作程序,确保检验结果准确可靠。
适用范围:中药原药材。
责任人:质量保证部主任、质量控制部主任、化验员。
标准来源:《中华人民共和国药典》2010年版一部、《安徽省中药饮片炮制规范》。
内容:
1、性状
取本品适量,放入白瓷盘中,用眼观察,可见以下性状特征:
本品呈圆柱形,稍扭曲,长10~20cm,直径0.5~1cm。
表面淡灰黄色或淡棕黄色,有纵皱纹横长皮孔样突起及支根痕。
根头略膨大,可见暗绿色或暗棕色轮状排列的叶柄残基和密集的疣状突起。
体实,质略软,断面皮部黄白色,木部黄色。
气微,味微甜后苦涩。
2、鉴别
主要使用仪器:电子分析天平、电子显微镜等。
2.1显微鉴别:
2.1.1 试液配制
2.1.1.1 水合氯醛试液:取水合氯醛50克,加水15毫升与甘油10毫升使溶解,即得。
2.1.1.2 甘油醋酸试液:取甘油、醋酸及水各等份混匀,即得。
2.1.1.3 稀甘油:取甘油33毫升,加水稀释至100毫升,再加樟脑一小块或液化苯酚1滴,即得。
2.1.2 供试品制备
2.1.2.1 取本品10g,研细后取少量粉末,置载玻片上,滴加水合氯醛搅拌均匀,置酒精灯上加热透化;加稀甘油数滴,搅拌均匀,分装2~3片,加盖玻片,即得。
2.1.2.2 取研细的粉末少量置载玻片上,加甘油醋酸试液,搅拌均匀,加盖玻片,即得。
2.1.2.3取研细后取少量粉末,置载玻片上,滴加水搅拌均匀,同时滴加少许稀甘油,加盖玻片,即得。
2.1.2.4横切面制备:取供试品欲观察部位,经软化处理后,用徒手切片法切成10~20μm的薄片,选取平整的薄片置载玻片上,滴加水合氯醛试液后,在酒精灯上加热透化,并滴加稀甘油,盖上盖玻片。
2.1.3 置显微镜下观察
可见本品横切面:木栓层为数列细胞。
栓内层狭。
韧皮部宽广,射线明显,形成层成环。
木质部导管黄色,类圆形,直径约至80μm;有木纤维束。
薄壁细胞含淀粉粒。
2.2理化鉴别
取本品水煎液,置紫外光灯(365nm) 下观察,显蓝色荧光。
2.3薄层鉴别
2.3.1取本品粉末0.5g,加稀乙醇20ml,超声处理20分钟,滤过,滤液蒸干,残渣加稀乙醇1ml使溶解,作为供试品溶液。
另取精氨酸对照品,加稀乙醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(《中华人民共和国药典》附录ⅥB)试验,吸取上述两种溶液各1~2μl,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上(自然干燥),以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出,热风吹干,喷以茚三酮试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
2.3.2取本品粉末1g,加80%甲醇20ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取板蓝根对照药材1g,同法
制成对照药材溶液。
再取(R,S)-告依春对照品,加甲醇制成每1ml含0.5 mg的溶液,作为对照品的溶液。
照薄层色谱法(《中华人民共和国药典》附录Ⅵ B)试验,吸取上述三种溶液各5~10 μl,分别点于同一硅胶GF254薄层板上,以石油醚(60~90℃)-醋酸乙酯(1:1)为展开剂,展开,取出,晾干,置紫外光灯(254 nm)下检视。
供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的斑点。
3、检查主要使用仪器:电子分析天平、电热恒温干燥箱、马弗炉、坩埚等。
3.1 水分
取供试品2-5g,平铺于干燥至恒重的扁形称量瓶中厚度不超过5mm,精密称定,打开瓶盖在100~105℃干燥5小时,将瓶盖盖好,移置干燥器中,冷却30分钟,精密称定,再在上述温度干燥1小时,冷却,称重,至连续两次称重的差异不超过5mg为止。
根据减失的重量,按下式计算即得。
W2-W3
供试品中的含水量(%)=────────×100%
W2-W
W 称量瓶重(g)
W2 烘前称量瓶和样品重之和(g)
W3 烘后称量瓶和样品重之和(g)
本品含水量不得过15.0%。
3.2 总灰分
取供试品适量,粉碎使能通过二号筛混合均匀后,取3~5g,置炽灼至恒重的坩埚中,称定重量(准确至0.01g),缓缓炽热,注意避免燃烧,至完全炭化时,逐渐升高温度至500~600℃,使完全灰化并至恒重。
根据残渣重量,按下式计算即得。
W2-W1
供试品中总灰分的含量(%)=────────×100%
W
W1坩埚重(g)
W 样品重(g)
W2炽灼残渣与坩埚重之和(g)
本品总灰分不得过9.0%。
3.3酸不溶灰分
取上项所得的灰分,在坩埚中小心加入稀盐酸约10ml,用表面皿覆盖坩埚,置水浴上加热10分钟,表面皿用热水5ml冲洗,洗液并入坩埚中,用无灰滤纸滤过,坩埚内的残渣用水洗于滤纸上,并洗涤至洗液不显氯化物反应为止。
滤渣连同滤纸移置同一坩埚中,干燥,炽灼至恒重。
根据残渣重量,按下式计算即得。
W2-W1
供试品中酸不溶灰分的含量(%)=────────×100%
W
W1坩埚重(g)
W 样品重(g)
W2炽灼后残渣与坩埚重之和(g)
本品酸不溶灰分不得过2.0%。
3.4二氧化硫残留量
按中国药典2010 年版第一增补本附录二氧化硫残留量测定法测定,取本品细粉10g,精密称定,置于两颈圆底烧瓶中,加水300ml—400 ml(应加水至没过氮气导气管的下端),取6mol/L盐酸10ml加入带刻度的分液漏斗中连接分液漏斗,并导入氮气至瓶底,。
锥形瓶内加水125ml和淀粉指示液1 ml作为吸收液,置于磁力搅拌器上不断搅拌。
连接回流冷凝管,在冷凝管上部连接导气管,将导气管插入250ml锥形瓶底部,开通氮气,调节氮气流量为0.2L/min,打开带刻度的分液漏斗的活塞,使盐酸流入烧瓶。
加热圆底烧瓶内的溶液至沸,并保持微沸约3分钟后开始用0.01mol/l, 的碘滴定液滴定,吸收液置于磁力搅拌器上不断搅拌,至吸收液显蓝色或蓝紫色,持续30秒不消失,并将滴定的结果用空白校正,每1毫升的碘滴定液(0.01mol/l)相当于0.6406mg的二氧化硫。
本品二氧化硫量不得过150mg/kg。
4、浸出物
主要使用仪器:电子分析天平、电热恒温干燥箱、水浴锅、蒸发皿等。
取供试品适量,粉碎使能通过二号筛,并混合均匀后,取约2~4g,精密称定,置100~250ml的锥形瓶中,精密加45%乙醇50~100ml,密塞,称定重量,静置1小时后,连接回流冷凝管,加热至沸腾,并保持微沸1小时。
放冷后,取下锥形瓶,密塞,再称定重量,用45%乙醇补足减失的重量,摇匀,用干燥滤器滤过,精密量取滤液25ml,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105℃干燥3小时,置干燥器中冷却30分钟,迅速精密称定重量。
以干燥品按下式计算即得。
(W2-W1)×2
供试品中醇溶性浸出物的含量(%)=────────×100%
W×(1-W4)
W 样品重(g)
W1蒸发皿重(g)
W2残渣与蒸发皿重之和(g)
W4 供试品的含水量(%)。
本品浸出物不得少于25.0%。
5、含量测定
照高效液相色谱法(《中华人民共和国药典》附录ⅥD)测定。
5.1色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.02%磷酸溶液(7:93)为流动相;检测波长为245 nm。
理论板数按(R,S)-告依春峰计算应不低于5000。
5.2对照品溶液的制备取(R,S)-告依春对照品适量,精密称定,加甲醇制成每1 ml含40 µg的溶液,即得。
5.3供试品溶液的制备取本品粉末(过四号筛)约1 g,精密称定,置圆底瓶中,精密加入水50 ml,称定重量,煎煮2小时,放冷,再称定重量,用水补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取对照品溶液与供试品溶液各10~20 μl,注入液相色谱仪,测定,即得。
按下式计算即得供试品的含量:
A x×C R×V x
供试品的含量(%)=────────——×100%
A R×G×(1-W)×106
A x 供试品的峰面积或峰高。
V x 供试品的体积(ml)
C R 对照品的浓度
A R 对照品的峰面积或峰高
G 供试品的重量(g)
W 供试品的含水量(%)
本品按干燥品计算,含(R,S)-告依春(C5H7NOS)不得少于0.020 %。