6第6章气体吸收2011习题
- 格式:ppt
- 大小:401.00 KB
- 文档页数:2

第七章1.已知101.3kPa,25℃时,100g水中溶有1g氨,其平衡分压为0.987kPa,在此浓度范围内气液平衡关系服从亨利定律。
试求:亨利系数E,以kPa表示;H以kPa.m3/kmol表示;以及相平衡常数m值。
2.在20℃时,氧溶解于水中的平衡关系为p e=4.06×106x。
式中p e为氧的平衡分压,kPa;x为氧在水中的摩尔分数。
试求:(1)与101.325kPa之大气充分接触的20℃水中最大溶氧浓度为多少?分别以摩尔分数和质量比表示。
(2)若将20℃的饱和含氧水加热至95℃,则最大溶氧浓度又为多少?分别以摩尔分数和质量比表示。
3.常压、30℃条件下,于填料塔中用清水逆流吸收空气-SO2混合气中的SO2。
已知入塔混合气中含SO2为5%(体积分数),出塔气中SO2为0.2%(体积分数);出塔吸收液中每100g 含SO2为0.356g。
若操作条件下气液平衡关系为y e=47.87x,试求塔底和塔顶处的吸收推动力,分别以Δy、Δx、Δp、Δc表示。
4.在1.1768Mpa、20℃条件下,用清水于填料塔内逆流吸收H2-CO2混合气中的CO2。
已知入塔混合气中含CO2为30%(体积分数),假若出塔吸收液中CO2达到饱和,那么1kg水可吸收多少千克CO2。
假定此吸收和解吸的平衡关系服从亨利定律。
5.在0℃、101.3kPa下,Cl2在空气中进行稳态分子扩散。
若已知相距50mm两截面上Cl2的分压分别为26.66kPa和6.666kPa,试计算以下两种情况Cl2通过单位横截面积传递的摩尔流量。
(1)Cl2与空气作等分子反向扩散;(2)Cl2通过静止的空气作单向扩散。
6.在一直立的毛细玻璃管内装有乙醇,初始液面距管口10mm,如附图所示。
管内乙醇保持为293K(乙醇饱和蒸气压为1.9998kPa),大气压为101.3kPa。
当有一空气始终缓吹过管口时,经100h后,管内乙醇液面下降至距管口21.98mm处。


第6章 气体吸收1)总压100,温度25℃的空气与水长时刻接触,水中的的浓度为多少?别离用摩尔浓度和摩尔分率表示。
空气中 的体积百分率为。
解:将空气看做理想气体:y= p*=yp=79kPa查表得 E=×510kPa610/*-==E p xH=)./(10342.6)181076.8/(1000)/(65m kN kmoL EMS -⨯=⨯⨯=ρ C=p*.H=79××10-5=×10-4kmol/m 32)已知常压、25℃下某体系的平稳关系符合亨利定律,亨利系数E 为大气压,溶质A 的分压为大气压的混合气体别离与三种溶液接触:①溶质A 浓度为 的水溶液;②溶质A 浓度为的水溶液;③溶质A 浓度为 的水溶液。
试求上述三种情形下溶质A 在二相间的转移方向。
解: E=×104atm ,p=,P=1atm ,y=p/P=① m EP==⨯015104. x 135002110183610=⨯=⨯-.. ∴y mx 110054*.== ∴∆y y y =-=10*∴平稳② x 2350001110181810=⨯=⨯-.. ∴y mx 220027*.== ∴∆y y y =-20* ∴气相转移至液相 ③ x 3350003110185410=⨯=⨯-.. ∴y mx 330081*.== ∴∆y y y =-30*∴液相转移至气相④ P=3atm y= E=×104atm∴m=E/P=×104 x 4=x 3=×10-5∴y mx 440027*.== ∴∆y y y =-40* ∴气相转移至液相 3)某气、液逆流的吸收塔,以清水吸收空气~硫化氢混合气中的硫化氢。
总压为1大气压。
已知塔底气相中含%(摩尔分率),水中含的浓度为 (摩尔分率)。
试求塔底温度别离为5℃及30℃时的吸收进程推动力。
解:查表得(50C ) E1=×104kpa m 1=E 1/P=315 p*1=Ex=KPa 5724.0108.11055=⨯⨯⨯-6222222222225422224205111111111.111063.6/*0040.0*011.033.101/1106.1/**1106.1108.11017.6*609/,1017.6301096.2/*0093.0*015.00057.033.101/5742.0/**---⨯=-=-=∆=-=∆====⨯⨯⨯====⨯=⨯=-=-=∆=-=∆====x m y x x x y y y P p y kpa x E p p E m KPa E C x m y x x x y y y y P p y 液相推动力:气相推动力:):查表得(液相推动力:气相推动力:4)总压为100 ,温度为15℃时 的亨利系数E 为 。

气体吸收(化工原理)习题及答案气液平衡1.在常压、室温条件下,含溶质的混合气的中,溶质的体积分率为10%,求混合气体中溶质的摩尔分率和摩尔比各为多少?解:当压力不太高,温度不太低时,体积分率等于分摩尔分率,即y=0.10根据 y-1y Y =,所以0.110.1-1 0.1Y == 2.向盛有一定量水的鼓泡吸收器中通入纯的CO 2气体,经充分接触后,测得水中的CO 2平衡浓度为2.875×10-2kmol/m 3,鼓泡器内总压为101.3kPa ,水温30℃,溶液密度为1000 kg/m 3。
试求亨利系数E 、溶解度系数H 及相平衡常数m 。
解:查得30℃,水的kPa 2.4=s pkPa 1.972.43.101*=-=-=s A p p p稀溶液:3kmol/m 56.55181000==≈S M c ρ421017.556.5510875.2--⨯=⨯==c c x A kPa 10876.11017.51.9754*⨯=⨯==-x p E A )m kmol/(kPa 1096.21.9710875.2342*⋅⨯=⨯==--A Ap c H 18543.10110876.15=⨯==p E m 3.在压力为101.3kPa ,温度30℃下,含CO 2 20%(体积分率)空气-CO 2混合气与水充分接触,试求液相中CO 2的摩尔浓度、摩尔分率及摩尔比。
解:查得30℃下CO 2在水中的亨利系数E 为1.88×105kPaCO 2为难溶于水的气体,故溶液为稀溶液 kPa)kmol/(m 1096.2181088.11000345⋅⨯=⨯⨯==-S SEM H ρ kPa 3.2033.10120.0*A =⨯==yp p334*km ol/m 1001.63.201096.2--⨯=⨯⨯==A A Hp c 18523.1011088.15=⨯==p E m 4-101.0818520.20m y x ⨯=== 4-4--4101.08101.081101.08x -1x X ⨯=⨯⨯=-= 4.在压力为505kPa ,温度25℃下,含CO 220%(体积分率)空气-CO 2混合气,通入盛有1m 3水的2 m 3密闭贮槽,当混合气通入量为1 m 3时停止进气。

06章一、填空题 (一)易(基础题)1、热力学第二定律的微观实质可以理解为:在孤立系统内部所发生的不可逆过程,总是沿着熵 增大 的方向进行。
2、热力学第二定律的开尔文表述和克劳修斯表述是等价的,表明在自然界中与热现象有关的实际宏观过程都是不可逆的,开尔文表述指出了____功热转换__________的过程是不可逆的,而克劳修斯表述指出了___热传导_______的过程是不可逆的.3.一定量的某种理想气体在某个热力学过程中,外界对系统做功240J ,气体向外界放热620J ,则气体的内能 减少 (填增加或减少),E 2—E 1= -380 J 。
4.一定量的理想气体在等温膨胀过程中,内能 不变 ,吸收的热量全部用于对外界做功 。
5.一定量的某种理想气体在某个热力学过程中,对外做功120J ,气体的内能增量为280J ,则气体从外界吸收热量为 400 J 。
6、在孤立系统内部所发生的过程,总是由热力学概率 小 的宏观状态向热力学概率 大 的宏观状态进行。
7、一定量的单原子分子理想气体在等温过程中,外界对它作功为200J.则该过程中需吸热____-200____J.补充1、一定量的双原子分子理想气体在等温过程中,外界对它作功为200J.则该过程中需吸热____-200____J.补充2、一定量的理想气体在等温膨胀过程中,吸收的热量为500J 。
理想气体做功为 500 J 。
补充3、一定量的理想气体在等温压缩过程中,放出的热量为300J ,理想气体做功为 -300 J 。
8、要使一热力学系统的内能增加,可以通过 做功 或 热传递 两种方式,或者两种方式兼用来完成。
9、一定量的气体由热源吸收热量526610J ⋅⨯,内能增加541810J ⋅⨯,则气体对外作 功______J.10、工作在7℃和27℃之间的卡诺致冷机的致冷系数为 14 ,工作 在7℃和27℃之间的卡诺热机的循环效率为 6.67% 。
(二)中(一般综合题)1、2mol 单原子分子理想气体,经一等容过程后,温度从200K 上升到500K,则气体吸收的热量为_37.4810⨯____J.2、气体经历如图2所示的一个循环过程,在这个循环中,外界传给气体的净热量是 90J 。

第六章气体吸收教学重点1、亨利定律、菲克定律2、吸收速率方程3、吸收塔的物料衡算与操作线方程4、吸收剂用量的决定、填料层高度的基本计算式5、对数平均推动力法计算传质单元数6、掌握填料塔的构造和吸收操作控制。
教学方法1、用化工生产实例引入吸收单元操作,介绍其在化工生产中的广泛应用,用动画展示吸收操作流程,以提高学生的学习兴趣。
2、在学生已熟悉的组成表示方法基础上引入新的相组成的表示法——摩尔比。
3、简单复习气体在液体中的溶解度的影响因素,引导学生回忆《物化》中讲过的亨利定律的表达形式,为了吸收计算的方便,引入其他表示形式。
4、类比动量传递中的牛顿粘性定律、传热过程中的傅立叶定律,引入传质过程中的菲克定律;5、与列管式换热器中的传热过程相类比,引出传质过程中的双膜理论。
6、根据传递速率的普遍规律写出吸收速率方程式的各种表达形式、运用吸收塔的物料衡算得出各操作参数和操作线方程。
7、分析最小液气比的影响因素,确定最佳吸收剂用量、运用前面学过的物料衡算、平衡关系和速率关系,引导学生得出填料层高度的基本计算式。
8、结合吸收操作过程理解传质单元高度与传质单元数的概念、运用难点分解法讲授传质单元数的求法。
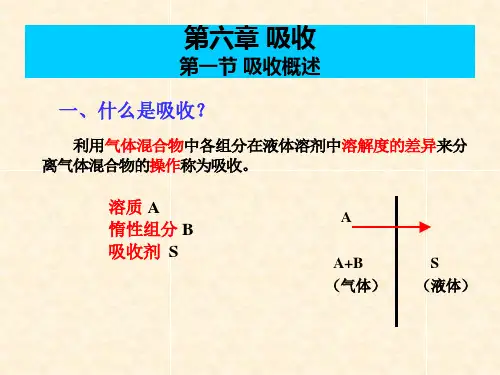
第一节:概述一、化工生产中的传质过程传质分离过程:利用物系中不同组分的物理性质或化学性质的差异来造成一个两相物系,使其中某一组分或某些组分从一相转移到另一相,即进行相际传质,并由于混合物中各组分在两相间平衡分配不同,则可达到分离的目的。
以传质分离过程为特征的基本单元操作:气体吸收, 液体蒸馏, 固体干燥, 液-液萃取,结晶, 吸附, 膜分离等。
本章介绍气体吸收。
二、相组成表示法1、质量分数与摩尔分率(质量分数与摩尔分数)质量分数:是指在混合物中某组分的质量占混合物总质量的分率。
m m w AA =摩尔分率:摩尔分率是指在混合物中某组分的摩尔数n A 占混合物总摩尔数n 的分率。
气相: n n y AA =液相: n n x AA =质量分数与摩尔分率的关系为:A x =NN B B A A A A /M w /M w /M w /M w ⋅⋅⋅++ 2、质量比与摩尔比质量比:是指混合物中某组分A 的质量与惰性组分B (不参加传质的组分)的质量之比。

第六章 吸收习题参考答案(注:红色字体标注部分对教材所给答案进行了修正,请核查)【6-1】 含有8%(体积分数)22C H 的某种混合气体与水充分接触,系统温度为20℃,总压为101.3kPa 。
试求达平衡时液相中22C H 的物质的量浓度。
解:混合气体按理想气体处理,则22C H 在气相中的分压为101.30.088.104p p y kPa kPa ==⨯=总22C H 为难溶于水的气体,故气液平衡关系符合亨利定律,并且溶液的密度可按纯水的密度计算。
查得20℃水的密度为ρ=998.23/kgm 。
由 *Ac Hp =, SH EM ρ=故 *ASpc EM ρ=查表8-1可知,20℃时22C H 在水中的亨利系数E=1.23⨯510kPa ,故 *333A5998.28.104/ 3.65410/1.231018c kmol m kmol m -⨯==⨯⨯⨯ 【6-2】 总压为101.3 kPa ,温度为20 ℃的条件下,使含二氧化硫为3.0%(体积分数)的混合空气与含二氧化硫为3503/gm 的水溶液接触。
试判断二氧化硫的传递方向,并计算以二氧化硫的分压和液相摩尔分数表示的总传质推动力。
已知操作条件下,亨利系数E=3.55310⨯kPa ,水溶液的密度为998.2kg/3m 。
解:由道尔顿分压定律101.30.03 3.039p p y kPa kPa ==⨯=总液相摩尔分数为(溶液近似按纯水计算):0.35640.0000986998.218x ==稀溶液符合亨利定律,所以:*33.55100.00009860.35p Ex kPa ==⨯⨯=p >p *,二氧化硫由气相向液相传递,进行吸收过程。
用气相分压表示的总推动力为:3.0390.35 2.689p p kPa *-=-=与气相浓度相平衡的液相平衡浓度:33.0390.0008563.5510p x E *===⨯ 用液相摩尔分数表示的总推动力为:0.0008560.00009860.0007574x x *-=-=【6-3】 在某填料塔中用清水逆流吸收混于空气的2CO ,空气中2CO 的体积分数为8.5%,操作条件为15℃、405.3kPa ,15℃时2CO 在水中的亨利系数为1.24510⨯kPa ,吸收液中2CO 的组成为411.6510x -=⨯。

一、单选题1.用纯溶剂吸收混合气中的溶质。
逆流操作,平衡关系满足亨利定律。
当入塔气体浓度y1上升,而其它入塔条件不变,则气体出塔浓度y2和吸收率ϕ的变化为:()。
C(A)y2上升,ϕ下降(B)y2下降,ϕ上升(C)y2上升,ϕ不变(D)y2上升,ϕ变化不确定2.在填料塔中,低浓度难溶气体逆流吸收时,若其它条件不变,但入口气量增加,则气相总传质单元数()。
BA 增加 B减少 C不变 D不定3.在填料塔中,低浓度难溶气体逆流吸收时,若其它条件不变,但入口气量增加,则出口气体组成将()。
AA 增加 B减少 C不变 D不定4.在填料塔中,低浓度难溶气体逆流吸收时,若其它条件不变,但入口气量增加,则出口液体组成()。
AA 增加 B减少 C不变 D不定5.低浓度的气膜控制系统,在逆流吸收操作中,若其它条件不变,但入口液体组成增高时,则气相总传质单元数将()。
CA 增加 B减少 C不变 D不定6.低浓度的气膜控制系统,在逆流吸收操作中,若其它条件不变,但入口液体组成增高时,则气相总传质单元高度将()。
CA 增加 B减少 C不变 D不定7.低浓度的气膜控制系统,在逆流吸收操作中,若其它条件不变,但入口液体组成增高时,则气相出口组成将()。
AA 增加 B减少 C不变 D不定8.低浓度的气膜控制系统,在逆流吸收操作中,若其它条件不变,但入口液体组成增高时,则液相出口组成将()。
AA 增加 B减少 C不变 D不定9.正常操作下的逆流吸收塔,若因某种原因使液体量减少以至液气比小于原定的最小液气比时,下列哪些情况将发生? C(A)出塔液体浓度增加,回收率增加(B)出塔气体浓度增加,但出塔液体浓度不变(C)出塔气体浓度与出塔液体浓度均增加(D)在塔下部将发生解吸现象10.最大吸收率与()无关。
DA 液气比 B液体入塔浓度 C相平衡常数 D吸收塔型式11.逆流填料吸收塔,当吸收因数A<1且填料为无穷高时,气液两相将在()达到平衡。

气体吸收(化工原理)习题及答案气液平衡1.在常压、室温条件下,含溶质的混合气的中,溶质的体积分率为10%,求混合气体中溶质的摩尔分率和摩尔比各为多少?解:当压力不太高,温度不太低时,体积分率等于分摩尔分率,即y=0.10根据 y-1y Y =,所以0.110.1-1 0.1Y == 2.向盛有一定量水的鼓泡吸收器中通入纯的CO 2气体,经充分接触后,测得水中的CO 2平衡浓度为2.875×10-2kmol/m 3,鼓泡器内总压为101.3kPa ,水温30℃,溶液密度为1000 kg/m 3。
试求亨利系数E 、溶解度系数H 及相平衡常数m 。
解:查得30℃,水的kPa 2.4=s pkPa 1.972.43.101*=-=-=s A p p p稀溶液:3kmol/m 56.55181000==≈S M c ρ421017.556.5510875.2--⨯=⨯==c c x A kPa 10876.11017.51.9754*⨯=⨯==-x p E A )m kmol/(kPa 1096.21.9710875.2342*⋅⨯=⨯==--A Ap c H 18543.10110876.15=⨯==p E m 3.在压力为101.3kPa ,温度30℃下,含CO 2 20%(体积分率)空气-CO 2混合气与水充分接触,试求液相中CO 2的摩尔浓度、摩尔分率及摩尔比。
解:查得30℃下CO 2在水中的亨利系数E 为1.88×105kPaCO 2为难溶于水的气体,故溶液为稀溶液 kPa)kmol/(m 1096.2181088.11000345⋅⨯=⨯⨯==-S SEM H ρ kPa 3.2033.10120.0*A =⨯==yp p334*km ol/m 1001.63.201096.2--⨯=⨯⨯==A A Hp c 18523.1011088.15=⨯==p E m 4-101.0818520.20m y x ⨯=== 4-4--4101.08101.081101.08x -1x X ⨯=⨯⨯=-= 4.在压力为505kPa ,温度25℃下,含CO 220%(体积分率)空气-CO 2混合气,通入盛有1m 3水的2 m 3密闭贮槽,当混合气通入量为1 m 3时停止进气。

第六章 吸收一.填空1.吸收操作用于分离 混合物,其依据是 。
2.在常压下,20℃时氨在空气中的分压为50mmHg ,此时氨在混合气体中的摩尔分数y= , 摩尔比Y= 。
3.吸收中,温度不变,压力增大,可使相平衡常数 ,传质推动力 。
(增大、减小、不变)4.在吸收塔内用清水吸收空气中的氨气,若提高混合气体的流量,则气相吸收总系数将 。
5.双膜理论认为,吸收阻力主要集中于界面两侧的 和 之中。
6.易溶气体溶液上方的分压 ,难溶气体溶液上方的分压 。
7.亨利定律的表达式Ex p =*,若某气体在水中的亨利系数E 值很大,说明该气体为____气体。
8.对接近常压的低溶质浓度的气液平衡系统,当总压增大时,亨利系数E ______,相平衡常数m ,溶解度系数H 。
(增大、减小或不变) 9.压力 ,温度 ,将有利于解吸的进行。
10.由于吸收过程中,气相中的溶质组分分压总是______溶质的平衡分压,因此吸收操作线总是在平衡线的________。
11.溶解度很大气体,吸收时属于 控制,强化吸收的手段是 。
12.若总吸收系数和分吸收系数间的关系可表示为GL L k Hk K +=11,其中L k 1表示 ,当______项可忽略时,表示该吸收过程为液膜控制。
13.某低浓度气体吸收过程,已知相平衡常数m=1,气膜和液膜体积吸收系数分别为k y a=2×10-4kmol/m 3.s, k x a =0.4kmol/m 3.s, 则该吸收过程中气膜阻力占总阻力的百分数为 ;该气体为 溶气体。
14.在吸收塔某处,气相主体浓度y=0.025,液相主体浓度x=0.01,气相传质分系数k y =2kmol/m 2·h ,气相传质总K y =1.5kmol/m 2·h ,则该处气液界面上气相浓度y i 应为⎽⎽ ⎽⎽⎽。
平衡关系y=0.5x 。
15.吸收操作中增加吸收剂用量,操作线的斜率 ,吸收推动力 。
【例6-1】 总压为101.325kPa 、温度为20℃时,1000kg 水中溶解15kg NH 3,此时溶液上方气相中NH 3的平衡分压为2.266kPa 。
试求此时之溶解度系数H 、亨利系数E 、相平衡常数m 。
解:首先将此气液相组成换算为y 与x 。
NH 3的摩尔质量为17kg/kmol ,溶液的量为15kg NH 3与1000kg 水之和。
故0156.018/100017/1517/15=+=+==BA A A n n n n n x022403251012662...Pp y *A*===436.10156.00224.0*===x ym由式(6-11) E =P ·m =101.325×1.436=145.5kPa或者由式(6-1)3.1450156.0266.2*===xp E A kPa溶剂水的密度ρs =1000kg/m 3,摩尔质量M s =18kg/kmol ,由式(6-10)计算H382.0183.1451000=⨯=≈ssEMH ρkmol/(m 3·kPa )H 值也可直接由式6-2算出,溶液中NH 3的浓度为 ()()869.01000/10001517/15//=+=+==ss A AA A A m m Mm V n c ρkmol/m 3所以 383.0266.2869.0*===AA p c H kmol/(m 3·kPa )【例6-2】 在20℃及101.325kPa 下CO 2与空气的混合物缓慢地沿Na 2CO 3溶液液面流过,空气不溶于Na 2CO 3溶液。
CO 2透过厚1mm 的静止空气层扩散到Na 2CO 3溶液中。
气体中CO 2的摩尔分数为0.2。
在Na 2CO 3溶液面上,CO 2被迅速吸收,故相界面上CO 2的浓度极小,可忽略不计。
CO 2在空气中20℃时的扩散系数D 为0.18cm 2/s 。
问CO 2的扩散速率是多少?解:此题属单方向扩散,可用式6-17计算。
气体吸收-选择题(题目)层次:A(1) x08a02023只要组分在气相中的分压__________液相中该组分的平衡分压,吸收就会继续进行,直至达到一个新的平衡为止。
(A)大于(B)小于(C)等于(D)不等于(2) x08a02024对极易溶的气体,气相一侧的界面浓度y i__________y e。
(A)大于(B)等于(C)接近于(D)小于(3) x08a02025在吸收塔设计中,当吸收剂用量趋于最小用量时,____________________。
(A)回收率趋向最高;(B)吸收推动力趋向最大(C)操作最为经济;(D)填料层高度趋向无穷大(4) x08a02065逆流操作的填料吸收塔,当吸收因数A <1 且填料为无穷高时,气液两相将在————达到平衡。
(A 塔顶、B 塔底、 C 塔中部)(5) x08a02086选择题:(按 a.增加、b.减少、c.不变、d.不定, 填入括号内)随温度增加,气体的溶解度(),亨利系数E()。
(6) x08a02090选择题:(请按a.增加、b.减少、c.不变,填入括号内)对接近常压的低浓度溶质的气液平衡系统,当温度和压力不变,而液相总浓度增加时其溶解度系数H 将(),亨利系数E将()。
(7) x08a02099通常所讨论的吸收操作中,当吸收剂用量趋于最小用量时,_______。
(A)回收率趋向最高(B)吸收推动力趋向最大(C)操作最为经济(D)填料层高度趋向无穷大。
(8) x08a03091选择题:(请按a.增加、b.减少、c.不变,填入括号内)在常压下用水逆流吸空气中的CO2,若将用水量增加,则出口气体中的CO2含量将()气相总传质系数Ky 将(),出塔液体中CO2浓度将()。
(9) x08a03111选择题:(按 a.增加、b.减少、c.不变、d.不定, 填入括号内)双组分理想气体进行定常单向扩散,如维持气相各部分p不变,则在下述情况下,气相中的传质通量N A将如何变化?⑴总压增加,N A();⑵温度增加,N A();⑶气相中惰性组分的摩尔分率减少,则N A()。
第六章练习题一、选择题1.若一理想气体在绝热容器中作真空自由膨胀后,气体的( E )A )内能增加B )相改变C )压强增加D )温度改变E )熵改变2.如下图所示,在给出的4个图像中,能够描述一定质量的理想气体在可逆绝热过程中密度随压强变化的图像为(D )3.设Q d 表示一个微元过程中系统吸收的热,T 表示系统的温度,⎰21TQd 为系统从状态1变化到状态2的过程中的积分,则热力学系统的任意两个平衡态1和2的熵差12S S -为( C ) A )与系统状态变化的具体过程有关,由该过程中的积分⎰21T Qd 决定 B )可用任意过程中的积分⎰21TQ d 表示 C )可用任意可逆过程中的积分⎰21T Qd 表示 D )可用任意不可逆过程中的积分⎰21TQ d 表示4.设热源的绝对温度是冷源的N 倍,则在一个可逆的卡诺循环中,气体将把从热源得到的热量的( C )给冷源A )N 倍B )(N —1)倍C )N 1倍 D )NN 1+倍 5. 一绝热容器被隔板分成两半,一半是真空,另一半是理想气体,若把隔板抽出,气体将进行自由膨胀,达到平衡后,则(A )A) 温度不变,熵增加 B) 温度升高,熵增加 C) 温度降低,熵增加 D) 温度不变,熵不变6.“理想气体和单一热源接触作等温膨胀时,吸收的热量全部用来对外做功。
”对此说法,有如下几种评论,其中正确的是( C )A )不违反热力学第一定律,但违反热力学第二定律B )违反热力学第一定律,但不违反热力学第二定律C )不违反热力学第一定律,也不违反热力学第二定律D )违反热力学第一定律,也违反热力学第二定律 7.关于可逆过程和不可逆过程的判断 (1)可逆热力学过程一定是准静态过程 (2)准静态过程一定是可逆过程(3)不可逆过程就是不能向相反方向进行的过程 (4)凡有摩擦的过程,一定是不可逆过程 以上4种判断正确的是(C )A)(1)、(2)、(3) B)(1)、(2)、(4) C)(2)、(4) D )(1)、(4) 8.“不可逆过程就是不能往反方向进行的过程”,这个判断是( )B)D)C)ρA)A )正确的B )错误的C )不能判定9.在等文登呀若2N 和2O 均为理想气体,则0.8mol 的2N 和0.2mol 的2O 混合后,熵变约为( )K J / (注:61.12.0ln -=,22.08.0ln -=)A) 41013.4-⨯ B) 13.4 C) 41013.4⨯ D)21013.4-⨯ E) 3.4110.设热源的绝对温度是冷源的N 倍,则在一个可逆的卡诺循环中,气体将把从热源得到的热量的( C )给冷源A )N 倍B )(N —1)倍C )N 1倍 D )NN 1+倍 二、简答题1、简要回答下列过程是否可逆(1)在恒温下加热使水蒸发(2)由外界做功,设法使水在恒温下蒸发(3)通过活塞(活塞与容器器壁间无摩擦)缓慢地压缩容器中的空气 (4)在体积不变的情况下加热容器内的空气,使温度由1T 升到2T(5)在一绝热容器内,不同温度的两种液体混合 (6)高速行驶的卡车突然刹车停止2.热力学第零定律、第一定律及热力学第二定律的内容各是什么?热力学第零定律:两个热力学系统中的每一个都与第三个热力学系统处于热平衡,则它们彼此也必定处于热平衡热力学第一定律:自然界一切物质都具有能量,能量有各种不同的形式,能够从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转化和传递中能量的数量不变。
第九章 气体吸收一、本章学习的目的、应掌握的内容和学习注意事项1. 本章学习的目的通过本章的学习,掌握气体吸收与解吸的基本概念和气体吸收过程的基本计算方法。
2. 本章重点掌握的内容(1)气体吸收过程的平衡关系 (2)气体吸收过程的速率关系 (3)低浓度气体吸收过程的计算 本章应掌握的内容(1)费克定律和分子传质问题的求解方法 (2)双膜模型本章一般了解的内容(1)溶质渗透模型和表面更新模型 (2)吸收系数3. 本章学习应注意的问题(1)表示吸收过程的平衡关系为亨利定律,亨利定律有不同的表达形式,学习中应注意把握它们之间的联系。
(2)表示吸收过程的速率关系为吸收速率方程,吸收速率方程有不同的表达形式,学习中应注意把握它们之间的联系。
(3)学习分子传质,不要机械地记忆各过程的求解结果,应注意把握求解的思路和应用背景。
(4)学习中应注意把握传质机理和吸收过程机理之间的联系,注意体会讲述传质机理和吸收过程机理的目的和意义。
二、例题解析9-1 惰性气与CO 2的混合气中CO 2体积分数为30%,在表压1MPa 下用水吸收。
设吸收塔底水中溶解的CO 2达到饱和,此吸收液在膨胀槽中减压至表压20kPa ,放出大部分CO 2,然后再在解吸塔中吹气解吸。
设全部操作范围内水与CO 2的平衡关系服从亨利定律,操作温度为25℃。
求1kg 水在膨胀槽中最多能放出多少千克CO 2气体。
解:依题意,在全部操作范围内水与CO 2的平衡关系服从亨利定律,查附录二得25℃下CO 2溶于水时的亨力系数为MPa 1066.12⨯=E方法一:对膨胀槽作CO 2物料平衡(以1kg 水为衡算基准) 入膨胀槽吸收液中CO 2的组成321110990.11066.1/3.01013.1/-⨯=⨯⨯==E p x设此液1kg 水中溶解CO 2的kg 数为W 1,则有:kg 10875.410990.118/144/44/313111--⨯=⇒⨯=+=W W W x出膨胀槽吸收液中CO 2的组成422210307.71066.1/)020.01013.0(/-⨯=⨯+==E p x设此液1kg 水中溶解CO 2的kg 数为W 2,则有:kg 10788.110307.718/144/44/324222--⨯=⇒⨯=+=W W W x故1kg 水在膨胀槽中最多能释放出CO 2的kg 数为O /kgH kgCO 1009.310)788.1875.4(223321--⨯=⨯-=-=W W W方法二:不考虑气流夹带走的水量,则膨胀槽内水的量恒定不变,于是1kg 水在膨胀槽中最多能放出CO 2气体的的千克数为O/kgH kgCO 00308.010*******)3.1213.03.1101(1/)()()(223CO 21CO 21CO 21222=⨯⨯⨯-⨯⨯=-=-≈-=E M p p L M x x L M X X L m s s s9-2 某水杯中初始水面离杯上缘1cm ,水温30℃,水汽扩散进入大气。
气体吸收1 .向盛有一定量水的鼓泡吸收器中通入纯的CO 气体,经充分接触后,测得水中的CO 平衡浓度为2.875 22X10-2kmol/m 3,鼓泡器内总压为101.3卜「@,水温30℃,溶液密度为1000 kg/m 3。
试求亨利系数E 、溶 解度系数H 及相平衡常数m 。
解:查得 u30℃,水的ps = 4.2kPap * A = p — p = 101.3 — 4.2 = 97.1kPaC _ 2.875 义 10-2-A-- ---------C 55.56p *97.1E - J --------------------------- --- 1.876x 105kPa % 5.17 x 10 -4〃 C ,2.875 x 10-2 H - -A ----- --------------- p * 97.1A2 .在总压101.3kPa,温度30c 的条件下,SO 2摩尔分率为0.3的混合气体与SO 2摩尔分率为0.01的水溶液相接触,试问:(1)从液相分析SO 2的传质方向;(2)从气相分析,其他条件不变,温度降到0℃时SO 2的传质方向;(3) 其他条件不变,从气相分析,总压提高到202.6kPa 时SO 2的传质方向,并计算以液相摩尔分率 差及气相摩尔率差表示的传质推动力。
解:(1)查得在总压101.3kPa ,温度30℃条件下SO 2在水中的亨利系数E =4850kPa 所以 m -E -竺50 - 47.88 p 101.3 从液相分析故SO 2必然从液相转移到气相,进行解吸过程。
p稀溶液:C XMS1000= 55.56kmol/m 3 18-5.17 义 10 - 4-2.96x 10-4kmol/(kPa - m 3)1.876 x105101.3- 18542 二 0.3m — 47.88- 0.00627 < %=0.01(2)查得在总压101.3kPa ,温度0℃的条件下,SO 2在水中的亨利系数E =1670kPa从气相分析y *=mx= 16.49X 0.01=0.16<y=0.3故SO 2必然从气相转移到液相,进行吸收过程。