染色体标本的制作及组型观察
- 格式:docx
- 大小:71.83 KB
- 文档页数:4

人的外周血淋巴细胞培养及染色体制片方法、染色体组型分析一、实验背景1、Carnoy固定液:固定液的重要特性是能迅速穿透细胞,将其固定并维持染色体结构的完整性,还要能够增强染色体的嗜碱性,达到优良染色效果。
单纯的固定液一般难以达到这些要求,因此在实验中使用两种混合的固定液。
由于Carnoy首先使用的甲醇和冰乙酸混合液而称其为卡诺氏固定液。
Carnoy固定液(甲醇∶冰乙酸=3∶1)每次使用前需临时配制,长时间放置影响固定效果,固定时间15min至24h,冰箱、室温均可。
必要时可改变甲醇和冰乙酸的比例,冰乙酸比例增加,利于细胞膨胀、染色体铺展,但易导致细胞破裂、染色体散失。
2、低渗液(hypotonic solution)低渗液是指渗透压和离子强度均低于正常细胞生理条件的溶液,渗透压低于组织液,与外周血混在一起时,水分迅速进入细胞,使其膨胀,甚至破裂,获得分散良好的染色体分裂象。
常见的低渗液:水、低渗的柠檬酸钠或氯化钠、甘油磷酸钾(0.65mol/L)、氯化钾(0.075mol/L)等。
低渗效果取决于低渗液的化学组成、低渗的温度和处理时间。
低渗处理是凭借反渗透作用使细胞膨胀染色体铺展,同时可使黏附于染色体的核仁物质散开,以便能在一个平面上观察所有染色体形态。
实验室中一般选用0.075mol/L KCl为低渗液,其优点有:①染色体轮廓清楚,可染色性强,染色时间短。
②用于显带染色时能充分显示带型特点。
低渗处理为37℃,25~30min,以预实验条件为准。
2、肝素N-硫酸和艾杜糖醛酸含量较多的一种糖胺聚糖,由D-β-葡糖醛酸(或L-α-艾杜糖醛酸)和N-乙酰氨基葡糖形成重复二糖单位组成的多糖。
肝素是一种抗凝剂,是由二种多糖交替连接而成的多聚体,在体内外都有抗凝血作用。
2、PHA植物血凝素(Phytohaemagglutinin)是一种有丝分裂原,主要用于激活免疫细胞—淋巴细胞。
是一种干扰素诱导剂,不仅可以刺激机体产生白介素-2和干扰素;还可以刺激机体产生非特异性抗体。


染色体标本的制备及组型实验生命科学学院张瀛【实验目的】1.掌握染色体标本的制作方法。
2.认识不同生物染色体的特征,学会做染色体组型图。
【实验用品】小白鼠,秋水仙素,生理盐水,0.3%KCl液,固定液,铜网,酒精灯,离心机,注射器,剪刀,镊子,载玻片,滴管,显微镜等。
【实验原理】染色体标本制作的原理细胞分裂中期染色体形状较为清楚,故使用中期细胞,并以每条染色体相对独立存在为染色体标本制作的四大要点1)PHA:促细胞分裂,使淋巴细胞返幼,变为淋巴母细胞。
2)秋水仙素:破坏微管装配,使纺锤体不能形成,使大量细胞停止在分裂中期。
(相同作用:秋水仙胺、长春碱、鬼臼素)3)低渗作用:水进入细胞内,使细胞内容空间变大,染色体间的距离拉大,易于染色体分散开。
4)空气干燥:使细胞和染色体展开。
5)固定:用camoy`s solution(甲醇:冰醋酸=3:1)作用使蛋白质变性,对染色体内的组蛋白来说,变形后硬度增加,保持了染色体的“即时形态”,对细胞膜蛋白来说,变形使细胞膜硬度增强,形成屏障作用,防止了细胞内物质外溢和丢失。
染色体标本制作的意义根据染色体的特征(数目、形态、大小等)制作染色体组型图。
染色体标本制作的应用1) 生物学方面:根据染色体特征鉴别生物及种类。
染色体数目:兔-44条,猫-38条,狗-78条,马-64条,人-46条,小鼠-40条(18对端着丝粒染色体,第17、18对为亚端着丝粒染色体),大鼠-42条,鸡-78条。
2) 临床医学方面:主要用于遗传性疾病的诊断及研究。
因此,染色体组型实验广泛应用于胎儿遗传性疾病早期诊断中(抽取羊水)。
染色体组型把真核生物的一个体细胞中的各个染色体按其长度、形状和着丝粒的位置排列成一定顺序的过程,即为染色体组型。
染色体核型染色体组型是染色体核型的模式表达。
染色体组型及分群依据主要根据染色体的相对长度,着丝粒的位置,其次是臂的长短,以及次级缢痕或随体的有无等方面。

果蝇唾腺染色体标本的制备与观察摘要:多线染色体广泛存在于双翅目、弹尾目的消化道及消化腺细胞中。
为遗传学,尤其是果蝇研究带来不少便利。
不论在经典细胞遗传学时代,还是当今的基因组时代,多线染色体都对遗传学研究有着重要的意义。
本次实验中,我们使用果蝇三龄幼虫唾液腺的染色体为材料制备、观察。
分辨了果蝇的不同染色体,练习了果蝇唾腺染色体标本的制备与观察。
染色体研究通常面临两个困难:一是染色体很小;一是初级少数动植物,如玉米祖先期的染色体上具有染色体里这样的结构可以作为识别或定位的标志外,大多数生物的染色体都没有标志。
而作为遗传学研究的模式生物黑腹果蝇,有丝分裂中期的染色体格外小。
多线染色体就是在这样的背景下被重新发现的。
多线染色体最早在要闻幼虫的唾液腺中发现。
广泛存在于双翅目、弹尾目的消化道及消化腺细胞中。
这些戏胞发育到一定阶段后,停止在间期,,但紧密配对的同源染色体不断复制。
,而复制后产生的染色体彼此不分开而形成。
少数植物中也发现有多线染色体,但没有昆虫体内的大。
多线染色体为遗传学,尤其是果蝇研究带来不少便利。
一个重要进展是Pardue等1907建立了双翅目昆虫多县染色体的原位杂交方法。
有了这种方发,确定一条RNA或DNA序列在染色体上的位置就变得非常简单。
不论在经典细胞遗传学时代,还是当今的基因组时代,多线染色体都对遗传学研究有着重要的意义。
在本次实验中,我们使用果蝇三龄幼虫唾液腺的染色体为材料制备、观察。
1.实验步骤1.1试验材料显微镜,双筒体式显微镜,解剖针两只,小毛笔一只,眼科镊,载玻片,盖玻片,滤纸片,香柏油,镜头纸,果蝇三龄幼虫,卡宝品红染液,盐酸1mol/L,蒸馏水,生理盐水。
1.2试验方法1.2.1三龄幼虫的饲养培养基富含营养;虫口密度要小;低温培养。
1.2.2剥去唾液腺选取果蝇三龄幼虫放在载片上,加一滴0.7%生理盐求,幼虫以体型大、虫龄长的为好。
将载片置双筒解剖镜下。
解剖针不宜过于尖锐,避免用力时刺破头部,拉不出唾腺,反而不便第二次拉取了。

果蝇幼虫唾腺染色体标本的制备与观察摘要果蝇幼虫唾腺细胞染色体是一种特化的巨大染色体,由于其外形具横纹与胀泡等结构,可作为物种区别标志与基因定位标志。
实验采用普通果蝇的三龄幼虫,剥离出其唾腺,通过固定、染色与压片等步骤制成果蝇幼虫唾腺染色体标本,在显微镜下观察,最终对果蝇幼虫唾腺染色体的外形、结构、特征做出简要描述。
引言果蝇三龄幼虫的唾腺细胞处于永久早期,染色体解旋呈伸展状态.在幼虫发育过程中细胞核中的DNA多次复制,但细胞、细胞核不分裂。
复制后的染色单体DNA不分开,这种现象叫做核内有丝分裂,从而形成了多线染色体。
加之唾腺细胞中同源染色体互相靠拢在一起呈现一种联会状态,而使其比一般分裂中期体细胞中的染色体长100~150倍。
由于在唾腺细胞中8条染色体之间以着丝粒互相连结在一起形成染色盘或异染中心,以及同源染色体之间的假联会,经碱性染料染色后,可以观察到一个染色较深的染色盘和以染色盘为中心向外辐射出的5条染色体臂。
在这些染色体臂上可以看到染色深浅不同,被称作明带、暗带的横纹,这些横纹的位置,宽窄、数目都具有物种的特异性。
不同物种,不同染色体的不同部位形态位置是固定的。
因此根据染色体各条臂带纹特征和各条臂端部带纹特征能准确识别各条染色体。
另外某染色体上出现的变异,在唾腺染色体相应的臂上就能反映出来,这样这些横纹就成了精确基因定位的“坐标”。
将野生型果蝇的带纹与缺失、重复、倒位等突变体的带纹进行比较,就可以将一些基因定位在染色体上。
[1]在染色体臂上还可看到某些带纹通过染色体的解旋、膨大形成的疏松区胀泡,其中最大的一个胀泡叫做巴尔比尼氏环。
胀泡富含转录出来的RNA,因此不着色,是基因活动的区域。
在个体发育的不同阶段,胀泡或巴尔比尼氏环在染色体上出现的部位不同,据此研究基因的表达,开展各种染色体变异的研究等等。
本次实验将通过对果蝇幼虫唾腺染色体标本的制备与观察,了解并掌握果蝇三龄幼虫唾腺的剖离技术,掌握唾腺染色体标本的制备方法,了解唾腺染色体的形态结构特点。

动物骨髓细胞染色体标本的制备实验报告
通过制备动物骨髓细胞染色体标本,进一步了解细胞染色体的形态和结构,以及染色体在遗传学研究中的应用。
实验原理
动物骨髓细胞是一种快速分裂细胞,其中染色体数目和结构较为清晰,因此通常用于染色体分析和遗传学研究。
为了制备动物骨髓细胞染色体标本,需要经过细胞取样、细胞处理与固定、染色和镜检等几个步骤。
实验步骤
1. 取样:在实验动物体内取出一小段骨髓组织,置于离心管中,加入10ml生理盐水,轻轻摇晃,使细胞均匀分散。
2. 细胞处理和固定:取出适量的细胞液,加入等体积的去离子水后进行处理。
将细胞液滴于预先贴有载玻片上的正常细胞培养液中,使其渐渐均匀分散。
将玻片放置在室温下,使细胞贴附在玻片上并进行细胞固定。
细胞固定可用10%甲醛或70%乙醇,也可用50%醋酸处理。
3. 染色:将固定的细胞标本先置于1%琼脂糖中5~10分钟,用注射器吸取琼
脂糖,并把细胞标本冲洗干净,然后用生理盐水洗净。
若要染色,则滴上适量的霉素酚-吡啶溶液或可以染细胞核者,如吉姆萨红溶液或乙酰苯胺-三甲胺水溶液等,等颜色形成后即可洗净。
4. 镜检:放入顶匣,用显微镜观察染色后细胞形态和染色体。
如果需要拍照,则可利用显微摄影技术,对样本进行记录。
实验结果
通过实验可以观察到动物骨髓细胞染色体的形态、数量和结构,进一步了解染色体在遗传学研究中的应用。
同时,该实验对熟悉细胞培养和染色技术也有一定帮助。
实验结论
通过本次实验,我们可以获得动物骨髓细胞染色体标本,并学习了细胞处理、固定、染色和镜检等关键步骤。
实验结果可以为生物学研究提供相关实验基础。

人体外周血淋巴细胞培养及染色体组型分析实验方案2012级师范2班第3组组员:吴婵胡颖月央珍杨基伟杨青松宋海燕田金梅(组长)一、实验目的掌握人体外周血淋巴细胞培养与染色体组型分析的方法。
二、实验原理人的1ml外周血约含有1×10*6~3×10*6个小淋巴细胞,它们几乎都处于G0或G1期,一般情况下不分裂,但但采用人工离体培养的方法,经PHA(植物血球凝集素)刺激后,能转变成可分裂的淋巴母细胞进行有丝分裂。
所谓外周血培养即是将外周血接种在适当的培养物中加入适量的秋水仙素,使纺锤体微管解聚,这样细胞停留在中期,可以获得大量的分裂细胞。
用低渗盐溶液(一般是0.075mol/L的KCl)处理,使其中的红细胞及分裂相细胞膜和一部分细胞质除去然后用Carnoy固定液固定,最后以气干法制片,可获得较好的染色体标本。
核型(karyotype)指一个细胞中的整套染色体,按其大小、形态特征顺序排列所构成的图像。
通常是将显微摄影得到的染色体照片剪贴而成。
在完全正常的情况下,一个体细胞的核型一般可代表该个体的核型。
组型(idiogram)是以模式图的方式表示,它是通过许多细胞染色体的测量取其平均值绘制成的,是理想的,模式化的染色体组成,代表一物种染色体组型的特征。
将待测细胞的核型进行染色体数目、形态特性的分析,确定其是否与正常核型完全一致,称为核型分析(karyotype analysis)。
这对于探索人类遗传病的发病机理,探讨动物和植物的起源,以及物种间的亲缘关系等都具有重要意义。
染色体的特征以有丝分裂中期最为显著,所以一般都分析中期分裂相。
根据染色体着丝粒位置可将染色体分为中部着丝粒染色体(m),亚中部着丝粒染色体(sm),亚端部着丝力粒染色体(st),端部着丝力粒染色体(t)。
对于任何一个的基本形态特征来说,重要的参数有以下3个:(1)相对长度=单条染色体的长度/(单倍体常染色体+X或Y染色体)的总长度×100%(2)臂指数=长臂/短臂(反映着丝粒位置的指数)(3)着丝粒指数=短臂/整个染色体长度×100%(反映着丝粒位置的指数)人类体细胞的正常核型是含有23对染色体,共46条。


青蛙骨髓细胞染色体标本的制备及染色体的核型分析陈钧瑜(中山大学生命科学学院08级生物技术广州510275)摘要:染色体组型具有物种的特异性,它们在遗传过程中是相对稳定的,因此可以作为物种分类的基本依据之一。
本实验以青蛙的骨髓为材料,制备了青蛙骨髓细胞染色体标本,选择形态完好的中期分裂相进行拍照放大,用常规统计方法测量染色体的相对长度、臂比和着丝粒指数等。
结果表明青蛙骨髓细胞二倍染色体数目为26,可配成13对同源染色体,其中有5对大型染色体(相对长度>9%)和8对小型染色体(相对长度<7%);8对为中部着丝粒染色体,其余5对为亚中部着丝粒染色体。
青蛙骨髓细胞染色体核型公式为K(2n)=26 =13n=16m+10sm。
关键词:青蛙;骨髓细胞;染色体;核型1、引言核型一词首先由前苏联学者TA 列维茨基等在上世纪20 年代提出,它是指每种生物染色体的数目、大小和形态等特征的总和。
染色体核型或组型分析(Chromosome karyotype analysis) 是染色体研究中的一个基本方法。
染色体组型是细胞分类学的重要数据,也是从细胞遗传学角度了解物种间亲缘关系的有效途径,对染色体核型分析,不仅有助于了解生物的遗传组成、遗传变异规律和发育机制,而且对预测鉴定种间杂交和多倍体育种的结果、了解性别遗传机理以及基因组数、物种起源、进化和种族关系的鉴定都具有重要的参考价值[1]。
骨髓细胞具有丰富的细胞质和高度分裂能力,因此不必经体外培养,也不需要植物血球凝集素(PHA)的刺激,可直接观察到分裂的细胞。
经秋水仙素处理后,分裂的骨髓细胞被阻断在有丝分裂中期,再经离心、低渗、固定、滴片等步骤,便可制作出理想的染色体标本,是研究动物细胞遗传学的好材料。
用Giemsa染色法制备骨髓细胞染色体标本,所得标本清晰无缺失与重叠[2],用显微拍摄技术采集染色体的电子图片信息,后期用Adobe公司的Photoshop软件优化处理照片[3]],获得完整、清晰的染色体核型,并采用Levan[4]的方法进行核型分析。

青蛙骨髓细胞染色体标本的制备及染色体的核型分析陈钧瑜(中山大学生命科学学院08级生物技术广州510275)摘要:染色体组型具有物种的特异性,它们在遗传过程中是相对稳定的,因此可以作为物种分类的基本依据之一。
本实验以青蛙的骨髓为材料,制备了青蛙骨髓细胞染色体标本,选择形态完好的中期分裂相进行拍照放大,用常规统计方法测量染色体的相对长度、臂比和着丝粒指数等。
结果表明青蛙骨髓细胞二倍染色体数目为26,可配成13对同源染色体,其中有5对大型染色体(相对长度>9%)和8对小型染色体(相对长度<7%);8对为中部着丝粒染色体,其余5对为亚中部着丝粒染色体。
青蛙骨髓细胞染色体核型公式为K(2n)=26 =13n=16m+10sm。
关键词:青蛙;骨髓细胞;染色体;核型1、引言核型一词首先由前苏联学者TA 列维茨基等在上世纪20 年代提出,它是指每种生物染色体的数目、大小和形态等特征的总和。
染色体核型或组型分析(Chromosome karyotype analysis) 是染色体研究中的一个基本方法。
染色体组型是细胞分类学的重要数据,也是从细胞遗传学角度了解物种间亲缘关系的有效途径,对染色体核型分析,不仅有助于了解生物的遗传组成、遗传变异规律和发育机制,而且对预测鉴定种间杂交和多倍体育种的结果、了解性别遗传机理以及基因组数、物种起源、进化和种族关系的鉴定都具有重要的参考价值[1]。
骨髓细胞具有丰富的细胞质和高度分裂能力,因此不必经体外培养,也不需要植物血球凝集素(PHA)的刺激,可直接观察到分裂的细胞。
经秋水仙素处理后,分裂的骨髓细胞被阻断在有丝分裂中期,再经离心、低渗、固定、滴片等步骤,便可制作出理想的染色体标本,是研究动物细胞遗传学的好材料。
用Giemsa染色法制备骨髓细胞染色体标本,所得标本清晰无缺失与重叠[2],用显微拍摄技术采集染色体的电子图片信息,后期用Adobe公司的Photoshop软件优化处理照片[3]],获得完整、清晰的染色体核型,并采用Levan[4]的方法进行核型分析。
实验报告课程名称:分子医学实验 指导老师: 成绩: 实验名称: 人类外周血染色体标本制备G 带观察及核型分析 同组学生姓名:一、实验目的及原理三、实验结果二、操作步骤 四、讨论分析一、 实验目的及原理熟悉人类外周血淋巴细胞的培养方法。
初步掌握人类染色体标本培养和制备的基本方法。
通过实验掌握G带标本制备的基本方法,学会在显微镜下直接观察G 带分裂相。
在细胞周期的不同阶段,染色体的结构不同,在细胞分裂间期,染色体呈现细长的丝状结构,分散于细胞核中,且交织成网状,难以识别其数目和每个染色体特有的结构;在细胞有丝分裂中期,染色体凝缩形成短的棒状结构,排列在赤道板上,此时染色体的形态、数目最清楚,所以一般选择有丝分裂中期的细胞来观察染色体的形态、数目。
在人类遗传分析中,普遍采用外周血培养的方法制备染色体标本。
但是在正常情况下,外周血中的淋巴细胞,几乎都处在G1期或G0期,因而外周血细胞中是没有分裂相的。
在细胞培养过程中加入植物血凝素(phytohaemagglutinin, PHA) ,可以刺激外周血淋巴细胞转变为淋巴母细胞,进行有丝分裂,再通过秋水仙素处理,将细胞阻断在有丝分离中期。
再通过离心、低渗、固定和滴片,就可以获得大量有丝分裂相。
最后通过染色就可以观察染色体的结构和数目。
本方法已为临床医学、病毒学、药理学、遗传毒理学等方面广泛应用。
有许多显示G带的方法,最常用的是将已经过老化的染色体制片放到37℃胰酶中进行处理,然后用Giemsa 染色。
胰酶可以从染色体上抽取蛋白特定的组成部分。
通过胰酶处理使G带区的疏水蛋白被除去或使它们构型变为更疏水状态。
由此可见在G带区中抽取的蛋白往往是疏水蛋白。
关于显带机理有多种论点,总的来说,还不能完全解释显带的机理问题。
二、操作步骤人类外周血染色体标本制备1、采血2、培养RPMI1640培养液,37℃ 0.5℃恒温中培养72小时。
3、秋水仙素(colchicine)处理在终止培养前2-3小时,加入秋水仙素。
xx学院xx系《细胞生物学》课程实验报告
有丝分裂原理
细胞周期基础:植物细胞的有丝分裂是一个连续的过程,但为了便于研究,可以将其划分为间期、前期、中期、后期和末期。
间期是细胞进行物质准备的阶段,包括DNA 复制和有关蛋白质合成。
此时染色体呈细丝状的染色质状态。
前期变化:前期,染色质开始螺旋化缩短变粗,形成染色体。
每个染色体包含两条姐妹染色单体,它们由一个着丝粒相连。
同时,核仁逐渐解体,核膜逐渐消失,纺锤体开始形成。
纺锤体由微管组成,它的作用是牵引染色体运动。
中期特征:中期时,染色体的着丝粒排列在赤道板上,这是一个假想的平面,与纺锤体的中轴相垂直。
此时染色体的形态比较固定,数目比较清晰,是观察染色体形态和数目的最佳时期。
后期动态:后期,着丝粒分裂,姐妹染色单体分开,成为两条子染色体,分别向细胞的两极移动。
这一过程是由于纺锤体微管的牵引作用,使得染色体能够均匀地分配到细胞的两极。
末期变化:末期,到达两极的染色体逐渐变成染色质丝,核膜、核仁重新出现,形成两个新的细胞核。
同时,在赤道板的位置形成细胞板,细胞板向四周扩展,逐渐形成新的细胞壁,将细胞一分为二,完成有丝分裂。
植物染色体标本的制备和观察摘要:目的1、掌握常规压片法制备植物染色体标本的基本原理和方法;2、学会观察和统计植物细胞的染色体数目;3、了解和学习去壁低渗法进行植物染色体制片的基本原理和方法。
方法大蒜的根尖是分裂比较旺盛的,我们可以利用秋水仙素处理根尖使得大蒜根尖的细胞分裂处于分裂中期,然后经固定染色等处理将染色体染色固定,以便观察。
结果大蒜的染色体有16条,都被染色成红色的条状或细丝状物质。
结论大蒜染色体有16条。
关键词:植物染色体;大蒜;秋水仙素前言染色体是遗传物质的载体,本实验便是观察染色体的形态和数目。
植物染色体标本的制备,常用分生组织,如根尖、茎尖和嫩叶做材料。
常规压片法仍是当今观察植物染色体常用的方法。
其程序包括取材、预处理、固定、解离、染色和压片等步骤,即可观察到较多的、处于有丝分裂中期的细胞和染色体。
由于现在洋葱发根较难,我们采用的是大蒜根尖进行相关实验。
材料与方法1.实验材料大蒜根尖、白姜花的根尖、野百合的根尖等。
2.实验试剂:0.02%秋水仙素;改良苯酚品红染液;卡诺氏固定液,1N盐酸,浓盐酸:95%乙醇(1:1)解离液。
3. 实验用具显微镜、剪刀、镊子、刀片、培养皿、吸水纸、滴管、载玻片、盖玻片。
4.实验植物和试剂大蒜根尖、 0.02%秋水仙素;改良苯酚品红染液;卡诺氏固定液,1N盐酸;70%酒精;95%乙醇;85%乙醇;蒸馏水5.实验方法和步骤5.1 取材先将大蒜浸泡若干小时,然后转入一个垫有湿润滤纸的培养皿中,置25℃恒温培养箱中萌发,待幼根长至1~2cm时,于上午9~11时剪下根尖。
5.2 预处理将剪下的根尖放进装有0.02%秋水仙素溶液的烧杯中,浸泡处理3~4小时。
5.3 固定将经过预处理或没有预处理的材料,放到卡诺氏固定液中固定(固定液的量约为材料的10倍,要求一个容器中所装的材料不能太多,温度不能太高)。
固定2~24h后分别在95%和85%乙醇中各30min ,再转入70%酒精中,于4℃冰箱内保存,保存时间最好不超过二个月。
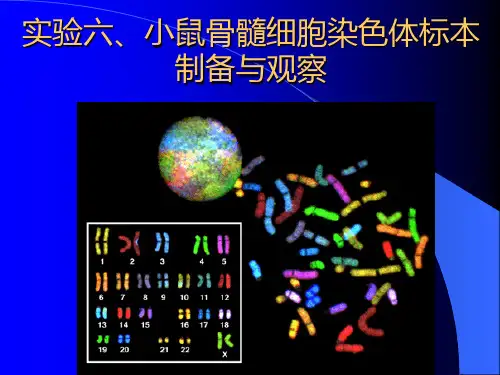
1 小鼠染色体制备与观察 【实验目的】 1. 了解小白鼠睾丸细胞染色体的形态及数目。 2. 初步掌握小白鼠睾丸细胞染色体的玻片标本制作方法。 3. 观察动物细胞染色体的数目和形态。 【实验原理】 染色体是遗传物质的载体,它具有种属特异性,通常不同物种以不同亚种的核型是不同的。通过对各种动物染色体核型的研究可以丰富物种的信息系统,对了解物种的遗传变异进化以及物种的分类均有一定的意义。 真核细胞染色体的数目和结构是重要的遗传指标之一。制备染色体标本是细胞遗传学最基本的技术,优良的染色体制片是进行染色体显带、组型分析、原位杂交等的先决条件。 染色体的制备在原则上可以从所有发生有丝分裂的组织和细胞悬浮液中得到。最常用的途径是从骨髓细胞、血淋巴细胞和组织培养的细胞中制备染色体。小型动物的染色体制片最好最有效的材料就是骨髓组织。
骨髓细胞中,有丝分裂指数相当高,因此可以直接得到中期细胞而不必象淋巴细胞或、其它组织那样要经过体外培养;对大型动物通常采用对骨骼、脊或胸骨穿刺术吸取红骨髓,小型动物多采用剥离术取股骨以获得骨髓细胞。 对于小鼠精巢染色体标本的制作,一般包括以下几个要点: 1. 用一定剂量的秋水仙素破坏纺锤丝的形成,使细胞分裂停滞在中期, 使中期染色体停留在赤道面处; 2. 用低渗法使将细胞膨胀, 以至于在滴片时细胞被胀破, 使细胞的染色体铺展到载玻片上; 3. 空气干燥法可使使细胞的染色体在载片上展平, 经Giemsa染色后便可观察到染色体的显微图象。 2
制作染色体标本的先决条件 1. 细胞具有旺盛的分裂能力 选择活跃的组织:胸腺,骨髓,睾丸,小肠 施加药物使细胞分裂:PHA 2. 设法得到大量的中期细胞:秋水仙素 A. PHA:粗细胞分裂,使淋巴细胞返幼,变为淋巴母细胞 B. 秋水仙素:破坏微管装配,使纺锤体不能形成,使大量细胞停止在分裂中期。 C. 低渗作用:水进入细胞内,细胞内容空间变大,染色体间的距离拉大,易于染色体展开 D. 空气干燥:使细胞和染色体展开 E. 固定:用甲醇:冰醋酸=3:1作用使蛋白质变性,对染色体内的组蛋白讲,变性后硬度增加,保持了染色体的“及时形态”,对细胞膜蛋白讲,变性使细胞膜硬度增强,形成屏障作用,防止了细胞内物质外溢和丢失。 染色体组型又名核型,是指根据染色体的长度、形态和着丝粒的位置将中期染色体依照所规定的标准顺序和组次予以系统排列而成的模式图,它代表了一个个体或物种的染色体特征。进行染色体组型主要依据有以下几个参数: 1. 相对长度(relative length): 指单个染色体的长度与包括X染色体在内的单倍体染色体总长度之比,相对长度=单条染色体的长度/(单倍体常染色体+X染色体)的总长度×100%。 2. 臂指数(arm index): 指染色体长臂与短臂的比率,臂指数=长臂/短臂。 3. 着丝粒指数(centromere index): 指短臂占整个染色体长度的比率,着丝粒指数=短臂/整个染色体长度×100%, 该比率决定了着丝粒在染色体中的相对位置。 4. 染色体的臂数: 对于端部着丝粒染色体,臂数为1,其它为2。根据Levan(1964)所制定的人类染色体标准,臂指数在1.0~1.7之间的染色体为中央着丝粒染色体,在1.7~3.0之间为亚中央着丝粒染色体,在3.0~7.0间为亚端部着丝粒染色体,大于7.0为端部着丝粒染色体;着丝粒指数在50.0~37.5之间的染色体为中央着丝粒染色体,在37.5~25.0之间为亚中央着丝粒染色体,在25.0~12.5之间为亚端部 3
染色体标本的制备及组型观察
【实验目的】
1. 掌握染色体标本制作的基本方法;
2. 认识不同生物的染色体的状态,学会做染色体组型图。
【制作染色体标本的意义】
了解染色体的特征(形态、大小、数目)一一绘制染色体组型图
【染色体组型图的应用】
①生物学方面:根据染色体特征鉴别生物及种类:兔44条;小鼠40条;大鼠42条;
鸡78条;猫38条;狗78条;人46条;马64条
②临床医学方面:主要用于遗传性疾病的诊断和研究:
十21三体综合症:是21对常染色体多一条,此种人“先天愚型”,或称“伸舌样白痴”
J卵巢退化症:45 XO,外貌表现为女性,卵巢发育不全或无, 1.5米以下,不能生育。
.睾丸退化症:47 XXY,外貌为男性,比一般男性高,睾丸发育不全,有女性样乳房,
智力低下或超常,不能生育,发声尖高。
因此,染色组型实验广泛应用于胎儿遗传性疾病早期诊断中(抽羊水做组型)
【染色体标本制作的原理】
------------------ 选择活跃的组织:胸腺,骨髓,睾丸,小肠“ 细胞具有旺盛尸
_________________ 的分裂能力卞
制作染色体标彳J施加药物使细胞分裂:PHA
本的先决条件
设法得到大量的分裂中期细胞:秋水仙素
1. PHA促进细胞分裂,使淋巴细胞返幼,变成淋巴母细胞。
2. 秋水仙素:破坏微管装配,使纺锤体不能形成,使大量细胞停在分裂中期。
3. 空气干燥:使细胞与染色体展开。
4. 低渗作用:水进入细胞内,细胞内容空间变大,染色体间的距离变大,易于染色体分散开。
5. 固定:用Camoy s solution,作用使蛋白变性,对染色体内的组蛋白讲,变形后硬度增力口,保持了染
色体的“即时形态”对细胞膜蛋白讲,变性使细胞膜硬度增强,形成屏障作用,防止了细胞内物质外溢
和丢失。
【实验用品】
1. 实验器材:显微镜、载玻片、盖玻片、镊子、手术剪、解剖盘、胶头滴管、离心管、离心机、小烧
杯、冰箱、酒精灯、小烧杯
2. 实验药品:蒸馏水、0.9% NaCl 溶液、0.3% KCl 溶液,固定液(甲醇:冰醋酸=3:1 )、秋水仙
素
3. 实验材料:小鼠
【实验步骤】
1. 取雄性小鼠,以每克体重4 微克注射秋水仙素(约1mL),14-16h 后,用断头法处死小
鼠,取出睾丸用生理盐水(0.9% NaCl 溶液)洗去血污,置于解剖盘中。
2. 将睾丸放入装有1mL 0.3% KCl 溶液的小烧杯中剪碎(液体呈乳白色)。
3. 用铜网过滤到刻度离心管中,再加0.3% KCl 溶液至4mL。
4. 37C静置30mins,进行低渗处理。
5. 以800-1000r/min 离心8 分钟。
6. 弃上清液,加入2mL甲醇•冰醋酸固定液。
用吸管至管底吹气,轻轻打散细胞,固定8mins。
7. 再以800-1000r/min 离心8 分钟。
8. 弃上清液,加入1mL甲醇•冰醋酸固定液,再制成细胞悬液,固定5mi ns。
9. 取去洁净的低温预冷载片,距载片10-15cm的高度滴下2-3滴细胞悬液,从载片一边向另一边轻轻吹
气,并同时轻轻敲打载片,以使细胞均匀分布和促使染色体展开。
10. 用滤纸擦去载片上的多余液体,空气干燥或文火干燥。
11. 用染液染色20——30 分钟,细水冲洗玻片背面,去除多余染液,气干。
12. 镜检:低倍镜下寻找分散良好,染色适中的分裂相,高倍镜或油镜下观察染色体形态并计数。
实验结果】
【实验结果分析】
1. 显微镜下可看到蓝紫色的染色体。
还有很多未破碎的细胞。
因为本实验采用的是小鼠的睾丸进行实验,
所以视野中可见大量的精子,它们有一个比较圆的头部和鞭毛。
2. 我观察到的细胞处在分裂中期,显微镜下大致可观察到32条染色体,这可能是因为部
分染色体在实验过程中丢失;分析丢失原因如下:
(1).摔碎细胞时可能高度有点过高,导致细胞被摔碎后,其中的染色体也被一同摔
了出去。
(2).因为染色时间过长,玻片在染液中浸泡时间太久,染色体丢失在染液中。
3. 有同学在显微镜下观察到20条染色体,这部分细胞为单倍体细胞,处于减数第二次分裂中期。
4. 实验结果所得到的染色体大多数棒状而不是V型,这是因为吹气时染色体未展平好。
5. 实验中观察到的大多数细胞未破碎,分析原因可能如下:
(1). 摔细胞时高度不够,细胞未完全摔碎;
(2). 在剪碎组织时没有剪好,大量细胞聚集在一起,滴片时采用的高度很难摔碎;
(3). 低渗不完全,细胞膨胀不完全,很难摔碎;
(4). 敲打细胞时力度不够,导致细胞还是聚集在一起。
【注意事项】
1. 吹散细胞:应该轻轻地吹细胞,如果太用力会导致细胞破裂。
2. 铜网过滤:利用铜网进行过滤操作的时候,应尽量将组织剪碎,并且让滤液慢慢流下,不能人为破坏铜网
以加快速度。
3. 剪碎组织时,应尽量将组织剪碎,若烧杯中或者过滤完铜网上还有较大块的组织,应在烧杯中继续加入
0.3% KCl 溶液,继续剪。
4. 本实验采用倒置染色法,目的:1). 可以节省染料;2). 可以避免染液快速挥发;3). 可以防止染
色颗粒沉淀,影响观察。
5. 在染色时应注意,多个样品同时染色应摆放紧密,不要有间隙;滴染液时应尽量慢,不要有气泡,以免
部分染色体不被着色。
6. 染色:染色之后应冲去染液并晾干,注意使用小水流并从背面冲洗,这样可以避免冲去细胞。
7. 摔碎细胞:摔碎细胞时应注意滴管与载玻片的距离,如果距离太小,则细胞很难摔碎,不会观察到染色
体;但如果距离太大,会使细胞完全的碎开,染色体飞出或者染色体布满视野,给计数造成一定难度。
【实验反思】
本次试验,虽然成功的在显微镜下找到了染色体,但染色体未伸展完全,并且我做的玻片上面细胞太多,找染色体时有一定的难度,这是因为滴片的时候加入的液体稍多。
并且染色体条数也不符合规律,主要是因为实验操作过程中不是太仔细,造成了染色体的丢失,日后必须提高。