谷氨酰胺通过一个Kras基因调控的代谢途径促进胰腺癌的生长
- 格式:ppt
- 大小:4.22 MB
- 文档页数:31


谷氨酰胺在肿瘤治疗中的应用谷氨酰胺(glutamine,Gln)是人体内含量最为丰富的游离氨基酸。
随着对谷氨酰胺研究的深入,谷氨酰胺被认为是一种条件必须氨基酸,具有多种生物学功能。
大多数实验证明,在肿瘤的治疗过程中,补充谷氨酰胺可以减轻放化疗引起的毒副作用、增加化疗疗效、改善营养状况、增强对肿瘤治疗的选择性、提高机体的免疫功能。
在肿瘤治疗中补充谷氨酰胺是安全有效的,具有良好的应用前景。
标签:谷氨酰胺;肿瘤治疗;化疗由于谷氨酰胺(glutamine,Gln)在组织细胞代谢中具有特殊作用,愈来愈引起营养学家和临床医生的极大兴趣。
近十年中所发表有关Gln的应用报道较多。
Gln作为应激状态下的一种条件必须氨基酸,在各组织、脏器中的作用日益受到重视。
本文着重介绍Gln在肿瘤治疗的应用。
1 Gln的生理生化功能Gln是一种非必需的中性氨基酸,几乎能在体内所有组织中合成。
分子量147.1,血浆浓度0.6~0.9mmol/L。
Gln的分子结构显示,有2个氨基成分,一个为α-氨基;另一个为酰胺基。
由于有2个氨基的特性,决定了Gln具有独特的重要生理作用。
Gln是一种生糖氨基酸,组织摄取肠内食物及循环血中的Gln,用其碳源作为能量。
每mol Gln通过α-酮戊二酸进入三羧酸循环完成氧化可产生30mol的ATP,它是一种高效能的能量物质。
Gln分子中的酰胺氮对所有细胞的生物合成是绝对必要的,它是体内细胞合成嘌呤、嘧啶及核苷酸的氮前体,不仅是正常机体组织细胞的重要氮载体和呼吸燃料,也是肿瘤细胞之间或肿瘤细胞与正常组织细胞间的重要氮载体和肿瘤细胞的营养物质和呼吸燃料。
Gln的代谢主要受二种酶的调节:Gln合成酶(GS)和Gln酶(Glnase)。
大多数组织都有这二种酶,但通常是其中一种有较大的酶活性。
GS位于细胞浆内,主要存在于肌肉和脑组织中;Glnase位于线粒体膜上,主要存在于一些快速增值、分化的细胞中,如:肠粘膜细胞、淋巴细胞、内皮细胞。

靶向KRAS下游信号通路或细胞内一碳代谢途径抗胰腺癌的活性及机制研究胰腺癌是恶性程度极高的消化系统肿瘤,其中90%为胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)。
在美国,胰腺癌患者死亡人数居恶性肿瘤的第四位,死亡率为99%。
大多数病人诊断时即为晚期,5年生存率不足8%。
因此,研究新的治疗方案,以提高胰腺癌的治疗效果,延长患者生存时间已成为当务之急。
首先我们从绝大多数胰腺癌具有KRAS突变的这一特征为出发点,探寻强效的治疗胰腺癌药物联用方案,从而达到提高胰腺癌治愈率的目的。
RAS信号可以影响胰腺癌细胞的增殖、迁移、代谢和自噬。
在超过90%的胰腺癌中,致癌基因KRAS发生突变。
尽管KRAS及其突变在胰腺癌发生发展中具有关键作用,但是靶向KRAS治疗胰腺癌尚未获得成功,因此开发靶向KRAS下游效应分子的抑制剂已成为研究热点。
KRAS的下游PI3K/m TOR信号通路在细胞的增殖、迁移、生长和存活中具有关键作用,而KRAS的突变将会导致该信号通路异常激活。
第一种PI3K/m TOR信号传导途径的抑制剂是雷帕霉素及雷帕霉素类似物,其靶向m TOR,但由于药物诱导的反馈激活导致雷帕霉素表现出有限的临床效果。
PI3K/m TOR双靶点抑制剂则可以克服由m TOR抑制引起的PI3K的反馈激活。
然而,细胞依旧可以通过激活其它途径阻碍药物治疗功效。
KRAS的另一个主要下游信号通路MEK/ERK通路对于细胞的存活也至关重要。
PI3K/AKT和MEK/ERK信号通路曾一度被认为是线性信号传导途径,但进一步的研究提示两者之间存在交叉对话。
ERK活化可导致m TOR激活,PI3K可通过AKT调节ERK信号。
MEK抑制剂可通过旁路引起ERK活化进而引起耐药,并引起PI3K/AKT信号通路的持续活化。
m TOR参与负反馈环路调节ERK。
因此,同时靶向这两个信号途径可能是治疗胰腺癌的有效方法。

来自美国哈佛医学院,Dana-Farber癌症研究所的研究人员发现了胰腺导管腺癌细胞中的一种特殊谷氨酰胺代谢途径,这种途径与常见谷氨酰胺途径不同,是肿瘤生长所必需的代谢途径。
基于这种途径对癌细胞的重要性,以及对正常细胞的无关紧要性,可以研发出一种针对这一途径的癌症治疗新方法。
这一研究成果公布在3月28日《自然》(Nature)杂志在线版上。
领导这一研究的是美国哈佛医学院Lewis C. Cantley教授,这位学者是著名的PI3K 的发现者,磷脂酰肌醇3-激酶(PI3K)是一种抗癌新药的重要药物靶标。
Cantley教授也是Agios 医药公司的的联合创始人,是系统生物学领域的先锋人物,他致力于将遗传学家和分子生物学家所关注的微观事物以更为连贯统一的方式整合起来。
今年二月,他与其他几位科学家荣获了生命科学巨奖,获得了高达300万美元的奖金。
癌细胞具有代谢依赖性,这是其与其它细胞的重要区别之一,这种代谢依赖性的特征之一就是提高合成代谢途径中氨基酸谷氨酰胺的利用率。
但是谷氨酰胺依赖性肿瘤有哪些,以及谷氨酰胺如何支持癌细胞代谢的机制,目前仍然属于待研究领域。
在这篇文章中,研究人员在人胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)细胞中发现了一种谷氨酰胺异常途径,这种途径是肿瘤生长所必需的,与常见谷氨酰胺途径不同。
胰腺导管腺癌是胰腺癌最常见的类型,其形态学特征是由不同分化程度的导管样结构构成。
据美国全国癌症研究所公布的数据,胰腺导管腺癌是全美第四大癌症死因,其肿瘤生长过程中没有明显症状,很多患者检查出患病时已处晚期。
5年生存率只有3%至5%。
虽然大部分细胞采用的是谷氨酸脱氢酶(GLUD1)将线粒体中的谷氨酰胺衍生的谷氨酸转换成α-酮戊二酸,用于三羧酸循环,但是PDAC癌细胞采用的是一种独特的途径,其中谷氨酰胺来源的天冬氨酸被传递到细胞质中,在那里它能被谷草转氨酶(GOT1)转换成草酰乙酸。

KRAS突变对胰腺癌的发生有重要作用胰腺癌可算得上是目前最难有效控制的恶性肿瘤,它不仅对许多治疗手段有局限性,而且疗效也不甚良好,以前诱发胰腺癌的病因尚未完全清楚,但是德州大学的癌症中心一项研究成果发现一种诱发胰腺癌的基因突变,这也许为胰腺癌的病因找到了证据,也为有效治疗提供了一种突破口。
近期在癌症研究领域,多名学者推荐了由德州大学MD Anderson癌症中心完成了的一项重要研究成果:发现一种诱发胰腺癌的遗传突变,在肿瘤生长和扩散的代谢途径中也扮演了重要角色。
这种突变基因就是KRAS,ras基因家族是一类与人类肿瘤密切相关的基因家族,其中包括HRAS、KRAS和NRAS,分别定位在11、12和1号染色体上。
在ras基因中,KRAS对人类癌症影响最大,它好像分子开关,当正常时能控制调控细胞生长的路径,发生异常时,则导致细胞持续生长,并阻止细胞自我毁灭。
这种基因还参与细胞内的信号传递,当KRAS基因突变时,这一基因永久活化,不能产生正常的ras蛋白,使细胞内信号传导紊乱,细胞增殖失控而癌变。
研究人员研发了一种新型诱导KRAS转基因:iKRAS(inducible KRAS),并培育带有这种基因的小鼠。
这样研究人员就能通过注入多西环素(doxycycline),观察小鼠胰腺中KRAS的表达启动,以及撤回着这种药物,来观察这一基因的关闭。
代谢研究表明KRAS中止将会导致葡萄糖代谢相互的中间物的减少,以及葡萄糖摄入降低,和乳糖生成,研究人员在转录分析中发现了这种与基因表达改变相关的代谢变化。
这些受影响的葡萄糖中间物也存在于其它葡萄糖途径中,因此研究人员又分析了己糖胺合成途径(hexosamine biosynthesis pathway,HBP),以及磷酸戊糖途径(pentose phosphate pathway,PPP)--这两个途径都参与了细胞构建,比如DNA和RNA的组装。
研究人员发现随着KRAS基因表达中止,一种在许多细胞进程中扮演重要信号作用的步骤:通过HBP的蛋白糖基化水平降低,这种糖基化水平能在葡萄糖饥饿状态下出现。
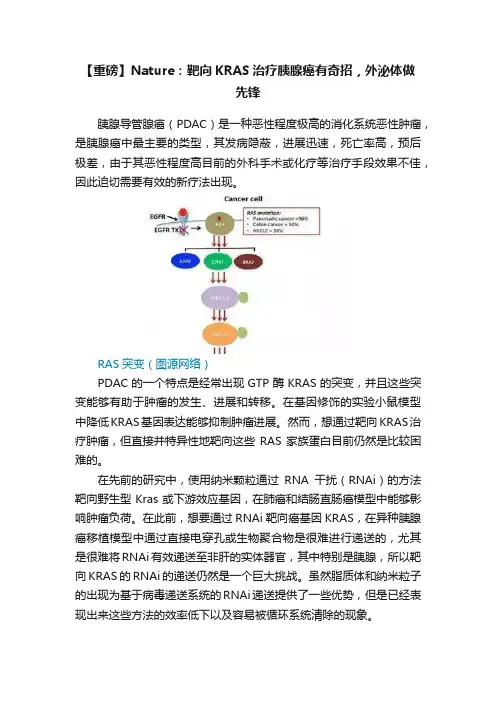
【重磅】Nature:靶向KRAS治疗胰腺癌有奇招,外泌体做先锋胰腺导管腺癌(PDAC)是一种恶性程度极高的消化系统恶性肿瘤,是胰腺癌中最主要的类型,其发病隐蔽,进展迅速,死亡率高,预后极差,由于其恶性程度高目前的外科手术或化疗等治疗手段效果不佳,因此迫切需要有效的新疗法出现。
RAS突变(图源网络)PDAC的一个特点是经常出现GTP酶KRAS的突变,并且这些突变能够有助于肿瘤的发生、进展和转移。
在基因修饰的实验小鼠模型中降低KRAS基因表达能够抑制肿瘤进展。
然而,想通过靶向KRAS治疗肿瘤,但直接并特异性地靶向这些RAS家族蛋白目前仍然是比较困难的。
在先前的研究中,使用纳米颗粒通过RNA干扰(RNAi)的方法靶向野生型Kras或下游效应基因,在肺癌和结肠直肠癌模型中能够影响肿瘤负荷。
在此前,想要通过RNAi靶向癌基因KRAS,在异种胰腺癌移植模型中通过直接电穿孔或生物聚合物是很难进行递送的,尤其是很难将RNAi有效递送至非肝的实体器官,其中特别是胰腺,所以靶向KRAS的RNAi的递送仍然是一个巨大挑战。
虽然脂质体和纳米粒子的出现为基于病毒递送系统的RNAi递送提供了一些优势,但是已经表现出来这些方法的效率低下以及容易被循环系统清除的现象。
在这项研究中,来自美国MD安德森癌症中心的研究人员探讨了外泌体是否可以作为RNAi的有效载体的可能性。
外泌体是一种具有脂质双层膜的纳米尺寸的细胞外囊泡(40-150nm),其能够被所有细胞释放并有效进入其他细胞。
与脂质体和其他合成药物纳米颗粒载体不同,外泌体含有可能增强内吞作用的跨膜和膜锚定蛋白,从而促进其内容物的递送。
CD47是外泌体蛋白质之一,是一个广泛表达的整合素相关跨膜蛋白,其部分功能可以保护细胞免受吞噬作用。
CD47是信号调节蛋白α(SIRPα,也称为CD172a)的配体,CD47-SIRPα间的结合能够发出“不要吃我”的信号,从而抑制吞噬作用。
癌基因RAS 能够促进胰腺癌细胞增殖,增强胞饮作用从而促进肿瘤细胞摄取外泌体。

氨基酸代谢与肿瘤能量代谢的关系研究肿瘤是一种严重的疾病,其病因和发病机制一直是医学研究的热门话题之一。
近年来,科学家们发现肿瘤细胞的能量代谢方式与正常细胞有很大区别。
在正常情况下,身体的能量来源主要是通过糖分解产生的三磷酸腺苷(ATP)。
而在肿瘤生长中,特别是在缺氧环境下,肿瘤细胞开始利用非糖类代谢物质,如脂肪酸、氨基酸等来产生能量,从而满足其高度增殖和生长的需要。
其中,氨基酸代谢在肿瘤生长中占有重要地位。
氨基酸代谢是指细胞对氨基酸的吸收、转运、代谢和再利用等过程。
氨基酸可以产生能量和蛋白质,还可以参与细胞生物合成过程。
在正常人体中,氨基酸代谢受到多种生理和内分泌调节的控制。
而在肿瘤中,由于致癌基因或调节子的异常表达,使得氨基酸代谢发生明显变化。
一种常见的氨基酸代谢途径是谷氨酸循环。
谷氨酸循环中的主要代谢物是谷氨酸、谷氨酰胺和丙酮酸等。
该循环的产物可供细胞生长和生物合成过程中的能量需要。
在肿瘤细胞中,谷氨酸循环被广泛利用,以满足肿瘤细胞增殖和生长的需要。
此外,肿瘤细胞产生较高程度的乳酸,这是因为它们通过糖酵解产生的丙酮酸不能通过线粒体氧化,而只能以乳酸的形式排出体外。
一些研究表明,氨基酸的供应与代谢在肿瘤生长中发挥着重要的作用。
例如,赖氨酸在肝癌中被广泛利用,供能和蛋白质合成。
亮氨酸是胰腺癌的代表性氨基酸,常用于突变K-Ras原癌基因的代谢途径,并提供ATP供能。
精氨酸是肾癌和心肌瘤的重要代谢物。
此外,一些氨基酸如苜蓿氨酸、丝氨酸和蛋氨酸等,则在乳腺癌中起着重要的作用。
如何利用这些特殊代谢通路抑制肿瘤细胞的生长和增殖,是当前研究的热点之一。
最近的一些研究表明,通过调节肿瘤细胞的氨基酸代谢,可以有效地抑制肿瘤细胞的生长和扩散。
例如,通过抑制谷氨酰胺转移酶(Glutamine transferase,GLS)这一rate-limiting enzyme的表达,可以干扰肿瘤细胞内谷氨酸循环的正常过程,从而抑制肿瘤细胞的生长。

谷氨酰胺代谢通路对肿瘤细胞生长的影响探究肿瘤是一类严重威胁人类健康和生命的疾病,其发生和发展常伴随着代谢异常。
在肿瘤发生和发展过程中,谷氨酰胺代谢通路在细胞的代谢调节中发挥着非常关键的作用。
本文将探究谷氨酰胺代谢通路对肿瘤细胞生长的影响。
谷氨酰胺代谢通路的作用谷氨酰胺代谢通路是细胞骨架由谷氨酸合成谷氨酰胺的代谢通路,包括谷氨酰胺合成、谷氨酰胺裂解和谷氨酰胺转运三个环节。
谷氨酰胺代谢通路参与了多个主要生物活动的调控,包括氧化磷酸化、细胞凋亡、转录因子活性、细胞周期控制等。
在肿瘤细胞生长和发展过程中,谷氨酰胺代谢通路发挥着重要的作用。
一方面,肿瘤细胞生长速度快,需要大量的生物能和代谢物来支撑其代谢活动;另一方面,肿瘤细胞对外界环境的适应能力较差,常常处于细胞应激状态。
谷氨酰胺代谢通路在这一过程中发挥着重要的作用。
谷氨酰胺代谢通路在肿瘤细胞生长中的作用谷氨酰胺代谢通路在肿瘤细胞生长中的具体作用主要有以下几个方面:1. 细胞能量供给谷氨酰胺代谢通路能够向肿瘤细胞提供能量。
在肿瘤细胞处于缺氧状态下,谷氨酰胺代谢途径可以产生ATP等能量分子,从而满足肿瘤细胞的能量需求。
此外,谷氨酰胺代谢通路还可以通过调节哺乳动物靶器官动态平衡蛋白(mTOR)路径,促进脱氧核糖核酸的合成。
2. 氨基酸供给谷氨酰胺代谢通路可以提供肿瘤细胞所需的氨基酸。
在肿瘤细胞中,谷氨酰胺合成通路可以产生非必需氨基酸和其他生物基因组DNA和RNA母体。
同时,谷氨酰胺代谢通路还与谷氨酸-尿素循环相互作用,从而调节氨基酸的合成和解构过程。
3. 细胞凋亡及肿瘤治疗谷氨酰胺代谢通路也在肿瘤细胞凋亡及肿瘤治疗中起着重要作用。
实验证明,抑制谷氨酰胺代谢通路可以诱导肿瘤细胞凋亡,并增强肿瘤细胞对化疗药物的敏感度。
此外,通过改变谷氨酰胺代谢通路的代谢方向,还可以调节肿瘤细胞的代谢和增殖能力。
总之,谷氨酰胺代谢通路在肿瘤细胞生长和发展中起着重要的作用,对研究肿瘤的发生、发展及治疗提供了新的思路和研究方向。

谷氨酰胺合成酶对肿瘤细胞生长的调控作用肿瘤是当今世界上最为常见和棘手的疾病之一,尽管经过多年的努力已经取得了一定的进展,但是治疗策略和新药研发仍然存在很大的问题。
因此,寻找新的治疗手段和药物被认为是解决当前肿瘤问题的最好方法之一。
在这样的背景下,谷氨酰胺合成酶亦被视为一个极有前景的治疗靶点。
谷氨酰胺合成酶(glutamine synthetase,GS)是一种催化谷氨酰胺合成的合成酶。
谷氨酰胺是细胞生长和代谢所需的重要生物分子,细胞的生存、增殖和分化都需要谷氨酰胺的参与。
GS可以将谷氨酸与氨转化为谷氨酰胺,这项反应对于肿瘤细胞生长至关重要。
由于肿瘤细胞的剧烈增殖和糖酵解过程中能量和原料的缺陷,谷氨酰胺在这些细胞中的供给通常是不足的。
因此,GS对于肿瘤细胞生长的调控作用备受关注。
GS抑制剂作为肿瘤治疗的新靶点肿瘤细胞的快速分裂和增殖使它们对谷氨酸的需求量极大,这导致肿瘤细胞通常拥有较高的谷氨酰胺合成能力。
因此,尝试通过干扰GS的活性和表达来治疗肿瘤已成为一项热门研究方向。
GS抑制剂的研发已成为肿瘤治疗和预防的一个重要方向。
据研究发现,使用GS抑制剂已被证明可以抑制肿瘤细胞的生长,并减轻化疗药物诱导的肝脏和肾脏损害。
GS在多种肿瘤中的表达和功能GS在肝癌、结肠癌、胃癌等多种肿瘤中都有表达,而在正常细胞中,GS的表达通常是较低的。
一些研究揭示了GS在肿瘤中的生物学功能,该酶作为一个调节器,可以在肿瘤细胞内支持细胞的生存和增殖。
除了其在常见肿瘤中的作用,GS 在胶质瘤等神经系统肿瘤中的表达和功能也受到了广泛关注。
GS在神经系统肿瘤中的作用和研究发现神经系统肿瘤是一类分化不良的肿瘤,多发生在中枢神经系统中。
这些肿瘤以侵袭性强和易复发著称。
由于神经系统肿瘤的治疗通常受限于肿瘤位置的复杂性和较大的毒副作用,因此对于神经系统肿瘤的治疗和药物研发的需求极高。
胶质瘤是神经系统肿瘤中最常见的类型之一。
先前的研究揭示了GS在胶质瘤中的高表达,而且GS的表达水平越高,胶质瘤的许多病理学特征(如侵袭性、抗药性、预后差等)就越明显。

谷氨酰胺代谢与肿瘤细胞增殖关系的研究与应用前景肿瘤是一种严重的疾病,目前还没有特效的治疗方法。
人们希望能找到新的治疗方案,并加速肿瘤研究的步伐。
近年来,越来越多的科学家将注意力集中在谷氨酰胺代谢与肿瘤细胞增殖关系的研究上。
本文将从谷氨酰胺的代谢途径、作用机制和应用前景三个方面介绍谷氨酰胺代谢与肿瘤细胞增殖关系的研究进展和未来发展趋势。
一、谷氨酰胺的代谢途径谷氨酰胺是一种氨基酸,也是体内的一种重要代谢产物。
在人体内,谷氨酰胺主要由谷氨酸和甘氨酸通过谷氨酰胺酰转移酶催化合成。
谷氨酰胺合成后可以分解在肝脏中,其中的谷氨酸可以由肝脏转化为尿素,排出人体。
另外,谷氨酰胺还可以在肌肉、肾脏、脾脏和肠道等组织中代谢。
二、谷氨酰胺在肿瘤细胞中的作用机制谷氨酰胺在人体内作用很广泛,其中在肿瘤细胞中的作用机制尤为复杂。
研究表明,肿瘤细胞在代谢过程中常常出现谷氨酰胺缺乏的情况,这时肿瘤细胞会通过多途径补充谷氨酰胺。
谷氨酰胺供应短缺时,肿瘤细胞常常会利用体内的谷氨酸、天冬氨酸等氨基酸进行代谢,以维持细胞的生存和增殖。
另外,肿瘤细胞还可以通过提高谷氨酰胺转运蛋白在细胞膜上的表达,或在细胞内部促进谷氨酰胺的合成来解决这一问题。
谷氨酰胺供应过剩时,肿瘤细胞常常会利用谷氨酰胺代谢,从而产生必需的氨基酸、核苷酸等物质,以促进细胞的增殖和生长。
所以,谷氨酰胺在肿瘤细胞中的作用可谓是“双刃剑”。
如果能够控制谷氨酰胺在肿瘤细胞中的作用,很可能就能有效地抑制肿瘤细胞的增殖和生长。
三、谷氨酰胺代谢在肿瘤治疗中的应用前景因为谷氨酰胺在肿瘤细胞中的作用十分重要,所以人们研究在肿瘤治疗中应用谷氨酰胺代谢调节剂的可行性和效果。
目前已有多项研究表明,通过调节谷氨酰胺代谢途径,可以有效地抑制肿瘤细胞的增殖和生长,促进肿瘤细胞的死亡。
一些谷氨酰胺代谢调节剂,如谷氨酰胺水解酶抑制剂、谷氨酰胺转移酶抑制剂、谷氨酰胺合成酶抑制剂等,在体内表现出良好的抑制肿瘤细胞的作用,但其对正常细胞也具有一定的毒性。
CancerDiscovery:KRAS诱导线粒体自噬来促进胰腺癌发展癌细胞在肿瘤的低能量环境中使用一种奇怪的繁殖策略:他们破坏了自己的线粒体!冷泉港实验室(CSHL)的研究人员现在也知道了这个过程是如何发生的,为胰腺癌治疗提供了一个有希望的新靶点。
为什么癌细胞想要破坏自己的线粒体功能?医学博士Brinda Alagesan承认:'这似乎非常违反直觉。
'她是CSHL David Tuveson 博士实验室的成员。
图片来源:Tuveson lab CSHL根据Alagesan的观点,要想知道癌细胞为什么会这样做,最简单的方法就是把线粒体看作动力装置。
'线粒体是细胞的动力源,'她说道。
就像传统的动力装置一样,线粒体也会产生污染。
Alagesan补充说:'这些有害的副产品或污染物被称为活性氧(ROS)。
'其中很多会对细胞造成损害。
我们相信,胰腺癌细胞(通过吞噬自身的线粒体)正在减少这些破坏性活性氧的产生,同时仍在制造足够的能量进行增殖。
'这仍然是一个假设,但它可以解释为什么胰腺癌细胞更容易发生自噬,一种形式的自噬或'自食'线粒体。
在《Cancer Discovery》杂志上,Alagesan和共同的主要作者Timothy Humpton博士描述了当一种叫做KRAS的蛋白质在胰腺肿瘤独特的营养缺乏的环境中变得活跃时会发生什么。
KRAS启动了一个'信号级联',导致细胞吞噬自己的线粒体,葡萄糖和谷氨酰胺从剩余的线粒体转移。
这些转移的营养物质被用来支持细胞分裂。
Alagesan解释说:'理想情况下,我们想要直接抑制促进KRAS蛋白的癌症,但不幸的是,到目前为止还没有人能够以临床相关的方式做到这一点。
'Tuveson团队没有直接阻止KRAS,而是跟踪了KRAS激活后的蛋白信号级联。
他们发现了一种导致蛋白质NIX增加的途径。
【摘要】目的:探讨KRAS基因突变在胰腺疾病中的临床意义和在胰腺癌诊断中的价值。
方法:合酶链反应一单链构象多态性分析(PCR-SSCP)方法分别检测胰腺癌、癌旁组织、手术切缘正常组织、慢性胰腺炎石蜡包埋组织的KRAS突变并进行DNA测序确认。
结果胰腺癌K RAS 12密码子突变率(79.2%)显着高于慢性胰腺炎(33 .3 % ,P<0 . 01),且在切缘正常组织一癌周导管增生一癌周不典型增生一胰腺癌过程中,突变率有逐渐上升的趋势。
突变方式以12 密码子GGT-GAT 、GTT、CGT 为主,同一例患者突变方式一致。
结论:KRAS基因突变在胰腺癌发生中起作用,但KRAS 基因突变作为胰腺癌诊断的分子标志缺乏特异性。
【关键词】胰腺癌;慢性胰腺炎;KRAS基因;突变胰腺癌临床确诊时大多已属晚期,其5年生存率仅为1%5%。
提高其早期发现率可使更多患者获得手术切除的机会而提高其生存率。
众多研究表明,KRAS基因与胰腺癌高度相关,其第一外显子12密码子的点突变在胰腺导管腺癌组织中高达70%〜100 %,且是胰腺肿瘤发生的早期事件,可用于早期诊断胰腺癌。
而近来研究却表明,KRAS突变亦可见于良性胰腺疾病及正常胰腺,对它可作为胰腺癌早期诊断的分子标志提出了疑问。
本研究旨在探讨KRAS突变在胰腺疾病中的临床意义和在胰腺癌诊断中的价值。
材料和方法1.对象选择:收集上海长海医院 1996年1月至2000 年2月 良恶性胰腺疾病术后石蜡包埋组织标本,诊断由手术及病理证 实,所有病例均有完整的手术记录资料及临床资料 腺导管腺癌患者的胰腺导管腺癌 24 例、癌旁胰腺导管增生 58例、 癌旁胰腺导管不典型增生 19例和手术切缘正常胰腺 16 例;恶性 胰腺黏液性囊腺瘤 1 例;慢性胰腺炎 24 例,选择胰腺导管增生 组织蜡块,慢性胰腺炎患者经 1〜5年随访全部健在,且无一例 发展为胰腺癌。
7例正常胰腺组织为非胰腺疾病患者尸检标本。
胰腺癌与KRAS基因的关联
K-ras基因是一种原癌基因,位于染色体12p12.1上,编码的p21蛋白具有重要的信
息转导作用。
突变后的ras基因所编码的蛋白会丧失灭活的功能,从而刺激细胞自发性
生长和分化,导致肿瘤发生。
K-ras突变见于80%~95%的胰腺癌中。
大多数报道认为,
K-ras突变与胰腺癌预后、分期无关。
1.粪便的应用
Caldas等用斑点杂交技术检测出胰腺癌患者粪便中K-ras突变率为55%(6/11)。
与直接收集胰液相比,粪便中检出率较低。
并且25%大肠癌和30%大肠腺瘤粪便中也可检出
K-ras变异,所以这种方法的特异性不高。
但由于简单易行,可用于胰腺癌的普查。
2.胰液的应用
最初认为K-ras突变是与胰腺癌有关的特异性变化,可以作为判断胰腺癌存在的敏
感标记物。
最近研究发现,胰腺良性肿瘤、慢性胰腺炎或胰腺囊肿中也存在较高的K-ras 突变率,因此,不能仅依据K-ras突变来诊断胰腺癌。
Tateishi等于注射胰泌素后在内
窥镜胆道造影(ERCP)下收集胰液检测,结果K-ras突变率在单纯性胰腺囊肿为43%(6/14),胰腺癌中为50%(10/20),导管内乳头状瘤为60%(9/15),在慢性胰腺炎为17%(1/6)。
由于这种方法特异性较强,对于胰腺癌的筛选诊断有一定的实用性。
目前临床缺乏KRAS抑制剂,KRAS突变在研新药安卓健(Antroquinonol)现已进入
二期临床试验,一期临床结果良好,尤其安全性高于其他靶向药物,未来将针对多种癌症开展临床试验,以期为众多患者提供治疗方案。
靶向谷氨酰胺代谢增强抗肿瘤免疫和免疫治疗的研究进展2024代谢重编程和免疫逃逸被认为是肿瘤的两大特征,在肿瘤的发生发展过程中起着重要作用。
免疫检查点抑制剂的成功,开启了免疫疗法治疗肿瘤的新纪元。
越来越多的证据表明,肿瘤细胞的代谢重编程有助于肿瘤免疫逃逸。
肿瘤细胞处于高代谢状态,通过改变代谢途径来满足不受控制的生长和增殖需求。
对谷氨酰胺的高需求导致多种类型的肿瘤对谷氨酰胺的依赖性。
谷氨酰胺的代谢变化对肿瘤侵袭性和肿瘤微环境的重塑有显著影响。
谷氨酰胺对免疫细胞的增殖和激活也至关重要。
肿瘤细胞对谷氨酰胺的大量消耗会导致免疫抑制性肿瘤微环境,以及对免疫检查点抑制剂的耐药性。
本综述总结了肿瘤细胞的谷氨酰胺代谢特征及促进肿瘤免疫逃逸的研究进展,并探讨了靶向谷氨酰胺代谢增强抗肿瘤免疫和免疫治疗的最新策略。
1、肿瘤细胞中谷氨酰胺代谢的特征肿瘤细胞优先利用糖酵解途径分解为葡萄糖,导致葡萄糖转化为乙酰辅酶A进入三羧酸(TCA)循环的过程被阻断。
肿瘤细胞转而加速提高细胞内谷氨酰胺代谢,将代谢中间产物补充到TCA循环,以维持细胞内的生物合成水平,这个过程被称为“回补”。
谷氨酰胺回补驱动TCA循环能够为氨基酸和核酸的合成提供氮,并为补充TCA循环中间体提供碳,这些中间体是生物合成的基石。
此外,谷氨酰胺促进谷胱甘肽(GSH)和还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)产生,参与维持细胞氧化还原稳态。
谷氨酰胺分解代谢活跃是肿瘤细胞的一个基本代谢特征。
谷氨酰胺分解是指细胞通过多种酶将谷氨酰胺转化为 TCA 循环代谢物的过程。
谷氨酰胺通过溶质载体 (SLC) 转运蛋白进入细胞后,首先通过谷氨酰胺酶(GLS)转化为谷氨酸。
谷氨酸接着通过两条不同的途径转化为α-酮戊二酸(α-KG):①通过谷氨酸脱氢酶(GLUD);②通过一组转氨酶,包括谷氨酸–草酰乙酸转氨酶(GOT)、谷氨酸–丙酮酸转氨酶(GPT)和磷酸丝氨酸转氨酶(PSAT)。
谷氨酰胺辅助肿瘤治疗的可能性谷氨酰胺(Glutamine,简称Gln)是一种人体必需的氨基酸,在维持生命过程中发挥着重要的作用。
然而,谷氨酰胺不仅是人体必需的成分,在肿瘤治疗中也展现出了重要的作用。
在肿瘤生长、代谢和治疗过程中,谷氨酰胺都扮演着重要角色,因此在肿瘤治疗中,谷氨酰胺的辅助疗法引起了人们的关注。
一、谷氨酰胺在肿瘤代谢过程中的作用谷氨酰胺是蛋白质代谢过程中的重要组成部分,能够促进肿瘤细胞的生存和生长。
肿瘤细胞往往具有高度的代谢活性,而谷氨酰胺的供应能够满足肿瘤细胞的能量、氮和碳源需要,从而维持肿瘤细胞的生长和生存。
此外,谷氨酰胺还可以通过调节细胞内的代谢酶活性,促进肿瘤细胞的糖酵解、氧化磷酸化等代谢途径,为肿瘤细胞提供更多的生存保障。
二、谷氨酰胺在肿瘤治疗中的应用尽管谷氨酰胺对于肿瘤细胞的代谢具有积极作用,但是在肿瘤治疗中,谷氨酰胺的却起到了辅助治疗的作用。
1.减轻化疗的毒副作用化疗对于肿瘤细胞的杀伤作用是极强的,但是化疗对于正常细胞也会产生不可避免的损伤。
据研究发现,谷氨酰胺能够减轻化疗对于正常细胞的破坏,并且有助于恢复正常细胞的代谢功能。
此外,谷氨酰胺还能够保护肠道黏膜、肝脏和肾脏等器官的健康,从而减轻化疗对于器官功能的影响,提高化疗的安全性。
2.增加肿瘤细胞的敏感性化疗对于不同种类的肿瘤细胞的杀伤作用是不同的,其中一部分原因是由于肿瘤细胞的代谢途径存在差异。
谷氨酰胺能够干扰肿瘤细胞代谢产物的形成和排出,从而增加肿瘤细胞对化疗药物的敏感性,提高治疗效果。
3.促进免疫系统功能免疫系统是机体抵御病毒、细菌和肿瘤等侵袭的重要保护系统,而化疗对于免疫系统的损伤也是不可避免的。
谷氨酰胺能够促进免疫系统功能的恢复,增加免疫细胞的数量和活性,提高机体的疾病抵抗能力。
三、谷氨酰胺辅助治疗的风险尽管谷氨酰胺在肿瘤治疗中的应用具有一定的优势,但是其使用仍然存在一定的风险需要关注。
1.过度使用谷氨酰胺会加速肿瘤生长和扩散谷氨酰胺虽然可以提供肿瘤细胞的代谢所需,但是谷氨酰胺也同样可以促进正常细胞的生长,从而加速肿瘤的生长和扩散。
谷氨酰胺代谢与癌症治疗癌症是一种严重的疾病,影响着全球数百万人的生命质量。
癌症的发生机理非常复杂,涉及到许多生化和遗传学过程。
其中,谷氨酰胺代谢是癌症研究中备受关注的一个领域。
在本文中,我们将探讨谷氨酰胺代谢在癌症中的作用,并讨论将其作为一种治疗选择的潜在机会。
1. 谷氨酰胺代谢的基础知识谷氨酰胺是一种氨基酸代谢产物,它在身体中有多种作用。
在健康的细胞中,谷氨酰胺经过一系列酶的催化作用转化为谷氨酸和甘氨酸。
这个过程发生在线粒体中,通过氧化磷酸化过程产生ATP能量。
其中一些谷氨酰胺可通过肝脏排泄,其余谷氨酰胺则可通过尿液排放。
然而,在肿瘤细胞中,谷氨酰胺途径通常被改变。
肿瘤组织通常表现出对谷氨酰胺的异常需求,以满足其不断增长和分裂的能量需求。
肿瘤细胞主要通过两种谷氨酰胺途径来满足其能量需求:一种是通过转移酰胺酶催化转移的谷氨酰胺代谢途径(TCA),另一种是通过谷氨酰胺酯化途径(GAG)。
2. 谷氨酰胺代谢与癌症之间的关系肿瘤细胞的迅速增殖和分裂需要大量的能量和营养物质。
正常情况下,能源主要来源于葡萄糖,并通过线粒体氧化磷酸化过程产生ATP。
然而,在一些肿瘤细胞中,由于基因突变或表达异常,线粒体功能异常,并导致肿瘤细胞对葡萄糖的利用能力降低。
在这样的情况下,肿瘤细胞通常通过转移酰胺酶催化的TCA途径来利用谷氨酰胺获得能源。
在这种途径中,谷氨酰胺经过多个复杂的代谢步骤,最终通过线粒体氧化磷酸化过程产生ATP和其他代谢产物。
谷氨酰胺代谢过程的增强和紊乱有利于维持肿瘤细胞的生存和增殖。
一些研究表明,抑制肿瘤细胞中的TCA途径可以降低肿瘤细胞的生存和增殖,并增加其对其他治疗干预的敏感性。
除了转移酰胺酶催化的TCA途径外,谷氨酰胺酯化途径也是肿瘤细胞主要的谷氨酰胺代谢途径之一。
该途径通常由酸性胺基酸转移酶催化,可以促进谷氨酰胺的转化和利用,并产生多种代谢产物。
一些研究表明,抑制肿瘤细胞中的GAG途径也可以降低其生存和增殖,并增加其对其他治疗干预的敏感性。