严重不良事件报告表SAE国家食品药品监督管理局.doc
- 格式:doc
- 大小:27.50 KB
- 文档页数:4




严重不良事件(SAE)报告什么是严重不良事件?严重不良事件(SAE)是指发生在临床试验中可能会危及受试者生命或健康的不良事件。
与其他不良事件(例如轻微不适)不同,SAE往往需要立即上报给监管机构和该试验的伦理委员会。
SAE也可以发生在药品和医疗器械的正式营销中,这时也需要进行临床研究以确认安全性和有效性。
SAE报告的流程1. 紧急处理SAE在发生SAE之后,研究人员应立即采取措施,尽可能减少潜在的风险和继续伤害。
这包括为患者提供紧急治疗、停止试验药物的使用、暂停试验流程、调整试验流程或终止试验等。
2. 上报SAE在紧急处理后,研究人员需要尽快将SAE报告给监管机构和伦理委员会。
这通常需要按照监管机构特定的SAE上报表格或表格模板提交报告,例如中国FDA的SAE报告表格。
3. 追踪SAE进展在提交SAE报告之后,研究人员需要监测SAE患者的进展情况,同时将其汇报给监管机构和伦理委员会。
这些报告可以包括SAE的病因学、症状、严重程度和治疗方法等信息,以及治疗效果和不良反应的监测结果。
除此之外,要及时调整伦理委员会的决策和试验计划。
4. SAE报告/追踪的时间点在报告SAE时,有一定时间限制,这通常是在SAE发生后24小时内或发现亚组后7个日历日内内报告。
对于中国而言,采用了《食品药品安全法》和中国FDA对“在中国进行药物和医疗器械的临床试验管理规定”,规定紧急报告的时间为24小时内。
对于非紧急的SAE报告,则需要在30天内提交报告。
5. SAE报告的必要性SAE报告对于临床研究的推动起着重要作用。
SAE报告不仅有助于确保研究人员能够充分了解试验中不良反应的情况,而且可以促进试验的透明性和公平性,提高患者与公众对试验的信任和接受度。
同时也为监管机构和伦理委员会提供了必要的依据,以评估受试者安全和试验质量。
结论总之,SAE的发生需要及时采取处理措施并报告给监管机构和伦理委员会,提高试验的透明性和公平性。

SAE上报单位:
1、国家局
2、省局
3、医院伦理
4、申办方
5、卫计委(暂未知联系
方式)
SAE向SFDA报告的相关汇报方式如下:
1.传真汇报给:CFDA注册司研究监督处 fax: 010-8836 3228
2.首选传真的方式。
如果遇到无法传真的情况,以EMS方式邮寄过去
(必须是EMS,不接受其他方式的快递,同时也不接受邮件的方式),
邮寄地址:国家食品药品监督管理局注册司研究监督处
北京市西城区宣武门西大街26号院2号楼
邮编:100053 联系人:李金菊(处长)/王闻
雅电话:0、
注:如果通过EMS邮寄,请保留传真失败记录,并保留EMS底单复印
件。
SAE向卫计委报告的相关汇报方式如下:
国家卫生和计划生育委员会医政医管局医疗安全与血液处陈兵
地址:北京市西城区北礼士路甲38号
电话:0
传真:0
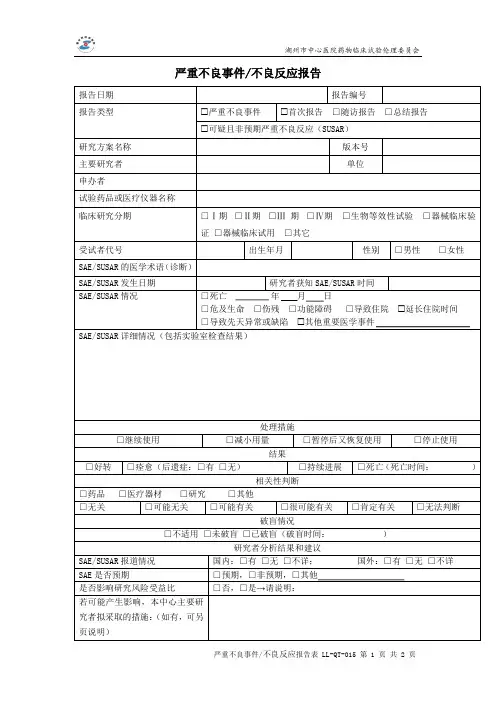
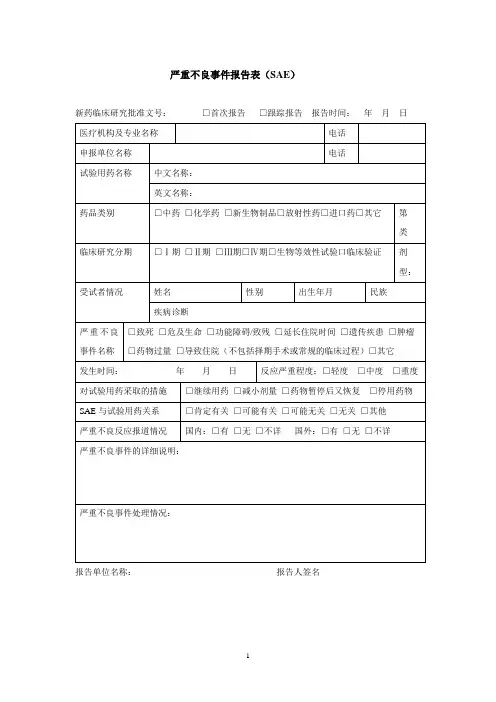
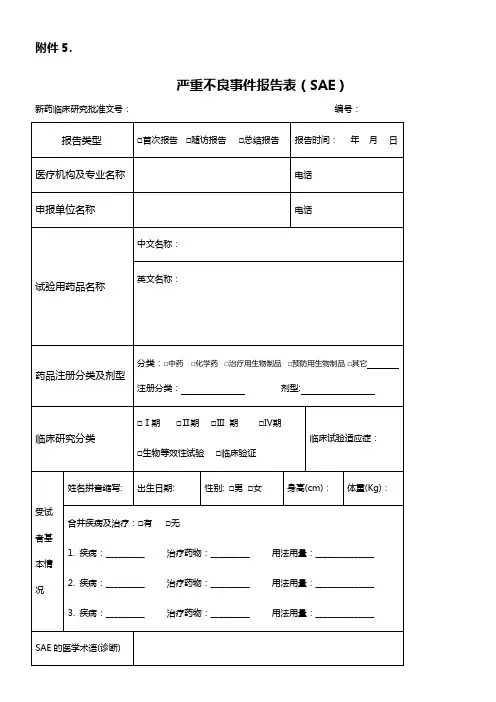
严重不良事件报告表(SAE)
新药临床研究批准文号:编号:
报告单位名称:报告人职务/职称:报告人签名:。



SAE上报单位:
1、国家局
2、省局
3、医院伦理
4、申办方
5、卫计委(暂未知联系
方式)
SAE向SFDA报告的相关汇报方式如下:
1.传真汇报给:CFDA注册司研究监督处 fax: 010-8836 3228
2.首选传真的方式。
如果遇到无法传真的情况,以EMS方式邮寄过去
(必须是EMS,不接受其他方式的快递,同时也不接受邮件的方式),
邮寄地址:国家食品药品监督管理局注册司研究监督处
北京市西城区宣武门西大街26号院2号楼
邮编:100053 联系人:李金菊(处长)/王闻
雅电话:0、
注:如果通过EMS邮寄,请保留传真失败记录,并保留EMS底单复印
件。
SAE向卫计委报告的相关汇报方式如下:
国家卫生和计划生育委员会医政医管局医疗安全与血液处陈兵
地址:北京市西城区北礼士路甲38号
电话:0
传真:0
严重不良事件报告表(SAE)
新药临床研究批准文号:编号:
报告单位名称:报告人职务/职称:报告人签名:。
严重不良事件报告表
5.对试验药物采取的措施
口继续用药口减小剂量口药物暂停后又恢复口停用药物
6.严重不良事件的转归
口症状消失,无后遗症口症状消失,有后遗症(请说明):
口症状持续,时至口还在接受治疗
口死亡,死亡日期:
7.是否有合并用药和基础疾病(列举严重不良事件发生时的合并用药和基础疾病,包括合并用药的剂量、给药途径和用药的持续时间)
8.严重不良事件是否预期
口该严重不良事件为预期不良事件,已经在获批准的研究方案/知情同意书中说明。
口该严重不良事件为可疑且非预期严重不良反应,没有在获批准的研究方案/知情同意书中说明。
口其他,请说明:
9.破盲情况
口未破盲口已破盲(破盲时间:年月日):
口试验组口对照组
10.已采取措施
是否打算修改方案和/或知情同意书
口否
口是口已经修改方案和/或知情同意书以避免该风险口即将修改方案和/或知情同意书
主要研究者签名:日期:建议审查方式:
口不良事件审查委员初审口紧急会议审查口会议通报
主任/副主任委员签名:日期:。