大学二年级分析化学-第5章酸碱滴定法2
- 格式:ppt
- 大小:2.41 MB
- 文档页数:5





分析化学酸碱滴定法分析化学中的酸碱滴定法是一种常用的定量分析方法,广泛应用于各种领域,包括环境监测、制药、食品检验等。
该方法通过在化学反应中加入一种已知浓度的酸或碱溶液,利用滴定终点的指示剂的颜色变化或电动势的变化来确定待测溶液的浓度。
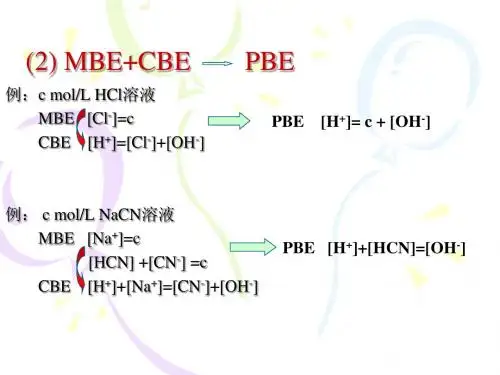
酸碱滴定法的基本原理是酸和碱反应的定量关系:n1V1=n2V2,其中n1和n2分别是酸和碱的摩尔数,V1和V2分别是酸和碱的体积。
根据这一关系,可以确定待测溶液中酸或碱的浓度。
在酸碱滴定法中,滴定终点的判断是关键步骤。
常用的指示剂有酚酞、溴酸甲基橙、甲基红等,其颜色在酸碱反应过程中发生明显变化。
当滴加的酸或碱溶液足够与待测溶液中的酸或碱反应到足够数量时,指示剂的颜色发生转变,即达到了滴定终点。
酸碱滴定法有以下几个主要步骤:1.准备滴定溶液:根据待测溶液的性质选择合适的酸或碱溶液作为滴定溶液,调整其浓度,使其能够反应到滴定终点。
2.准备待测溶液:将待测溶液取出一定容积,用烧杯或容量瓶装放。
3.添加指示剂:根据待测溶液的酸碱性质选择合适的指示剂,加入待测溶液中。
4.滴定:用滴定管将滴定溶液滴加到待测溶液中,直到指示剂颜色发生转变,即达到滴定终点。
5.计算结果:根据酸碱反应的定量关系,使用酸碱滴定公式计算出待测溶液中酸或碱的浓度。
酸碱滴定法的优点是操作简单,结果准确可靠。
然而,该方法也有一些局限性。
首先,滴定终点的判断具有主观性,可受到操作人员的视力、光线等因素的影响。
其次,在滴定过程中,应该严格控制滴加速度,以避免溅液影响滴定结果。
此外,滴定终点对于复杂样品或多种酸碱的滴定来说可能会出现困难。
为了提高酸碱滴定法的准确性和灵敏度,人们引入了一些改进方法,如自动滴定器和电位滴定法。
自动滴定器可以自动控制滴加速度和滴定终点的判断,减少了人为误差。
电位滴定法则通过跟踪滴定过程中的电位变化来确定滴定终点,提高了滴定方法的精确性。
总之,酸碱滴定法是一种常用的分析化学方法,其简单易行、结果可靠的特点使其得到广泛应用。



(完整版)酸碱滴定实验详细步骤酸碱滴定实验详细步骤酸碱滴定实验详细步骤用已知物质量浓度的酸(或碱)来测定未知物质物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定【实验】以把已知物质的量浓度的盐酸注入事先已用该盐酸溶液润洗过的酸式滴定管,至刻度“ 0”上,把滴定管固定在滴定管夹上。
轻轻转动下面的活塞,使管的尖嘴部分充满溶液且无气泡。
然后调整管内液面,使其保持在“0”或“0”以下的某一刻度,并记下准确读数;把待测浓度的NaOH溶液注入事先已用该溶液润洗过的碱式滴定管,也把它固定在滴定管夹上。
轻轻挤压或“ 0”以下玻璃球,使管的尖嘴部分充满溶液且无气泡,然后调整管内液面,使其保持在“ 0”某一刻度,并记下准确读数。
在管下放一洁净的锥形瓶,从碱式滴定管放出25.00 mL NaOH溶液,注入锥形瓶,加入2滴酚酞试液,溶液立即呈粉红色。
然后,把锥形瓶移到酸式滴定管下,左手调活塞逐滴加入已知物质的量浓度的盐酸,同时右手顺时针不断摇动锥形瓶,使溶液充分混合。
随着盐酸逐滴加入,锥形瓶里OH-浓度逐渐减小。
最后,当看到加入1滴盐酸时,溶液褪成无色,且反滴一滴NaOH溶液又变回红色说明反应恰好进行完全。
停止滴定,准确记下滴定管溶液液面的刻度,并准确求得滴定用去盐酸的体积。
为保证测定的准确性,上述滴定操作应重复二至三次,并求出滴定用去盐酸体积的平均值。
然后根据有关计量关系,计算出待测的NaOH 溶液的物质的量浓度。
具体计量关系为C(A)*V(A)=C(B)*V(B),其中A(Acid)为酸,B(Base)为碱。
【酸碱中和滴定的注意事项】一摇瓶时,应微动腕关节,使溶液像一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出。
二滴定时左手不能离开旋塞让液体自行流下。
三注意观察液滴落点周围溶液颜色变化。
开始时应边摇边滴,滴定速度可稍快(每秒3~4滴为宜),但是不要形成水流。
接近终点时应改为加一滴,摇几下,最后,毎加半滴,即摇动锥形瓶,直至溶液出现明显的颜色变化,准确到达终点为止。
