生物化学复习重点
- 格式:doc
- 大小:21.00 KB
- 文档页数:7

一.n解释1.氨基酸的等电点(pI):在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的pH称为该氨基酸的等电点。
2. .蛋白质的等电点(pI):当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的pH称为蛋白质的等电点。
蛋白质溶液的pH大于等电点时,该蛋白质颗粒带负电荷,反正则带正电荷。
3.蛋白质变性:在某些理化因素的作用下,其特定的空间构象被破坏,也即有序的空间结构变成无序的空间结构,从而导致其理化性质的改变和生物活性的丧失。
4.核酸的变性:在某些理化因素作用下,核酸分子中的氢键断裂,双螺旋结构松散分开,理化性质改变,失去原有的生物学活性。
5解链温度、溶解温度或Tm:在解链过程中,紫外吸光度的变化△A260达到最大变化值的一半时所对应的温度称为DNA的解链温度。
6.Km:等于酶促反应速度为最大速度一半时的底物浓度。
6.酶的活性中心或活性部位:这些必需基团在一级结构上可能相距很远,但在空间上彼此靠近,组成具有特定空间结构的区域,能和底物特异的结合并将底物转化为产物。
这一区域称为酶的活性中心或活性部位。
辅酶或辅基参与酶活性中心的组成。
7.同工酶:指催化相同化学反应,但酶蛋白的分子结构、理化性质乃至免疫学性质不同的一组酶。
8.变构酶:变构效应的剂与酶分子活性中心以外的部位可逆的组合,使酶分子发生构象改变,从而改变了催化活性的酶称为变构酶。
9.酶原的激活:酶原向酶的转化过程称为酶原的激活,酶原的激活实际上是酶的活性中心形成或暴露的过程。
10.糖酵解:在机体缺氧条件下,葡萄糖经一系列酶促反应生成丙酮酸进而还原成乳酸的过程称为糖酵解。
11.糖的有氧氧化:葡萄糖在有氧条件下彻底氧化成水和二氧化碳的反应过程称为有氧氧化。
是体内糖代谢最主要途径。
12.糖异生:从非糖化合物(乳酸,甘油,生糖氨基酸,丙酮酸)转化为葡萄糖或糖原的过程称为糖异生。

1.生物化学的概念P1是研究生物体的化学组成和生命过程中的化学变化规律的一门科学。
具体来讲,它是从分子水平来研究生物体(包括人类、动物、植物、微生物)内基本物质的化学组成、结构及在生命活动中这些物质所进行的化学变化(即代谢反应)的规律及其与生理功能的关系的一门科学,是一门生物学与化学相结合的基础学科。
2. 生物化学研究的基本内容P1静态生化:研究生物体内物质的化学组成、结构、性质、功能及结构与功能的关系。
发现和阐明构成生命物体的分子基础——生物分子的化学组成、结构和性质。
生物分子的结构、功能与生命现象的关系。
动态生化:研究生物体内物质代谢(新陈代谢)、能量转变及其调控机理生物分子在生物体中的相互作用及其变化规律。
蛋白质的化学3.组成蛋白质的元素P62主要有C(50-55)、H(6-8)、O(19-24)、N(13-19)和S。
有些蛋白质含有少量磷或金属元素铁、铜、锌、锰、钴、钼,个别蛋白质还含有碘。
4.凯式定氮法及蛋白质含量计算凯氏定氮法是测定化合物或混合物中总氮量的一种方法。
即在有催化剂的条件下,用浓硫酸消化样品将有机氮都转变成无机铵盐,然后在碱性条件下将铵盐转化为氨,随水蒸气馏出并为过量的酸液吸收,再以标准碱滴定,就可计算出样品中的氮量。
由于蛋白质含氮量比较恒定,可由其氮量计算蛋白质含量,故此法是经典的蛋白质定量方法。
各种蛋白质的含氮量很接近,平均为16%。
蛋白质的大致含量:100克样品中蛋白质的含量( g % )= 每克样品含氮克数×6.25×100即蛋白质的含量= 蛋白质含氮量× 6.255.氨基酸结构通式P63存在自然界中的氨基酸有300余种,但组成人体蛋白质的氨基酸仅有20种,且均属L-氨基酸(甘氨酸除外)-氨基酸:各种氨基酸的区别在于侧链R基的不同。
20种基本氨基酸按R的极性可分为非极性氨基酸、极性性氨基酸、酸性氨基酸和碱性氨基酸按R基极性分两类:极性AA:11种亲水性丝、苏、酪甘半光非极性AA:9种疏水性按水溶性酸碱性分为三类:1、中性AA(有极性与非极性15种):2、酸性AA(2种):天冬氨酸、谷氨酸3、碱性AA(3种):组、赖、精谷氨酸:甘氨酸:丝氨酸:半胱氨酸组氨酸6.氨基酸的化学性质P65★两性解离: 等电点:在某一pH环境中,氨基酸解离成阳性离子及阴性离子的趋势相等,所带净电荷为零,在电场中不泳动。

●绪论●生物化学定义研究任务目的●第一章糖第一节单糖一、葡萄糖的分子结构构象:指一个分子中,不改变共价键结构,仅单键周围的原子旋转所产生的空间排布。
一种构象改变为另一种构象时,不要求共价键的断裂和重新形成。
构型:指一个分子由于其中各原子特有的固定的空间排列,而使该分子所具有的特定的立体化学形式。
构型改变要求共价键的断裂和重新形成。
不对称碳原子:连接四个不同原子或基团的碳原子。
镜像对映体:旋光异构现象和旋光度:异头物:二、单糖的分类糖:含多羟基的醛或酮的化合物醛糖:含醛基酮糖:含酮基三、单糖的物理性质和化学性质『一』物理性质『二』化学性质四、重要的单糖第二节寡糖一、双糖1、麦芽糖:两个葡萄糖以α(1-4)糖苷键缩合2、蔗糖:由α-D-葡萄糖和β-D -果糖各一分子以α,β(1-2)糖苷键型缩合。
3、乳糖:由α-D-葡萄糖和β-D -半乳糖各一分子以β(1-4)糖苷键型缩合。
第三节多糖1、淀粉支链淀粉直链淀粉2、糖原3、纤维素●第二章脂类定义生物功能第一节脂酰甘油类定义一、脂肪酸二、甘油三酯的类型三、甘油三酯的理化性质皂化和皂化值酸败和酸值卤化和碘值●第三章蛋白质第一节蛋白质通论一、蛋白质的化学组成:平均含氮量16%,是凯氏定氮法的基础平均分子量110第二节蛋白质的基本结构单位-氨基酸一、氨基酸的分类蛋白质氨基酸:20种α氨基酸:脯氨酸为亚氨基酸,其余都是。
旋光性:除甘氨酸外,都有旋光性各类氨基酸:二、氨基酸的酸碱性质广义酸碱:酸,质子供体。
碱,质子受体。
等电点:PI=1/2(PK1+PK2)在等电点以上的任何PH,氨基酸带净负电荷,并由此在电场中将向正级移动,在低于等电点的任一PH,氨基酸将带净正电荷,在电场中将向负极移动。
三、氨基酸的化学反应:Sanger反应Edman降解印三酮反应四、氨基酸的分析分离离子交换层析第三节蛋白质的共价结构(一级结构)一、肽和肽键的结构肽单位肽键共价主链肽平面同源蛋白质二、N末端和C末端氨基酸残基的测定Sanger反应DNS(丹蟥酰氯法)Edman降解第四节蛋白质的二级结构和纤维状蛋白质二级结构:多肽链中有规则重复的构象。

⽣物化学复习重点⽣物化学复习重点第⼀章蛋⽩质1.蛋⽩质的元素组成:C、H、O、N、S及其他微量元素,蛋⽩质含氮量:16%公式:每克样品含氮量×6.25×100=100克样品蛋⽩质含量(克%)2.氨基酸通式特点:α-L -氨基酸,只有⽢氨酸没有⼿性(旋光性),脯氨酸为亚氨基酸。
3.氨基酸分类:(1)、酸性氨基酸:⼀氨基⼆羧基氨基酸,有天冬氨酸、⾕氨酸,带负电荷(2)、碱性氨基酸:⼆氨基⼀羧基氨基酸,有赖氨酸、精氨酸、组氨酸,带正电荷(3)、中性氨基酸:⼀氨基⼀羧基氨基酸,有⽢氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、⾊氨酸、酪氨酸、脯氨酸、天冬酰胺、⾕氨酰胺、丝氨酸、苏氨酸。
不带电荷。
(4)含S氨基酸:甲硫氨酸、半胱氨酸(5)含羟基氨基酸:丝氨酸、苏氨酸(6)芳⾹族氨基酸:苯丙氨酸、⾊氨酸、酪氨酸(7)含酰胺基氨基酸:天冬酰胺、⾕氨酰胺4.氨基酸的等电点PI:氨基酸所带正负电荷相等时的溶液pH。
pI=(pK1,+pK2,)/25.氨基酸紫外吸收:280nm,苯丙氨酸、⾊氨酸、酪氨酸有紫外吸收6.蛋⽩质的⼀级结构(Primary structure):它是指蛋⽩质中的氨基酸按照特定的排列顺序通过肽键连接起来的多肽链结构。
肽键:⼀个氨基酸的a-COOH 和相邻的另⼀个氨基酸的a-NH2脱⽔形成共价键。
7.蛋⽩质⼆级结构的概念:多肽链在⼀级结构的基础上,按照⼀定的⽅式有规律的旋转或折叠形成的空间构象。
其实质是多肽链在空间的排列⽅式蛋⽩质⼆级结构主要类型有:a-螺旋、β-折叠、β-转⾓维持⼆级结构的作⽤⼒:氢键a-螺旋(a-Helix)⼜称为3.613螺旋,Φ= -57。
,Ψ= -47。
结构要点:(1)、多个肽键平⾯通过α-碳原⼦旋转,主链绕⼀条固定轴形成右⼿螺旋。
(2)、每3.6个氨基酸残基上升⼀圈,相当于0.54nm。
(3)、相邻两圈螺旋之间借肽键中C=O和N-H形成许多链内氢健,即每⼀个氨基酸残基中的NH和前⾯相隔三个残基的C=O 之间形成氢键,这是稳定α-螺旋的主要键。

一、蛋白质的结构与功能1.蛋白质的含氮量平均为16%.2.氨基酸是蛋白质的基本组成单位,除甘氨酸外属L-α-氨基酸。
3.酸性氨基酸:天冬氨酸、谷氨酸;碱性氨基酸:赖氨酸、精氨酸、组氨酸。
4.半胱氨酸巯基是GSH的主要功能基团。
5.一级结构的主要化学键是肽键。
6.维系蛋白质二级结构的因素是氢键7.并不是所有的蛋白质都有四级结构。
8.溶液pH>pI时蛋白质带负电,溶液pH<pl时蛋白质带正电。
9.蛋白质变性的实质是空间结构的改变,并不涉及一级结构的改变。
二、核酸的结构和功能1. RNA和DNA水解后的产物。
2.核苷酸是核酸的基本单位。
3.核酸一级结构的化学键是3′,5′-磷酸二酯键。
4. DNA的二级结构的特点。
主要化学键为氢键。
碱基互补配对原则。
A与T, c 与G.5. Tm为熔点,与碱基组成有关6. tRNA二级结构为三叶草型、三级结构为倒L型。
7.ATP是体内能量的直接供应者。
cAMP、cGMP为细胞间信息传递的第二信使。
三酶1.酶蛋白决定酶特异性,辅助因子决定反应的种类与性质。
2.酶有三种特异性:绝对特异性、相对特异性、立体异构特异性酶活性中心概念:必须基因集中存在,并构成一定的空间结构,直接参与酶促反应的区域叫酶的活性中心3.B族维生素与辅酶对应关系。
4. Km含义;Km值一般由一个数乘以测量单位所表示的特定量的大小. 对于不能由一个数乘以测量单位所表示的量,可参照约定参考标尺,或参照测量程序,或两者都参照的方式表示。
5.竞争性抑制特点。
某些与酶作用底物相识的物质,能与底物分子共同竞争酶的活性中心。
酶与这种物质结合后,就不能再与底物相结合,这种作用称酶的竞争性抑制作用。
抑制是可逆的,抑制作用的大小与抑制剂和底物之间的相对浓度有关。
四糖代谢1.糖酵解限速酶:己糖激酶,磷酸果糖激酶,丙酮酸激酶;净生成ATP:2分子ATP;产物:乳酸2.糖原合成的关键酶是糖原合成酶。
糖原分解的关键酶是磷酸化酶。

基础生物化学重要知识要点(一)名词解释1.蛋白质的三级结构:指蛋白质在二级结构的基础上借助各种次级键卷曲折叠成特定的球状分子结构的构象。
2.氢键:指负电性很强的氧原子或氮原子与N-H或O-H的氢原子间的相互吸引力。
3.蛋白质的四级结构:指多亚基蛋白质分子中各个具有三级结构的多肽链以适当方式聚合所呈现的三维结构。
4.超二级结构:指蛋白质分子中相邻的二级结构单位组合在一起所形成的有规则的、在空间上能辨认的二级结构组合体。
5.盐析:在蛋白质溶液中加入一定量的高浓度中性盐(如硫酸氨),使蛋白质溶解度降低并沉淀析出的现象称为盐析。
6.盐溶:在蛋白质溶液中加入少量中性盐使蛋白质溶解度增加的现象。
7.蛋白质变性:蛋白质分子的天然构象遭到破坏导致其生物活性丧失的现象。
蛋白质在受到光照、热、有机溶剂以及一些变性剂的作用时,次级键遭到破坏导致天然构象的破坏,但其一级结构不发生改变。
8.蛋白质复性:指在一定条件下,变性的蛋白质分子恢复其原有的天然构象并恢复生物活性的现象。
9.肽平面:组成肽键的四个原子和与之相边的α-碳原子都处于同平面内,此刚性结构的平面叫肽平面或酰胺平面。
10.反密码子(anticodon):在tRNA链上有三个特定的碱基,组成一个密码子,由这些反密码子按碱基配对原则识别mRNA链上的密码子。
反密码子与密码子的方向相反。
11.核酸的变性、复性(denaturation、renaturation):当呈双螺旋结构的DNA溶液缓慢加热时,其中的氢键便断开,双链DNA便脱解为单链,这叫做核酸的“溶解”或变性。
在适宜的温度下,分散开的两条DNA链可以完全重新结合成和原来一样的双股螺旋。
这个DNA螺旋的重组过程称为“复性”。
12.DNA退火(annealing):当将双股链呈分散状态的DNA溶液缓慢冷却时,它们可以发生不同程度的重新结合而形成双链螺旋结构,这现象称为“退火”。
13.必需氨基酸:指人体(和其它哺乳动物)自身不能合成,机体又必需,需要从饮食中获得的氨基酸。

绪论掌握:生物化学、生物大分子与分子生物学的概念。
【复习思考题】1、何谓生物化学?2、当代生物化学研究的主要内容有哪些?蛋白质的结构与功能掌握:蛋白质元素组成及其特点;蛋白质基本组成单位--氨基酸的种类、基本结构及主要特点;蛋白质的分子结构;蛋白质结构与功能的关系;蛋白质的主要理化性质及其应用;蛋白质分离纯化的方法及其基本原理。
【复习思考题】1、名词解释:蛋白质一级结构、蛋白质二级结构、蛋白质三级结构、蛋白质四级结构、肽单元、模体、结构域、分子伴侣、协同效应、变构效应、蛋白质等电点、电泳、层析2、蛋白质变性的概念及本质就是什么?有何实际应用?3、蛋白质分离纯化常用的方法有哪些?其原理就是什么?4、举例说明蛋白质结构与功能的关系?核酸的结构与功能掌握:核酸的分类、细胞分布,各类核酸的功能及生物学意义;核酸的化学组成;两类核酸(DNA与RNA)分子组成异同;核酸的一级结构及其主要化学键;DNA右手双螺旋结构要点及碱基配对规律;mRNA一级结构特点;tRNA二级结构特点;核酸的主要理化性质(紫外吸收、变性、复性),核酸分子杂交概念。
第三章酶掌握:酶的概念、化学本质及生物学功能;酶的活性中心与必需基团、同工酶;酶促反应特点;各种因素对酶促反应速度的影响、特点及其应用;酶调节的方式;酶的变构调节与共价修饰调节的概念。
第四章糖代谢掌握:糖的主要生理功能;糖的无氧分解(酵解)、有氧氧化、糖原合成及分解、糖异生的基本反应过程、部位、关键酶(限速酶)、生理意义;磷酸戊糖途径的生理意义;血糖概念、正常值、血糖来源与去路、调节血糖浓度的主要激素。
【复习思考题】1、名词解释:、糖酵解、糖酵解途径、高血糖与糖尿病、乳酸循环、糖原、糖异生、三羧酸循环、活性葡萄糖、底物水平磷酸化。
2.说出磷酸戊糖途径的主要生理意义。
3.试述饥饿状态时,蛋白质分解代谢产生的丙氨酸转变为葡萄糖的途径。
4.试述三大能源物质在体内分解代谢产生CO2与H2O及ATP的主要途径。

生物化学复习资料第一章蛋白质的结构与功能1.蛋白质是许多氨基酸通过肽链相连形成的高分子含氮化合物。
2.蛋白质组成元素:C、H、O、N、S,N的含量基本相同为16%。
3.氨基酸为蛋白质的基本单位,人体内含20种,除甘氨酸外皆为α-氨基酸。
4.氨基酸分类:①非极性疏水性氨基酸7种:甘氨酸Glycine Gly G 丙氨酸Alanine Ala A 缬氨酸Valine Val V 亮氨酸Leucine Leu L 异亮氨酸Isoleucine Ile I 脯氨酸Proline Pro P 苯丙氨酸Phenylalanine Phe F②极性中性氨基酸8种:酪氨酸Tyrosine Tyr Y 色氨酸Tryptophan Trp W 丝氨酸Serine Ser S 苏氨酸Threonine Thr T 半胱氨酸Cystine Cys C 蛋氨酸Methionine Met M 天冬酰胺Asparagine Asn N 谷氨酰胺Glutarnine Gln Q③酸性氨基酸2种:天冬氨酸Asparticacid Asp D 谷氨酸Glutamicacid Glu E④:碱性氨基酸3种:赖氨酸Lysine Lys K精氨酸Arginine Arg R组氨酸Histidine His H5.氨基酸的理化性质:①两性解离的性质,等电点:中性时的PH值,用PI表示。
②含共轭双键(络氨酸和色氨酸残基)具有紫外吸收性质(波长:280nm),用于分析蛋白质的含量。
③茚三酮反应生成蓝紫色化合物(吸收光570nm),用于氨基酸定量分析。
6.几种生物活性肽:①谷胱甘肽(谷氨酸+半胱氨酸+甘氨酸).用GSH表示,具还原性、分解H2O2、解毒。
②多肽类激素及神经肽。
7.蛋白质的一级结构:多肽链中氨基酸的排列顺序。
主要化学键:肽键,部分含二硫键。
一级结构是蛋白质空间构象和特异生物学功能基础,决定空间结构,非决定空间结构的唯一因素。
8.蛋白质的二级结构:指蛋白质分子中某一段肽链的局部空间结构,不涉及氨基酸残基的侧链构象。

生物化学考试重点概要
一、概述
生物化学是研究生物体内的化学成分及其相互关系的学科,涉及生物大分子、代谢途径、酶的功能等领域。
本文档将重点概括生物化学考试中的重要内容。
二、生物大分子
1. 蛋白质:结构、功能、合成与降解
2. 核酸:DNA和RNA的结构、功能和复制过程
3. 碳水化合物:单糖、多糖的组成和功能
4. 脂类:脂肪酸、甘油与脂质的分类和代谢
三、代谢途径
1. 高级碳水化合物代谢:糖原合成与分解、糖酵解、柠檬酸循环
2. 氨基酸代谢:氨基酸合成与降解、尿素循环
3. 脂类代谢:脂肪酸合成与降解
4. 核酸代谢:核苷酸合成与降解
四、酶的功能
1. 酶的分类与特性:氧化还原酶、转移酶、水解酶等
2. 酶促反应:酶的动力学参数、酶反应速率与底物浓度的关系
3. 酶的调控机制:酶的诱导与抑制、酶活性调节因子
五、其他重要知识点
1. 酶联免疫吸附测定(ELISA)原理与应用
2. PCR技术的原理与应用
3. 蛋白质电泳的原理与应用
六、复建议
1. 重点记忆各个代谢途径的关键酶与反应物
2. 针对酶的功能和调控机制进行重点理解与实例分析
3. 多做题和模拟考试,加强对知识点的掌握和应用能力
以上是生物化学考试重点概要的完整版。
希望本文档能帮助你全面复生物化学知识,取得优异的考试成绩。

第一章、糖类化学一、名词解释:1.糖类:多羟基醛或多羟基酮及其缩聚物和某些衍生物的总称。
2.单糖:是不能被水解的最简单的糖类,是多羟基醛或酮的衍生物。
3.寡糖:也称低聚糖,由2~10分子的单糖脱水缩合而成,水解后产生单糖。
4.多糖:由多分子单糖或单糖衍生物聚合而成,水解后产生单糖或其衍生物。
5.同多糖:由一种分子单糖或单糖衍生物聚合而成的多糖,水解后产生单一单糖或单糖衍生物。
6.杂多糖:由二种及二种以上分子单糖或单糖衍生物聚合而成的多糖。
7.纤维素:由β-D-葡萄糖通过β(1→4)糖苷键链接而成的线性大分子物质。
8.直链淀粉:由α-D-葡萄糖通过α(1→4)糖苷键链接而成的线性大分子物质,直链淀粉分子的空间构象是卷曲成螺旋的,每个螺旋有6个葡萄糖残基。
能溶于热水而不成糊状。
遇碘显蓝色。
9.支链淀粉:由α-D-葡萄糖所构成的大分子聚合物,葡萄糖残基间除以α-1,4-糖苷键相连外,还有以α-1,6-糖苷键相连的。
所以带有分支,支链淀粉中每一单位直链长度约20~30个葡萄糖单位,每隔8~9个葡萄糖单位就有一个分支。
在冷水中不溶,与热水作用则膨胀而成糊状。
遇碘呈紫或红紫色。
10.淀粉:是葡萄糖的高分子聚合物,广泛分布于植物种子和块根中,是白色颗粒状的固体。
11.糖原:亦称“动物淀粉”,由葡萄糖结合而成的支链多糖,其糖苷链为α型。
主要由D-葡萄糖通过α-1,4联接组成糖链,并通过α-1,6连接产生支链。
12.变旋:单糖溶于水放置后,其比旋光度发生改变。
变旋的原因是糖从一种结构α-型变成另一种结构β-型,或相反从β-型变成α-型。
变旋作用是可逆的,当α-或β-两型互变达到平衡时,比旋光度即不再变化。
13.糖胺聚糖:又称粘多糖,是一类含己糖胺和糖醛酸或半乳糖的杂多糖,是由多个二糖单位形成的长链多聚物。
14.肽聚糖:又称粘肽,氨基糖肽或粘质。
它是由N-乙酰葡萄糖胺与N-乙酰胞壁酸通过β-1,4-糖苷键组成的多糖链为骨干与四肽连接所构成的杂多糖肽聚糖的功用是保护细菌细胞不易被破坏。
生物化学期中复习一、名词解释1、必需氨基酸:有一些氨基酸在人和非反刍动物中不能够合成,必须从食品中吸收,以保证正常的生命活动的需要,这种氨基酸叫做必需氨基酸。
成人有8种,为苏氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、色氨酸、赖氨酸和蛋氨酸,对于婴幼儿来说,组氨酸也为必需氨基酸。
2、两性解离:既能解离阳离子,又能解离阴离子,如氨基酸在水中的偶极离子。
3、氨基酸等电点:在一个特定的pH条件下,氨基酸分子在溶液中解离成阳离子和阴离子的数目的趋势是相等的,即氨基酸分子所带的静电荷等于0(也就是说它在电场中既不向阳极移动,也不向阴极移动),此时氨基酸所处的溶液的pH 称为等电点,也可用PI表示。
4、氨基酸残基:肽链中的氨基酸由于参加肽键的形成已经不是原来完整的分子。
5、蛋白质一级结构:氨基酸的排列顺序。
6、构型:指手性碳原子所连接的4个不同的原子或基团在空间的两种不同的排列。
7、构象:指一个由几个碳原子构成的分子因一些单键的旋转而形成的不同的碳原子上各个取代基团或原子的空间排列。
8、酰胺平面:肽键是一个共振杂化体,共振的后果是肽键具有部分双键性质,不能绕键自由旋转;主链肽基成为刚性平面,称酰胺平面,平面内C=O与N—H呈反式排列,各原子间有固定的键角和键长。
9、二面角:在A—B—C—D四原子依次连接的系统中,含A、B、C的平面和含B、C、D的平面之间的夹角。
10、肽单元:肽键相连的四个原子和两个α—碳原子组成的结构称为肽单元。
11、蛋白质的二级结构:具有一定程序规则的氢键结构的多肽链的主链的空间排布。
12、α—螺旋结构:①多肽链主链环绕着螺旋中心轴螺旋式上升,每隔3.6个氨基酸残基螺旋上升一圈,螺旋原中心轴每上升一圈向上平移0.54nm;②每个残基绕轴旋转100°,沿轴上升0.15nm;③每个氨基酸残基上的亚氨基(N—H)和位于其前的第四个氨基酸残基上的羰基(C=O)形成氢键;④螺旋体上氨基酸的R基团伸向外侧,在螺旋体上呈现出辐射状排列;甘氨酸、异亮氨酸、苏氨酸、天冬氨酸对α—螺旋的形成有不利影响,脯氨酸是α—螺旋的破坏者;⑤天然蛋白质中的α—螺旋绝大部分呈右手螺旋;⑥二面角中ψ角度:-45°—(-50°);φ角度:-60°13、β—折叠结构:指一条多肽链的若干个肽段之间依靠羰基上的O和亚氨基上的H形成氢键,这种结构称为β—折叠结构。
一、名词解释生物化学复习材料1. 血糖:通过各种途径进入血液的葡萄糖称为血糖。
2. 糖原合成与分解:由单糖合成糖原的过程称为糖原合成,糖原分解是指糖原分解成葡萄糖的过程。
3. 糖异生:由非糖物质合成葡萄糖的过程。
4. 糖酵解:在供氧不足时,葡萄糖在细胞液中分解成丙酮酸,丙酮酸进一步还原成乳酸(同时释放少量能量合成ATP)的过程。
5. 三羧酸循环:在线粒体内,乙酰CoA与草酰乙酸缩合生成柠檬酸,柠檬酸在经过一系列酶促反应之后又生成草酰乙酸,形成一个反应循环,该循环生成的第一个化合物是柠檬酸,它含有三个羧基,所以称为三羧酸循环。
6. 有氧氧化:在供养充足时,葡萄糖在细胞液中分解生成的丙酮酸进入线粒体,彻底氧化成CO2和H2O,并释放大量能量,称为有氧氧化途径。
7. 血脂:血浆中脂类的总称。
主要包括甘油三酯、磷脂、胆固醇和游离脂肪酸。
8. 血浆脂蛋白:是脂类在血浆中的存在形式和转运形式。
(一类由脂肪、磷脂、胆固醇及其酯与不同载脂蛋白按不同比例组成的,便于通过血液运输的复合体,包括CM、VLDL、LDL 和HDL。
)9. 脂肪动员:脂肪细胞内的甘油三酯被脂肪酶水解生成甘油和脂肪酸,释放入血,供给全身各组织氧化利用的过程。
10. 酮体:包括乙酰乙酸、β-羟丁酸和丙酮,是脂肪酸分解代谢的正常产物。
11. 必需脂肪酸:亚油酸、α亚麻酸和花生四烯酸是多不饱和脂肪酸,是维持人和动物正常生命活动所必需的脂肪酸,但哺乳动物体内不能合成或合成量不足,必须从食物中摄取,所以称为必需脂肪酸。
12. 必需氨基酸:8种体内需要而自身又不能合成、必须由食物供给的氨基酸称为必需氨基酸。
13. 食物蛋白质的互补作用:将不同种类营养价值较低的蛋白质混合食用,可以相互补充所缺少的必需氨基酸,从而提高其营养价值,称为蛋白质的互补作用。
14. 转氨基作用:是指由氨基转移酶催化,将氨基酸的α-氨基转移到一个α-酮酸的羧基位置上,生成相应的α-酮酸和一个新的α-氨基酸。
生物化学复习提纲1.生物氧化a)呼吸链:代谢物上的氢原子被脱氢酶激活脱落后,经过一系列的传递体,最后传递给被激活的氧分子,并与之结合生成水的全部体系称呼吸链。
b)P/O比值:物质氧化时,每消耗1摩尔氧原子所消耗无机磷的摩尔数,即一对电子经电子传递链转移至1摩尔氧原子时生成ATP的摩尔数。
c)生物氧化:有机物在生物体内氧的作用下,生成CO2和水并释放能量的过程称为生物氧化。
d)高能化合物:含自由能高的磷酸化合物称为高能化合物。
e)氧化磷酸化:伴随放能的氧化作用而进行的磷酸化作用称为氧化磷酸化。
f)底物水平磷酸化:底物水平磷酸化是在被氧化的底物上发生磷酸化作用,即在底物被氧化的过程中,形成了某些高能的磷酸化合物,这些高能磷酸化合物通过酶的作用使ADP生成ATP。
g)电子水平磷酸化:电子由NADH或FADH2经呼吸链传递给氧,最终形成水的过程中伴有ADP磷酸化为ATP,这一过程称为电子水平磷酸化。
h)磷酸-甘油穿梭系统:在脑和骨骼肌,胞液中产生的还原当量转运进入线粒体氧化的方式。
以磷酸甘油为载体,进入线粒体FADH2氧化呼吸链氧化,生成1.5分钟ATP。
i)苹果酸-天冬氨酸穿梭系统:在心肌和肝,胞液中产生的还原当量转运进入线粒体氧化的方式。
以苹果酸为载体,进入线粒体NADH氧化呼吸链氧化,生成2.5分钟ATP。
各种生物的新陈代谢过程虽然复杂,但却有共同特点:反应条件温和,由酶所催化,对内外环境条件有高度的适应性和灵敏的自动调节机制。
有机物在生物体内氧的作用下,生成CO2和H2O并释放能量的过程称为生物氧化。
生物体内氧化反应有脱氢、脱电子、加氧等类型。
常见的高能化合物:磷酸烯醇丙酮酸、乙酰磷酸、腺苷三磷酸、磷酸肌酸、乙酰辅酶A典型的呼吸链有NADH呼吸链与FADH2呼吸链。
呼吸链由线粒体内膜上NADH脱氢酶复合物(复合物I),细胞色素b、c1复合物(复合物III)和细胞色素氧化酶(复合物IV)3个蛋白质复合物组成。
生物化学期末复习重点一.名词解释1.脱氧核苷酸:是脱氧核糖核酸(DNA)的基本单位。
2.增色效应:当DNA从双螺旋结构变为单链的无规则卷曲状态时,它在260nm处的吸收便增加,这叫增色效应。
3.DNA一级结构:是指将脱氧核苷酸按照有序的顺序排列起来而形成的原始脱氧核苷酸链。
4.DNA复性:在适宜的温度下.分散开的两条DMA链可以完全重新结合成和原来一样的双股螺旋。
这个DNA螺旋的重组过程称为复性。
5.B-DNA:DNA钠盐在较高温度下的纤维结构,是B型双螺旋,称为B-DNA结构。
6.核酸分子杂交:按照互补碱基配对而使不完全互朴的两条多核苷酸相互结合的过程称为分子杂交。
7.结构域:指蛋白质多肽链在二级结构的基础上进一步卷曲折叠成几个相对独立的近似球形的组装体。
8.蛋白质等电点:存在一个PH使蛋白质的表面净电荷为零即等电点。
9.蛋白质三级结构:指蛋白质在二级结构的基础上借助各种次级键卷曲折叠成特定的球状分子结构的构象。
10.变构效应:是寡聚蛋白与配基结合改变蛋白质构象,导致蛋白质生物活性改变的现象。
11.蛋白质变性:在某些物理和化学因素作用下,蛋白质特定的空间构象被破坏,从而导致其理化性质的改变和生物活性的丧失,称为蛋白质的变性。
12.酶:是由活细胞产生的在体内外都具有催化作用的一类生物催化剂。
13.酶活性中心:酶分子中直接与底物结合,并催化底物发生化学反应的部位,称为酶的活性中心。
14.酶原激活:使酶原转变为有活性酶的作用称为酶原激活。
15.酶活力单位:是指在特定条件(25c其它为最适条件)下,在1分钟内能转化1微摩尔底物的酶量,或是转化底物中1微摩尔的有关基团的酶量。
16.别构酶:具有别构效应的酶称为别构酶。
17.同工酶:是指有机体内能够催化同一种化学反应,但其酶蛋白本身的分子结构组成却有所不同的一组酶。
18.固定化酶:是指在一定的空间范围内起催化作用,并能反复和连续使用的酶。
19.EMP:指糖酵解,是细胞将葡萄糖转化为丙酮酸的代谢过程。
第1章绪论1、生物化学:主要是从分子水平研究生物体的化学组成及其在生命活动过程中化学变化的一门科学,又称生命的化学2、生物化学主要的研究对象:①生物体的化学组成;②物质与能量代谢及其调节第2章糖类化学1、糖:糖是一类多羟基醛或多羟基酮,或通过水解可以产生多羟基醛或酮的物质2、糖的分类:1)单糖:单糖是最简单的糖,只含一个多羟基醛或多羟基酮单位,分为醛糖和酮糖2)寡糖:又称低聚糖,是由几个(一般为2~10个)3)多糖:多糖由10个以上糖单位组成3、手性碳原子(不对称碳原子):连接有四个原子或原子团的碳原子,在空间呈不对称排布4、对于含有多个手性碳原子的糖分子,其相对构型是根据其分子结构中离羟基最远的手性碳原子连接的-OH来确定的5、葡萄糖分子的特点:1)四个手性碳原子(2、3、4、5);2)距羰基最远的手性碳原子C5上的-OH 在右侧,为D-葡萄糖3)天然葡萄糖为D-(+)-葡萄糖6、单糖的主要化学性质:①成苷反应;②成脂反应;③氧化反应;④还原反应认识糖苷键的位置7、糖苷结构中没有半缩醛羟基,不能转变为开链结构,所以糖苷没有还原性8、氧化反应:托伦试剂银镜班氏试剂砖红色9、凡是能被碱性弱氧化剂氧化的糖,都称为还原糖。
单糖都是还原糖10、二糖:1)麦芽糖:由2分子D-葡萄糖,具有还原性2)蔗糖:由1分子D-葡萄糖和1分子D-果糖以α-1,2-β-糖苷键相连而成,无还原性3)乳糖:由1分子D-半乳糖和1分子D-葡糖糖以β-1,4-糖苷键相连而成,具有还原性11、多糖:(一)同多糖1)淀粉—淀粉是直链淀粉和支链淀粉的混合物,由-D-葡萄糖组成①直链淀粉由D-葡萄糖以α-1,4-糖苷键相连而成线性分子,支链淀粉由D-葡萄糖以α-1,4-糖苷键接成短链,α-1,6-糖苷键相连形成分支②淀粉的主要性质:A.淀粉遇碘呈蓝色B.淀粉在酸或酶的作用下,形成糊精(紫~、红~、无色~2)糖原—由-D-葡萄糖组成,结构与支链淀粉相似,分支比支链淀粉更短、更密,遇碘呈紫红色或红褐色含有α-1,4-糖苷键和α-1,6-糖苷键3)其他多糖:①纤维素:含有β-1,4-糖苷键(二)杂多糖第3章脂质化学1、脂肪是由甘油与脂肪酸形成的三酰甘油(TAG),又称甘油三酯脂类包括:类脂:磷脂、糖脂、类固醇甘油三酯2、脂肪酸的结构:1)大多数天然脂肪酸是含偶数碳原子的直链一元酸2)碳原子数目一般在4~26之间,尤以C16和C18为最多3)结构通式:R-COOH3、根据是否含有碳-碳双键可分为饱和与不饱和脂肪酸4、必需脂肪酸:维持人和动物正常生命活动所必需的,但哺乳动物体内不能合成或合成量不足,需由食物提供的脂肪酸,包括亚油酸,亚麻酸和花生四烯酸5、皂化值:水解1g脂肪所消耗氢氧化钾的毫克数称为皂化值,皂化值越大表示脂肪中的脂肪酸的平均分子量越小6、碘值(或碘价):通常将100g脂肪通过加成反应所消耗碘的克数称为碘值(或碘价),碘值越大表示脂肪中的脂肪酸的不饱和程度越高7、酸败:脂肪长期暴露在空气中,分子中的碳碳双键和酯键发生氧化水解等反应,产生难闻的气味,这种现象称为酸败8、磷脂:1)甘油磷脂—磷脂酸及其衍生物;既含有亲水基又含有疏水基①磷脂酰胆碱:俗称卵磷脂(PC),是各种膜性结构的主要成分,具有协助脂类运输的作用,可用于防治脂肪肝②磷脂酰乙醇胺:俗称脑磷脂(PE),构成生物膜,参与凝血③磷脂酰肌醇(PI)2)鞘磷脂(略)9、类固醇:类固醇是胆固醇及其衍生物体内重要的类固醇:胆固醇、胆固醇酯、维生素D、胆汁酸和类固醇激素等1)胆固醇及其酯:既是其它类固醇化合物的合成原料,又是细胞膜的重要成分两种存在形式:胆固醇和胆固醇酯2)胆汁酸:是人和动物胆汁的主要成分,分为游离型胆汁酸、结合型胆汁酸3)类固醇激素:①肾上腺皮质激素:是由肾上腺皮质分泌的一类激素;皮质醇和皮质酮具有很强的调节糖代谢的作用,故称为糖皮质激素;醛固酮对盐和水的平衡具有较强的调节作用,被称为盐皮质激素②性激素:分为雄激素、雌激素和孕激素。
生物化学名词解释和答案蛋白质化学一.名词解释1.基本氨基酸:2.α-碳原子:直接与氨基和羧基相连的碳原子。
3.两性电解质:同时带有可解离为负电荷和正电荷基团的电解质。
4.氨基酸的等电点:当溶液为某一pH值时,氨基酸分子中所带正电荷和负电荷数目正好相等,净电荷为0。
这一pH值即为氨基酸的等电点,简称pI5.肽(peptide):氨基酸通过肽键连接而成的化合物。
6.肽键(peptide bond)一个氨基酸分子的α羧基与另一分子的α氨基脱水缩合而成的酰胺键。
7.二肽(dipeptide):两个氨基酸残基通过一个肽键连接而成的肽。
8.多肽(polypeptide):含十个氨基酸残基以上的肽。
9.氨基酸残基(residue):组成多肽的氨基酸在形成肽链时丢失了一分子水,肽链中的氨基酸分子已不完整,称为氨基酸残基(酰)。
10.二硫键(disulfide bond):肽链之间或肽链内部的两个半胱氨酸残基的巯基氧化后形成的共价相互作用力,有较高的强度。
11.离子键(ionic bond):又称盐键,是正电荷和负电荷之间的一种静电相互作用。
12.配位键(dative bond):由两个原子之间提供共用电子对所形成的共价键。
13.氢键(hydrogen bond):多肽链中的氮原子或氧原子的故对电子与氢原子间相互吸引而形成的键。
14.范德华力(Van der waal,s):一种普遍存在的作用力,是原子、基团或分子之间比较弱的、非特异性的作用力。
15.疏水作用力hydrophobic bond疏水基团或疏水侧链避开水分子而相互靠近聚集的作用力。
16.一级结构(primary structure):蛋白质多肽链中氨基酸的排列顺序。
17.二级结构(secondary structure):多肽链主链在一级结构的基础上进一步盘旋或折叠,从而形成有规律的构象。
18.三级结构(tertiary structure):球状蛋白质的多肽链在二级结构的基础上相互配置二形成特定的构象。
绪论掌握:生物化学、生物大分子和分子生物学的概念。
【复习思考题】1. 何谓生物化学?2. 当代生物化学研究的主要内容有哪些蛋白质的结构与功能掌握:蛋白质元素组成及其特点;蛋白质基本组成单位--氨基酸的种类、基本结构及主要特点;蛋白质的分子结构;蛋白质结构与功能的关系;蛋白质的主要理化性质及其应用;蛋白质分离纯化的方法及其基本原理。
【复习思考题】1. 名词解释:蛋白质一级结构、蛋白质二级结构、蛋白质三级结构、蛋白质四级结构、肽单元、模体、结构域、分子伴侣、协同效应、变构效应、蛋白质等电点、电泳、层析2. 蛋白质变性的概念及本质是什么有何实际应用?3. 蛋白质分离纯化常用的方法有哪些其原理是什么?4. 举例说明蛋白质结构与功能的关系核酸的结构与功能掌握:核酸的分类、细胞分布,各类核酸的功能及生物学意义;核酸的化学组成;两类核酸(DNA与RNA)分子组成异同;核酸的一级结构及其主要化学键;DNA 右手双螺旋结构要点及碱基配对规律;mRNA一级结构特点;tRNA二级结构特点;核酸的主要理化性质(紫外吸收、变性、复性),核酸分子杂交概念。
第三章酶掌握:酶的概念、化学本质及生物学功能;酶的活性中心和必需基团、同工酶;酶促反应特点;各种因素对酶促反应速度的影响、特点及其应用;酶调节的方式;酶的变构调节和共价修饰调节的概念。
第四章糖代谢掌握:糖的主要生理功能;糖的无氧分解(酵解)、有氧氧化、糖原合成及分解、糖异生的基本反应过程、部位、关键酶(限速酶)、生理意义;磷酸戊糖途径的生理意义;血糖概念、正常值、血糖来源与去路、调节血糖浓度的主要激素。
【复习思考题】1. 名词解释:.糖酵解、糖酵解途径、高血糖和糖尿病、乳酸循环、糖原、糖异生、三羧酸循环、活性葡萄糖、底物水平磷酸化。
2.说出磷酸戊糖途径的主要生理意义。
3.试述饥饿状态时,蛋白质分解代谢产生的丙氨酸转变为葡萄糖的途径。
4.试述三大能源物质在体内分解代谢产生CO2和H2O及ATP的主要途径。
5.简述6-磷酸葡萄糖在体内的来源、去路。
6.试述糖酵解和有氧氧化途径中ATP的生成过程。
7.什么是乳酸循环有何生理意义?8.简述糖酵解的生理意义。
9.简述血糖的来源、去路、正常值和体液调节?10.什么是底物水平磷酸化写出糖的有氧氧化中出现的底物水平磷酸化反应。
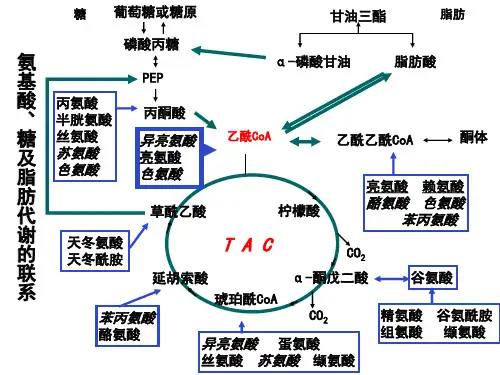
11.为什么Ⅰ型糖尿病患者可引起白内障第五章脂类代谢掌握:脂类的组成、基本结构构成;脂肪的动员;脂肪酸的b-氧化;酮体的生成及利用;胆固醇代谢;血脂的种类、血浆脂蛋白的分类、组成及结构;载脂蛋白的作用;血浆脂蛋白的生理功能。
【复习思考题】1. 名词解释:必需脂酸、脂肪动员、脂解激素、脂蛋白脂肪酶、抗脂解激素、卵磷脂胆固醇脂酰转移酶(LCAT)、LDL受体代谢途径、酮体、载脂蛋白、酰基载体蛋白(ACP)。
2. 什么是酮体酮体的代谢主要的生理意义是什么?3. 简述乙酰CoA在体内的来源和去路。
4. 简述脂类消化吸收过程中参与的物质及其作用。
5. 以1分子的软脂酸(16C)为例,说明脂酸在体内彻底氧化分解生成CO2、H2O 和ATP的过程。
6. 葡萄糖在体内是如何转变为脂肪的?7. 脂蛋白有哪两种分类方法各种血浆脂蛋白的功能是什么?8. 简述脂酸氧化分解的关键酶及其调控因素。
9. 写出胆固醇合成的原料、部位和关键酶。
胆固醇的主要生理作用是什么?10. 胆固醇在体内的代谢去路有哪些第六章生物氧化掌握:生物氧化的概念及生物学意义;呼吸链的概念,呼吸链中复合体及其他成分的作用;两条主要呼吸链的顺序组成;氧化磷酸化偶联部位及主要电子传递抑制剂的作用部位;底物水平磷酸化、氧化磷酸化、P/O比值的概念;ATP的生成和利用。
【复习思考题】1. 名词解释:氧化磷酸化、作用物水平磷酸化、呼吸链。
2. 说明体内能量的储存形式,如何区分能源物质的储备和高能化合物的储备?3. 举例说明体内ATP的生成方式。
4. 呼吸链中四种复合体各有何作用?5. 写出二种呼吸链的简单组成及排列顺序,说明磷酸化的偶联部位。
6. 在生物氧化过程中,CO2是通过什么方式生成的?7. 什么是P/O比值影响氧化磷酸化的因素有哪些第七章氨基酸代谢掌握:蛋白质的营养作用;氨基酸的脱氨基作用;a-酮酸的代谢;氨的代谢;一碳单位的代谢;甲硫氨酸与转甲基作用;芳香族氨基酸代谢的重要产物。
【复习思考题】1. 名词解释:氮平衡、嘌呤核苷酸循环、葡萄糖-丙氨酸循环、甲硫氨酸循环、鸟氨酸循环、一碳单位2. 试述体内氨基酸的代谢概况。
3. 体内氨基酸脱氨基方式有哪些各方式是怎样进行的?4. 试述体内氨的来源、运输形式和去路5. 简述血氨的来源与去路。
6. 试述体内尿素生成过程。
7. 简述高血氨症和氨中毒的发病机制。
8. 简述一碳单位的来源及生理意义。
第八章核苷酸代谢掌握:核苷酸的生物学功用;核苷酸(嘌呤核苷酸、嘧啶核苷酸)从头合成途径及补救合成途径的概念;嘌呤碱与嘧啶碱分解代谢的终产物。
【复习思考题】1. 名词解释:核苷酸从头合成、核苷酸补救合成。
2. 简述核苷酸的生物学功能。
3. 简述嘌呤核苷酸和嘧啶核苷酸从头合成的特点。
4. 简述痛风症的病因和治疗的生化机制。
5. 如果将氨甲喋呤加入到生长细胞的培养基中,能造成对DNA合成的抑制作用吗第九章物质代谢的联系与调节掌握:三级水平代谢调节,即细胞水平调节、激素水平调节和中枢神经系统主导的整体水平调节;酶的变构调节概念及酶的化学修饰概念、特点。
1. 名词解释:酶的变构调节、酶的化学修饰。
2.试述短期饥饿状态下,糖、脂、蛋白质在体内代谢的特点。
3.比较别构调节和化学修饰的特点。
4. 机体内物质代谢的特点有哪些第十章DNA的生物合成掌握:遗传学中心法则和扩大的中心法则、复制和半保留复制、反转录概念;参与的酶和因子(包括它们的功能)。
【复习思考题】1. 何谓DNA的复制什么是复制子(replicon),什么是复制体(replisome)?2. 什么是半不连续复制(semi-continuous、半保留复制(semi-conservative)什么是冈奇片段?3. 参与DNA复制的酶有哪些各起什么作用4. 什么是逆转录(reverse transcrition)?5. 什么是突变(mutation),突变的方式有哪些?6. 什么是DNA损伤(DNA damage),其修复方式(repair modes)有几种第十一章RNA的生物合成掌握:转录的概念;复制与转录的异同点;核酶概念、hnRNA转录后加工、修饰。
【复习思考题】1. 何谓转录(transcription),何为转录单元(transcription Unit).2. 转录与复制的异同点.3. 原核生物及真核生物启动子的特点.4. 不依ρ因子的终止子(ρ-dependent terinator)的结构特点.5. 何谓顺式作用元件(cis-acting elements),何为反式作用因子(trans-acting factor),并分别举例说明.6. 真核生物转录后修饰有几种方式?7. 什么是基因,什么是断裂基因(splitting gene)断裂基因是真核生物的真质标记(hall marker)吗?8. 何为核酶(ribozyme)第十二章蛋白质的生物合成掌握:翻译的概念,遗传密码的含义及特点,mRNA、tRNA和核蛋白在翻译过程中的作用。
1. 何为翻译( translation)参与翻译的RNA有几类,各起什么作用?2. 何为三联体密码(coden),三联体密码有什么基因特性?3. 三联体密码共有多少个编码氨基酸的密码子有几个起始密码子有哪几个终止密码有哪几个?4. 何为密码子的简并性(degeneracy)5. 何为顺反子(cistron),多顺反子(poly-cistron),单顺反子(mono-cistron)?6. 何为SD序列(S-D sequence)?7. 何为核糖体循环(ribosomal cycle),说说其基本过程.8. 原核生物蛋白质合成时,为什么会出现多聚核蛋白体(polysome)真核生物蛋白质合成时, 也会出现多聚核蛋白体(polysome)吗,为什么?9. 何为分子伴侣(molecular chaperon),它有什么功能?10. 何为信号肽(signal peptide) ,有什么结构特点和功能?11. 何为开放阅读框(opening reading fram,ORF)12. 何为分子折叠(Molecular folding)13. 简述蛋白质翻译后的加工过程(post-translational processing)第十三章基因表达调控掌握:基因、基因组、基因表达概念,操纵子的结构与功能,真核基因组结构特点,顺式作用元件,反式作用因子定义、类型,启动子或启动序列、增强子、沉默子和转录因子的含义。
【复习思考题】1. 何为基因(gene)、基因组(genome)和基因表达(gene expresstion).2. 原核生物基因组有什么特点,表达调控有什么特点?3. 真核生物基因组有什么特点,表达调控又有什么特点?4. 何为组成性基因表达(constitutive gene expression),何为诱导表达(inductive expression)。
5. cAMP在生物体内有什么作用。
6. 乳糖操纵子(lac operon)的结构是什么,其调控机理如何?7. 色氨酸操纵子(trp operon)的结构和调控机理如何真核生物会出现类似的调控机现吗,为什么?8. 什么是衰减子(attenuator)其结构上有什么特点?9. 基因的表达有哪几个水平涉及到哪些作用主要在哪一级上进行调控为什么第十四章基因重组与基因工程掌握:基因重组和基因工程的概念,细菌基因转移的接合作用、转化作用和转导作用,DNA克隆、限制性核酸内切酶、基因载体、cDNA文库、基因组DNA文库的概念,目的基因的来源,基因载体的类型,重组DNA技术的操作程序。
【复习思考题】1. 何为同源重组,其特点是什么holliday中间体是什么?2. 什么是接合作用(conjugation)、转化作用(transformation)、转导(transduction)3. 何为转座常见的两种转座子是什么组成上有什么特点?4. 什么是基因工程(genetic engineering),基因工程包括哪些基因步骤?5. 基因工程的手术刀-限制性核酸内切酶在识别序列和切割上有什么特点?6. 目的基因获得的方法有哪些?7. 作为基因工程的载体应具有哪些特点第十五章细胞信息传递掌握:信号分子的种类,第二信使的类型,受体和配体的结合特点,膜受体介导的信息传导的七条途径。