01年度内部体系审核计划表
- 格式:xls
- 大小:16.00 KB
- 文档页数:4


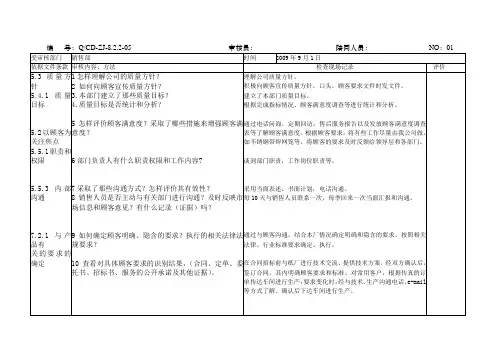
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
13
内部质量体系审核检查表
编号:Q/CD-ZJ-8.2.2-05 审核员:陪同人员: NO:14
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表。

浙江天成机械有限公司内部审核资料2020年2月内审实施计划内审会议签到表内审实施计划浙江天成机械有限公司内审实施计划浙江天成机械有限公司内审检查表编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:高管层审核员:B 审核日期:2020年2月2日注:判定一列合格划“√”,不合格说明是一般还是严重。
浙江天成机械有限公司编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:高管层审核员:B 审核日期:2020年2月2日注:判定一列合格划“√”,不合格说明是一般还是严重。
浙江天成机械有限公司编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:高管层审核员:B 审核日期:2020年2月2日注:判定一列合格划“√”,不合格说明是一般还是严重。
浙江天成机械有限公司编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:高管层审核员:B 审核日期:2020年2月2日注:判定一列合格划“√”,不合格说明是一般还是严重。
浙江天成机械有限公司编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:高管层审核员:B 审核日期:2020年2月2日注:判定一列合格划“√”,不合格说明是一般还是严重。
浙江天成机械有限公司内审检查表编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:高管层审核员:B 审核日期:2020年2月2日注:判定一列合格划“√”,不合格说明是一般还是严重。
浙江天成机械有限公司内审检查表编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:高管层审核员:B 审核日期:2020年2月2日浙江天成机械有限公司编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:办公室审核员:A 审核日期:2020年2月2日注:判定一列合格划“√”,不合格说明是一般还是严重。
浙江天成机械有限公司编号:QR-8.2.2-03 版次/修订次:A/0受审核部门:办公室审核员:A 审核日期:2020年2月2日注:判定一列合格划“√”,不合格说明是一般还是严重。

新版三体系内审检查表全套2022版某某某某某有限责任公司内审资料2022年08月内审首(末)次会议签到表2022年内部审核实施计划JL-12-01目的:评价管理体系与GB/T19001-2022、GB/T24001-2022和GB/T28001-2022标准的符合程度;评价管理体系整体的持续有效性。
范围:本组织管理体系覆盖的部门/场所的生产/服务/活动依据:GB/T19001-2022、GB/T24001-2022和GB/T28001-2022标准、管理手册、程序文件、作业文件、适用法律法规审核组:组长:某某某某组员:某某某某某审核时间:2022/某某/某某-2022/某某/某某某首次会议:2022/某某/某某某08:00-08:30,管理层、各部门负责人参加与管理层交换意见/末次会议:2022/某某某/某某某某16:30-17:00,参加人员同上日期时间部门及要素管理层及职业健康安全事务代表:08:30某日至12:00Q:4.1/4.2/4.3/4.4/5.1.1/5.1.2/5.2/5.3/6.1/6.2/6.3/7.1.1/7.4 /9.1.1/9.3/10.1/10.3;E:4.1/4.2/4.3/4.4/5.1/5.2/5.3/6.1/6.1.3/6.2/7.1/7.4/9.3/10.1/10. 3;S:4.1/4.2/4.3.2/4.3.3/4.4.1/4.6;办公室:Q:6.2/5.3/4.1/4.2/6.1/6.3/7.1.2/7.1.3/7.1.4/7.1.6/7.2/7.3/7.4/14 :007.5.1/7.5.2/7.5.3/9.1.1/9.1.2/9.1.3/9.2/10.2;某日至E:6.2/5.3/4.1/4.2/6.1/6.1.2/6.1.3/6.1.4/7.2/7.3/7.4/7.5.1/7.5.S: 4.4.1/4.3.1/4.3.2/4.3.3/4.4.2/4.4.3/4.4.4/4.4.5/4.4.6/4.4.7/4.5.1/4.5.2/4.5.3/4.5.4/4.5.5;市场部:08:00Q:6.2/5.3/8.1/8.2.1/8.2.2/8.2.3/8.2.4/8.4.1/8.4.2/8.4.3/8.5 .1/某日至8.5.2/8.5.3/8.5.4/8.5.5/8.5.6/8.6/8.7/9.1.2;S:4.4.1/4.3.1/4.4.6;15:00财务部:某日至E:5.3/6.1.2/6.1.4/8.1;某某某16:00S:4.4.1/4.3.1/4.4.6;某某某15:00E:6.2/5.3/6.1.2/6.1.4/8.1;某某某某18:002/7.5.3/8.1/8.2/9.1/9.2/10.2;某某某某审核员11日16:30末次会议至17:00全体Q/E:6.2(S:4.3.3);Q/E:5.3(S:4.4.1);E:8.1(4.4.6),在各部门均应审到编制:某某某某批准:某某某某某日期:日期:内部审核检查表审核员审核部门涉及条款管理层审核内容受审核人日期审核记录JL -12-02结论Q/E:4.4公司的概况及体系的策参加人员:总经理:某某某;管代:某某某,职业健康安全事务代表:某某某符合S:4.4.1划、建立和实施过程;1)总经理介绍公司概况:公司成立于某某某某某,现有员工某某某某人,其中技术人员某某某某企业的组织机构、职位于某某某某某某,人,公司从事某某某某某某某。
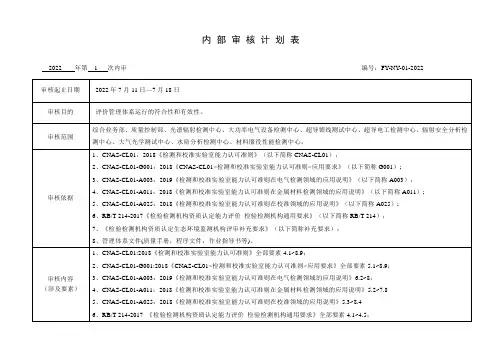

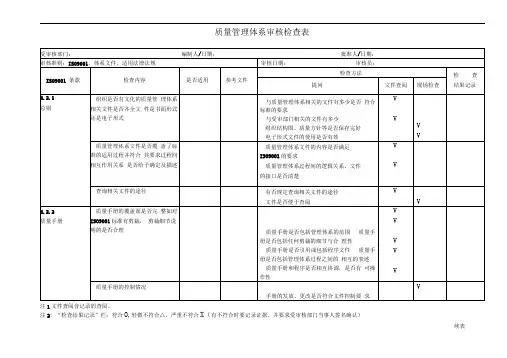
质量管理体系审核检查表注1文件查阅含记录的查阅。
注2: “检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)续表注2: “检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注2:“检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
注2: “检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
注2: “检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
注2: “检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
注2: “检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
注2: “检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注2:“检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
注2: “检查结果记录”栏:符合O,轻微不符合△,严重不符合X(有不符合时要记录证据,并要求受审核部门当事人签名确认)注1文件查阅含记录的查阅。
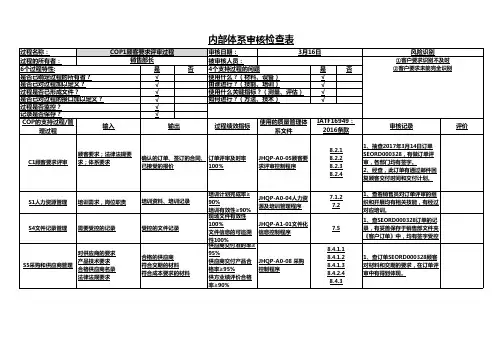

质量体系内部审核程序1 目的对检验科质量体系的有效性、符合性及适合性进行全面的、系统的审核,重点审核对患者医护有关键意义的领域,对不符合工作进行纠正和记录,制定纠正措施和/或预防措施,确保本检验科的质量持续符合质量体系各文件及CNAS-CL02:2008《医学实验室质量和能力认可准则》标准的要求,并保持其有效性。
2 范围适用于本检验科内审活动全过程。
3 职责3.1 质量负责人a)制定内审计划,组织并主持内部审核;b)成立内审组,指定内审组长;c)监督内审实施,批准内审报告。
3.2 内审组长a)组织内审员编制内审检查表,按计划实施内审;b)编写内审报告,向质量负责人上报内审报告。
3.3 内审员a)编制被审核组的内审检查表,提交所审核组的内审小结报告及不符合工作报告,协助内审组长编写内审报告;b)跟踪验证内审后采取的纠正措施和预防措施的有效性,验证有效后提出修改相关文件建议。
3.4 检验科其他人员a)在其工作范围内协助组织和进行内审;b)实施纠正措施和预防措施。
3.5 文档管理员负责有关记录的归档保存。
4 工作程序4.1 制定年度内审计划检验科规定每年至少进行一次内审,至少每12个月进行一次,特殊情况下允许增加附加审核。
质量负责人每年年初制定本年度《年度质量体系内审计划表》,明确审核依据、审核范围、审核时间。
并将《年度质量体系内审计划表》发放至各专业组。
4.2 建立内审组根据年度内审计划,于内审前两周组成内审小组,由质量负责人指定内审组组长。
组长协助质量负责人选择内审员,组成内审组。
内审员应经过CNAS-CL02:2008标准培训或已经过内审培训且具备相应能力,具有一定资格且与被审核的工作无直接责任的人担任。
4.3 内审准备4.3.1 编制实施计划内审组长制订当次《质量体系内审实施计划表》。
计划内容包括:审核目的、范围、依据、内审员分工、被审核对象及日程安排等,重点审核对患者医护有关键意义的领域。
计划由质量负责人批准后发至被审核专业组并实行。
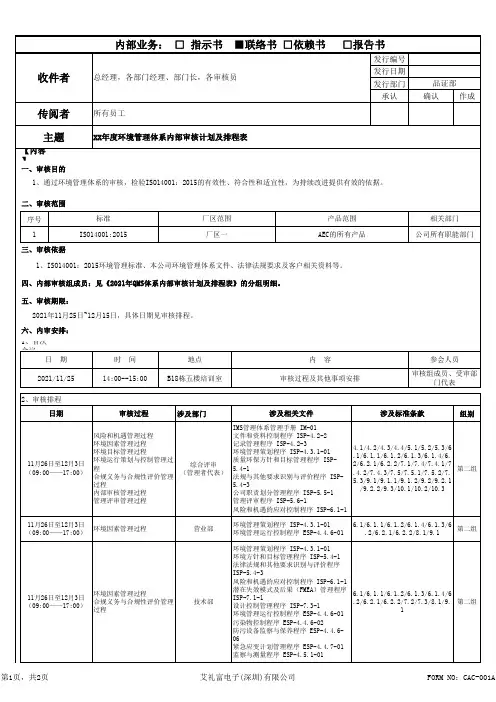
QHSE管理体系内部审核检查表单位:编号:迎审单位参加人员日期审核组长审核员审核标准要素QMS:EMS:OHSMS:标准要素名称审核内容及方法审核记录审核判定备注4.QHSE管理体系4.1 总要求1.询问如何运用过程方法建立实施保持QHSE管理体系。
2.是否对过程进行了删减,删减是否合理。
3.是否识别了外包过程,外包过程如何控制。
4.2 文件要求4.2.1 总则4.2.2 管理手册1.查证是否建立了包括管理手册、程序、作业文件、记录在内的QHSE体系文件。
2.查证QHSE体系文件是否覆盖并满足Q/SY 2.2标准全部条款的要求。
4.2.3 文件控制4.2.3 文件控制1.询问负责人文件控制职责,与相关部门的接口关系是否清楚2.查阅文件清单,抽查3-6份文件,查证:2.1 发布前是否经过批准,文件是否充分适宜?2.2 文件是否保持清晰并易于识别(包括修订状态)?2.3 核查发放范围及发放记录,是否使用场所得到了适用文件的有效版本? 2.4 是否识别了与质量、环境和安全有关的全部外来文件(包括法律法规),并对其进行了管理控制?2.5 作废文件的回收记录,可否保证作废文件的非预期使用?作废文件保留是否作了标识?3.询问对文件评审、更新、再批准的规定,查l-3份更改文件,核查规定执行情况。
4.2.4 记录控制4.2.4 记录控制1.询问负责人记录控制职责,与相关部门的接口关系是否清楚。
2.询问是否形成了QHSE体系记录清单,是否包括了QHSE体系要求的所有记录,否规定了各种记录的保存期限。
3.管理部门及其他部门各种类型的记录3-6份,核查标识情况,填写是否清晰?是否易于识别?4.询问对记录的收集、归档、检索,是否符合规定要求?记录贮存条件是否适宜?5.询问对记录借阅、复印、处置的管理。
4.3法律法规及其他要求4.3法律法规及其他要求1.询问负责人法律法规及其他要求职责,与相关部门的接口关系是否清楚。
2.问主管部门建立了哪些法律法规和其他要求的获取渠道,获取的方式和频次,查询各获取渠是否满足要求。
ISO9001内部审核※※※※※※※※※此文件未经批准﹐不准复印※※※※※※※※※※1.0目的通过内部品质体系审核活动,验证各项品质活动与相关结果是否符合计划安排进度,而判断品质体系的有效性。
2.0范围适用于本公司内部品质体系审核过程。
3.0权责管理者代表制定本程序,相关部门配合执行。
4.0定义(无)5.0内容5.1审核计划:管理者代表负责编制《年度内审计划》,报管理者代表批准,对品质体系全部要素的执行情况进行审核,每年至少进行两次,需要时经管理者代表或总经理批准,可以增加审核次数。
5.2审核人员:根据年度内审计划,由管理者代表指定负责具体范围、项目的审核组长及审核成员,由公司内审员担任,审核组长及成员必须与被审核的部门无直接关系,内审员由管理者代表在满足下述要求人员中任命:A.必须经专业机构培训,取得内部品质体系审核员培训合格证书;B.对公司品质体系运作有一定的了解;5.3审核准备工作A.审核组长制定《内审实施计划》,经管理者代表批准后通知受审核部门负责人。
B.审核小组调阅品质手册、相关程序文件及其它文件。
C.审核小组编制《内审检查表》,由审核组长审核。
5.4实施审核A.由管理者代表组织召开一次简短的首次会议,说明本次审核活动的目的、内容和过程安排。
B.进行现场审核,搜集客观证据。
C.分析观察结果,确定不合格项填写《内审不符合报告》。
D.召开末次会议,宣布审核结果,所有《内审不符合报告》必须经受审核部门负责人确认后,由审核组长批准。
5.5审核报告A.每次审核活动,审核组长应编写《内审报告》,在审核结束两个星期内完成。
B.审核报告应阐述所审核范围的品质体系运行情况,并作出总的结论。
C.审核报告应交管理者代表审批,然后分发给受审核部门负责人。
5.6决定和措施:受审核部门负责人,应根据报告的结论、《内审不符合报告》,对不合格项应及时采取纠正措施,按《改进程序》执行。
5.7跟踪验证:内审组负责组织对纠正措施的跟踪验证,跟踪验证工作以“谁审核,谁跟踪”的原则进行,由审核组长执行跟踪验证结果,呈交管理者代表审批。
实验室质量管理体系内部审核检查表(1)实验室质量管理体系内部审核检查表二Ο一五年十二月实验室质量管理体系内部审核检查表4 管理要求4.1组织4.1.1 实验室是单位法人是否有相应的单位法人证明和合法的服务范围证明?实验室不是单位法人是否有母体单位的法人证书和合法的服务范围证明?是否有由母体发布的实验室建制的批准文件?主要负责人是否有正式书面任命,并授权独立进行检测和校准工作?4.1.2 是否明确承诺并切实履行职责,保证从事的检测和校准活动满足认可准则和外部有关各方的要求?4.1.3 所有场所进行的检测和校准活动是否按实验室的管理体系要求进行?是否有管理非固定场所进行检测和校准活动文件?4.1.4. 若实验室的母体不是从事检测和校准活动的组织,是否能排除潜在的利益冲突?4.1.5 实验室a)管理和技术人员是否有履行其职责的权力和资源?b)是否有措施保证管理者和员工免受来自内外部的任何可能影响工作质量的压力和影响?c)是否有程序保护客户的机密信息和技术所有权d) 是否有政策和程序防止卷入降低其能力、公正性、判断力或工作诚实性方面的可信度的活动?e)是否用组织结构图明确了内外部关系?f)是否规定了对检测和/或校准质量有影响的所有管理、操作和核查人员的职责、权力和相互关系?(包括最高管理者及其副手、技术管理者、质量主管、部门及其负责人、监督员、内深远、复核员、检校员、取样员、安全员、设备及计量管理员、样品管理员、档案员等。
)g)是否任命了熟悉各项方法、程序、目的和结果评价的人员担任监督员并对检测和校准工作进行了充分监督?h)是否有技术管理者对技术运作和确保运作质量所需的资源全面负责?i)是否指定了质量主管并保证管理体系在任何时候都能得到实施和执行?他是否能最高管理者直接联系?j)是否为最高管理者、技术管理者、质量主管和授权签字人等指定了代理人?①本核查表依据认可准则CNAL/AC01要求编制,其条款编号与准则一致;②当活动被判定为符合项记为Y,不符合项时记为“N”,观察项记为“Y ”,条款不适用记为“NA”。