王镜岩核酸的物理化学性质
- 格式:ppt
- 大小:2.84 MB
- 文档页数:38
![[王镜岩生物化学第三版笔记]第六章 核酸](https://img.taocdn.com/s1/m/356f964aa6c30c2259019eb8.png)
第六章 核酸核酸是遗传物质1868年瑞士Miesher.从脓细胞的细胞核中分离出可溶于碱而不溶于稀酸的酸性物质。
间接证据:同一种生物的不同种类的不同生长期的细胞,DNA含量基本恒定。
直接证据:T2噬菌体DNA感染E.coli用35S标记噬菌体蛋白质,感染E.coli,又用32P标记噬菌体核酸,感染E.coliDNA、RNA的分布(DNA在核内,RNA在核外)。
第一节核酸的化学组成核酸是一种线形多聚核苷酸,基本组成单位是核苷酸。
结构层次:核酸核苷酸组成核酸的戊糖有两种::D-核糖和D-2-脱氧核糖,据此,可以将核酸分为两种:核糖核酸(RNA)和脱氧核糖核酸(DNA)P330 表5-1 两类核酸的基本化学组成一、 碱基1. 嘌呤碱:腺嘌呤鸟嘌呤2. 嘧啶碱:胞嘧啶尿嘧啶胸腺嘧啶P331 结构式3. 修饰碱基植物中有大量5-甲基胞嘧啶。
E.coli噬菌体中,5-羟甲基胞嘧啶代替C。
稀有碱基:100余种,多数是甲基化的产物。
DNA由A、G、C、T碱基构成。
RNA由A、G、C、U碱基构成。
二、 核苷核苷由戊糖和碱基缩合而成,糖环上C1与嘧啶碱的N1或与嘌呤碱的N9连接。
核酸中的核苷均为β-型核苷P332 结构式腺嘌呤核苷胞嘧啶脱氧核苷DNA 的戊糖是:脱氧核糖RNA 的戊糖是:核糖三、 核苷酸核苷中戊糖C3、C5羟基被磷酸酯化,生成核苷酸。
1、构成DNA、RNA的核苷酸P333表5-32、细胞内游离核苷酸及其衍生物①核苷5’-多磷酸化合物A TP、GTP、CTP、ppppA、ppppG在能量代谢和物质代谢及调控中起重要作用。
②环核苷酸cAMP(3’,5’-cAMP) cGMP(3’,5’-cGMP)它们作为质膜的激素的第二信使起作用,cAMP调节细胞的糖代谢、脂代谢。
③核苷5’多磷酸3’多磷酸化合物ppGpp pppGpp ppApp④核苷酸衍生物HSCoA、 NAD+、NADP+、FAD等辅助因子。
GDP-半乳糖、GDP-葡萄糖等是糖蛋白生物合成的活性糖基供体。

王镜岩《生物化学》第三版考研笔记(提要版本071页)内容提要:1、氨基酸与蛋白质氨基酸分类:常见蛋白质氨基酸,不常见蛋白质氨基酸,非蛋白氨基酸;氨基酸的酸碱化学,氨基酸两性解离,氨基酸的等电点;氨基酸的旋光性和紫外吸收。
蛋白质的共价结构:蛋白质的化学组成和分类,蛋白质功能,蛋白质的形状和大小,蛋白质构象和组织层次。
肽:肽键结构,肽的物理化学性质,活性多肽。
蛋白质一级结构测定:Sanger试剂,DNS及Edman降解,二硫桥位置确定。
蛋白质的三维结构:XRD原理;稳定蛋白质三维结构的作用力,肽平面和两面角;蛋白质的二级结构:α-螺旋,β-折叠片,β-转角;超二级结构和结构域;球状蛋白的三级结构;亚基缔合和四级结构。
蛋白质结构与功能的关系:肌红蛋白和血红蛋白的结构与功能,镰刀状细胞贫血病;免疫球蛋白。
蛋白质的分离、纯化和表征:蛋白质分子量测定,沉降分析及沉降系数,沉降系数单位,凝胶过滤及SDS-PAGE法测分子量;蛋白质的沉淀;电泳:区带电泳、薄膜电泳、等电聚焦电泳、毛细管电泳。
2、酶和辅酶酶催化作用特点:反应温合、高效、专一、可调节控制;酶活性调节控制:调剂酶浓度、激素调节、反馈抑制调节、抑制剂激活剂调节、别构调控、酶原激活,可逆共价修饰;酶的化学本质及其组成,辅酶和辅基,单体酶,寡聚酶和多酶复合体。
酶的命名和分类:习惯命名法;国际系统命名法及酶的编号,六大类酶的特征。
酶的专一性:“锁与钥匙”学说;诱导楔合假说;过渡态理论,过渡态类似物与医药和农药的设计,催化抗体。
酶的活力测定:酶活力单位,比活力。
酶工程:化学修饰酶,固定化酶,人工模拟酶。
酶促反应动力学:底物浓度与酶反应速度,酶促反应动力学方程式及推导,米氏常数的意义和求法。
酶的抑制作用:不可逆抑制和可逆抑制及动力学判断,一些重要的抑制剂,有机磷农药和磺胺药作用机制。
温度、PH、激活剂对酶反应影响。
酶的作用机制:酶活性部位及研究方法;影响酶催化效率的有关因素:临近和定向效应、底物形变和诱导契合、酸碱催化、共价催化、金属离子催化、多元催化和协同效应、微环境影响;溶菌酶作用机制和胰凝乳蛋白酶。

第一章蛋白质化学I 主要内容一、蛋白质的生物学意义蛋白质是生物体内最为重要的有机化学物质之一,它几乎参与了生物体所有的生命活动,如生物体的构成、机体的运动、化学催化、机体的免疫保护、生物遗传信息的传递与表达等等,可以说蛋白质是一切生命活动的重要支柱,没有蛋白质就没有生命现象的存在,因此,蛋白质化学是生物化学中一个重要的研究方面。
二、蛋白质的元素组成蛋白质是由C、H、O、N、S等几种元素构成,其中C 50-55%、H 6-8%、O 20-30%、 N 15-17%、S 0-4%,且含量基本相同,因此通过测定蛋白质样品中元素含量就可以推测出样品中蛋白质的含量。
三、蛋白质的氨基酸组成(一)氨基酸的结构及特点一般的蛋白质都是由20种氨基酸构成,这些氨基酸都是在蛋白质的合成过程中直接加进去的,并有专门的遗传密码与其对应,这些构成蛋白质的基本氨基酸称为天然氨基酸(通用氨基酸)。
天然氨基酸具有如下特点:1. 20种天然氨基酸均有专门的遗传密码与其对应,它们在蛋白质的合成中是直接加上去的。
2. 除甘氨酸外,其它氨基酸至少含有一个手性碳原子。
3. 除脯氨酸外,其它氨基酸均为 -氨基酸。
4. 氨基酸虽有D、L–型之分,但存在于天然蛋白质中的氨基酸均为L-型氨基酸。
(二)天然氨基酸的分类1.根据氨基酸分子中氨基和羧基的相对数量进行分类2.根据氨基酸分子结构分类3.根据氨基酸侧链基团极性分类氨基酸根据其侧链基团在近中性的pH条件下是否带电荷以及带电荷的种类分成四类:非极性氨基酸、极性不带电荷氨基酸、极性带正电荷氨基酸、极性带负电荷氨基酸。
(三)稀有蛋白质氨基酸这部分主要是指虽然在蛋白质中有所存在,含量却较少的一类氨基酸。
蛋白质中的稀有氨基酸是在蛋白质合成后的加工过程中通过化学的方法在天然氨基酸的基础上增加某些基团而形成的。
(四)非蛋白质氨基酸非蛋白质氨基酸是细胞中不参与天然蛋白质合成的一类氨基酸。
(五)氨基酸的重要理化性质1. 一般理化性质2. 氨基酸的酸碱性质与等电点3. 氨基酸的主要化学性质(1)茚三酮反应(2)桑格反应(Sanger reaction)(3)埃德曼反应(Edman reaction )4. 氨基酸的光学性质由于氨基酸分子中除甘氨酸外都有不对称碳原子的存在,因此,天然氨基酸中除甘氨酸外均有旋光现象的存在。


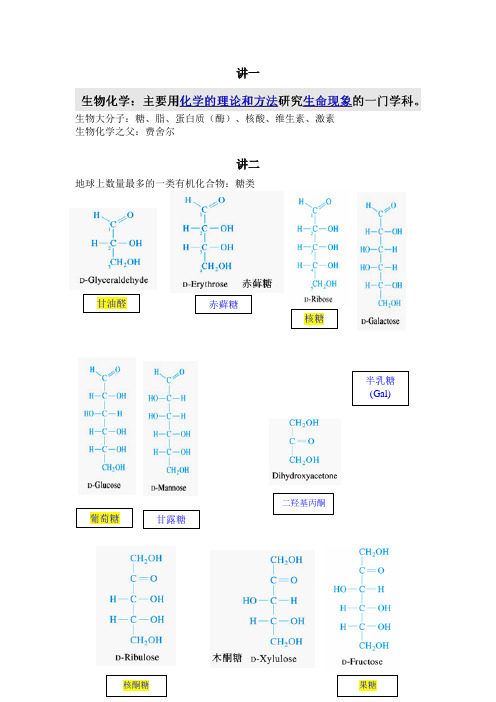
赤藓糖葡萄糖甘油醛核糖甘露糖半乳糖(Gal)((Gal)二羟基丙酮核酮糖果糖讲一生物大分子:糖、脂、蛋白质(酶)、核酸、维生素、激素生物化学之父:费舍尔讲二地球上数量最多的一类有机化合物:糖类α和β吡喃葡萄糖(羟基在下为α型,在上为β型)糖原高度分支的生理意义:第三章、蛋白质20种氨基酸英文名等电点掌握氨基酸的用途、现象DNFB法PITCCys半胱氨酸Ellman反应,DTNB,二硫硝基苯甲酸Ellman反应(二硫硝基苯甲酸,DTNB)Cys与二硫硝基苯甲酸(DTNB) 或称Ellman 试剂发生硫醇-二硫化物交换反应。
反应中1 分子的Cys引起1分子的硫硝基苯甲酸的释放。
它在pH 8.0 时, 在412nm 波长处有强烈的光吸收, 因此可利用分光光度法定量测定-SH。
肽平面(酰胺平面)——由肽键周围的6个原子组成的刚性平面3.6蛋白质的纯化注:用尽可能少的步骤、尽可能短的时间。
1.前处理阶段物理法——冻融法,超声波法,均浆法,研磨法等。
酶裂解法——就是利用水解酶将细胞壁和细胞膜消化的方法,常用的水解酶有溶菌酶、葡聚糖酶、蛋白酶、糖苷酶、壳多糖酶、细胞壁溶解酶等。
其中溶菌酶主要对细菌类有作用,其他酶对酵母作用显著。
2.粗分级/粗分离根据蛋白质的①溶解性质、②大小不同、③带电状态不同/电荷多少④净化方法根据与其他化合物相互作用的蛋白质(部分蛋白质对..有特定的..)②:凝胶过滤层析常用凝胶过滤介质Sephadex:交联葡聚糖,是采用环氧氯丙烷作交联剂将右旋葡聚糖交联而成。
干粉容易膨胀,在水、盐溶液、有机溶液、碱和弱酸中化学性质稳定,可高压灭菌。
高交联度的Sephadex,其颗粒坚硬,适于高流速下操作。
Sephacryl : 烯丙基葡聚糖同N、Nˊ—甲叉双丙烯酰胺共价交联而成。
颗粒坚硬,性质比Sephadex更为稳定,可高压灭菌,在pH3~11条件下稳定,可用有机溶剂洗脱,也可用SDS、尿素及盐酸胍洗脱。
第一章糖第一节概述一、糖的命名糖类是含多羟基的醛或酮类化合物,由碳氢氧三种元素组成的,其分子式通常以Cn(H2O)n 表示。
因为一些糖分子中氢和氧原子数之比往往是2:1,与水相同,过去误认为此类物质是碳与水的化合物,所以称为"碳水化合物"(Carbohydrate)。
实际上这一名称并不确切,如脱氧核糖、鼠李糖等糖类不符合通式,而甲醛、乙酸等虽符合这个通式但并不是糖。
只是"碳水化合物"沿用已久,一些较老的书仍采用。
我国将此类化合物统称为糖,而在英语中只将具有甜味的单糖和容易的寡糖称为糖(sugar)。
二、糖的分类按照分子的构成,糖可分为单糖、寡糖、多糖、结合糖和衍生糖。
1.单糖单糖是不能水解为更小分子的糖。
葡萄糖,果糖都是常见单糖。
按照羰基在分子中的位置,单糖可分为醛糖和酮糖。
按照碳原子数目,可分为丙糖,丁糖,戊糖,己糖和庚糖。
2.寡糖寡糖由2-6个单糖分子构成,其中以双糖最普遍。
寡糖和单糖都可溶于水,多数有甜味。
3.多糖多糖由多个单糖聚合而成,又可分为同聚多糖和杂聚多糖。
同聚多糖由同一种单糖构成,杂聚多糖由两种以上单糖构成。
4.结合糖糖链与蛋白质或脂类物质构成的复合分子称为结合糖。
其中的糖链普通是杂聚寡糖或杂聚多糖。
如糖蛋白,糖脂,蛋白聚糖等。
5.衍生糖由单糖衍生而来,如糖胺、糖醛酸等。
三、糖的分布与功能1.分布糖在生物界中分布很广,几乎所有的动物,植物,微生物体内都含有糖。
糖占植物干重的80%,微生物干重的10-30%,动物干重的2%。
糖在植物体内起着重要的结构作用,而动物则用蛋白质和脂类代替,所以行动更灵便,适应性强。
动物中惟独昆虫等少数采用多糖构成外骨胳,其形体大小受到很大限制。
在人体中,糖主要以三种形式存在:(1)以糖原形式贮藏在肝和肌肉中。
糖原代谢速度很快,对维持血糖浓度衡定,满意机体对糖的需求有重要意义。
(2)以葡萄糖形式存在于体液中。
细胞外液中的葡萄糖是糖的运输形式,它作为细胞的内环境条件之一,浓度相当衡定。
第六章核酸核酸是遗传物质1868年瑞士Miesher.从脓细胞的细胞核中分离出可溶于碱而不溶于稀酸的酸性物质。
间接证据:同一种生物的不同种类的不同生长期的细胞,DNA含量基本恒定。
直接证据:T2噬菌体DNA感染E.coli用35S标记噬菌体蛋白质,感染E.coli,又用32P标记噬菌体核酸,感染E.coliDNA、RNA的分布(DNA在核内,RNA在核外)。
第一节核酸的化学组成核酸是一种线形多聚核苷酸,基本组成单位是核苷酸。
结构层次:核酸核苷酸组成核酸的戊糖有两种::D-核糖和D-2-脱氧核糖,据此,可以将核酸分为两种:核糖核酸(RNA)和脱氧核糖核酸(DNA)P330 表5-1 两类核酸的基本化学组成一、碱基1. 嘌呤碱:腺嘌呤鸟嘌呤2. 嘧啶碱:胞嘧啶尿嘧啶胸腺嘧啶P331 结构式3. 修饰碱基植物中有大量5-甲基胞嘧啶。
E.coli噬菌体中,5-羟甲基胞嘧啶代替C。
稀有碱基:100余种,多数是甲基化的产物。
DNA由A、G、C、T碱基构成。
RNA由A、G、C、U碱基构成。
二、核苷核苷由戊糖和碱基缩合而成,糖环上C1与嘧啶碱的N1或与嘌呤碱的N9连接。
核酸中的核苷均为β-型核苷P332 结构式腺嘌呤核苷胞嘧啶脱氧核苷DNA 的戊糖是:脱氧核糖RNA 的戊糖是:核糖三、核苷酸核苷中戊糖C3、C5羟基被磷酸酯化,生成核苷酸。
1、构成DNA、RNA的核苷酸P333表5-32、细胞内游离核苷酸及其衍生物①核苷5’-多磷酸化合物A TP、GTP、CTP、ppppA、ppppG在能量代谢和物质代谢及调控中起重要作用。
②环核苷酸cAMP(3’,5’-cAMP)cGMP(3’,5’-cGMP)它们作为质膜的激素的第二信使起作用,cAMP调节细胞的糖代谢、脂代谢。
③核苷5’多磷酸3’多磷酸化合物ppGpp pppGpp ppApp④核苷酸衍生物HSCoA、NAD+、NADP+、FAD等辅助因子。
GDP-半乳糖、GDP-葡萄糖等是糖蛋白生物合成的活性糖基供体。
教学目标:1.掌握蛋白质的概念、重要性和分子组成。
2.掌握α-氨基酸的结构通式和20种氨基酸的名称、符号、结构、分类;掌握氨基酸的重要性质;熟悉肽和活性肽的概念。
3.掌握蛋白质的一、二、三、四级结构的特点及其重要化学键。
4.了解蛋白质结构与功能间的关系。
5.熟悉蛋白质的重要性质和分类第一节蛋白质的分子组成一、蛋白质的元素(化学)组成主要有 C(50%~55%)、H(6%~7%)、O(19%~24%)、N(13%~19%)、S(0%~4%)。
有些蛋白质还含微量的P、Fe、Cu、Zn、Mn、Co、Mo、I等。
各种蛋白质的含氮量很接近,平均为16%。
因此,可以用定氮法来推算样品中蛋白质的大致含量。
每克样品含氮克数×6.25×100=100g样品中蛋白质含量(g%)二、蛋白质的基本组成单位——氨基酸蛋白质在酸、碱或蛋白酶的作用下,最终水解为游离氨基酸(amino acid),即蛋白质组成单体或构件分子。
存在于自然界中的氨基酸有300余种,但合成蛋白质的氨基酸仅20种(称编码氨基酸),最先发现的是天门冬氨酸(1806年),最后鉴定的是苏氨酸(1938年)。
(三)氨基酸的重要理化性质1.一般物理性质α-氨基酸为无色晶体,熔点一般在200 oC以上。
各种氨基酸在水中的溶解度差别很大(酪氨酸不溶于水)。
一般溶解于稀酸或稀碱,但不能溶解于有机溶剂,通常酒精能把氨基酸从其溶液中沉淀析出。
芳香族氨基酸(Tyr、Trp、Phe)有共轭双键,在近紫外区有光吸收能力,Tyr、Trp的吸收峰在280nm,Phe在265 nm。
由于大多数蛋白质含Tyr、Trp残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速简便的方法。
2.两性解离和等电点(isoelectric point, pI)氨基酸在水溶液或晶体状态时以两性离子的形式存在,既可作为酸(质子供体),又可作为碱(质子受体)起作用,是两性电解质,其解离度与溶液的pH有关。