2018届高考化学认识有机化合物有机化合物的结构特点有机化合物中碳原子的成键特点(1)练习
- 格式:doc
- 大小:51.50 KB
- 文档页数:3

2017春高中化学第1章认识有机化合物第2节有机化合物的结构特点(第1课时)有机化合物中碳原子的成键特点课堂达标验收新人教版选修5编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017春高中化学第1章认识有机化合物第2节有机化合物的结构特点(第1课时)有机化合物中碳原子的成键特点课堂达标验收新人教版选修5)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017春高中化学第1章认识有机化合物第2节有机化合物的结构特点(第1课时)有机化合物中碳原子的成键特点课堂达标验收新人教版选修5的全部内容。
有机化合物中碳原子的成键特点1.下列说法正确的是错误!( A )A.碳骨架为的烃的结构简式为(CH3)2C==CH2B.有机物分子里一定既有非极性键也有极性键C.有的烃分子中,一个碳原子形成3个共价键D.乙烷的键线式为2.(2016·经典习题选萃)下列结构式从成键情况看不合理的是错误!( D )3.下列烃的结构简式代表物质的种数是错误!( B )A.5种B.3种C.4种D.2种4.下面是几种烃的球棍模型(黑球表示碳原子,氢原子省略):导学号 46302048(1)属于烷烃的有__B、D__(填字母).(2)分子中氢原子数最少的是__E、F__(填字母)。
(3)属于烯烃的是__A、C、G__(填字母),并写出其结构简式:CH3CH2CH===CH2、CH3CH===CHCH3、(CH3)2C===CH2。
解析:分析成键情况,B、D中全部为C—C单键的链状烃,属于烷烃,分子式是C4H10.H是C-C单键的环状烃,属于环烷烃,H分子式是C4H8;A、C、G含C===C双键,属于烯烃,分子式是C4H8;E、F中含C≡C叁键,分子式是C4H6,氢原子数最少。

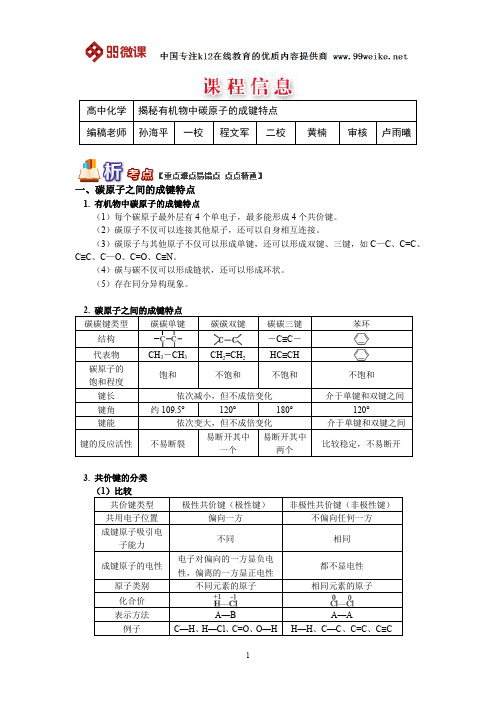
一、碳原子之间的成键特点1. 有机物中碳原子的成键特点(1)每个碳原子最外层有4个单电子,最多能形成4个共价键。
(2)碳原子不仅可以连接其他原子,还可以自身相互连接。
(3)碳原子与其他原子不仅可以形成单键,还可以形成双键、三键,如C—C、C=C、C≡C、C—O、C=O、C≡N。
(4)碳与碳不仅可以形成链状,还可以形成环状。
(5)存在同分异构现象。
CH3-CH CH2=CH3. 共价键的分类A—B A—A(2)极性键的强弱①取决于成键原子吸引电子能力的相对强弱,即非金属性的相对强弱,一般来说,差别越大,极性越强。
吸引电子能力强弱常用元素的电负性来衡量。
②键的极性不是一成不变的,会受到邻近基团或外界环境的影响,键的极性及其强弱程度可能会发生变化。
二、有机物的表示方法分子式、电子式、结构式、结构简式、最简式、键线式、碳骨架式、模型。
1. 电子式:在元素符号周围用小黑点“.”或小叉“×”来表示元素原子的最外层电子。
2. 结构式:表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子,所有的键全展开写。
3. 结构简式:同一个碳上的氢原子合并写;表示原子间形成单键的…—‟可以省略;C=C、C≡C中的双键和三键不能省略,但是醛基、羧基的碳氧双键可以简写为—CHO、—COOH。
4. 最简式:又称实验式,它表示有机物中各种原子的最简整数比,一般通过实验测出。
5. 键线式:将结构式中氢原子和碳原子符号省略(但不是所有的氢原子和碳原子符号都省略),用锯齿状的折线表示有机化合物中的共价键情况,每个拐点和终点均表示一个碳原子。
如,,,。
6. 碳骨架式:只能表示碳原子的连接方式,不能表示分子组成。
一般只用于题目分析,正规的书写表达时不用,如。
7. 模型:有球棍模型和比例模型两种,能体现分子真实的空间构型。
正四面体平面平面正六边形四、有机化合物结构与性质的关系1.官能团与有机化合物性质的关系①官能团的极性越强,键越活泼。

有机化合物的结构特点思考:从下图(图中黑球表示碳原子)和所学知识归纳有机物中碳原子的成键特点一、有机物的成键特点(一)碳原子的成键特点1、四个共价键(既能与碳原子相连,也能与其它原子相连)2、键型多样:C—C、C=C、C≡C、芳香环等(只有碳碳单键可自由旋转)3、碳链多样:__________、__________、_________等(二)有机物组成与结构的表示方法(1)化学式:C2H6(2)最简式(实验式):___________(3)电子式:________________(4)结构式:_______________(5)结构简式:_____________(6)键线式:把有机物分子中的碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有一个碳原子,称为键线式。
★不饱和度(缺氢指数)Ω1、C X H Y O ZΩ=(2X+2-Y)/22、已知结构Ω=双键数+环数+叁键数×2+苯环×4(三)烃的代表物的结构特征1、甲烷的立体结构——正四面体结构甲烷具有正四面体的结构特征,当烷烃中的碳原子数大于3的时候,碳链就形成_____________形状。
2、乙烯的结构特征乙烯分子中6原子共平面,键角约_____________。
3、乙炔的结构特征结构式________________结构简式___________________空间结构_________________4、苯的结构特征例:能说明苯分子中的碳碳键不是单、双键交替的事实是()A、苯的一元取代物没有同分异构体B、苯的邻位二元取代物只有一种C、苯的间位二元取代物只有一种D、苯的对位二元取代物只有一种二、同系物1、定义:结构相似,在分子组成上相差一个或若干个__________的物质互称为同系物。
类:官能团的种类、个数和连接方式相同。
差:组成上相差n个CH2原子团。
2、特点:1、化学性质________,物理性质_____________________;2、有相同的_______、不同的___________,但满足相同通式的不一定是同系物。

有机化合物中碳原子的成键特点1.四价性:碳原子具有四个价电子,每个电子可与其他原子的电子形成共价键。
四价性使得碳原子可以与其他碳原子或其他元素形成多种多样的化学键,使得有机化合物的结构和性质多样化。
2.杂化轨道:由于碳原子的四价性,碳原子的4个价电子需要形成四个稳定的共价键。
为了完成这四个共价键,碳原子中的三个2s和一个2p 杂化轨道参与成键。
碳原子通过sp3杂化形成了四个等能量的sp3杂化轨道,每个轨道空间分布方向相互垂直,并指向一个立体角的顶点,从而有机化合物中的碳原子呈现出四面体结构。
3.正向和侧向重叠成键:有机化合物中的碳原子通过两种方式与其他原子成键,即正向和侧向重叠成键。
在正向重叠成键中,碳原子的sp3杂化轨道与其他原子的轨道正向重叠,形成σ键。
而在侧向重叠成键中,碳原子的p轨道与其他原子的轨道侧向重叠,形成π键。
4.自由旋转性:由于碳原子的四面体结构,有机化合物中碳原子与其它原子成键后,存在自由旋转的能力。
这种自由旋转性使得有机化合物在空间中具有很大的灵活性,不同的构象和立体异构体可相互转变。
5.链状结构:由于碳原子可以与自身形成多个共价键,碳原子可以通过形成共价键与其他碳原子连接在一起,形成链状结构。
这种链状结构使得有机化合物能够形成复杂的化学结构,且碳链的长度可以很长。
6.亲电性:碳原子相对于其它元素的原子,亲电性较小。
这是因为碳原子的电负性较低,即它不容易鼓励与其它原子形成共价键。
这种亲电性较小使得碳原子具有稳定性,不容易发生反应。
总之,有机化合物中碳原子的成键特点主要包括四价性、杂化轨道、正向和侧向重叠成键、自由旋转性、链状结构和亲电性。
这些特点使得有机化合物具有很高的结构多样性和反应活性,是有机化学研究的基础。

第一章认识有机化合物第二节有机化合物的结构特点讲义第二节有机化合物的结构特点一有机化合物中碳原子的成键特点:1.碳原子的成键特点:(1)碳原子最外层有4个电子,不易失去或获得电子而形成阳离子或阴离子,碳原子常通过共价键与H、O、S、P等原子形成共价化合物(2)碳原子与碳原子之间也能以共价键结合,不仅可以形成稳定的单键,还可以形成稳定的双键或三键(3)多个碳原子可以相互结合成链状,也可以结合成环状,还可以带有支链(4)有机物分子中普遍存在同分异构现象说明:任何有机物都含有碳元素,碳原子相互连接而形成的碳链或碳环是有机化合物的基本骨架。
碳原子有4个价电子,可以形成4条共价键。
碳原子之间可以相互形成碳碳单键、双键、三键等。
另外,碳原子还可以形成碳氢单键()、碳氧单键()、碳氧双键()以及一些更加复杂的化学键形成【同步训练】1.迄今为止,以下各族元素中形成化合物种类最多的是()A.ⅡA B.ⅢA C.ⅣA D.ⅤA★2.下列有关有机化合物的组成和结构的叙述中,正确的是()A.有机化合物中的碳原子只能以共价键形成碳链,不能形成碳环B.有机化合物分子中可存在碳碳单键,也可以存在碳碳双键或碳碳三键C.碳、氧原子之间只能形成碳氧双键D.碳、氮原子之间可存在碳氮单键,也可以存在碳氮双键或碳氮三键2.有机物分子的空间构型——甲烷分子的结构特点;科学实验证明,甲烷分子里1个碳原子与4个氢原子形成4个共价键,构成以碳原子为中心,4个氢原子位于四个顶点的正四面体立体结构CH4科学实验证明:在甲烷分子里,4个碳氢键是等同的,它们的键长均为109.3 pm(1 pm=10–12 m),两个碳氢键间的夹角均为109°28′(约为109.5°),键能为413.4 kJ/mol说明:①键长:成键的两个原子,原子核间的距离称为键长②键角:分子中一个原子与另外两个原子形成的两个共价键在空间的夹角称为键角③键能:以共价键结合的双原子分子,裂解成原子时所吸收的能量称为该共价键的键能,键能越大,化学键越稳定【同步训练】1.下列五种物质:①CO2②CHCl3③甲烷④CCl4⑤P4,其结构具有正四面体构型的是()A.①②③B.③④⑤C.②③④D.①④⑤-C-H-C-O---O分子式电子式结构式结构示意图球棒模型比例模型CH HHC××××HHHH2.甲烷分子是以碳原子为中心的正四面体结构而不是平面正方形结构,其理由是( ) A .CH 3Cl 不存在同分异构体 B .CH 2Cl 2不存在同分异构体 C .CHCl 3不存在同分异构体 D .CCl 4是非极性分子 3.对CF 2Cl 2(商品名称为氟利昂-12)的叙述正确的是( ) A .有两种同分异构体 B .是非极性分子 C .只有一种结构 D .有四种同分异构体二 有机化合物的同分异构现象1.同分异构现象:化合物具有相同的分子式,但结构不同,因而产生了性质上的差异的现象 2.同分异构体:具有同分异构现象的化合物3.各种异构现象及同分异构体的书写:(1)碳链异构:由于碳链骨架不同而产生的异构现象以烷烃C 6H 14为例,写出所有同分异构体(烷烃只有碳链异构)四句话:主链由长到短;支链由整到散;位置由心到边;碳均满足四键注意:从母链取下的碳原子数不得多于母链剩余部分(2)位置异构:官能团的位置不同而产生的异构现象 以烯烃C 5H 10为例,写出烯烃范围内的同分异构体书写方法:先链后位,即先写出可能的碳链方式(只写碳骨架),再加上含有的官能团位置碳链异构:综上所述,C 5H 10共有5种同分异构体说明:C 5H 10在烯烃范围内的同分异构体共有5种,实际上环烷烃与烯烃可构成官能团异构。
2018-2019学年高中化学第一章认识有机化合物第二节第1课时《有机化合物中碳原子的成键特点》知识点归纳及例题解析新人教版选修5编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018-2019学年高中化学第一章认识有机化合物第二节第1课时《有机化合物中碳原子的成键特点》知识点归纳及例题解析新人教版选修5)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018-2019学年高中化学第一章认识有机化合物第二节第1课时《有机化合物中碳原子的成键特点》知识点归纳及例题解析新人教版选修5的全部内容。
第1课时有机化合物中碳原子的成键特点[学习目标定位] 认识有机化合物的成键特点,学会有机物分子结构的表示方法,熟知几种典型分子的空间构型。
1.下列有机化合物中,属于脂肪烃的有①③⑧,属于脂环烃的有②④,属于芳香烃的有⑤⑦(填序号)。
2.甲烷的分子结构中碳原子最外层的4个电子分别与4个氢原子的电子形成4个共价键。
因此甲烷的分子式为CH4,电子式为,结构式为,其空间构型为正四面体形.探究点一有机化合物中碳原子的成键特点1.下列三种有机化合物①CH3—CH2—CH3②CH3-CH===CH2③CH3—C≡CH,它们共同的类别是链烃,分子结构(碳原子结合方式)上的相同点是碳原子间以共价键形成碳链,不同点是①中全部为碳碳单键,②中含有,③中含有—C≡C—。
2.有下列三种有机物(1)根据官能团的不同,判断它们的类别:①醇,②卤代烃,③羧酸。
(2)它们共同的类别是环状有机物,其中属于芳香化合物的是②③。
(3)三种有机物在分子结构上的相同点是都含有碳环。
有机化合物中碳子的成键特点教学目标 :1、碳原子的成键特点2、有机分子的空间构型和有机物中碳原子的成键特点的关系3、有机化合物结构的表示方法:结构式、结构简式、键线式知识分析(一)有机物的特点:①构成有机物质元素少(C、H、O N、S、P),但有机物种类繁多,结构复杂。
②大多数有机物难溶于水而易溶于汽油、酒精、苯等有机溶剂。
③绝大多数有机物受热易分解,而且容易燃烧。
④绝大多数有机物是非电解质,不易导电,熔点低。
⑤有机物所起的化学反应比较复杂,一般比较慢,并且还常伴随有副反应发生。
(二)有机物中碳原子的成键特点碳原子位于周期表第W主族第二周期,碳原子最外层有4个电子,碳原子既不易失电子、也不易得电子。
有机物种类繁多的原因,主要是由C原子的结构决定的。
其成键特点是:(1)在有机物中,碳原子有4 个价电子,碳呈四价,价键总数为4。
(成键数目多)(2)碳原子既可与其它原子形成共价键,碳原子之间也可相互成键,既可以形成单键,也可以形成双键或三键。
(成键方式多)①碳原子间的成键方式:C-C、C=C A C②有机物中常见的共价键:C— C、C=C AC、C-H、C-O C—X、C=O C= N、C—N、苯环。
③在有机物分子中,仅以单键方式成键的碳原子称为饱和碳原子;连接在双键、叁键或在苯环上的碳原子(所连原子的数目少于4)称为不饱和碳原子。
④C-C单键可以旋转而C= C不能旋转(或三键)(3)多个碳原子可以相互结合成长短不一的碳链和碳环,碳链和碳环还可以相互结合。
{知识回顾}1共价键的定义:原子间通过共用电子对所形成的相互作用2、共价键的类型:①非极性键:由同种非金属原子组成,共用电子对处在成键原子中间。
如:②极性键:由不同种非金属原子组成,电子对偏向于成键原子非金属性强的一方。
如:H-CH 3、H3C-OH[小结]由于乙烯分子中双键的键能小于C-C单键键能的2倍,同时双键中的两个键键能也不相等,即双键中一个键的键能不等于双键键能的1/2,其中一个键的键能小于另一个键的键能。
【学习目标】1. 进一步认识有机化合物的成键特点;通过有机化合物常见的同分异构体现象的学习体会物质结构的多样性决定物质性质的多样性.2。
能准确判断同分异构体及其种类的多少【重点难点】正确书写同分异构体;【自主学习】一、有机化合物中碳原子的成键特点 1.碳原子的结构及成键特点碳原子的最外层有 个电子,很难得失电子,易与碳原子或其他原子形成 个共价键。
2.碳原子的结合方式⑴ 碳原子之间可以形成稳定的单键,还可以形成稳定的双键或三键. ⑵ 多个碳原子可以相互结合成长短不一的碳链,碳链也可以带有支链,还可以结合成碳环,碳链和碳环也可以相互结合。
⑶ 碳原子还可以和氧原子等多种非金属原子形成共价键。
(氯乙烷)。
⑷ 有机物分子中还普遍存在 现象. 二。
有机物的分子构型名称分子式结构模型键角空间构型甲烷(四氯甲烷)CH 4109。
50 正四面体乙烯 C 2H 41200 平面三。
有机化合物的同分异构现象同分异构体的概念:是指分子式相同而结构式不同的物质之间的互称。
关键要把握好以下两点:⑴分子式相同CH3—CH—CH—CH3 CH3—C—CH2—CH3CH3CH3CH3CH3故己烷(C6H14)的同分异构体的数目有5种。
变式训练2—1。
写现庚烷的同分异构体.2.位置异构⑴烯炔的异构(碳链的异构和双键或叁键官能团的位置异构)方法:先写出所有的碳链异构,再根据碳的四键,在合适位置放双官能团。
例C5H10属于烯烃的同分异构体典例3.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是()三、判断同分异构体数目的常见方法和思路:⑴记忆法①碳原子数目1~5的烷烃异构体数目:甲烷、乙烷、丙烷均无异构体,丁烷有二种异构体,戊烷有三种异构体.②碳原子数1~5的一价烷基:甲基一种(-CH3),乙基一种(—CH2—CH3)、丙基二种[—CH2CH2CH3、-CH(CH3)2], 【方法指导】⑴按照同分异构体的书写步骤书写.⑵先碳链异构后位置异构。
有机化合物中碳原子的成键特点
1.下列关于乙烯和乙烷相比较的说法中,不正确的是( )
A.乙烯是不饱和烃,乙烷是饱和烃
B.乙烯能使酸性高锰酸钾溶液和溴水退色,乙烷则不能
C.乙烯分子中碳碳双键的键能是乙烷分子中碳碳单键的键能的两倍,因此乙烯比乙烷稳定D.乙烯分子为“平面形”结构,乙烷分子为立体结构
2.下列不属于碳原子成键特点的是()
A.易失去最外层的电子形成离子
B.最外层电子易与其他原子的外层电子形成共用电子对
C.能够形成单键、双键和三键等多种成键形式
D.每个碳原子最多与其他原子形成4个共价键
3.对制冷剂氟利昂-12(CF2Cl2)的叙述正确的是()
A.只有一种结构B.有两种结构
C.有四种不同的结构D.无法确定其结构
4.下列关于同系物的叙述中不正确的是()
A.某有机物同系物组成可用通式C n H2n+2表示
B.同系物互为同分异构体
C.两个同系物之间相对分子质量相差14或14的整数倍
D.同系物具有相似的化学性质
5.分子式为C8H16O2有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条下可转化成D,则A的可能结构有( )
A.2种B.3种C.4种D.5种
6.下列说法错误的是()
A.分子式为C3H8与C6H14的两种有机物一定互为同系物
B.具有相同通式的有机物不一定互为同系物
C.两个相邻同系物的相对分子质量数值一定相差14
D.分子组成相差一个或若干个CH2原子团的化合物必定互为同系物
7.下列取代基或微粒中,碳原子都满足最外层为8电子结构的是()
A.乙基(—CH2CH3) B.碳正离子[(CH3)3C+]
C.碳化钙 (CaC2) D.碳烯 (:CH2)
8.下列方案能够达到实验目的的是()
A.用浓溴水除去苯中的苯酚
B.用新制Cu(OH)2悬浊液鉴别苯、乙醛、乙酸
C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸
D.将溴乙烷和NaOH溶液混合加热后,再加入硝酸银溶液,检验溴元素
9.目前用于治疗甲型H1N1流感的特效药物达菲,是以我国特有的中药材八角的提取物——莽草酸为原料合成的。
莽草酸的分子式为C7H10O5,它属于()
A.单质 B.氧化物 C.无机物 D.有机物
10.分析下表中各项的排布规律,按此规律排布第26项应为( )
A.C7H16
B.C7142818818
参考答案:
1.答案: C
解析:碳碳双键的键能并不是碳碳单键的键能的两倍,而是比其两倍略小,因此,只需要较少的能量,就能使碳碳双键中的一个键断裂,所以乙烯比乙烷性质活泼。
2.答案: A
解析:碳原子既难得电子,又难失电子,一般与其他原子形成共用电子对,由于其最外层有4个电子,所以最多可形成4个共价键.
3.答案: A
解析: CF2Cl2可以认为是甲烷分子中的氢原子被两个氯原子和两个氟原子所取代的结果。
4.答案: B
解析:分子结构相似,组成上相差一个或若干个“CH2”原子团的一系列有机化合物称为同系物,其相对分子质量相差14的整数倍。
烷烃同系物组成可用通式C n H2n+2表示;同系物具有相似的结构,因此具有相似的化学性质;同系物与同分异构体是两个不同的概念范畴,互为同系物的有机物不可能互为同分异构体。
5.答案: A
6.答案: D
解析:试题分析:构相似,分子组成相差若干个CH2原子团的同一类物质互为同系物,A中两种有机物都是烷烃,互为同系物,A正确;B、C都是正确的,D不正确,选D。
考点:考查同系物的有关判断
点评:该题是基础性试题的考查,试题基础性强,主要是考查学生对同系物含义以及判断依据的了解掌握程度,有助于培养学生的逻辑思维能力,也有助于开阔学生的思维,提高学生的应试能力。
7.答案: C
解析:
8.答案: B
解析:
9.答案: D
解析:
10.答案: C
解析:把它分为4循环,循环顺序为C n H2n、C n H2n+2、C n H2n+2O、C n H2n O2,26=4×6+2,也就是说第24项为C7H14O2,接着后面就是第25项为C8H16,第26项为C8H18。