肿瘤模型专题
- 格式:doc
- 大小:28.50 KB
- 文档页数:13

肿瘤动物模型“新宠“——PDTX篇导读近年来,随着“肿瘤精准医疗”概念的提出,一种新的肿瘤模型应运而生,并被称为“目前最接近人类临床实际情况的肿瘤模型”,它对肿瘤新药研发、靶点筛选及个性化治疗起着重大推动作用。
它就是我们本期主角:人源肿瘤组织异种移植模型(PDTX),本文就为大家详细介绍这种PDTX模型的应用和常见PDTX模型的建立。
什么是PDTX模型?PDTX(Patient-derived tumor xenograft)即人源性肿瘤组织异种移植模型,又名PDX。
指将肿瘤患者的新鲜肿瘤组织移植(异位或原位)到免疫缺陷鼠(NOD/SCID、NRG小鼠等)上,在小鼠上培育出人的肿瘤组织。
该模型保持了人源肿瘤的原始多样性,更好地模拟了肿瘤细胞在人体内的生长环境[1]。
PDTX模型与CDTX比较,优势在哪里?CDTX(肿瘤细胞系移植模型)一直是我们往期内容的主角,它因易构建、成瘤率高、周期短等优点而被广泛应用,然而却依然存在一些缺陷而无法接近临床病人肿瘤的实际情况。
最大的缺陷就是CDTX缺乏肿瘤异质性!CDTX也可称为传统的荷瘤模型,即使用传统的体外处理过的永生化肿瘤细胞系移植小鼠,由于这类细胞的同质性,缺少细胞外基质、非肿瘤细胞等肿瘤微环境,使得肿瘤移植后难以有临床组织病理特征。
因此所得出的药物剂量范围、疗效与实际临床会有较大出入[2]。
就在去年,美国国家癌症研究所(NCI)宣布被全世界使用了25年的NCI-60(在培养基中生长的60种人类癌细胞系)从其药物筛选程序中“退休”,并决定将启动一个得到更新的、来源于病人新鲜样本的癌症模型库。
如下表为PDTX与CDTX的比较:PDTX的应用1. 药物筛选:经过近几十年的研究,发现PDTX模型进行药物筛选的结果跟临床的相关性非常高,所以很多研究单位和制药企业都纷纷采用PDTX模型进行肿瘤药物的筛选和评估,得出更加合理有效的治疗方案[3]。
2. 肿瘤个性化治疗:同一肿瘤在不同患者上发展情况不同,加上同一肿瘤还有许多分型,因此选择的治疗方法也不相同。

这些肿瘤免疫小鼠模型,别说你不知道订阅号APExBIO要说当今社会哪种癌症治疗手段最火热,癌症免疫疗法(Cancer Immunotherapy)当之无愧。
科学家们热衷于从免疫系统着手消灭肿瘤细胞。
自美国詹姆斯·艾利森(James P. Allison)和日本免疫学家本庶佑(Tasuku Honjo)因其开创性的癌症治疗方法获得2018年诺贝尔医学奖后,更是为癌症的免疫治疗增添了热度。
虽说免疫检查点抑制剂、癌症疫苗和细胞治疗等方面取得的成就为患者带来了希望,然而建立可以模拟人类疾病的免疫活性小鼠模型仍是一个重大挑战。
免疫疗法的临床前研究需要具有完整功能免疫系统的体内模型。
当前的临床前免疫治疗小鼠模型包括同源肿瘤模型、基因工程小鼠模型和人源化肿瘤模型,本文将浅谈这几种模型。
一、同源肿瘤模型▲同源肿瘤模型(Syngeneic tumor models)。
利用在体外生长和扩增的鼠肿瘤细胞系,将其注射(通常皮下或原位)到免疫活性(Immune-competent)宿主中。
这是最早出现和最常使用的临床前模型。
同源肿瘤模型是将永生化的小鼠肿瘤细胞系接种到近交品系小鼠中形成的同种移植模型。
肿瘤细胞系可以是自发性的、致癌物诱导的或转基因的。
受体小鼠拥有完整的鼠源免疫系统,具有完全的免疫活性(immuno-competent),且该免疫系统与同种移植肿瘤组织相容。
▲常见的同源肿瘤小鼠模型整理(包括鼠肿瘤细胞系、癌症类型、鼠宿主和使用的药物)同源模型易于建立,且有良好的免疫应答。
可以用免疫检查点抑制剂(例如抗PDL-1,抗PD-1,抗-CTLA-4)等药物来评估荷瘤小鼠中肿瘤免疫疗法的效果。
同源细胞系可以在实验室中轻松培养和大量扩增,这种模型价格低廉,操作起来相当简单且重复性强。
同系模型的另一个优点是宿主的免疫系统是正常的,这可能最大化模拟肿瘤微环境的真实生活情况。
缺点是移植的小鼠组织可能无法完全代表临床情况下人类肿瘤的复杂性。

肿瘤的诊断模型摘要本文对肿瘤的诊断问题,应用神经网络与模糊数学的理论,给出了几种乳房癌的量化诊断方案.首先,建立了LVQ神经网络模型,使用500组数据的前400组作为训练样本,用后100组数据对网络性能进行检测,诊断正确率达98%.然后对这500个特征向量进行了回归分析,从30个特征中筛选出了6个特征,它们分别是:细胞核直径均值、标准差和最坏值、紧密度的均值、面积的最坏值、周长的均值.并将以上6个特征用于LVQ网络,诊断正确率达95%.进一步考虑到神经网络与模糊数学各自的特点,将二者有机结合构造了神经模糊系统,并用以上的6个特征对系统进行训练,诊断正确率达96%.本文构造的模型具有良好的稳定性,对于模式识别问题具有很强的实用价值,最后本文提出了神经网络和模糊数学深层次结合的方向.一.问题的重述肿瘤通过穿刺采样进行分析可以确定其为良性或恶性.医学研究发现乳房肿瘤病灶组织的细胞显微图像的10个量化特征:细胞核直径,质地,周长,面积,光滑度,紧密度,凹陷度,凹陷点数,对称度,断裂度与该肿瘤的性质有密切关系.现有500个已确诊病例,每个病例的一组数据包括采样组织中各细胞核的这十个特征量的平均值,标准差和“最坏值”(各特征的3个最大特征的平均值)共30个数据.根据这500组数据建立诊断模型,并将其用于另外69名已做穿刺采样的患者.为节省费用发展一种只用此30个特征数据中的部分特征来区分乳房肿瘤是良性还是恶性的方法.二.问题的假设1.所给的500组病例具有广泛的代表性.2.500组病例所反映的良性与恶性的概率分布符合病例的自然分布.三.问题的分析本问题是一个典型的模式识别问题,要求根据它的特征量来进行分类.对于模式识别问题,现今有两类解决办法.一类是传统的线性模型.另一类是近年来发展起来的非线性模型.本题是一个典型的非线性问题,用传统的线性模型解决有一定的困难,而且识别率不高.所以非线性模型是解决此类问题的首选.现今常用的非线性模型有神经网络模型和模糊系统模型.神经网络由许多并行运算的简单单元组成,单个神经元的结构及其简单,但大量神经元相互连接组成人工神经元网络显示出人脑的某些特征:1)分布存储和容错性;2)大规模并行处理;3)自学习、自组织和自适应性;4)它并不是各单元行为的简单相加,而表现出一般复杂非线性动态系统的特性.神经元可以处理一些环境信息十分复杂、知识背景不清楚和推理规则不明确的问题,如乳房癌诊断问题.模糊集打破了传统的分明集只有0和1的界限,任意元素可同时部分地属于多个模糊子集,隶属关系用隶属的程度来表示.这更接近人的表述方式.模糊规则是定义在模糊集上规则,常采用“If-then ”(若…则…)的形式,可用来表示专家的经验、知识等.由一组模糊规则构成的模糊系统可代表一个输入、输出的映射关系.从理论上说,模糊系统可以近似任意的连续函数.模糊系统除了模糊规则外,还包括模糊逻辑推理和去模糊化的部分.由于模糊集能处理非定量的信息,因此在模式识别(尤其是具有模糊特点的识别问题)中模糊系统具有很大的优势,本题肿瘤的良性、恶性正是模糊概念,所以用模糊系统进行模式识别会得到很好的效果.为了避免量纲的影响,在应用数据之前对数据经行了标准化.标准化方法:用每个数据与整体均值的差除以整体标准差.四. 模型的建立与求解(一)神经网络模型学习向量量化(LVQ)是在监督状态下对竞争层进行训练的一种学习算法.LVQ 网络由一个竞争层和一个线性层组成.竞争层的神经元将输入向量分成组,由现行层组合到期望的类中.在任何给定的时刻,线性层的输出神经元只有一个非零输出1,该神经元就是竞争中得胜者.假定获胜的元为j N ,它之所以获胜的原因是它受到了最大的输入刺激,那么,j N 的总加权输入为i Ni ij j x S ∑==1ω其中,j S 表示j N 的状态,ij ω表示第j 个元到第i 个元的权值,i x 表示第i 个输入分量.其矩阵形式为j S j W x= 若元j N 获胜,就意味着{}k m k j W x W x},,2,1{max∈=若连接到每个输出层神经元的权向量 ),,,(21m k k k T k W W W W =都是规范化的,上式等价于{}Tk m k T j W x W x -=-∈},,2,1{min网络输入模式为k x 时,具有权向量T j W 与k x最近的元将获得竞争的胜利.若元j N 竞争获胜,将权值作如下调整()T j k T j W x W -=∆η (1)使获胜者的权向量向输入向量移近一小段距离,这使网络在遇到k x 或与k x接近的模式时,元j N 可以有更大的获胜可能性.若j N 在竞争中失败,将权值作如下调整()T j k T j W x W --=∆η (2)使权向离开样品的方向移动,这样就减小了错误分类的机会.在(1)、(2)式中,η表示学习率.在本模型中取η为0.01,取隐竞争层的神经元数为60,取输出层神经元数为2,并规定输出(0,1)为良性,输出(1,0)为恶性.用前400组数据作训练样本,经过15000次迭代,两类样本的聚类情况如下图:用后100组数据对训练进行检测,诊断正确率达98%.对69组待定病例的诊断结果如下表:病例号类别病例号类别病例号类别病例号类别914862 B 917062 B B 924632 B91504 M 917080 B 919812 B 924934 B91505 B 917092 B 921092 B 924964 B915143 M M 921362 B 925236 B915186 B 91789 B 921385 B 925277 BB 917896 B 921386 B 925291 BB 917897 B 921644 B 925292 BB 91805 B 922296 B 925311 B915452 B B 922297 B 925622 M915460 M B 922576 B 926125 M91550 B 918192 B 922577 B 926424 M915664 B 918465 B 922840 B 926682 M915691 M 91858 B 923169 B 926954 M915940 B B 923465 B 927241 MB B 923748 B 92751 B916221 B M 923780 B916799 M 919537 B 924084 B916838 M 919555 M 924342 B为了节省费用,增加网络训练速度,考虑将所给的数据降维,用多元回归分析的逐步回归法对数据进行了回归分析,把30个特征做为自变量,因变量采用良性病例取值为0,恶性病例取值为1.逐步回归法避免了只将变量剔除就不再选入的缺点,它可以将变量反复选入、剔除,最终可得到一组最优权值,结果如下图所示:从30个特征中筛选出了6个特征,它们分别是:细胞核直径均值、标准差和最坏值、紧密度的均值、面积的最坏值、周长的均值.只用以上6个特征对网络进行训练,仍使用前400组数据作为训练,用后100组数据检验,诊断正确率达95%.对69组待定病例的诊断结果如下表:病例号类别病例号类别病例号类别病例号类别914862 B 917062 B B 924632 B91504 B 917080 B 919812 B 924934 B91505 B 917092 B 921092 B 924964 B915143 M M 921362 B 925236 B915186 B 91789 B 921385 B 925277 BB 917896 B 921386 B 925291 BB 917897 B 921644 B 925292 BB 91805 B 922296 B 925311 B915452 B B 922297 B 925622 M915460 M B 922576 B 926125 M91550 B 918192 B 922577 B 926424 M915664 B 918465 B 922840 B 926682 M915691 B 91858 B 923169 B 926954 M915940 B B 923465 B 927241 MB B 923748 B 92751 B916221 B M 923780 B916799 M 919537 B 924084 B916838 M 919555 M 924342 B五.神经模糊系统模型从映射角度看,模糊系统和神经网络都具有(非线性)函数近似的能力.它们有着以下的共同之处:(1)它们均可以从给定的系统输入/输出信号(数据)中,建立系统的(非线性)输入/输出关系.(2) 从数据处理的形式上看,它们均采用并行处理的结构.但是,模糊系统和神经网络有着明显的不同之处.神经网络虽然对环境的变化具有较强的自适应学习能力,但是从系统建模的角度而言,它采用的是典型的黑箱型的学习模式.因此当学习完成后,神经网络所获得的输入/输出关系无法用容易被人接受的方式表示出来.相反,模糊系统是建立在被人容易接受的“如果-则”表达方法之上,但如何自动生成和调整隶属度函数和模糊规则,则是一个很棘手的问题.因此,将模糊理论和神经网络有机结合起来,取长补短,提高整个系统的学习能力和表达能力,是目前这一领域最受人注目的课题之一.神经网络和模糊系统的等价性:[Kolmogorov 定理] 给定任意连续函数y x f R U f m n =→)(,:,这里U 是单位闭区间[0,1],f 可以精确地用一3层前向网络实现,此网络的中间层(隐层)有2n+1个处理单元.[BP 定理] 给定任意0>ε和任意2L 函数m n R f →]1,0[:,存在一3层BP 网络,它可在任意ε平方误差精度内逼近f .[模糊系统的存在定理] 给定任意连续函数R U f n →:和任意0>ε,存在由(1)式定义的)(x g 使 .神经网络和模糊系统各自本身就是一个非线性的输入/输出映射,因此模糊系统可以用一等家的神经网络来表示,同样,神经网络也可以用一等价的模糊系统来表示.基于神经网络的模糊系统:模糊系统采用高木-管野(Takagi-Sugeno Model )(简称TS 模型): 如果1x 为j A 1,和2x 为 ,2j A ,和n x 为j n A ,则)(x f y j =输入变量的联合隶属函数和结论部的函数f j (x)都用神经网络来求得.模糊规则的个数由减法聚类方法得到,聚类参数如下:Range of influence: 0.3 Squash factor: 1.1 Accept factor: 0.6 Reject ratio: 0.15神经网络采用前向的BP 网络,神经元的传递函数为Sigmoid 函数,输出层采用线性函数.网络结构如下图所示:由于系统的结构比较复杂,用30维的数据进行训练十分缓慢,只用了前面已提取出的6个特征对系统进行了训练,得到了神经模糊系统.用后100组数据进行检验,诊断正确率达96%.六.模型的进一步讨论神经网络和模糊系统的融合大致有两种形式:一种是用神经网络生成模糊系统的隶属函数和模糊规则来构造模糊系统,一种是使用模糊系统来初始化神经网络的初始权值来构造神经网络.二者都可用于模式识别,并都有良好的效果.但二者的特点又各不相同,第一种形式具有更加人性化的输出,便于构造专家系统,第二种形式有更好的自适应性.对于模型的进一步讨论可以考虑二者的进一步结合,可以让两种系统按并行或串行的方式结合到一起,前一种系统的输出作为后一种系统的输入,这样二者接替使用,最终由模糊系统输出结果,用于专家系统的分析.参考文献[1] 赵振宇、徐用懋,模糊理论和神经网络的基础与应用,清华大学出版社.[2] 袁曾任,人工神经元网络及其应用,清华大学出版社.[3] 叶其孝,大学生数学建模竞赛辅导教材,湖南教育出版社.[4] 施阳、李俊,MATLAB语言工具箱-TOOLBOX实用指南,西北工业大学出版社.[5] 徐昕、李涛、伯晓晨,MATLAB工具箱应用指南-控制工程篇,电子工业出版社.。




肿瘤的诊断模型【摘要】针对本题的实际,研究肿瘤的分类问题,通过对500个已知肿瘤性质(良性或恶性)细胞核的显微图像的30个量化特征进行分析,我们选择利用Fisher判别法和建立了Fisher判别模型,给出了判别函数和判别准则,并运用了R型聚类分析对变量进行了合理的分类缩减,得到了结果如下1、对未知的69个病例进行了判别,检测出了18个恶性肿瘤,51个良性肿瘤;2、对10个特征变量进行了缩减得到细胞核周长,紧密度,质地,光滑度,对称度,断裂度这6个特征变量的平均值,使得检测结果不仅效果明显,而且大大的节省了费用。
【关键字】:肿瘤Fisher判别R型聚类分析分类缩减1.问题的重述肿瘤通过穿刺采样进行分析可以确定其为良性(benign )的或为恶性(malignant )的。
附图分别给出了从患者病灶组织穿刺得到的病灶组织为良性和恶性的细胞核显微图像(见附录一)。
医学研究发现肿瘤病灶组织的细胞核显微图像的10个量化特征:细胞核直径,质地,周长,面积,光滑度,紧密度,凹陷度,凹陷点数,对称度,断裂度与该肿瘤的性质有密切的关系。
现有数据来自已经确诊的500个病例,每个病例的一组数据包括采样组织中各细胞核的这10个特征量的平均值,标准差和“最坏值”(各特征的三个最大数据的平均值)共30个数据.(见文件cancerdata.txt 中的前500组数据)。
本文需解决的问题有:问题一:试图根据已获得的实验数据建立起一种诊断肿瘤是良性还是恶性的方法,并将你的方法用于另外69名已做穿刺采样分析的患者(文件cancerdata.txt 中的最后69组数据)问题二:为节省费用,想发展一种只用此10个特征数据中的部分特征来区分肿瘤是良性还是恶性的方法,你是否可找到一个特征数少而区分又很好的方法?2.模型的假设与符号说明2.1模型的假设假设1:假设每个病例的30个数据能提供充分的分类信息。
假设2:假设所给数据基本没有误差且真实可信的,各样本病例的诊断结果完全正确。

肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。
其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。
小鼠模型分三大类:第一类是以S180、EAC、H22等为代表的,他们的宿主小鼠多选用KM,可产生腹水,也可在皮下成瘤。
多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药7到10天,接种10天后结束试验,剥取肿瘤称瘤重.1。
关于构建瘤种可以用体外细胞株培养后,用PBS悬浮至1~3×106/0。
1ml/mouse,i.p接种即可,最好用6号左右的针头,就是常用的2ml一次性注射的针头.2. 关于腹水传代观察到第一代的种鼠肚子较大后(一般约8~9天左右),可以传代,传代时取1ml注射器,用2ml注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个0.5ml就可以了,不用离心,直接用PBS3~6倍稀释后,接种到新的老鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整,第二代以后,尽量6~7天的时候传代,不要等的时间太久,否则腹水容易血性。
三代后可用于试验。
3. 关于接种进行试验这个时候抽取的腹水需要量比较多,一般需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。
然后进过一定的稀释后,接种到小鼠的腋下.关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的时候可以适当的计数,但是要用台盼兰染色后计活细胞数。
接种部位在小鼠腋下,但是不要深入到腋窝里面,会给以后的操作带来麻烦。
接种时的进针处离接种处远一点,让针头在皮下多走一段,不容易污染。

《肿瘤生长的动力学建模及抑制策略的研究》篇一一、引言随着科技的不断进步,癌症的治疗方法不断改进。
为了更深入地了解肿瘤生长的过程和规律,从而开发出更为有效的治疗方案,进行肿瘤生长的动力学建模成为科研领域的热门话题。
本篇文章旨在详细研究肿瘤生长的数学模型以及相关的抑制策略。
二、肿瘤生长的动力学建模1. 模型建立肿瘤生长的模型通常基于生物数学原理,通过数学方程来描述肿瘤细胞的增长、扩散和转移等过程。
这些模型通常包括细胞增殖、凋亡、营养供应等多个方面。
2. 模型分析通过对模型的深入分析,我们可以了解肿瘤生长的规律和特点。
例如,通过分析模型的参数,我们可以了解肿瘤细胞的增殖速度、凋亡速度等关键信息。
此外,我们还可以通过模拟实验来验证模型的准确性。
三、肿瘤生长的抑制策略1. 药物治疗药物治疗是当前最常用的肿瘤治疗手段之一。
通过使用化疗药物、靶向药物等,可以抑制肿瘤细胞的增殖和扩散。
然而,药物治疗也存在一定的副作用和耐药性问题,因此需要结合其他治疗方法进行综合治疗。
2. 免疫治疗免疫治疗是一种新兴的肿瘤治疗手段,通过激活或增强机体的免疫系统来对抗肿瘤。
这种方法具有较低的副作用和较好的耐受性,且对某些类型的肿瘤有较好的治疗效果。
然而,免疫治疗的疗效和安全性仍需进一步研究。
3. 放射治疗放射治疗是利用高能射线来杀死或抑制肿瘤细胞的治疗方法。
这种方法对某些类型的肿瘤有较好的治疗效果,但也可能对正常组织造成损伤。
因此,在制定放射治疗方案时需要权衡治疗效果和副作用。
四、综合策略及未来展望针对不同类型的肿瘤,我们需要制定综合的治疗策略。
这通常包括药物治疗、免疫治疗、放射治疗等多种方法的结合。
此外,我们还需要关注肿瘤的预防工作,如改善生活习惯、加强体检等。
未来,随着科技的不断进步,我们将有望开发出更为精准的肿瘤治疗方法和抑制策略。
例如,通过基因编辑技术来修复肿瘤细胞的基因缺陷,从而抑制其增殖;或者通过深度学习等技术来预测肿瘤的生长趋势和转移路径,为制定个性化的治疗方案提供依据。

肿瘤动物模型的构建——淋巴瘤篇导语淋巴瘤(Lymphoma)是一种原发于淋巴结和淋巴组织的恶性肿瘤。
近年来其发病率正以每年4%的速度上升。
初期往往仅因表现为持续发烧或淋巴结肿大,而被大家忽视。
加上淋巴瘤亚型(>80种)众多,治疗困难重重。
因此迫切需要建立正确的动物模型,这对于研究淋巴瘤的发病机制和治疗手段十分重要。
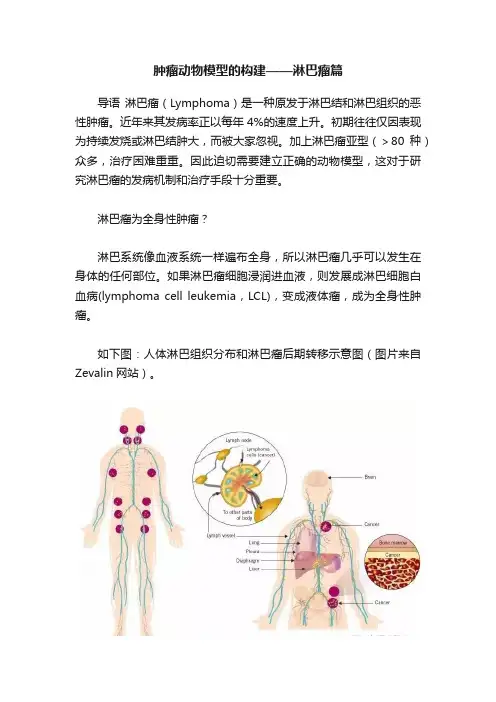
淋巴瘤为全身性肿瘤?淋巴系统像血液系统一样遍布全身,所以淋巴瘤几乎可以发生在身体的任何部位。
如果淋巴瘤细胞浸润进血液,则发展成淋巴细胞白血病(lymphoma cell leukemia,LCL),变成液体瘤,成为全身性肿瘤。
如下图:人体淋巴组织分布和淋巴瘤后期转移示意图(图片来自Zevalin网站)。
淋巴瘤分类众多淋巴瘤种类繁多,发病机制复杂,分为霍奇金淋巴瘤(Hodgkin lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)两类,其中以生发中心(Germinal center)来源的淋巴瘤占到NHL的80%,包括伯基特淋巴瘤,滤泡性淋巴瘤和弥漫大B淋巴瘤。
其发病机制是B细胞经历生发中心不同阶段时,基因发生突变易位等。
生发中心来源淋巴瘤发病机制示意图[1]临床上根据淋巴瘤分类分为多种细胞株,下面列举一些常用淋巴瘤细胞株:下面说说常见的淋巴瘤动物模型有哪些一、异种移植型淋巴瘤模型淋巴瘤细胞株或病人淋巴瘤组织种植于免疫缺陷动物体内,建立移植性淋巴瘤模型,是目前研究最多的肿瘤模型。
一般选择免疫缺陷小鼠:SCID小鼠或NOD/SCID小鼠淋巴瘤动物模型常选用SCID小鼠,它是一种先天性T/B淋巴细胞联合免疫缺陷动物,移植成功率比较高。
但SCID小鼠仍残留某些免疫功能,而NOD/SCID小鼠较SCID小鼠出现更多的免疫缺陷,它又降低了NK细胞的活性,成为淋巴瘤实验研究的有效工具。
异种移植进一步又分为细胞移植(CDTX)和组织块移植(PDTX)操作步骤如下图所示[2]:A(CDTX)和B(PDTX)注意:(1)细胞移植法:常用皮下荷瘤,也用腹腔注射,静脉注射和原位荷瘤。
常见肿瘤动物模型一览来源:解螺旋利用实验动物进行整体水平的肿瘤研究,是基础研究中的重要组成,可以说是高分文章必备之选。
翠花这里给大家汇总了常用的肿瘤动物模型,欢迎收藏!1、自发瘤模型:实验动物未经任何有意识的人工处理,自然发生肿瘤优点:①近似人类肿瘤发生过程,实验结果更易于外推到人;②相比移植瘤,对药物的敏感度不高,疗程长,便于进行综合治疗;③可观察遗传因素在肿瘤发生上的作用。
缺点:①个体之间生长速度差异较大,肿瘤发生发展参差不齐,很难在限定时间内获得大量生长均匀的荷瘤动物;②试验周期长;③需要的动物数多,耗费大。
应用:应用于病因学研究,可转为移植瘤,而继续发挥作用。
2、诱发瘤模型:利用外源性致癌物引起细胞遗传特性改变,从而出现异常生长活性细胞,形成肿瘤。
常用实验动物为大鼠,也有用小鼠、豚鼠、兔、犬等。
优点:①近似人类肿瘤发病特点和过程(约80%人癌是由环境因素引起的);②可以根据需要有目的进行诱导;缺点:①诱导时间长(3-5个月,甚至1-2年),成瘤率不高;②动物死亡率高,花费大;③诱导剂有毒,需谨慎操作;④肿瘤出现的时间、部位、病灶数等在个体之间表型不均一。
应用:常用于验证可疑致癌因素的作用以及在肿瘤病因学及肿瘤预防研究。
3、移植瘤模型:将动物或人体肿瘤细胞/组织移植到动物体内连续传代而形成肿瘤,分为同种动物移植以及异种动物移植,主要是人体肿瘤的异种移植;后者应用更多一些。
一般将人体细胞或组织移植于免疫缺陷的动物体内(为了避免免疫排斥),动物只是作为一个供给营养和生长环境的载体,肿瘤还能保持着人体肿瘤的组织学、免疫学及生物特性,是研究人体肿瘤最重要的模型之一,这里列举几个常用的模型:优点:①移植瘤保持着原发肿瘤的大部分生物学特性;②几乎所有类型人类肿瘤均能在免疫缺陷动物体内建立可移植性肿瘤模型;③同样的接种条件,动物个体间生长速度一直,成瘤速度差异较小,接种成瘤率高;④实验周期短。
缺点:①肿瘤增殖时间短,与人体肿瘤不同;②免疫缺陷动物需要生活在无菌环境,SPF动物房费用高;③人体肿瘤的所有细胞亚群不能全部出现在移植瘤中;④获得的肿瘤组织的间质可能带有免疫缺陷动物的成分。
恶性肿瘤的疾病模型与药物筛选恶性肿瘤是一种具有高度恶性和侵袭性的疾病,对人类健康构成严重威胁。
为了更好地研究恶性肿瘤的病理过程以及寻找有效的治疗方法,科学家们开发了多种不同的疾病模型并进行药物筛选。
本文将介绍几种常见的恶性肿瘤模型以及药物筛选的方法。
一、大鼠肿瘤模型大鼠肿瘤模型是最早被广泛应用于恶性肿瘤研究的模型之一。
通过移植人类肿瘤细胞株到大鼠体内,可以观察和研究肿瘤生长、转移以及对治疗药物的反应。
这种模型具有较高的可重复性和可操作性,可以提供更接近人类疾病的环境。
二、小鼠转基因模型小鼠转基因模型是通过基因工程技术将特定的致癌基因或抑癌基因转入小鼠体内,使其发生肿瘤变化。
这种模型可以模拟出人类肿瘤的发生机制,并且对于研究肿瘤的早期发展和治疗药物的疗效评估具有重要意义。
三、细胞系模型细胞系模型是将体外细胞培养技术与肿瘤研究相结合的模型。
科学家们将人类肿瘤细胞分离培养,并通过不同的培养条件模拟肿瘤在体内的生长环境。
这种模型具有较强的实验控制性和高效性,可以为药物筛选提供大量的样本。
四、三维组织工程模型三维组织工程模型是近年来发展起来的一种新型肿瘤模型。
将肿瘤细胞与支架材料相结合,形成具有结构和功能特性的肿瘤组织。
这种模型能够模拟真实的肿瘤组织结构和肿瘤微环境,对药物的筛选和治疗效果评估能提供更可靠的数据。
针对恶性肿瘤的药物筛选主要包括体外筛选和体内筛选两个阶段。
体外筛选主要利用细胞系模型或三维组织工程模型进行,通过评估药物对肿瘤细胞的抑制作用或诱导细胞凋亡的能力来初步筛选药物。
而体内筛选则需要将合适的肿瘤模型移植到动物体内,观察和评估药物对肿瘤生长、转移以及患者生存率的影响。
随着科学技术的不断发展,越来越多的新的恶性肿瘤模型和药物筛选方法不断涌现。
例如人工智能在肿瘤筛选方面的应用,有望为研究人员提供更准确、高效的药物筛选策略。
总之,恶性肿瘤的疾病模型与药物筛选是推动肿瘤研究和治疗进步的重要手段。
科学家们根据疾病的特点选择合适的模型,通过系统、全面地筛选药物,为寻找更有效的抗肿瘤药物提供科学依据,以期最终提高恶性肿瘤患者的生存率和生活质量。
肿瘤模型专题1.最新的药效学指导原则要求化药临床前进行至少5种人源肿瘤的体内抗癌活性评价,以确定药效及抗瘤谱。
2.瘤株对药物的敏感性通过体外筛选可以说明,而体内评价更大程度上是考虑药物经体内吸收、分布、代谢之后的活性,由于目前的肿瘤模型多采用皮下接种,并不能完全反映药物的组织分布对其影响,所以感觉这种要求就显得不是很必要。
注解:体内的敏感性不是仅考虑吸收分布代谢的影响,一些样品,体外活性都是不错的,体内甚至是瘤内直接注射给到很高剂量都没有效果,肿瘤细胞在体内和体外的生存环境差别很大,体外模拟的生存环境完全不能体现出体内的状态。
3.皮下接种是一个目前能找到的最好的权宜之计了,实际上,SFDA明确表示,鼓励原位肿瘤模型,但是由于技术的原因,很多瘤株都无法实现。
而皮下模型有它的一系列优点:稳定,便于观察,易于构建,易于控制等等,能够在一定程度上反映药物经过体内过程的疗效,所以目前只能用它来进行评价。
4.实际上原位肿瘤模型仍然不能很好的反映临床肿瘤的特点,目前能够预见得到最好的模型应该是经过基因修饰(转基因等)的能够集中比较均匀的自发模型,这才是和临床最接近的肿瘤模型。
但是目前的经过基因修饰的自发肿瘤模型种类很少,而且可控制性差,周期长,所以还要经过很长时间的改善才能大规模的应用。
5.常规的肿瘤细胞株接种后如果不能成瘤,细胞悬液就会被动物吸收6.瘤体积可用游标卡尺量最长径(a)和最短径(b),体积计算公式:V=πab^2/6,每2-3天测一次。
体积=宽^2*长/2的公式计算肿瘤体积;抑瘤率=(对照组-治疗组)/对照组*100%;; tumor size = width2· length · .;Πab2/6;关于肿瘤体积的计算:....../6约等于/2。
如果想做得讲究一点,应该用RTV计算肿瘤体积: RTV (某日某老鼠的相对肿瘤体积)=TV(测量当天该老鼠的肿瘤体积)/TV(分组当天该老鼠的肿瘤体积)*100,在此基础上进行平均值SD等数据的计算7.是否必须称重小鼠的胸腺和脾脏8.超过7天的腹水再传代就很容易出现血性;动物的周龄也不要太大,6周左右。
传代次数太多也很容易出现血性腹水。
血性腹水可以离心后加 N的NH4CL溶液破红细胞,然后精确一些的控制条件(接种量,传代时间,动物周龄等)传几代,很多情况下再传一两代后会有不血性的种鼠出现,然后用这只种鼠的腹水继续传代9.皮下接种与剥瘤子:小鼠肿瘤剥瘤子是一个艰难的过程,但是可以一定程度上的改善一下:接种的时候要精确控制接种在皮下,靠皮内会与皮肤强烈粘连,靠肌肉会与肌肉强烈粘连,而且不要太靠腋窝里面,可以往尾部靠一些,也可以稍微的往背部靠一点,不要往腹部靠,容易使肿瘤被垫料磨烂。
10.LD50是毒理中的半数致死量,ED50是体外试验中的半数有效量,一般体内实验没有类似的指标,如果想比较几个类似物的药效还是做量效曲线比较好。
11.剂量设置应该按照LD10(10%致死剂量,也叫最大耐受剂量)来分组,一般分别采用 1/2 LD10, 1/4 LD10, 1/7 LD10 或 1/10 LD,但最大剂量不得超过LD10。
这里面还得考虑ED 50,LD10与ED50的剂量相差越大越好。
用LD50作为标准设置剂量是不现实的,因为动物实验是不可能允许10%以上动物死亡的。
12.说到疗效的比较,如只是发文章,比较不同基团之间可能对母体抑瘤率的影响,一般做做体外试验,比一比大家的IC50就好了,不太做体内。
如是真正的筛药,我个人有些观点:这个不是孤立起来看某个或者某几个剂量下谁比谁的抑瘤率高。
主要要看谁更具有可开发性。
首先,要考虑它的毒性以及治疗窗口的大小,通俗的说,就是这个要在发挥疗效的剂量下,毒性是否大?比如A 药,10mg抑瘤率有50%,但是体重下降了20%;而B药,10mg的时候根本无效,30mg的时候有40%的抑瘤率,60mg的时候抑瘤率高达80%,而且体重几乎没有下降,这个时候A药与B药如何比较?特别如果是公司筛选新药,还要考虑成本,病人可接受度(动物上的有效剂量换算到人一天要吃2斤,这种药也是不现实的),制剂,工艺等等方面。
如果单纯从药理的角度给出答案,至少要考虑毒性和剂量限制的问题。
13.关于剂量选择,LD50的几分之一是一种比较通用的方法,目前相对更合理一些的剂量选择是做一个简单的多次给药的毒理试验来确定剂量,我们一般会连续给药一周,然后再观察一周,这样摸出来的最大剂量可以直接用于药效试验,然后其他的剂量都在此剂量的基础上往下减。
14.说到给药疗程,一般初筛的药物都是连续天天给药,qd。
但是给药途径,特别是与的选择,我们都是先做一个简单的PK试验考察一下,再确定,特别是如果PK试验的结果显示,血药浓度甚至达不到体外IC50的浓度,那么是否进行体内试验,就有待商榷了。
连续,小鼠的皮肤有时候会变厚,你可以换一边给药。
15.动物选择: KM小鼠,裸鼠,C57 等均可作为,但是个人认为KM能做出来最好,毕竟比较有普遍性,还是正常生理状态的健康动物,比较有说服力,还便宜,裸鼠或者其他特定品种,比较适合特定的瘤株16.关于肿瘤细胞活力的问题: 一般培养的肿瘤细胞活力往往是不够的,很难在短时间内长到规定重量,所以建议至少在动物体内传2代,让肿瘤细胞活力充分体现以后再开始用于实验.传代数次的原因在于让肿瘤细胞充分活化,要不活化也行,多接种点吧17.关于接种部位的问题:以小鼠为例一般可以选择腋下或者后肢,背部血管不发达,营养不够,一般不建议采用.接种一般采用皮下注射,针头沿皮肤水平进入,然后挑起表皮,注射18.关于肿瘤重量的问题: 模型组肿瘤重量应该不低于19.肺内原位注射制作肿瘤模型效果颇好,流程如下:麻醉->固定->皮肤消毒->剪开左侧胸部皮肤,大约第2-3肋间的位置->用镊子轻轻拨开皮下筋膜,可以看到呼吸运动的肺叶->将准备好的肿瘤细胞注射入肺,<30微升->分层缝合OK20.胸膜活检穿刺针规格:#20 #25(14G 12G) L 65 mm;用途:供人体胸腔穿刺,钩取胸膜活体组织用21.开始做肿瘤药效评价,应该采用s180这些小鼠肿瘤模型。
一个方面这些肿瘤对于药物很敏感,而且周期短,花费也少。
但如果要成药,裸鼠模型是必需的。
22.一般瘤重的SD在平均值的70~80%以下就还凑活,漂亮一点的是在30%以下,实在不行,100%也勉强,就是特别难看,但是SD越大,统计上就越不利23.皮下肿瘤模型中,腋下最适合肿瘤生长。
接种时由裸鼠体侧腰部稍靠上的部位进针,要保证与接种点的距离小于针头的长度,向头部方穿行,绝对不能刺破皮肤或者刺破肌肉层,当针头到达接种位点时注射,退出针头,这样操作的目的并不完全是避免漏液,其实熟练后,不需要皮下穿行也不会漏液,主要是避免污染,进针点还有少量污染的可能性的,针头在皮下穿行一段后,接种点离进针点较远,最大限度减少污染的可能。
24.如果是药效试验,不建议你用手术标本,因为SFDA的临床前研究指导原则上明确指出要用建株的肿瘤株进行试验,因为用手术标本的试验可重复性太差25.一般用4-5WK,体重15-17g鼠,年轻鼠接种瘤容易长26.种植肾被膜下:第一该区免疫豁免,第二贴近肾可以从此获得充分的养料.在实验时先用显微用的镊子在肾被膜上撕慨一个小口子,然后种植。
注意:肾被膜和肾脏是有一个间隙可以用镊子在被膜下赶肿瘤组织到远离撕开口处,不用缝合被膜.这样就可以了27.人肿瘤模型用裸鼠,基本上没有可成腹水的,只能皮下接种传代28.nude mice的数据在SCID mice上是比较有参考价值的,另外,因为免疫系统的进一步缺乏,肿瘤生长的进程可能会比nude mice 上更快一点29.接种后,用干净的棉签按住注射部位才拔针,拔针后再按住10秒种左右,一般不会有液体渗出30.K562第一代细胞接种的成瘤很好,传一代就很差了,没有几只成瘤的,到第三代就全军覆没31.不赞同用7901这个瘤株,国际公认度比较差32.分组要求平行性,尽量缩小组间差异,组内差异是实际情况的反映。
你可以按照肿瘤体积分层随机分组,这样平行性比较好33.肿瘤细胞悬液裸鼠接种前稀释效果顺序:相应的无血清培养基>PBS>saline34.现在常用的阳性对照药物是CTX和cisplatin,另外乳腺癌可以用Taxol。
阳性药的剂量途径和疗程不要求和样品一致,不过给药途径尽量一样。
还有,最好选用机制类似或者结构类似的阳性对照。
一般来说阳性对照的抑制率都会在60%以上或者更大,少数情况下只有50%左右。
35.细胞毒类抗肿瘤药物临床前体内试验一般至少应选用6种人癌移植瘤模型,其中应包括II期临床试验中拟筛选的肿瘤组织类型。
36.针对每一种人癌移植瘤模型,推荐采用相对肿瘤增殖率T/C(%)作为试验评价指标,评价标准通常为:T/C(%)>40 %为无效;T/C (%)≤40%,并经统计学处理P < 为有效。
在体内有效性试验采用的全部人癌移植模型中,一般至少应有1/3达到有效标准。
注解:对于T/C<40%,按照这个标准,很多现有的一线化疗药物都会被淘汰37.适于接种的瘤源的直径最好为1cm或者稍大一点,直径2cm可能对于有些瘤株来说会太大了一点。
一般来说,插块法,一个瘤源接种30只动物是没有问题的,匀浆法一般2只也可以接种30只了38.新的抗肿瘤药物指导原则上强调要3代以上才能用,并且不能超过15~20代(人肿瘤)。
39.只有少部分的小鼠实体瘤可以腹水传代,人实体瘤几乎没有能够腹水传代的40.一般来说,小鼠肿瘤比较推荐路易斯肺癌和B16。
国内的S180并不好,各实验室之间的变异很大。
国外基本都不用它。
其实并不是因为S180有多好大家才选用他,而是他进行实验的成本低,周期短,操作较容易41.灌胃药溶解用生理盐水可以吗:不一定,根据混悬效果来看,一般多用% 甲基纤维素钠(CMC-Na)42.实体肿瘤不可以采用生命持续时间这个指标,这个是明确有规定的43.正常的实体肿瘤都是越长越大,最后可能会溃破,但是没有消亡这个现象,如果肿瘤整体的自发消亡,说明模型有问题,最大可能是被污染了44.出针挂组织的问题,关键在于针头的磨制,在针后部的小突起于小缺口吻合后,实体针弯曲方向应该与套管针磨制的斜面一致,接种时,实体针要推到底,也就是后面的小突起与小缺口契合,然后针头“舔住”肌肉层转一圈再退针,还有就是瘤块一定要完全塞入针头内,外面不能有漏出来的。
45.S180、H22不需要测量肿瘤体积,试验结束后直接剥取肿瘤成瘤重46.瘤株皮下成瘤率好,那么到了原位应该会更好47.建议最好流水线操作,确保每一个步骤都是同一个人做到底的,比如插块法,可以一个人切,一个人塞瘤块,一个人接种;比较忌讳每个人自己切自己塞自己接种,然后只做一部分的动物48.B16是小鼠黑色素瘤,宿主一般多用C57小鼠,因为这个肿瘤的细胞是黑色的,用它做肺转移,在白色的肺叶上是黑色的转移灶,很容易分辨。