化学知识点测试:氯气与碱溶液的反应
- 格式:docx
- 大小:117.58 KB
- 文档页数:10
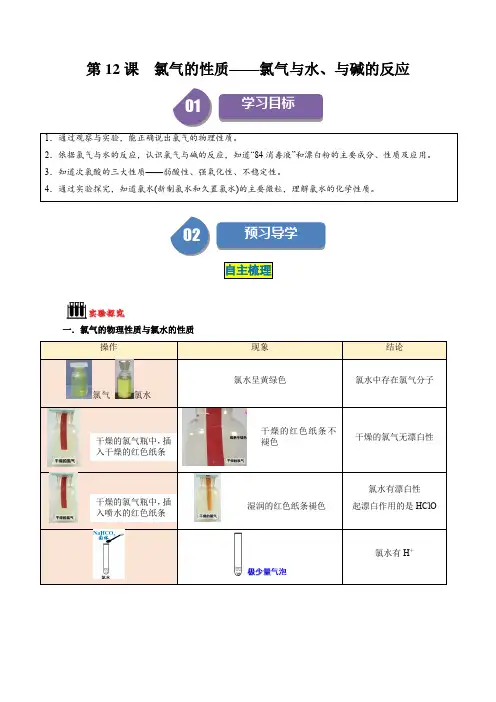


第2课时氯气与碱反应及Cl-的检验[学习目标定位]1、依照氯气与水的反应能正确写出氯气与碱[NaOH、Ca(OH)2]反应的化学方程式。
2、明白漂白粉的成分和用途。
3。
学会氯离子的检验方法。
一氯气与碱的反应1。
Cl2与NaOH溶液反应的化学方程式为2NaOH+Cl2===NaCl+NaClO+H2O。
2。
工业上制取漂白粉(Cl2和石灰乳)的原理与上述反应原理相似,则反应的化学方程式为2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O。
3、自来水常用氯气来杀菌消毒,但因氯气的溶解度不大,而且生成的HClO特别不稳定,不便于保存,而次氯酸盐性质稳定,且遇酸或空气中的CO2和水蒸气又可再生成HClO。
因此常用氯气与碱反应制取漂白粉。
归纳总结漂白液(粉)的制取与保存(1)漂白液是NaClO溶液;漂白粉的成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2;漂粉精的主要成分是Ca(ClO)2。
(2)漂白粉的使用原理:利用复分解反应原理和较强酸能够制取较弱酸的原理使Ca(ClO)2转化为HClO进行漂白。
①Ca(ClO)2+2HCl===CaCl2+2HClO,离子方程式:ClO-+H+===HClO。
①Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO(酸性:HClO酸性比H2CO3弱)。
(3)漂白粉保存不当会变质的原因是Ca(ClO)2和空气中的CO2和水蒸气反应生成HClO,易分解。
因此漂白粉和漂粉精的保存方法是密封、避光并置于阴凉干燥处、1、某化工厂生产的漂白粉,产品说明书如下:(1)请您为漂白粉写一份保存、使用的注意事项(不超过30字)___________________。
(2)用化学方程式表示:①漂白粉的生产原理:_______________________________。
①一般情况下,漂白粉失效的主要原因:________________________________________________________________________________________________________________________________________________、答案(1)密封、避光保存在阴凉处,随配随用,勿接触皮肤,不能用以漂洗丝、毛织品等(2)①2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O①Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO、2HClO错误!未定义书签。

第二节第2课时 氯气与碱的反应 氯离子的检验[核心素养发展目标] 1.熟知氯气与碱的反应,漂白粉的主要成分、漂白原理及保存方法。
2.通过对比实验掌握氯离子的检验方法,培养证据推理与科学探究能力。
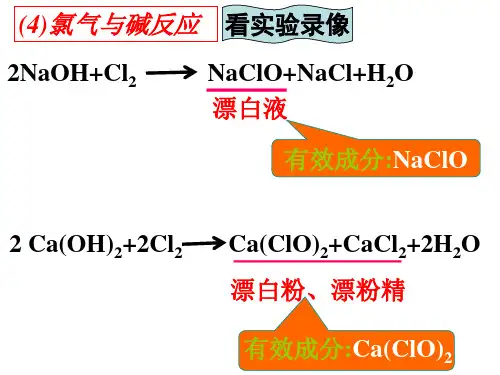
知识梳理一、氯气与碱的反应1.与氢氧化钠溶液反应——制取漂白液(1)制取反应的化学方程式:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
(2)漂白液的有效成分是次氯酸钠。
2.与石灰乳反应——制取漂白粉(1)制取反应的化学方程式:2Ca(OH)2+2Cl 2===CaCl 2+Ca(ClO)2+2H 2O 。
(2)漂白粉的主要成分是CaCl 2、Ca(ClO)2,有效成分是Ca(ClO)2,漂粉精的主要成分是Ca(ClO)2。
(3)漂白粉的漂白原理:利用复分解反应原理,漂白粉中的次氯酸钙与酸(如盐酸或碳酸等)反应生成具有漂白性的次氯酸。
(4)漂白粉的保存:漂白粉应密封、避光保存,并置于阴凉干燥处。
1.漂白粉长期露置于空气中,最终会失效,写出失效所发生的化学方程式。
提示 Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClO ;2HClO=====光照2HCl +O 2↑。
2.用次氯酸盐而不用氯水作漂白剂的优点是什么?工业制取漂白粉时,为什么用石灰乳而不用澄清石灰水?提示 便于保存且使用时生成的次氯酸浓度比氯水中的大。
Ca(OH)2在水中溶解度小,用石灰乳可以更好的(吸收Cl 2)制取漂白粉。
3.氯气及含氯化合物常被用来杀菌、消毒。
(1)我国多数地区的自来水厂使用氯气杀菌、消毒。
氯气和水反应生成具有杀菌作用的物质是___________。
(2)工业上将氯气通入氢氧化钠溶液中制取消毒液,反应的化学方程式是_________________,其中氧化剂是________;消毒液中的有效成分是______(填名称)。
(3)使用氯水消毒不如用消毒液方便,原因是_________________________________________。





氯气与NaOH反应的离子方程式
NaOH与氯气反应的离子方程式为:
2NaOH(溶液)+Cl2(气体)→2NaCl(溶液)+H2O(液体)
1. 两者的反应特点
(1)反应前:
氯气是一种深蓝色气体,无色可溶于水,比较容易挥发;NaOH是白色固体,可溶于水,质感沉重,无异味。
(2)反应中:
NaOH溶液与氯气反应后,可以看到NaOH溶液由白色改变为乳白色,产生由NaCl溶液,以及氯气反应后生成的H2O。
2. 离子方程式推导
NaOH属于强碱,在溶解过程中,NaOH会将其大部分离子化为Na+和OH-,其离子方程式为:
NaOH(溶液)+H2O(液体)→Na+(aq)+ OH-(aq)
氯气是一种深蓝色气体,在溶解过程中氯气会离子化,其离子方程式
为:
Cl2(气体)→2Cl-(aq)
最终,NaOH与Cl2的反应离子方程式为:
2NaOH(溶液)+Cl2(气体)→2NaCl(溶液)+H2O(液体)
3. 反应的热化学
NaOH与氯气反应的化学反应热为-412.6kJ·mol-1,反应的热力学分析可由以下方程式表示:
2NaOH(溶液)+Cl2(气体)→2NaCl(溶液)+H2O(液体)
ΔH=-412.6kJ·mol-1
可以看出,NaOH与氯气反应是一个负的热化学反应,即化学反应是化合反应;这表明,两者之间存在着化学相互作用,可以继续促进反应的进行。
4. 用途
NaOH与氯气反应的产物,即NaCl溶液,可以用来分离金属氯化物,也有被用于农业肥料、纺织原料、无机宝石、洗涤用品等方面。

氯气和氢氧化钠反应方程式是什么
氯气和氢氧化钠反应的化学方程式如下:1、2NaOH+Cl2=NaCl+NaClO+H2O2、6NaOH+3Cl2=5NaCl+NaClO3+3H2O(条件:加热)氯气,化学式为Cl₂。
常温常压下为黄绿色,有强烈刺激性气味的剧毒气体,具有窒息性,密度比空气大,可溶于水和碱溶液,易溶于有机溶剂。
氯气和氢氧化钠反应方程式
氯气和氢氧化钠反应的化学方程式如下:
1、2NaOH+Cl2=NaCl+NaClO+H2O
2、6NaOH+3Cl2=5NaCl+NaClO3+3H2O(条件:加热)
氯气和氢氧化钠反应的离子方程式如下:
1、2OH-+Cl2=Cl-+ClO-+H2O
2、6OH-+3Cl2=5Cl-+ClO3-+3H2O(条件:加热)
氯气和氢氧化钠的性质
氯气,化学式为Cl₂。
常温常压下为黄绿色,有强烈刺激性气味的剧毒气体,具有窒息性,密度比空气大,可溶于水和碱溶液,易溶于有机溶剂(如二硫化碳和四氯化碳),易压缩,可液化为黄绿色的油状液氯,是氯碱工业的主要产品之一,可用作为强氧化剂。
氢氧化钠,化学式为NaOH,俗称烧碱、火碱、苛性钠,为一种具有强腐蚀性的强碱,一般为片状或块状形态,易溶于水(溶于水时放热)并形成碱性溶液,另有潮解性,易吸取空气中的水蒸气(潮解)和二氧化碳(变质),可加入盐酸检验是否变质。
氢氧化钠是危化品吗
氢氧化钠是危化品。
侵入途径:吸入、食入。
健康危害:该品有强烈刺激和腐蚀性。
粉尘或烟雾会刺激眼和呼吸道,腐蚀鼻中隔,皮肤和眼与NaOH 直接接触会引起灼伤,误服可造成消化道灼伤,粘膜糜烂、出血和休克。
分解产物:可能产生有害的毒性烟雾。
cl2和氢氧化钠反应
摘要:
1.氯气和氢氧化钠的反应概述
2.反应原理
3.反应条件
4.反应产物
5.安全注意事项
正文:
氯气(Cl2) 和氢氧化钠(NaOH) 反应是一种常见的化学反应,可用于制备多种化合物。
以下是关于这个反应的详细信息。
1.氯气和氢氧化钠的反应概述
氯气和氢氧化钠反应可以生成氯化钠、次氯酸钠和水。
这个反应通常被写成化学方程式:
Cl2 + 2NaOH → NaCl + NaClO + H2O
2.反应原理
氯气和氢氧化钠反应是一种氧化还原反应。
在这个反应中,氯气被还原为氯化物离子(Cl-),而氢氧化钠被氧化为次氯酸根离子(ClO-)。
3.反应条件
这个反应需要氢氧化钠和氯气的存在。
反应条件通常包括温度和压力的控制。
在实验室中,这个反应通常在室温下进行,并且需要使用适当的安全设备。
4.反应产物
氯气和氢氧化钠反应的产物包括氯化钠、次氯酸钠和水。
这些产物可以用于制备其他化合物,例如漂白剂和清洁剂。
5.安全注意事项
氯气和氢氧化钠反应是一种危险的化学反应,需要谨慎操作。
必须穿戴适当的实验室服装和安全眼镜,并且必须在通风良好的环境下进行。
在操作过程中,应该避免直接接触反应物和产物,并且应该遵循实验室的安全规定。
氯气和氢氧化钠反应是一种常见的化学反应,可以用于制备多种化合物。
naoh与氯气反应方程式
NaOH与氯气反应方程式如下:
NaOH(溶液)+ Cl2(气体)→ NaCl(溶液)+ H2O(液体)
NaOH是一种常见的阴离子表面活性剂,也称为碱性溶剂,具有显
著的乳化特性。
NaOH和氯气之间的反应是一种完全反应,该反应使用
质量平衡方程来描述:
NaOH(溶液) + Cl2(气体)= NaCl(溶液) + H2O(液体)
该反应不发生转化,因此不发生能量突变,其温度也不会升高。
当NaOH与氯气反应时,NaOH中的氯离子与氯气在溶液中放出H+和Cl-。
这些离子参与下面的反应:
NaOH + HCl → NaCl + H2O
此外,NaOH和氯气之间的反应可以通过加上热量来加速。
氯气可
以将NaOH中的氢离子反应出H2O和Cl-,发生氢氧化反应:2NaOH + Cl2 → 2NaCl + 2H2O
NaOH反应具有乳化性和脱水作用,该反应通常伴随着大量的放热,可以将NaOH转化为氯化钠,而水则被完全抽走。
NaOH反应可以用氯气
很快完成,因此NaOH与氯气的反应通常是一种快速反应。
第二节 氯及其化合物第2课时 氯气与碱的反应 氯离子的检验1.下列生活中的物质与其有效成分的化学式、用途的对应关系中,不正确的是选项A B C D 生活中的物质食盐小苏打复方氢氧化铝片漂白粉有效成分的化学式NaCl 23Na CO ()3Al OH ()2Ca ClO 用途做调味品做发酵粉做抗酸药做消毒剂2.如图所示,从a 处通入新制备的2Cl ,关闭b 阀时,c 处的干燥红色布条看不到明显现象;当打开b 阀后,c 处红色布条逐渐褪色。
d 瓶中装的是( )①浓硫酸 ②NaOH 溶液 ③2H O ④饱和NaCl 溶液A.①③ B.②④ C.①②D.③④3.发生氯气泄漏时,下列防护措施合理的是( )①及时转移疏散人群,同时向有关部门如实报告事故有关情况 ②被转移人群应戴上用浓NaOH 处理过的口罩 ③用高压水枪向空中喷洒含碱性物质的水溶液 ④被转移人群应戴上用Na 2CO 3处理过的口罩(湿润)⑤将人群转移到地势较低的地方即可,不必走太远 ⑥及时清理现场,检查水源和食物等是否被污染 ⑦常温下氯气能溶解于水,所以只要向空气中喷洒水就可以解毒A .②③④⑤B .①③④⑥C .①②⑤⑥D .①③⑤⑦4.下列关于氯及其化合物的叙述正确的是A .氯气无漂白性,而次氯酸有,因此氯水能使鲜花褪色而干燥的氯气不行B .漂白粉的主要成分是Ca(ClO)2,主要用于杀菌消毒C .工业生产中不是将氯气通入澄清石灰水中来制取漂白粉D .漂白液和洁厕灵(主要含HCl)两种都是消毒剂,一起用效果更好5.下列说法正确的是A .漂白粉是纯净物,84消毒液是混合物,两者都可以长期保存B.漂白粉中含有次氯酸,所以漂白粉能使有机色质褪色C.工业上将氯气通入澄清石灰水中制取漂白粉D.漂白粉在空气中容易失效的原因是Ca(ClO)2与CO2、H2O反应生成的HClO不稳定6.下列关于含氯消毒剂的解释不正确的是A.“84”消毒液不能与洁厕灵混合使用:2H++Cl-+ClO-=Cl2↑+H2OB.工业上将氯气通入石灰乳制取漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OC.氯水应避光保存的原因是:2HClO 光照H2O+Cl2↑D.氯气意外发生泄漏,可用浸有一定浓度NaHCO3溶液的毛巾捂住鼻子,向高处转移7.(2021·洮南市第一中学高一月考)某溶液中含有较大量的Cl-、23CO 、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。
氯气和碱反应氯气和碱反应:氯气与碱发生氧化还原反应,Cl2既做氧化剂又作还原剂.属于氧化还原反应中的歧化反应。
典型的就是,制取漂白液漂白粉的反应啊。
制取漂白液:Cl2通入NaOH溶液中Cl2+2NaOH=NaCl+NaClO+H2O制取漂白粉:Cl2通入石灰乳(Ca(OH)2悬浊液)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O需要注意的是如果温度比较高,不生成次氯酸盐,而生成氯酸盐,甚至可能生成高氯酸盐。
氯气与碱反应:【题目】:(1)Cl2通入NaOH溶液反应制得漂白液化学方程式:___(实验室吸收多余氯气)离子方程式:___漂白液的有效成分:___(2)Cl2通入冷的消石灰反应制得漂白粉或漂白精化学方程式:___漂白粉或漂白精的有效成分是:___漂白粉或漂白精的密封保存原因:Ca(ClO)2+H2O+CO2═___.【答案解析】:(1)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,其反应方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,其反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;漂白液中的次氯酸钠具有强氧化性,能漂白,所以漂白液的有效成分为NaClO;故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;Cl2+2OH-=Cl-+ClO-+H2O;NaClO;(2)氯气与消石灰反应生成CaCl2、Ca(ClO)2、H2O,其反应的方程式为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;漂白粉的有效成分为Ca(ClO)2;次氯酸钙能与空气中的二氧化碳、水反应,所以要密封保存,其反应的方程式为:Ca(ClO)2+H2O+CO2═2HClO+CaCO3↓;故答案为:Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2;2HClO+CaCO3↓。
(1)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;(2)氯气与消石灰反应生成CaCl2、Ca(ClO)2、H2O,次氯酸钙能与空气中的二氧化碳、水反应,所以要密封保存。
氯气与氢氧化钠的反应方程式
答案:
1、Cl₂+H₂O=HCl+HClO,
2、HCl+NaOH=NaCl+H₂O,
3、HClO+NaOH=NaClO+H₂O,
总反应方程式为:Cl₂+2NaOH=NaCl+NaClO+H₂O。
分析:氯气的物理性质:
1、状态
常温常压下为有强烈刺激性气味的黄绿色的气体。
2、密度
氯气密度是空气密度的2.5倍,标况下ρ=3.21g/cm³。
3、易液化
熔沸点较低,常温常压下,熔点为-101.00℃,沸点-34.05℃,常温下把氯气加压至600~700kPa或在常压下冷却到-34℃都可以使其变成液氯,液氯是一种油状的液体,其与氯气物理性质不同,但化学性质基本相同。
4、溶解性
可溶于水,易溶于有机溶剂(例如:四氯化碳)难溶于饱和食盐水。
1体积水在常温下可溶解2体积氯气,形成黄绿色氯水,密度为 3.170g/L,比空气密度大。