湖北省武汉市部分学校2018届高三起点调研考试化学试卷附答案
- 格式:doc
- 大小:352.04 KB
- 文档页数:8

化学试题武昌区2018届高三年级元月调研理科综合试卷评分标准一、选择题:本大题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
26.(15分)(1)Mg2B2O5·H2O+2NaOH === 2NaBO2+2Mg(OH)2↓(2分)(2)2Na++4BO2-+2CO2+11H2O === Na2B4O7·10H2O↓+2HCO3-(2分)(3)c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3) (2分)(4)利用强酸制备弱酸H3BO3 (1分)(5)①淀粉溶液(1分)溶液由蓝色恰好变为无色(1分)②79.2%(2分)(6)NaBO3·H2O(1分)解题过程 (3分)解:T 3时 n (Na)=molg ×g /23℅230.20= 0.2 mol (1分)则30.80 g 样品中,依n (Na)∶ n (B)∶n (H)∶n (O)=l ∶1∶n ∶7可得 0.2 mol × 23 g/mol + 0.2 mol × 11 g/mol + 0.2n × 1g/mol + 7 × 0.2 mol × 16 g/mol = 30.80 g解得n = 8故原晶体为NaBO 3·4H 2O (1分) 设T 3时晶体的化学式为NaBO 3·m H 2O 则由T 3时晶体中钠元素的质量分数可得m1848112323+++× 100% = 23% 解得m = 1所以T 3时晶体的化学式为NaBO 3·H 2O (1分) 27.(14分)(1)加热(2分)(2)①1.33或34 (2分,若书写单位且正确得2分,单位错误不得分) ②C 、D (2分)(3)①B 、D (2分)②CH 3OCH 3-12e -+16OH -=== 2CO 32-+11H 2O (2分) ③C (2分) (4)CH 3OCH 3(g)+3O 2(g) === 2CO 2(g)+3H 2O(l) ΔH =-1454.98 kJ/mol (2分) 28.(14分)(1)减少副产物乙醚生成(1分)(2)b 中长直玻璃管内有一段液柱上升(1分)过度冷却,产品1 , 2-二溴乙烷在装置d 中凝固(1分) 防止倒吸(1分)(3)吸收乙烯气体中含有的CO 2、SO 2等酸性气体(2分)(4)①浓硫酸将部分乙醇氧化 ②发生副反应生成乙醚 ③乙醇挥发④乙烯流速过快,未完全发生加成反应(2分) (5)乙醚(2分) D (2分)(6)液封Br 2及1 , 2-二溴乙烷(2分)36.【化学——选修2 化学与技术】(15分)(1)不是(1分) C (1分)(2)A 、B 、C 、D (全选给3分,漏选给2分)(3)2NaClO 3+4HCl(浓) === 2NaCl +Cl 2↑+2ClO 2↑+2H 2O (2分) (4)2NaClO 2+Cl 2 === 2NaCl +2ClO 2 (2分)产率高,易于分离,没有产生毒副产品 (2分)(5)H 2C 2O 4+2NaClO 3+H 2SO 4=== Na 2SO 4+2CO 2↑+2ClO 2↑+2H 2O (2分)反应过程中生成的二氧化碳起到稀释作用 (2分)37.【化学——选修3 物质结构与性质】(15分)Ⅰ.(1)M (1分) 9(2分) (2)cd (2分)(3)N 、F 、H 三种元素的电负性为F > N >H ,在NF 3中,共用电子对偏向F ,偏离N 原子,使得氮原子上的孤电子对难于与Cu 2+形成配位键(2分)Ⅱ.(1)8(2分)3r (2分)(2)%100)()(32333⨯++⨯b a b a π(2分)(3)26% 或%100211921333⨯-(2分)38.【化学——选修5 有机化学基础】(15分)。

湖北省武汉市部分学校2018届高三9月起点调研考试化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 K 39 Cr 52Fe 56 Cu 64 Ag 108第I 卷(选择题,共42分)一、选择题(本大题共14小题,每小题 3 分,共42 分。
在每小题给出的四个选项中,只有一项是符合题.要求的)1.下列有关生产和生活的说法中,不正确的是A.肉制品加入适量的食盐可以防腐B. “可燃冰”是一种烃类化合物C.燃煤中加入生石灰可有效减少污染物的排放D.煤的气化、液化和干馏是实现煤的综合利用的主要途径2.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和槽人甑,蒸令气上,,其清如水,味极浓烈,盖酒露也。
”这里所用的“法”是指A.萃取B.渗析C.蒸馏 D.干馏3.设NA为阿伏加德罗常数的值。
下列说法正确的是A.常温下,23gNO2含有NA个氧原子B.标准状况下,将22.4 LNO和11.2LO2混合后,可以得到NA个NO2分子C.常温常压下,1L0.1mol/LHF溶液中含有0.1NA个H+D.0.1mol的羟基中含有电子的数目为NA4.下列关于有机化合物的说法中,正确的是A.乙醇与浓硫酸制乙烯的反应是取代反应B.用新制备的氢氧化铜悬浊液可以检验淀粉是否完全水解C. 的二氯代物有6种D. 的名称为:3,3,4—三甲基己烷5.利用如图所示装置进行下列实验,能得出相应实验结论的是选项①②③实验结论A 酸性高锰酸钾浓盐酸NaHCO3溶液Cl2与水反应生成酸性物质B 浓硫酸蔗糖澄清石灰水浓硫酸具有脱水性、氧化性C 浓硝酸铁片NaOH溶液铁和浓硝酸反应可生成NOD 稀盐酸Na2CO3 Na2SiO3溶液非金属性:Cl>C>Si·1·6.某温度下,将 1.1molI2加入到氢氧化钾溶液中,反应后得到KI、KIO、KI03的混合溶液。

2018届武汉市部分高中高三年级元调考试模拟训练化学试卷2018届武汉市部分高中高三年级元调考试模拟训练化学试卷本试卷共300分,考试用时150分钟。
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(必考题和选考题)两部分。
第Ⅰ卷1 至5 页,第Ⅱ卷6至16页。
本卷共16页。
第Ⅰ卷(选择题共126分)本卷共21小题,每小题6分,共126分。
可能用到的相对原子质量:H 1Li 7 C 12O 16 Na 23 Fe 56Se 79一、选择题:本大题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活、社会发展息息相关。
下列说法不正确...的是A.用SO2漂白过的草帽日久会变色B.用天燃气代替煤作燃料可减少大气污染C.“84消毒液”杀死病菌是因为蛋白质变性D.乙醇用作医用消毒剂时,无水乙醇消毒效果最好8.设N A为阿伏加德罗常数的值。
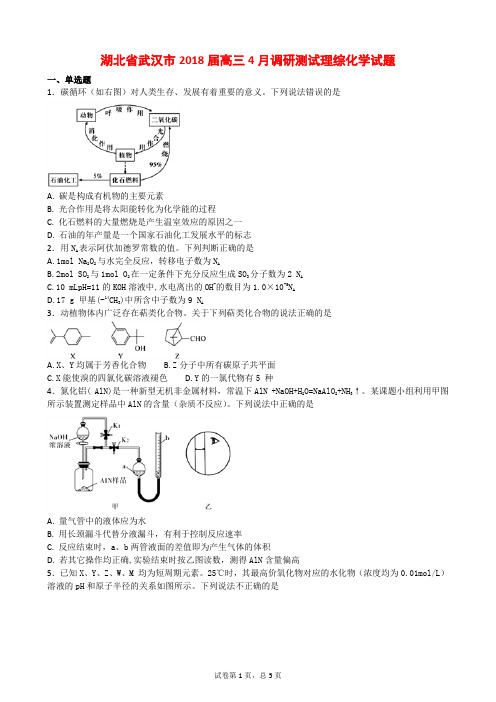
下列有关叙述正确的是A.107 g Fe(OH)3胶体中胶体粒子的数目为N AB .2 mol SO 2 与1 mol O 2反应生成的SO 3分子数为2N AC .14 g 分子式为C n H 2n 的链烃中含有的碳碳双键的数目为n N AD .7.8 g Na 2O 2与足量水反应转移的电子数为 0.2N A9.已知甲苯的结构简式为,其二氯代物的同分异构体有A .7种B .8种C .9种D .10种 10.下列选用的仪器和药品能达到实验目的的是AB C D尾气吸收Cl 2 吸收CO 2中的HCl 杂质 蒸馏时的接收装置 乙酸乙酯的收集装置 11.碱性硼化钒—空气电池工作时反应为:4VB 2+11O 2===4B 2O 3+2V 2O 5,室温下用该电池为电源,用惰性电极电解饱和氯化钠溶液,装置如图。
当外电路中通过0.04 mol 电子时,乙装置中溶液的体积为400 mL 。
则下列说法正确的是A .外电路中电子由a 电极流向b 电极B .c 电极上生成气体的体积为4.48 L —CH 3 NaOH 溶液 饱和NaHCO 3饱和碳酸钠溶液 VB 2电极 a KOH 溶液空气 甲 b cNaCl 溶液乙W、X原子的最外层电子数之比为5∶2,Z原子比X原子的核外电子数多5。

武汉市部分学校新高三起点调研测试化学试卷第I卷(选择题,共42分)一、选择题(本大题共14 小题,每小题 3 分,共42 分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1. 化学与社会、生产、生活和科技密切相关。
下列有关说法错误的是A .食醋又称为冰醋酸,易溶于水和乙醇.B.干冰、AgI都可用于人工降雨,但原理不同C.可燃冰(CH4•nH2O )属于新型的一次能源D.家用不粘锅的保护膜氟纶()属于有机高分子材料2.下列有关化学用语的表示正确的是A.乙烯的结构简式:C2H4B. HClO的电子式为:C.质子数与中子数相等的硫原子:D.的名称:2一乙基丙烷3.下列有关物质性质的叙述错误的是A.淀粉和纤维素水解的最终产物均为葡萄糖B.向蔗糖中加入浓硫酸发生一系列变化,体现了浓硫酸的脱水性和强氧化性C.明矾净水是因为KAl(SO4)2•12H2O 溶于水可形成Al (OH)3胶体D.乙硫醇(C2H5SH)的沸点比乙醇的高4.短周期主族元素X、Y、Z、W 原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表ⅢA 族,W 与X 属于同一主族。
下列说法正确的是A.原子半径:r ( W ) <r ( Y ) < r ( Z )B.由X、Y 组成的化合物中只含离子键C.Z 的最高价氧化物水化物的碱性比Y的强D.由Z、W 组成的化合物不能在水溶液中制备5.在给定条件下,下列选项所示的物质间转化均能实现的是A.B.C.D.6 .某有机化工原料的结构简式如下图所示。
下列关于该有机物说法正确的是A.不能与芳香族化合物互为同分异构体B.能与嗅水反应,最多生成3 种产物C.所有原子可能共平面D.一定条件下可以发生加成反应、加聚反应和氧化反应7.白磷在过量氢氧化钾溶液中可以发生反应:。
若用N A表示阿伏加德罗常数的值。
下列说法错误的是A.3.1g白磷所含共价键的数目为0.15N AB.10 mL pH = 11的KOH溶液稀释100倍,水电离的OH-的数目约为10-5N AC.2.8 g KOH 参加反应转移的电子数为0.05 N AD.KH2PO2为正盐,且10.4 g该固体物质中含离子数目为0.2 N A8.下列装置为某实验小组设计的Cu-Zn 原电池,关于其说法错误的是A.装置甲中电子流动方向为:Zn→电流表→CuB.装置乙比装置甲提供的电流更稳定C.装置乙盐桥中可用装有琼胶的Na2CO3饱和溶液D.若装置乙中盐桥用铁丝替代,反应原理发生改变9.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。

湖北省武汉市部分学校2018届新高三化学起点调研考试试题(扫描版)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(湖北省武汉市部分学校2018届新高三化学起点调研考试试题(扫描版))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为湖北省武汉市部分学校2018届新高三化学起点调研考试试题(扫描版)的全部内容。
以上就是本文的全部内容,可以编辑修改。
高尔基说过:“书是人类进步的阶梯。
”我希望各位朋友能借助这个阶梯不断进步。
物质生活极大丰富,科学技术飞速发展,这一切逐渐改变了人们的学习和休闲的方式。
很多人已经不再如饥似渴地追逐一篇文档了,但只要你依然有着这样一份小小的坚持,你就会不断成长进步,当纷繁复杂的世界牵引着我们疲于向外追逐的时候,阅读一文或者做一道题却让我们静下心来,回归自我。
用学习来激活我们的想象力和思维,建立我们的信仰,从而保有我们纯粹的精神世界,抵御外部世界的袭扰。
The above is the whole contentof this article, Gorky sai d: "the book is the ladder ofhuman progress." I hope you can make progress with the helpof thisladder. Material life is extremely rich, science and technology are developingrapidly, allof which gradually changethe way o fpeople's study and leisure. Many people are no longer eagerto pursue a document, but as long as you still have sucha small persistence, you will continue to grow and progress.When the complexworld leads us to chase out, reading anarticle or doing a problem makes us calmdown and re turn to ourselves.Withlearning,we can activate our imagination and thinking, establish our belief,keep our p ure spiritual world and resist the attack ofthe external wo rld.。
2017-2018学年可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 K 39 Cr 52Fe 56 Cu 64 Ag 108 第I 卷(选择题,共42分)一、选择题(本大题共14小题,每小题3 分,共42 分。
在每小题给出的四个选项中,只有一项是符合题.要求的)1. 下列有关生产和生活的说法中,不正确的是A. 肉制品加入适量的食盐可以防腐B. “可燃冰”是一种烃类化合物C. 燃煤中加入生石灰可有效减少污染物的排放D. 煤的气化、液化和干馏是实现煤的综合利用的主要途径【答案】B【解析】A. 肉制品加入适量的食盐氯化钠可以防腐,A正确;B. “可燃冰”是甲烷的水合物,不是一种烃类化合物,B错误;C. 燃煤中加入生石灰可以吸收二氧化硫最终转化为硫酸钙,因此可有效减少污染物的排放,C正确;D. 煤的气化、液化和干馏是实现煤的综合利用的主要途径,D正确,答案选B。
2. 我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和槽人甑,蒸令气上……其清如水,味极浓烈,盖酒露也。
”这里所用的“法”是指A. 萃取B. 渗析C. 蒸馏D. 干馏【答案】C【解析】乙醇和水的沸点相差较大,因此涉及的操作方法是蒸馏,答案选C。
点睛:掌握常见物质分离与提纯的方法是解答的关键,易错选项是A,注意萃取与蒸馏的区别,蒸馏是依据混合物中各组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,二者的原理是不同的。
3. 设N A为阿伏加德罗常数的值。
下列说法正确的是A. 常温下,23gNO2含有N A个氧原子B. 标准状况下,将22.4 LNO和11.2LO2混合后,可以得到N A个NO2分子C. 常温常压下,1L0.1mol/LHF溶液中含有0.1N A个H+D. 0.1mol的羟基中含有电子的数目为N A【答案】A【解析】A. 常温下,23gNO2的物质的量是0.5mol,虽然与N2O4之间存在平衡关系,但根据氧原子守恒可知含有N A个氧原子,A正确;B. 标准状况下,将22.4 LNO和11.2LO2混合后生成1molNO 2,但由于存在平衡关系:2NO2N2O4,因此得到的NO2分子个数小于N A个,B 错误;C. HF是弱电解质,存在电离平衡,因此常温常压下,1L0.1mol/LHF溶液中含有的氢离子个数小于0.1N A个,C错误;D. 0.1mol的羟基中含有电子的数目为0.9N A,D错误,答案选A。
湖北省部分重点中学2018届高三第一次联考高三化学试卷参考答案和评分标准一、选择题(每题3分,共42分)1. A2. C3. D4.B5. C6. C7.C8. D9. B 10. B 11.A 12.C 13.B 14.C二、非选择题(共58分)15.(11分)(1)HClO4(1分) S2-(1分)(2)H∶C⋮⋮C∶H(1分)(3)N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-640 kJ/mol(2分)(4)0.046(2分)(5)①2ClO2+2I-===2ClO2-+I2(1分)② ClO2-+4I-+4H+===Cl-+2I2+2H2O(1分)③0. 68(2分)16.(10分)(1)ab(1分)(2)0.075(2分) 0.56 (2分)(3)8.1(1分),玻璃棒、100ml容量瓶、胶头滴管(2分,答对2个给1分)(4)稀硫酸、酸性KMnO4溶液(1分)稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色(1分)17.(11分)(1)a d(1分)(2)①AS2S3(1分)②AS4S4+7O2===2AS2O3+4SO2(2分)(3)①6FeCl3+Bi2S3===2BiCl3+6FeCl2+3S(2分)②2Bi3++3Fe===3Fe2++2Bi(2分) Cl2(1分)③Pb-2e-===Pb2+(1分) Pb2++2e-===Pb (1分)18. (12分)(1)e接d,c接a,b接i,h接g ( 2分)(2)a(1分) 催化剂(1分)(3)通过观察气泡控制气流速度(或比例)( 1分); SO2Cl2+2H2O===H2SO4+2HCl(1分) (4)合理,因为硫酰氯易分解,这样可防止硫酰氯分解( 1分)(5)吸收多余SO2、Cl2,防止污染;防止水蒸气进入收集器使产品水解。
( 2分,只答对其中一点给1分)(6)①蒸馏(1分)②取适量产品充分加热后加水稀释,分成两份,一份滴加紫色石蕊试液变红,另一份加入BaCl 2溶液产生白色沉淀,说明含有H 2SO 4 (2分)19.(14分)(1)A (1分)(2)343c b a -+或-33c 4b a --(2分) (3)B (1分) A (1分) C 12H 22O 11-48e −+13H 2O===12CO 2↑+48H +(2分) Mn 2++2H 2O -2e -===MnO 2+4H +(2分)不变(1分) 89(2分) (4) 87 (2分)。
湖北省部分重点中学2017-2018学年度上学期新高三起点考试本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分100分。
考试用时90分钟。
答卷前,考生务必将自己的姓名、准考证号写在试题卷和答题卡上,并将准考证号条形码粘贴在答选择题选出答案之后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净选择题(本大题共14小题,每小题3分,共42分。
在每小题给出的四个选项中,只有一个选项符机高分子材料是同素异形体⑥糖类、蛋白质、油脂属于天然高分子化合物素组成的物质一定为纯净物⑤石墨和C60,下列推断不合理的是D为金属元素,且D原子最外层电子数等于其 K 层电子数;若往 E 单质的水溶液中滴加少量紫色石蕊试液,可观。
下列说法正确的是系如右图所示,则下列说法正确的是。
利用传感器测得滴定过程中溶液的电导率如图所示。
下列说法正确的是( )非选择题(包括必考题和选考题两部分,第15题~第19题为必考题,每个考生都必须作答,第2必考题(本题包括5小题,共43分)族,Z2-电子层结构与氖原子相同。
湿润的红色石蕊试纸变蓝的气体。
p的化学式为。
达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为。
和H2O,CO和H2O浓度变化如图所示:(2)中平衡时相同,则a= mol,b= mol。
,则阴极的电极反应式为。
酸钠反应生成气体的成分。
已知NO2和NO液化温度分别为21 ℃和-152 ℃。
______;仪器的连接顺序(按左→右连接)为A→________→________→________→B;_______________________________;(1)金属M为(2)加入H2O2的作用是(3)CoC2O4﹒2H2O高(4)已知Li2CO3微溶于_____________________________。
当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=________。
绝密★启用前【全国校级联考】湖北省部分重点中学2018届高三起点考试化学试题试卷副标题考试范围:xxx ;考试时间:63分钟;命题人:xxx学校:___________姓名:___________班级:___________考号:___________注意事项.1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上第I 卷(选择题)一、选择题(题型注释)1、某学习兴趣小组讨论辨析以下说法,其中说法正确的是 ①通过化学变化可以实现16O 与18O 间的相互转化 ②灼烧钠的化合物时,火焰呈黄色,发生化学反应 ③碱性氧化物一定是金属氧化物 ④只由一种元素组成的物质一定为纯净物 ⑤石墨和C 60是同素异形体⑥糖类、蛋白质、油脂属于天然高分子化合物A .③⑤⑥B .①②C .③⑤D .①③④2、化学与科技、医药、工业生产均密切相关。
下列有关叙述正确的是A .2017年4月26日,中国第二艘航母举行下水仪式,该航母使用了素有“现代工业的骨骼”之称的碳纤维。
碳纤维是一种新型的有机高分子材料B .离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜试卷第2页,共10页C .半导体行业中有一句话:“从沙滩到用户”,计算机芯片的主要材料是经提纯的SiO 2D .获得2015年诺贝尔生理学、医学奖的屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理3、用下列装置不能达到实验目的的是( )A .用甲图装置可证明ρ(煤油)< ρ(钠) < ρ(水)B .用乙图装置制备Fe(OH)2C .用丙图装置制取金属锰D .用丁图装置制取氯气4、最新报道:科学家首次用X 射线激光技术观察到CO 与O 在催化剂表面形成化学键的过程。
反应过程的示意图如下:下列说法正确的是A .CO 和O 生成CO 2是吸热反应B .在该过程中,CO 断键形成C 和O C .CO 和O 生成了具有极性共价键的CO 2D .状态Ⅰ→状态Ⅲ表示CO 与O 2反应的过程5、25 ℃时,下列各组离子在指定溶液中一定能大量共存的是 A .pH =1的无色溶液中:Na +、Cu 2+、Cl -、COB .使酚酞呈红色的溶液中:K +、Na +、NO 、Cl-C .0.1 mol·L -1的FeCl 2溶液中:H +、Al 3+、SO 、S 2-D .由水电离出的c (H +)=1×10-10mol·L -1的溶液中:Mg 2+、NH 、SO 、HCO6、N A 为阿伏伽德罗常数的值,下列叙述正确的是 A .12g 金刚石中含有C-C 键数目为2N AB .标准状况下,22.4 L 己烷含有的共价键数目为19 N AC .1L pH=13的NaOH 溶液中含有OH -的数目一定为0.1 N AD .1mol 的 Na 2O 和BaO 2混合物中含有的阴、阳离子总数为3N A7、现有Al 、Cl 2、Al 2O 3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间的关系如图所示,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是A .X 可能为Al 或Cl 2B .Y 一定为NaOH(aq)C .N 一定是HCl(aq)D .Q 、Z 中的一种必为Al 2O 38、下列表示对应化学反应的离子方程式正确的是 A .在FeCl 3溶液中投入足量的Zn 粉:2Fe 3++Zn=Zn 2++2Fe 2+B .NaHSO 4溶液与Ba(OH)2溶液混合后呈中性:2H ++ SO 42-+ Ba 2++2OH -=BaSO 4↓+2H 2OC .磁性氧化铁(Fe 3O 4)溶于氢碘酸:Fe 3O 4+8H +=Fe 2++2Fe 3++4H 2OD .Ca(ClO)2溶液中通入少量SO 2:Ca 2++2ClO -+SO 2+H 2O=CaSO 3↓+2HClO9、已知苯乙烯的结构为。
湖北省武汉市部分学校2018届高三9月起点调研考试化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 K 39 Cr 52Fe 56 Cu 64 Ag 108第I 卷(选择题,共42分)一、选择题(本大题共14小题,每小题3 分,共42 分。
在每小题给出的四个选项中,只有一项是符合题.要求的)1.下列有关生产和生活的说法中,不正确的是A.肉制品加入适量的食盐可以防腐B. “可燃冰”是一种烃类化合物C.燃煤中加入生石灰可有效减少污染物的排放D.煤的气化、液化和干馏是实现煤的综合利用的主要途径2.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和槽人甑,蒸令气上……其清如水,味极浓烈,盖酒露也。
”这里所用的“法”是指A.萃取B.渗析C.蒸馏 D.干馏3.设NA为阿伏加德罗常数的值。
下列说法正确的是A.常温下,23gNO2含有NA个氧原子B.标准状况下,将22.4 LNO和11.2LO2混合后,可以得到NA个NO2分子C.常温常压下,1L0.1mol/LHF溶液中含有0.1NA个H+D.0.1mol的羟基中含有电子的数目为NA4.下列关于有机化合物的说法中,正确的是A.乙醇与浓硫酸制乙烯的反应是取代反应B.用新制备的氢氧化铜悬浊液可以检验淀粉是否完全水解C. 的二氯代物有6种D. 的名称为:3,3,4—三甲基己烷5.利用如图所示装置进行下列实验,能得出相应实验结论的是选项①②③实验结论A 酸性高锰酸钾浓盐酸NaHCO3溶液Cl2与水反应生成酸性物质B 浓硫酸蔗糖澄清石灰水浓硫酸具有脱水性、氧化性C 浓硝酸铁片NaOH溶液铁和浓硝酸反应可生成NOD 稀盐酸Na2CO3 Na2SiO3溶液非金属性:Cl>C>Si6.某温度下,将1.1molI2加入到氢氧化钾溶液中,反应后得到KI、KIO、KI03的混合溶液。
经测定IO-与IO3-的物质的量之比是2:3。
下列说法错误的是A. I2在该反应中既做氧化剂又做还原剂B.I2的还原性大于KI的还原性,小于KIO和KI03的还原性C.该反应中转移电子的物质的量为1.7molD.该反应中,被还原的碘元素与被氧化的碘元素的物质的量之比是17:57.已知W、X、Y、Z为短周期元素,原子序数依次增大。
W、Z同主族,X、Y、Z同周期,其中只有X 为金属元素。
下列说法一定正确的是A.原子半径:X>Y>Z>WB.W的含氧酸的酸性比Z的含氧酸的酸性强C. W的气态氢化物的稳定性小于Y的气态氢化物的稳定性D.若W与X原子序数差为5,则形成化合物的化学式为X3W28.在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。
下列说法不正确的是A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除B.图中b点碳酸钙的结晶速率大于其溶解速率C.通过蒸发,可使溶液由a点变化到c点D.在25℃时,反应CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常数K=32509.下列有关实验操作的叙述中,正确的是A.用苯萃取碘水时,有机层从分液漏斗下口放出B.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中C.用50mL的量筒量取6.8mL盐酸D.中和滴定实验中,眼睛应注视锥形瓶内溶液颜色的变化10.下列离子方程式书写正确的是A.过量的SO2通入NaOH溶液中:SO2+ 2OH-=SO32-+H2OB.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2OD. NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-11.常温下,下列各组离子在指定溶液中一定能大量共存的是A.使甲基橙试液变红的溶液中:I-、Fe2+、NO3-、Na+B.含有大量Na+的溶液中:NH4+、HCO3-、SO42-、AlO2-C.水电离出c(H+)=1.0×10-12mol/L的溶液中:Cl-、Na+、ClO-、NH4+D.澄清透明的溶液中:Cu2+、Fe3+、SO42-、NO3-12A B C D将二氧化硫通入到一定量饱和氯水中将盐酸滴入到NaHCO3和Na2CO3混合溶液中将铜粉加入到一定量浓硝酸中将铁粉加入到一定量氯化铁溶液中13. 298K时,甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100mol/L,含碳元素的粒子的浓度与pH的关系如图所示。
下列说法正确的是A. 298K时,加蒸溜水稀释P点溶液,溶液中n(H+)·n(OH-)保持不变B.0.1mol/LHCOONa溶液中有c(HCOO-)+c(OH-)=c(H+)+c(HCOOH)C.298K时,HCOOH的电离常数Ka=1.0×10-3.75D. 0.1mol/LHCOONa溶液和0.1mol/LHCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)14.利用下图装置进行实验,甲、乙两池中均为1mol/L的AgNO3溶液,A、B均为Ag电极。
实验开始时光闭合K1,断开K2。
一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。
下列说法不正确的是A.闭合K1,断开K2后,B极发生氧化反应B.闭合K1,断开K2后,乙池溶液浓度上升C.闭合K1,断开K2后,NO3-向B电极移动D.闭合K1,断开K2后,当转移0.1mole-时,乙池质量减少17.0g第II卷(非选择题,共58分)二、非选择题(包括必考题和选考题两部分。
第15题一第18题为必考题,每个题考生都必须作答。
第19题、第20题为选考题,考生根据要求作答。
)(一)必考题(本题包括4小题,共43分)15.(10分)三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一。
(l)三氟化氮可由氨气和氟气反应得到: 4NH3+3F2=NF3+3NH4F。
NH3的电子式为______,反应中氨气显示的化学性质有________,当有17.0g氨气发生反应时,转移电子的物质的量为_____。
(2)在潮湿的空气中,NF3能与水蒸气发生反应,产物有HF、NO和一种酸,则被氧化与被还原元素原子的物质的量之比为_________,NF3、F2、NO三种气体氧化性由弱到强的顺序为_______。
(3)三氟化氮在空气中泄露时,很易被发现,依据的现象是____________。
(4)NCl3结构类似NF3,但NCl3中N元素显-3价,NCl3遇水发生反应,目反应为非氧化还原反应,该反应的化学方程式为____________。
16.(10分)二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:I.CO(g)+2H2(g) CH3OH(g)II.2CH3OH(g)===CH3OCH3(g)+H2O(g)(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为____反应(填”吸热”’或”放热”)。
(2)在恒容密闭容器中发生反应I:①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是(填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化B.混合气体的密度不再变化C.混合气体的平均相对分子质量不再变化D.v正(H2)=2v正(CH3OH)(3)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:①0~4min,反应I的v(H2)=______,反应I的平衡常数K=______。
②反应II中CH3OH的转化率α=_______。
(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。
用该电池对铁制品镀铜,当铁制品质量增加64g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
17.(10分)硒(Se)及其化合物在工农业生产中有许多用途。
以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示:回答下列问题:(1)“焙烧”时的硫酸浓度最好为_____(填标号)。
A.浓硫酸 B. 20%硫酸 C.50%硫酸 D. 80%硫酸(2)“焙烧”过程中Cu2Se参与反应时,该反应的氧化产物是_______。
(3)“水吸收”所发生反应的化学方程式为____________。
(4)“过滤”所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。
真空蒸馏的挥发物中硒含量与温度的关系如图所示:蒸馏操作中控制的最佳温度是_____(填标号)。
A.455℃B.462℃C.475℃D.515℃(5)“水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是______,“浸渣”中含有的金属单质是__________。
(6)若“浸出液”中,c(Ag+)=3.0×10-2mol/L,则溶液中c(SO42-)最大为_____(已知:Ksp(Ag2SO4)=1.4×10-5,计算结果保留2位有效数字)。
18.(13分)醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,不溶于水和乙醚(易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,其制备装置如下(已知:Cr3+水溶液颜色为绿色,Cr2+水溶液颜色为蓝色):回答下列问题:(1)装置甲中连通管a的作用是___________。
(2)向三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液:关闭K2打开K1,旋开分液漏斗的旋塞并控制好滴速;当观察到三颈烧瓶中溶液颜色由绿色完全转变为蓝色时,其操作为_____;当观察到装置乙中_____时,关闭分液漏斗的旋塞。
(3)装置乙中反应的离自方程式为_____________。
(4)将装置乙中混合物快速过滤、洗涤和干燥,称量得到mg[Cr(CH3COO)2]2·2H2O。
其中洗涤的目的是去除可溶性杂质和水分,下列洗涤试剂正确的使用顺序是_____(填标号。
A.乙醚B.去氧冷的蒸馏水C.无水乙醇(5)若实验所取用的CrCl3溶液中含溶质ng,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376 )的产率是___________。
(6)该实验装置有一个明显的缺陷是________,解决此缺陷的措施为_______。