新月体肾炎诊疗指南
- 格式:ppt
- 大小:2.83 MB
- 文档页数:13

新月体性肾小球肾炎作者:北京大学…文章来源:第六版《内科学》急进性肾小球肾炎是以急性肾炎综合征、肾功能急剧恶化、多早期出现少尿性急性肾衰竭为临床特征,病理类型为新月体性肾小球肾炎的一组疾病。
[病因和发病机制]本病是由多种原因所致的一组疾病,包括:(1)原发性急进性肾小球肾炎;(2)继发于全身性疾病(如系统性红斑狼疮肾炎)的急进性肾小球肾炎;(3)由原发性肾小球病(如系膜毛细血管性肾小球肾炎)的基础上形成广泛新月体,即其他病理类型转化而来的新月体性肾小球肾炎。
本文着重讨论原发性急进性肾小球肾炎(以下间称急进性肾炎)。
急进性肾炎根据免疫病理可分为3型,其病因和发病机制各不相同:(1)I型又称抗肾小球基底膜型肾小球肾炎,由于抗肾小球基底膜抗体与肾小球基底膜(GBM)抗原相结合激活补体而致病。
(2)II型又称免疫复合物型,因肾小球内循环免疫复合物的沉积或原位免疫复合物形成,激活补体而致病。
(3)III 型为非免疫复合物型,以往认为发病机制与细胞免疫相关。
现已证实50%-80%该型患者为肾微血管炎(原发性小血管炎肾损害),肾可为首发,甚至唯一受累器官或其他系统损害并存。
原发性小血管炎患者血清抗中性粒细胞胞浆抗体(ANCA)常呈阳性。
[临床表现和实验室检查]我国以II型多见,I型好发于青中年,II 型及III型常见于中、老年患者,男性居多。
患者可有前驱呼吸道感染,起病多较急,病情急骤进展。
以急性肾炎综合征(起病急,血尿、蛋白尿、尿少、浮肿、高血压),多早期出现少尿或无尿,进行性肾功能恶化并发展为尿毒症,为其临床特征。
患者常伴有中度贫血。
II 型患者常伴肾病综合征,III型患者常有不明原因的发热、乏力、关节痛或咯血等系统性血管炎的表现。
免疫学检查异常主要有抗GBM 抗体阳性(I型)、ANCA阳性(III型)。
此外,II型患者的血循环免疫复合物及冷球蛋白可呈阳性,并可伴血清补体C3降低。
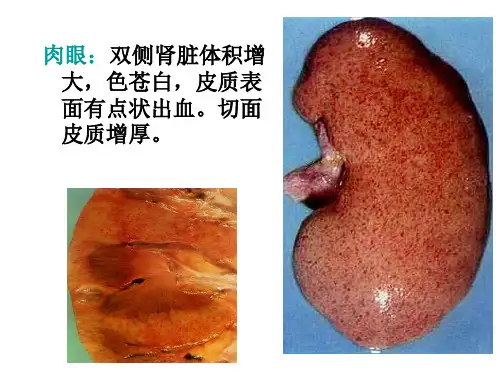
B超等影像学检查显示双肾增加大。

第节新月体肾炎一、诊断要点:1.临床表现为急进性肾炎综合征:多为急性起病,在血尿、蛋白尿、水肿和高血压基础上短期出现少尿、无尿、肾功能急剧下降。
部分患者就诊时已依赖透析。
2.辅助检查:⑴一般实验室检查:血尿、蛋白尿和血肌酐进行性上升;多有贫血,且其程度可与肾损害不平行。
多数有外周血白细胞增高,少免疫沉积型可见ESR增快、CRP强阳性。
血尿、蛋白尿常见,肾病综合征范围的蛋白尿主要见于免疫复合物型。
⑵血清自身抗体:血清抗GBM抗体阳性提示为抗GBM抗体型,且为诊断抗GBM病的必要条件之一。
ANCA阳性则支持少免疫沉积型。
免疫复合物型可见ANA和RF阳性,但也有少数免疫复合物型患者ANCA阳性。
⑶肾脏超声:双肾体积增大或大小正常。
3.以下两条是诊断的必备条件。
⑴肾活检50%的肾小球有新月体形成⑵且新月体为占受累肾小囊面积50%以上的大新月体。
4.肾脏病理:新月体肾炎病因很多,据肾脏免疫病理分为三型:Ⅰ型为抗肾小球基底膜(GBM)抗体型、Ⅱ型为免疫复合物型、Ⅲ型为少免疫复合物型。
⑴Ⅰ型:免疫荧光可见IgG和C3沿肾小球毛细血管袢呈典型的线样沉积。
光镜检查可见多数甚至100%肾小球新月体形成,且多数新月体类型基本一致。
肾小球多严重受损。
电镜下肾小球内基本无电子致密物沉积,肾小球基底膜和包曼囊可见断裂。
⑵Ⅱ型:免疫荧光可见免疫球蛋白(≥++)和补体成分在肾小球沉积,其沉积的荧光形态与基础肾小球病相关。
原发性表现为IgG和C3沿肾小球毛细血管袢呈颗粒样沉积,而多种免疫球蛋白和补体沉积形成的“满堂亮”多见于狼疮肾炎,肾小球系膜区以IgA主的沉积提示IgA肾病。
⑶Ⅲ型:免疫荧光检查呈现无或少量(≤+)免疫球蛋白沉积。
光镜检查多为局灶坏死性新月体肾炎。
该型特点新月体类型不一致,新旧不等。
电镜下无电子致密物,可见广泛肾小球基底膜破坏。
二、处理方法:目前主要有两种处理方案:一种强化血浆置换;一种甲泼尼龙冲击。
Ⅰ型总体预后最差,Ⅱ型和Ⅲ型相对较好。


寡免疫复合物新月体肾炎诊疗规范2023版寡免疫复合物新月体肾炎即新月体肾炎in型,指光镜显示为新月体肾炎,而免疫荧光无或仅见少量免疫复合物沉积。
通常认为,本病是系统性小血管炎的肾脏受累典型表现。
80%原发性小血管炎患者血清中可检测到抗中性粒细胞胞质抗体(ANCA),故又称为抗中性粒细胞胞质抗体相关性血管炎(antineutrophi1.cytop1.asmicantibodyassociatedvascu1.itis,AAV),包括肉芽肿性多血管炎(granu1.omatosiswithpo1.yangiitis,GPA,原称Wegener肉芽肿)、显微镜下多血管炎(microscopicpo1.yangitis,MPA)、嗜酸性肉芽肿性多血管炎(eosinophi1.icgranu1.omatosiswithpo1.yangiitis,EGPA,即Churg-Strauss综合征),,【发病机制】AAV的发生是多重因素共同作用的结果,ANCA、中性粒细胞、补体、抗内皮细胞抗体、淋巴细胞等在AAV的发病中发挥了重要作用。
ANCA在整个血管炎的发病机制中起核心作用,它的形成与药物、环境及感染等因素相关。
ANCA可激活中性粒细胞,导致脱颗粒反应,产生氧自由基和释放各种蛋白酶,从而造成血管内皮的损伤。
ANCA对应的抗原已发现有多种。
抗体在胞质呈均匀分布,称胞质型ANCA(C-ANCA),这些抗体通常直接对抗蛋白陋3(proieinase3,PR3);抗体呈环核分布,称核周型ANCA(P-ANCA),通常直接对抗髓过氧化物酹(mye1.operoxidase,MPO)o GPA主要与PR3-ANCA相关,而MPA主要与MPo-ANCA相关。
20%的GPA或MPA患者为其他ANCA阳性,至少10%的AAV患者为ANCA阴性。
【病理】光镜下表现为局灶节段性肾小球毛细血管样坏死、血栓形成和新月体形成,无明显细胞增殖,20%~50%肾活检标本显示肾小球以外的肾小动脉呈纤维素样坏死。

快速进展性肾小球肾炎和新月体肾炎诊疗规范2023版快速进展性肾小球肾炎(rapid1.yprogressiveg1.omeru1.onephritis,RPGN)又称急进性肾小球肾炎(急进性肾炎),是一组表现为血尿、蛋白尿及短期内进行性肾功能减退的临床综合征,是肾小球肾炎中最严重的类型,病理通常表现为新月体肾炎。
【病理分型】根据病理特征和发病机制将新月体肾炎分为3型:I型:又称抗基底膜抗体型新月体肾炎。
血清抗肾小球基底膜(g1.omeru1.arbasemen1.membrane,GBM)抗体阳性,免疫荧光显示免疫球蛋白(常为IgG)沿肾小球基底膜呈线性沉积。
I1.型:又称免疫复合物型新月体肾炎。
免疫荧光显示,免疫复合物沉积于肾小球毛细血管样和/或系膜区。
大多数情况下,患者的血清学和组织学表现会指向其基础疾病。
HI型:又称寡免疫复合物型新月体肾炎。
此型70%-80%患者血清中存在抗中性粒细胞胞质抗体(antineutrophi1.cytop1.asmicantibody,ANCA),故又称为ANCA相关性肾炎。
一些患者同时检测出ANCA阳性和抗GBM抗体阳性,这种情况也被称为“双抗体”阳性RPGN。
另一种情况有学者定义为"特发性RPGN",指的是:①不符合任一种已知分类的免疫复合物型RPGN;②ANCA阴性的寡免疫复合物型RPGNo【临床分型】按照病因、临床表现,新月体肾炎可以分为2类:①原发性新月体肾炎,指病因不明者和/或肾脏是唯一或最主要病变部位;②继发性新月体肾炎,指有明确原发病或明确病因者(表17・7・3・1)o表17-7-3-1导致新月体肾炎的疾病(新月体肾炎的临床分型)临床分型常见疾病1.原发性抗GBM肾炎新月体肾炎免疫复合物型新月体肾炎寡免疫型新月体炎,常为ANCA丽¥神仰小2.继发性其他原发性肾炎基础上的新月体新月肾炎体肾炎(膜增生性肾炎、IgA肾病等)狼疮性肾炎、紫瘢性肾炎、感染【发病机制】RPGN患者仔活检病理通常表现为新月体肾炎。


急进性肾小球肾炎急进性肾小球肾炎(rapidly progressive glomerulonephritis,RPGN) 是一组表现为血尿、蛋白尿及进行性肾功能减退的临床综合征,是肾小球肾炎中最严重的类型,肾活检病理通常表现为新月体肾炎。
RPGN的发生率占肾穿刺患者的2%,人群发生率为7/百万,是肾脏科常见的急危重症。
该病起病急骤,病情发展迅速,若未及时治疗,90%以上的患者于6个月内死亡或依赖透析生存。
所以,需要根据肾脏病理早期明确诊断,并针对不同的病因采取及时正确的治疗措施,以改善病人的预后。
疾病分类Couser分类法1.1 I型根据免疫荧光线条状沉积伴循环抗GBM抗体(抗肾小球基底膜抗体)的形成分为两类:①伴肺部损害的肺出血-肾炎综合征(Goodpasture syndrome);②不伴肺部损害的抗GBM抗体型肾小球肾炎(无肺出血)。
1.2 II型免疫荧光颗粒沉积型肾小球肾炎(免疫复合物型) , 此型在我国常见。
1.3 III型寡免疫复合物型肾小球肾炎。
近年研究表明, III型中70%~80%患者血清中存在抗中性粒细胞胞浆抗体( antineutrophil cytoplasmic antibodies, ANCA) , 故又称为ANCA相关性肾小球肾炎。
新5型分类法I型为IgG、C3呈线条状沉积于肾小球毛细血管壁,抗GBM抗体阳性,ANCA阴性;Ⅱ型为IgG、C3呈颗粒状沉积于系膜及毛细血管壁, 抗GBM 抗体阴性, ANCA阳性;III型为肾小球内基本无免疫沉积物, 抗GBM抗体阴性, ANCA阳性;IV型为IgG、C3呈线条状沉积于肾小球毛细血管壁, 抗GBM抗体阳性, ANCA阳性;Ⅴ型为肾小球内基本无免疫沉积物, 抗GBM抗体阴性, ANCA阴性。
上述分类法都是以肾脏病理为基础对RPGN进行分类,其中Couser 分类综合了病因和病理表现, 无论其为原发或继发, 病理上都表现为此3种形式, 而新5型分类不强调病因, 仅根据肾脏免疫病理学的结果, 再结合免疫学实验指标, 将Couser分类中的Ⅰ型进而分成Ⅰ型ANCA阴性和Ⅳ型ANCA阳性;原III型患者中,ANCA阳性者为III 型,ANCA阴性者为Ⅴ型。


第六节老年新月体肾炎新月体肾炎(crescentic glomerulonephritis, CGN)是指由不同病因引起的病理改变相同的疾病,病理改变为肾活检组织中超过50%的肾小球包曼囊内出现新月体,且单个新月体占每个肾小球面积50%以上。
因其临床上多表现为急性肾损伤或急性肾功能衰竭,起病急,数日至数周内出现少尿、无尿,肾功能下降等,故又称急进性肾炎(rapidly progressive glomerulonephritis, RPGN)。
急进性肾炎在病理上多表现为新月体性肾炎,但也有其他病因导致。
虽然二者虽常相互替代,但仍应注意区别。
根据其免疫特征和发病机制不同,新月体肾炎分为3类:(1)Ⅰ型:抗GBM抗体型肾炎(Anti- Basement Membrane Glomerulonephritis);(2)Ⅱ型:免疫复合物型新月体肾炎(Immune Complex-Mediated Crescentic Glomerulonephritis);(3)Ⅲ型:寡免疫复合物型新月体肾炎(Pauci-Immune Crescentic Glomerulonephritis)。
新月体的形成主要是由于各种原因导致肾小球毛细血管襻发生坏死,基底膜断裂或肾小球包曼囊壁断裂后,单核-巨噬细胞浸润增生,淋巴细胞浸润、炎性介质分泌等导致了参与了新月体的形成。
一、抗GBM抗体型肾炎1.流行病学及病因抗GBM抗体型肾炎(anti-glomerular basement membrane glomerulonephritis,anti-GBM glomerulonephritis)既可表现为病变局限于肾脏的疾病,又可表现为肺出血-肾炎综合征(Goodpasture’s syndrome)。
该病年龄段上有两个发病高峰:20~30岁和60~70岁,老年人群中多见于女性,并常仅累及肾脏。
抗GBM抗体型肾炎的确切病因尚未完全清楚,可能涉及感染(细菌、病毒等)、环境污染(有机化学溶剂、强氧化剂等)、基因等,有待进一步研究。

新月体肾炎临床路径一、新月体肾炎临床路径标准(一)适用对象。
第一诊断为急进性肾炎,新月体肾炎(ICD-10:N01.7)(二)诊断依据。
根据《临床诊疗指南–肾脏病学分册》(中华医学会编著,人民卫生出版社,2011年)、《临床技术操作规范–肾脏病学分册》(中华医学会编著,人民军医出版社,2009年)。
1.临床上表现为急进性肾炎综合征,即在肾炎综合征(血尿、蛋白尿、水肿、高血压)基础上,短期内出现少尿、无尿,肾功能急剧下降。
2. 病理:光镜表现为50%以上的肾小球有大新月体形成。
3. 分型:1)Ⅰ型为抗肾小球基底膜(GBM)抗体型:血清抗GBM 抗体阳性,免疫荧光表现为IgG及C3沿肾小球毛细血管袢呈线样沉积。
可以合并肺出血(Goodpasture综合征)。
部分合并血清抗中性粒细胞胞浆抗体(ANCA)阳性。
2)Ⅱ型称免疫复合物型:免疫荧光表现为IgG(或IgA、或IgM)、C3、C1q等呈颗粒状或团块状沉积于肾小球系膜区及毛细血管壁。
3)Ⅲ型为寡免疫复合物型:免疫荧光表现为无或很少量免疫复合物沉积,多数ANCA阳性。
(三)选择治疗方案的依据。
根据《临床诊疗指南–肾脏病学分册》(中华医学会编著,人民卫生出版社,2011年)、《临床技术操作规范–肾脏病学分册》(中华医学会编著,人民军医出版社,2009年)。
1.血浆置换(ICD-9-CM-3:99.07):可采用单膜或双重滤过血浆置换,如采用单膜血浆置换,通常每日或隔日置换1–2个血浆容量,一般连续治疗3–6次,或至血清抗GBM抗体转阴或伴有威胁生命的肺出血停止。
2.糖皮质激素冲击治疗:甲泼尼龙7–15mg/kg(0.5–1.0g/次),每日或隔日一次静脉滴注(30–60min内完成),每3次为一疗程;根据病情治疗1–2个疗程。
3.维持性免疫抑制治疗:泼尼松1mg/(kg·d),4–6周逐渐减量。
同时口服或静脉应用环磷酰胺等免疫抑制剂治疗。
4.肾脏替代治疗:严重肾功能受损者可给予肾脏替代治疗。