《6864医用卫生材料及敷料》
- 格式:doc
- 大小:72.50 KB
- 文档页数:11
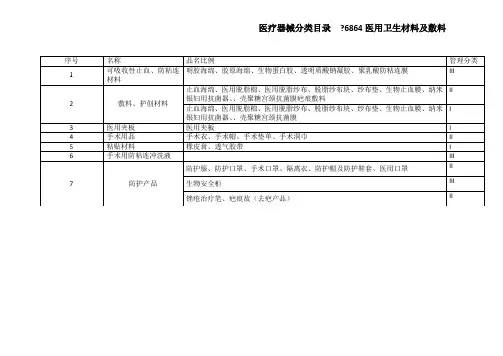
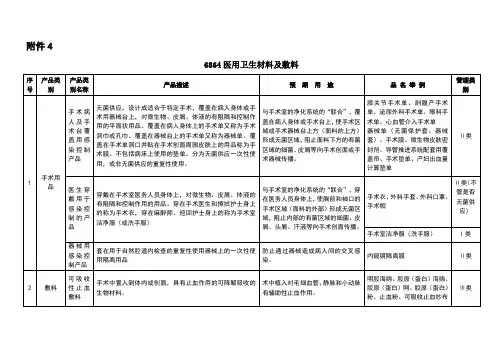
附件 46864 医用卫生材料及敷料管理品 名 举 例类别膝关节手术单、剖腹产手术单、泌尿外科手术单、眼科手术单、心血管介入手术单器械单(无菌保护套、器械套)、 Ⅱ类手术膜、微生物皮肤密封剂、导管推进系统配套用覆盖帘、手术 垫单、产妇出血量计算垫单 产品描述无菌供应,设计成适合于特定手 术,覆盖在病人身体或手术用器 械台上,对微生物、皮屑、体液的有阻隔和控制作用的平面状用品。
覆盖在病人身体上的手术单 又称为手术洞巾或孔巾。
覆盖在器械台上的手术单又称为器械单。
覆盖在手术单洞口并贴在手术创面周围皮肤上的用品称为手术膜。
不包括病床上使用的垫单。
分为无菌供应一次性使用,或非预 期 用 途与手术室的净化系统的“联 合”,覆盖在病人身体或手术台上, 使手术区域或手术器械台上方(面料的上方)形成无菌区域, 阻止面料下方的有菌区域的细菌、 皮屑等向手术创面或手术器械传播。
产品类别名称手术病人及手 术台覆盖用感 染控制产品产品类别手术用品 序号 1无菌供应的重复性使用。
穿戴在手术室医务人员身体上,对微生物、皮屑、体液的有阻隔医生穿戴用于和控制作用的用品。
穿在手术医感染控制的产生和擦拭护士身上的称为手术品衣,穿在麻醉师、巡回护士身上的称为手术室洁净服(或洗手服) 与手术室的净化系统的“联合”,穿在医务人员身体上,使胸前和袖口的手术区域(面料的外部) 形成无菌区域,阻止内部的有菌区域的细菌、皮屑、头屑、汗液等向手术创面传播。
Ⅱ类(不管是手术衣、外科手套、外科口罩、否无手术帽菌供应)手术室洁净服(洗手服) I 类2 敷料套在用于自然腔道内检查的重复器械用感染控性使用器械上的一次性使用隔离制产品用品手术中置入到体内或创面,具有可吸收性止血止血作用的可降解吸收的生物材敷料料。
手术中植入到体内或创面,具有可吸收性防粘辅助防粘连作用的可降解吸收的连敷料生物材料。
用医用脱脂棉,医用非织造敷布不可吸收传统制造,为外科手术和创面处理提外科敷料供辅助性支持的产品。
新旧版目录对照表医疗器械分类目录(2002版)关于指定《医疗器械分类目录》的说明一、《医疗器械分类目录》制定的依据《医疗器械监督管理条例》及《医疗器械分类规则》(第15号局长令)。
二、《医疗器械分类目录》与《医疗器械分类规则》的关系《医疗器械分类规则》用于指导《医疗器械分类目录》的制定和确定新的产品注册类别。
我国实行的医疗器械分类方法是分类规则指导下的目录分类制,分类规则和分类目录并存。
一旦分类目录已实施,应执行分类目录。
三、制定分类目录的原则执行分类规则指导下的目录分类制。
参照国际通行的分类,从严掌握。
使用风险是制定产品分类目录的基础。
分类目录尽可能适应管理的需要,有利于理顺监督管理,做到科学合理。
四、符合医疗器械定义的含药医疗器械为III类医疗器械。
五、由于各种手术包内组件不确定,所以本目录不包含该类产品。
凡手术包内含有III类医疗器械的,作为III类产品管理;只含有II类和I类医疗器械的,作为II类产品管理;只含有I类医疗器械的,作为I类产品管理。
六、依据《医疗器械分类目录》不能确定医疗器械分类时,由省级药品监督管理局根据分类规则进行预先分类,并报我局核定。
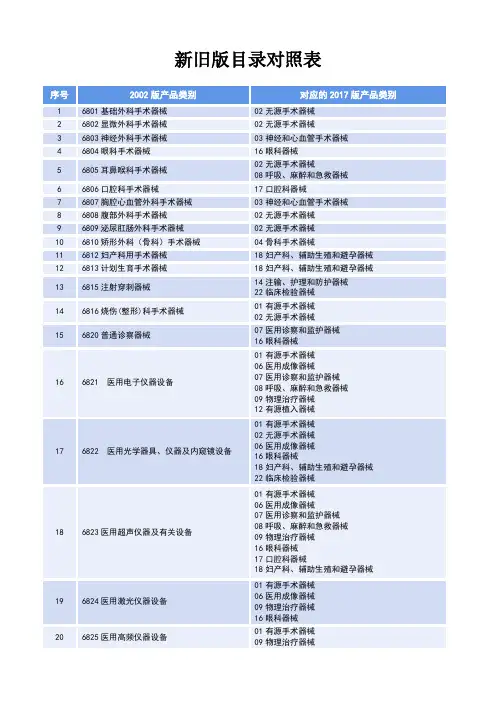
6803神经外科手术器械6805耳鼻喉科手术器械6807胸腔心血管外科手术器械6808腹部外科手术器械6809泌尿肛肠外科手术器械6810矫形外科(骨科)手术器械6812妇产科用手术器械6813计划生育手术器械6815注射穿刺器械6816烧伤(整形)科手术器械6820普通诊察器械6821 医用电子仪器设备6822 医用光学器具、仪器及内窥镜设备6823医用超声仪器及有关设备6824医用激光仪器设备6825医用高频仪器设备6826物理治疗及康复设备6827中医器械6828医用磁共振设备6830医用X射线设备6831医用X射线附属设备及部件6832医用高能射线设备6833医用核素设备6834医用射线防护用品、装置6840临床检验分析仪器6841医用化验和基础设备器具6845体外循环及血液处理设备6846植入材料和人工器官6854手术室、急救室、诊疗室设备及器具6855口腔科设备及器具6856病房护理设备及器具6857消毒和灭菌设备及器具6858医用冷疗、低温、冷藏设备及器具6863口腔科材料6864医用卫生材料及敷料6865医用缝合材料及粘合剂6866医用高分子材料及制品6870 软件附件:《医疗器械分类目录》(2002版)6877介入器材。




三类医疗器械分类目录
发布日期:2011-03-03 发布者:admin 页面功能:【字体:大中
小】
三类医疗器械分类目录
6804眼科手术器械
6815注射穿刺器械
6821 医用电子仪器设备
6822 医用光学器具、仪器及内窥镜设备
6823医用超声仪器及有关设备
6824医用激光仪器设备
6825医用高频仪器设备
6826物理治疗及康复设备
6828医用磁共振设备
6830医用X射线设备
6832医用高能射线设备
6833医用核素设备
6840临床检验分析仪器
6845体外循环及血液处理设备
6846植入材料和人工器官
6854手术室、急救室、诊疗室设备及器具
6858医用冷疗、低温、冷藏设备及器具
6863口腔科材料
6864医用卫生材料及敷料
6865医用缝合材料及粘合剂
6866医用高分子材料及制品
6870 软件
6877介入器材。
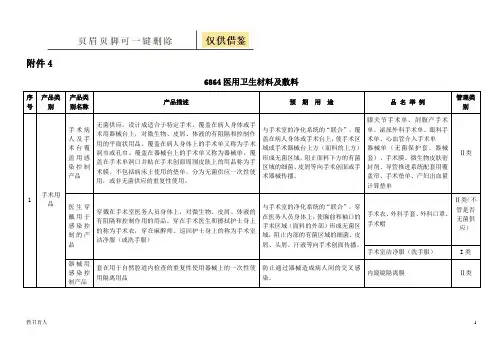
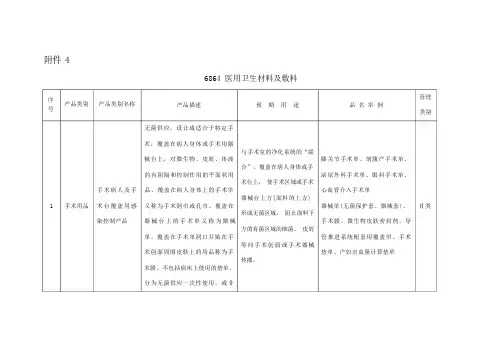
教书育人 1附件46864医用卫生材料及敷料序号 产品类别产品类别名称产品描述预 期 用 途品 名 举 例管理类别1手术用品手术病人及手术台覆盖用感染控制产品无菌供应,设计成适合于特定手术,覆盖在病人身体或手术用器械台上,对微生物、皮屑、体液的有阻隔和控制作用的平面状用品。
覆盖在病人身体上的手术单又称为手术洞巾或孔巾。
覆盖在器械台上的手术单又称为器械单。
覆盖在手术单洞口并贴在手术创面周围皮肤上的用品称为手术膜。
不包括病床上使用的垫单。
分为无菌供应一次性使用,或非无菌供应的重复性使用。
与手术室的净化系统的“联合”,覆盖在病人身体或手术台上,使手术区域或手术器械台上方(面料的上方)形成无菌区域,阻止面料下方的有菌区域的细菌、皮屑等向手术创面或手术器械传播。
膝关节手术单、剖腹产手术单、泌尿外科手术单、眼科手术单、心血管介入手术单 器械单(无菌保护套、器械套)、手术膜、微生物皮肤密封剂、导管推进系统配套用覆盖帘、手术垫单、产妇出血量计算垫单 Ⅱ类医生穿戴用于感染控制的产品穿戴在手术室医务人员身体上,对微生物、皮屑、体液的有阻隔和控制作用的用品。
穿在手术医生和擦拭护士身上的称为手术衣,穿在麻醉师、巡回护士身上的称为手术室洁净服(或洗手服)与手术室的净化系统的“联合”,穿在医务人员身体上,使胸前和袖口的手术区域(面料的外部)形成无菌区域,阻止内部的有菌区域的细菌、皮屑、头屑、汗液等向手术创面传播。
手术衣、外科手套、外科口罩、手术帽Ⅱ类(不管是否无菌供应) 手术室洁净服(洗手服)I 类 器械用感染控制产品套在用于自然腔道内检查的重复性使用器械上的一次性使用隔离用品防止通过器械造成病人间的交叉感染。
内窥镜隔离膜Ⅱ类教书育人22敷料可吸收性止血敷料手术中置入到体内或创面,具有止血作用的可降解吸收的生物材料。
术中植入对毛细血管、静脉和小动脉有辅助性止血作用。
明胶海绵、胶原(蛋白)海绵、胶原(蛋白)网、胶原(蛋白)粉、止血粉、可吸收止血纱布 Ⅲ类可吸收性防粘连敷料 手术中植入到体内或创面,具有辅助防粘连作用的可降解吸收的生物材料。
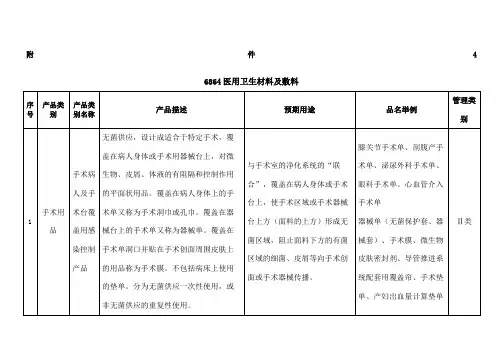
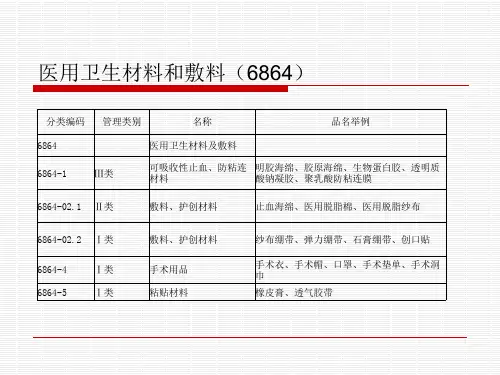
编码代号6864医用卫生材料及敷料分类编号6864-01
分类名称可吸收性止血、防粘连材料
品名举例明胶海绵、胶原海绵、生物蛋白胶、透明质酸钠凝胶、聚乳酸防粘连膜
管理类别Ⅲ类
编码代号6866医用卫生材料及敷料
分类编号6864-02.2
分类名称敷料、护创材料
品名举例纱布绷带、弹力绷带、石膏绷带、创口贴管理类别Ⅰ类
编码代号6865医用卫生材料及敷料
分类编号6864-02.1
分类名称敷料、护创材料
品名举例止血海绵、医用脱脂棉、医用脱脂纱布管理类别Ⅱ类
编码代号6868医用卫生材料及敷料
分类编号6864-05
分类名称粘贴材料
品名举例橡皮膏、透气胶带
管理类别Ⅰ类。
新版《医疗器械分类目录》实施后涉及管理类别调整的第二类敷料类产品在延续注册过程中的常见问题2023-03-2119:33内容提要:敷料是指用以覆盖伤口的医用材料,其作用是暂时起到皮肤的部分屏障功能(物理屏障),即保护伤口。
该类医疗器械产品具有品种繁杂、名目繁多、分类复杂和界定困难的特点。
因此,自2017年8月31日发布的新版《医疗器械分类目录》实施以来,出现了一些已注册待延续的敷料类产品涉及到管理类别调整或分类不清晰的问题,有些甚至已经影响到注册证的有效延续。
文章主要针对前述的第二类敷料类产品在延续注册技术审评过程中发现的常见问题,归纳并进行探讨,为注册申请人和技术审评部门提供参考。
随着人们对于医疗水平的要求和生物医学工程领域科学技术的不断提高,在传统用于充当物理屏障,保持伤口愈合环境清洁的敷料类产品基础上,敷料类产品正逐渐向材料创新、功能多元?□形式多样的方向发展。
从我国最早于2002年发布的《医疗器械分类目录》口](以下简称,"02版《目录》〃)和2017年发布的新版《医疗器械分类目录》[2](以下简称,〃新版《目录》")的对比也可以看出,敷料的种类也从7种增至22种,新增了水胶体敷料、纤维敷料、碳纤维和活性炭敷料、含壳聚糖敷料、含银敷料、胶原贴敷料等新型敷料,其管理类别判定的依据更加细化。
可即便如此,对于拟上市的敷料类产品的分类界定工作依然存在争议和挑战⑶。
同时,2023年新《条例》(国务院令第739号)、《医疗器械注册与备案管理办法》及一系列配套法规文件的实施,意味着对于已上市的敷料类产品的监管也日趋严格,多地监管机构已对于敷料市场的乱象开展相关整治工作[4]。
对于审评机构而言,敷料类产品在延续注册过程中管理类别的判定则需要严格把关,避免出现"高类低延"的问题。
根据广东省审评认证系统的不完全统计数据,新版《目录》于2018年8月1日实施后受理的第二类敷料类产品的延续注册申请事项有63份左右(时间截至2023年1月1日),其中有19份左右涉及分类问题的发补,接近总申报量的三分之一。