定量实验及其误差分析
- 格式:doc
- 大小:48.50 KB
- 文档页数:1

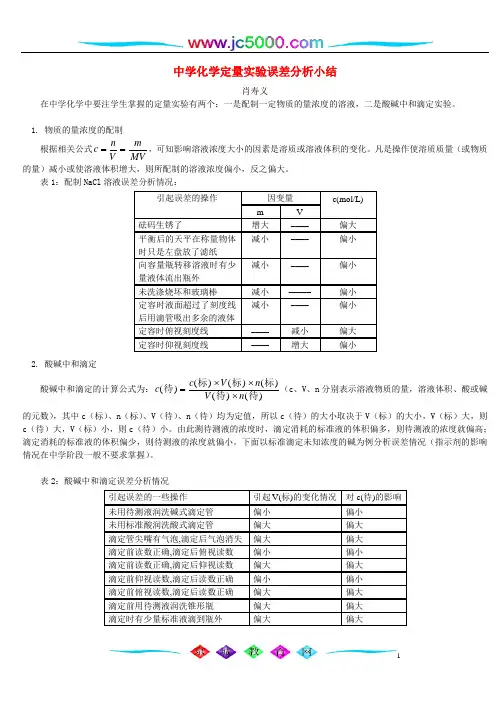
1中学化学定量实验误差分析小结肖寿义在中学化学中要注学生掌握的定量实验有两个:一是配制一定物质的量浓度的溶液,二是酸碱中和滴定实验。
1. 物质的量浓度的配制 根据相关公式c n V mMV==,可知影响溶液浓度大小的因素是溶质或溶液体积的变化。
凡是操作使溶质质量(或物质的量)减小或使溶液体积增大,则所配制的溶液浓度偏小,反之偏大。
表1:配制NaCl 溶液误差分析情况:因变量 引起误差的操作 m V c(mol/L) 砝码生锈了增大 –––– 偏大 平衡后的天平在称量物体时只是左盘放了滤纸 减小 –––– 偏小 向容量瓶转移溶液时有少量液体流出瓶外 减小 –––– 偏小 未洗涤烧坏和玻璃棒 减小 ––––– 偏小 定容时液面超过了刻度线后用滴管吸出多余的液体 减小 –––– 偏小 定容时俯视刻度线 –––– 减小 偏大 定容时仰视刻度线––––增大偏小2. 酸碱中和滴定酸碱中和滴定的计算公式为:c c V n V n ()()()()()()待标标标待待=⨯⨯⨯(c 、V 、n 分别表示溶液物质的量,溶液体积、酸或碱的元数),其中c (标)、n (标)、V (待)、n (待)均为定值,所以c (待)的大小取决于V (标)的大小,V (标)大,则c (待)大,V (标)小,则c (待)小。
由此测待测液的浓度时,滴定消耗的标准液的体积偏多,则待测液的浓度就偏高;滴定消耗的标准液的体积偏少,则待测液的浓度就偏小。
下面以标准滴定未知浓度的碱为例分析误差情况(指示剂的影响情况在中学阶段一般不要求掌握)。
表2:酸碱中和滴定误差分析情况引起误差的一些操作 引起V(标)的变化情况 对c(待)的影响 未用待测液润洗碱式滴定管 偏小 偏小 未用标准酸润洗酸式滴定管 偏大 偏大 滴定管尖嘴有气泡,滴定后气泡消失 偏大偏大 滴定前读数正确,滴定后俯视读数 偏小 偏小 滴定前读数正确,滴定后仰视读数 偏大 偏大 滴定前仰视读数,滴定后读数正确 偏小 偏小 滴定前俯视读数,滴定后读数正确 偏大 偏大 滴定前用待测液润洗锥形瓶 偏大 偏大 滴定时有少量标准液滴到瓶外偏大偏大。





定量分析中的误差定量分析中的误差,也称为测量误差,是指实际测量结果与真实值之间的差异。
在定量分析领域中,对误差的准确定义和评估是非常重要的,因为它直接影响到数据的可靠性和结果的准确性。
本文将探讨定量分析中的误差的类型、产生原因以及如何评估和控制误差。
1.系统误差是由于测量方法、仪器或实验条件等固有的偏倚或倾斜引起的误差。
这种误差是有方向性的,通常是持续的,会导致测量结果偏离真实值的固定量。
系统误差的产生原因包括:-仪器漂移:由于仪器老化、磨损或使用不当等,仪器的测量性能会逐渐下降,导致系统误差。
-校准不准确:如果仪器的校准不准确,或者校准曲线的拟合不好,都会产生系统误差。
-环境条件:例如温度、湿度等环境条件的变化,会影响到实验条件,进而产生系统误差。
-人为因素:操作员的技术水平、操作规范等因素也可能引起系统误差。
2.随机误差是由于各种随机因素所引起的误差,其大小和方向都是无规律的,因此也称为无偏差误差。
这种误差会导致在多次重复测量中,得到不同结果,形成结果的分布。
随机误差的产生原因包括:-个体差异:不同个体之间的差异,包括实验对象的差异和人体感知的差异等,会导致随机误差。
-实验条件的不确定性:例如仪器的读数精度、样品的异质性等,都会产生随机误差。
-测量误差的传播:由于测量值之间的运算和计算过程中的近似或舍入,误差会被传递到结果中,导致随机误差。
在定量分析中,我们需要对误差进行评估和控制,以保证数据的准确性和可靠性。
评估误差的方法包括:1.校准和验证:通过与已知标准值的比较,来评估仪器的准确性和正误差大小。
2.重复测量:通过多次重复测量同一样品,来评估测量值的离散程度,即随机误差的大小。
3.数据处理和统计分析:使用合适的统计方法,对测量数据进行处理和分析,以评估误差的大小和分布。
控制误差的方法包括:1.合理设计实验:在实验过程中,根据实验目的和特点,合理设计实验方案,减少系统误差和随机误差的产生。



初中化学实验中有三个定量实验:一是用托盘天平称量物质的质量,二是用量筒时取液体的体积,三是用pH试纸测量溶液的pH。
(1)托盘天平称量物质时引起误差①天平没有平衡引入正负误差。
②物码错位引起误差。
正确放置:左物有码物质质量:砝码质量+游码质量。
错位放置:左码右物物质质量=砝码质量-游码质量。
(2)量筒量取液体时引起误差①量取液体量与量筒的大小不匹配如量取10mL.液体用10mL.量筒即可,如果用 50mL量简或100mL。
量筒会引起误差。
②观察量筒液向引入误筹如果俯视观察凹液面(沿A线) 观察值>实际值如果平视观察凹液面(沿B线) 观察值=实际值如果仰视观察凹液面(沿C线) 观察值<实际值(3)pH试纸测定溶液pH引起误差pH试纸在测量前用水润湿相当于将溶液稀释,如果测定酸性溶液,pH偏大;如果测定碱性溶液,pH 偏小。
化学实验现象的规律:第一种是物质燃烧实验;第二种是加热固体物质实验;第三种是在溶液中进行的化学实验。
不同化学实验现象:1.物质燃烧实验都有三个明显的现象(1)放出大量的热。
(2)生成了一种或几种不同于反应物(指物质的色、态、味)的产物。
(3)固体直接燃烧则发出一定颜色和强度的光;气体或固、液体转变成气体再燃烧则发出一定颜色和强度的火焰(描述物质的燃烧现象:一光、二热、三生成)例如:镁条燃烧的现象是:①发出耀眼的白光;②放出大量的热;③生成一种白色固体。
再如,硫在氧气中燃烧的现象:①发出明亮的蓝紫色的火焰(硫受热先熔化,再汽化,最后才燃烧);②放出大量的热;③生成一种有刺激性气味的气体。
2.加热固体物质的实验现象主要包括物质的状态、颜色、质量变化及产物中是否有水和气体产生例如:加热碳酸氢铵的现象:(1)有一股刺激性的气味产生;(2)试管壁上有水珠生成;(3)有使澄清石灰水变浑浊的气体生成;(4)试管内的白色固体逐渐消失。
3.在溶液中进行的化学反应的实验现象主要包括反应物(液态)的物质和颜色变化及溶液中是否有沉淀(包括沉淀颜色)和气泡产生。
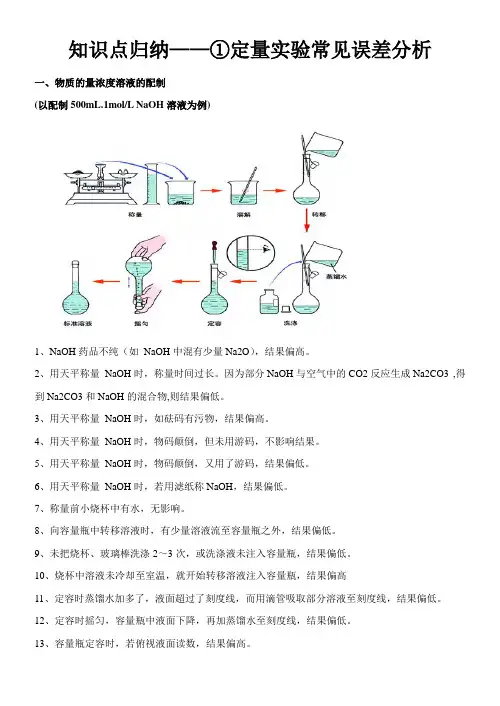
知识点归纳——①定量实验常见误差分析一、物质的量浓度溶液的配制(以配制500mL.1mol/L NaOH溶液为例)1、NaOH药品不纯(如NaOH中混有少量Na2O),结果偏高。
2、用天平称量NaOH时,称量时间过长。
因为部分NaOH与空气中的CO2反应生成Na2CO3 ,得到Na2CO3和NaOH的混合物,则结果偏低。
3、用天平称量NaOH时,如砝码有污物,结果偏高。
4、用天平称量NaOH时,物码颠倒,但未用游码,不影响结果。
5、用天平称量NaOH时,物码颠倒,又用了游码,结果偏低。
6、用天平称量NaOH时,若用滤纸称NaOH,结果偏低。
7、称量前小烧杯中有水,无影响。
8、向容量瓶中转移溶液时,有少量溶液流至容量瓶之外,结果偏低。
9、未把烧杯、玻璃棒洗涤2~3次,或洗涤液未注入容量瓶,结果偏低。
10、烧杯中溶液未冷却至室温,就开始转移溶液注入容量瓶,结果偏高11、定容时蒸馏水加多了,液面超过了刻度线,而用滴管吸取部分溶液至刻度线,结果偏低。
12、定容时摇匀,容量瓶中液面下降,再加蒸馏水至刻度线,结果偏低。
13、容量瓶定容时,若俯视液面读数,结果偏高。
14、容量瓶定容时,若仰视液面读数,结果偏低。
15、配制一定物质的量浓度稀H2SO4时,用量筒量取浓溶液,若俯视读数,结果偏低。
16、配制一定物质的量浓度稀H2SO4时,用量筒量取浓溶液,若仰视读数,结果偏高。
【误差分析】可能引起误差的操作c(mol∙L-1)天平的砝码上粘有其他物质或已锈蚀偏高试剂与砝码的左右位置搞错偏低量取液体溶质(如浓硫酸)时,俯视读数偏低定容时俯视刻度线偏高所配溶液未冷却至室温即转入容量瓶定容偏高转移溶液时不洗涤烧杯与玻璃棒或未将洗涤液转入容量瓶偏低溶解、转移、洗涤时有溶液流出容器外,使溶质减小偏低容量瓶在使用前,用蒸馏水洗净,在瓶内有少量水残留无影响定容摇匀后,静止时发现液面低于刻度线,再加水到刻度线偏低如配制氢氧化钠溶液,用滤纸称量氢氧化钠偏低二、酸碱中和滴定17、滴定管蒸馏水洗后未用标准液润洗,就直接装入标准液,造成标准液稀释,溶液浓度降低,滴定过程中消耗标准液体积偏大,测定结果偏高。
定量分析误差范文引言:1.仪器误差:精密仪器在设计、生产和使用过程中都难免出现一定的误差,例如测量仪器的刻度不准确或灵敏度不均匀,都会引起定量分析结果的误差。
2.人为误差:在进行定量分析实验时,操作人员的技术水平和经验都可能会产生误差。
比如,分析前不完全洗净实验设备,导致前后两次实验结果不一致;又或者在样本制备过程中,误差地加入了其他物质,导致结果偏差。
二、误差的影响因素:1.实验条件:实验环境的温度、湿度、光照等因素都会对定量分析结果产生一定的影响。
例如,在温度较高的条件下进行溶解实验,会导致反应速率加快,进而影响溶解度的测量结果。
2.样品质量:样品的纯度、含水量、杂质等因素都会对定量分析结果产生影响。
例如,在测定食品中其中一种成分的含量时,如果样品本身含有其他成分的杂质,就会导致实际测量出的该成分含量低于真实值。
3.数据处理方法:对于定量分析结果的数据处理方法也会对结果准确性产生影响。
例如,使用不恰当的统计方法或者对数据处理过程中出现漏算或重复计算等错误,都会导致结果偏差。
三、解决误差的方法和建议:1.选用合适的仪器和设备:在进行定量分析实验前,要仔细选择合适的仪器和设备,并保证其准确性和稳定性。
同时,在使用过程中要进行仪器的校准和维护,以减小仪器误差的影响。
2.确保实验条件的一致性:在进行定量分析实验时,尽可能保持实验条件的一致性,例如温度、湿度等环境因素,以减小其对结果的影响。
3.提高操作人员的技术水平:操作人员要具备扎实的理论基础和丰富的实验经验,在实验操作过程中严格按照标准操作程序进行,减小人为误差的产生。
4.样品制备和处理的标准化:在进行定量分析实验前,要对样品进行合适的制备和处理,保证样品的纯度和质量。
同时要规范操作流程,减小样品制备过程中的误差。
5.合理选择数据处理方法:对于定量分析结果的数据处理,要选择合适的统计学方法,并进行严谨的计算过程,以确保结果的准确性。
6.多次重复实验:在进行定量分析时,可通过多次重复实验来取平均值或者计算标准差,以提高结果的可靠性。
四个定量实验的误差分析
1.配制一定物质的量浓度溶液实验中的误差分析-以配制一定浓度的碳酸钠溶液为例
C=n/V=m/(M V )
2.中和滴定的误差分析—以已知浓度的盐酸滴定未知浓度的氢氧化钠溶液为例
测定待测液的浓度时,消耗标准溶液多,则结果偏高;消耗标准溶液少,则结果偏低。
从计算式分析,当酸碱恰好中和时,有关系式:
C 标· V 标·n 标=c 待·V 待·n 待(c 、V 、n 分别表示溶液物质的量浓度,溶液体积,酸或碱的元数)。
故c 待=(C 标· V 标·n 标)/(V 待·n 待),由于C 标、n 标、V 待、n 待均为定值,所以c 待的大小取决于V 标的大小,V 标大,则c 待大。
V 标小,则c 待小。
以标准酸溶液(HCl )滴定未知浓度的碱(NaOH )为例
根据实验原理对表格内的操作进行误差分析。
)
()()()(NaOH V HCl V HCl c NaOH c •=
3.测定硫酸铜晶体中结晶水含量的误差分析
根据实验原理对表格内的操作进行误差分析。
原理:n O H m CuSO m :1:18
)(160
)
(24
4.测定1摩尔气体体积的误差分析—以一定质量的镁与足量的稀硫酸反应为例
根据实验原理对表格内的操作进行误差分析。
Vm=(V 气体×M 金属)/m 金属。
定量实验及其误差分析
一.教学目标:
1.中学化学常见的定量实验:溶液的配制、滴定实验、食醋中总酸含量的测定、镀锌铁皮的厚度的测定。
2.定量实验中的误差分析
二.教学过程
问题一:“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。
镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。
某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL 6mol・L―1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。
将B、C重复上面实验。
(1)锌镀层完全反应的标志是。
(2)如何检验铁片已经洗净。
(3)该小组的实验数据记录及数据处理如下,完成下列表格(锌的密度为7.14g/cm3)数据记录数据处理
镀锌铁皮长度
/cm
宽度
/cm
镀锌铁皮
质量/g
铁皮
质量/g
锌镀层厚度
(单侧)/cm
锌镀层平均厚度
(单侧)/cm
A 5.00 4.90 4.460 4.313 4.201×10―4
B 5.10 5.00 4.421 4.267 4.229×10―4
C 5.20 5.00 4.640 4.467 4.660×10―4
计算镀锌铁皮锌镀层平均厚度(单侧)cm。
本实验中产生误差的原因可能有哪些(任意例举两种)、
(4)此实验中需要盐酸95mL 6mol・L―1,需用质量分数为
36.5%,密度为1.2g・m L―1的浓盐酸
ml ,下列操作能使配制溶液的浓度偏高的操
作。
A. 容量瓶定容时,若仰视液面读数,
B. 定容时蒸馏水加多了,液面超过了刻度线,而用滴管吸取部
分溶液至刻度线
C. 用量筒量取浓溶液,若仰视读数,
D. 烧杯中溶液未冷却至室温,就开始转移溶液注入容量瓶
方案二:已知锌与强碱溶液反应离子方程式为:
Zn+2OH―+2H2O=[Zn(OH)4]2―+H2↑。
某同学按右图装置设计
了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6mol・L―1 NaOH溶液中。
回答下列问题:(4)装置中导管a的作用是。
(5)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。
上述操作的顺序是(填序号)。
(6)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(实验条件的气体摩尔体积为Vm mol・L―1)。
则镀锌铁皮的厚度为cm。
(写出数学表达式)
问题二:食醋中醋酸含量的测定
问题与讨论:1.醋酸是一种有机弱酸,其离解常数Ka = 1.76×,可用标准碱溶液直接滴定,用什么指示剂?为什么?
2.如果要测定食醋的总酸含量,但无酸式滴定管,可用什么玻璃仪器来代替?使用此仪器是否要来溶液润洗?转移溶液时如何操作?请画出此操作的装置图。
3.如果滴定的终点没有控制好,即氢氧化钠滴加过量,溶液显深红色,你有没有补救的办法?如何补救?
4.中和滴定的反应容器是什么?需要润洗吗?
5.滴定的终点的现象如何描述?
例2在测定某铁矿石中的含铁量时,可准确称取0.2113g铁矿石溶解在酸里,再把Fe3+还原成Fe2+,然后用0.0223mol·L-1的KMnO4溶液滴定,发生反应的离子方程式如下:
5Fe2++MnO
4
+8H+=====5Fe3++Mn2++4H2O
滴定结果有消耗KMnO4溶液17.20mL,试计算和回答下列问题:
(1)矿石中含铁的质量分数为。
(2)KMnO4溶液应装在试管定管里,原因是。
(3)如果矿石是用盐酸溶解在制得的,Fe2+溶液里含有Cl-,则测定的结果矿石在含铁量(填偏高、偏低、无影响),原因是.
例3.20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,如图所示。
(1)试求X、Y的物质的量浓度之比。
(2)求盐酸的物质的量浓度。
小结:。