高一化学卤素
- 格式:pdf
- 大小:912.34 KB
- 文档页数:8

高一化学cl及其化合物知识点氯(化学符号Cl)是周期表中的第17号元素,属于卤素族。
它是一种常见的化学元素,在自然界中以氯化物的形式广泛存在。
本文将介绍高一化学中有关氯及其化合物的知识点。
一、氯的基本性质1. 物理性质:氯是一种黄绿色的气体,在常温下呈现刺激性气味,比空气密度大。
它较易溶于水,溶解后形成氯酸(HClO)和氯化氢(HCl)。
2. 化学性质:氯是一种高度活泼的元素,能与许多其他元素发生反应。
它常与金属反应,形成相应的氯化物。
二、氯的化合物及其应用1. 氯化氢(HCl):氯化氢是一种无色气体,具有强烈刺激性气味。
它可用于制备其他氯化物,如氯化钠(NaCl)和氯化铁(FeCl3)。
此外,氯化氢还是许多化学工艺过程中的重要中间体。
2. 氯化钠(NaCl):氯化钠是氯化物中最常见的化合物之一。
它是一种白色晶体,可在水中溶解。
氯化钠广泛用作食盐和调味品,同时也在工业生产中起重要作用。
3. 氯化铁(FeCl3):氯化铁是一种黑色晶体,能溶于水。
它常用于制备其他铁化合物,也可用于制备蓝色打火石、催化剂和水处理剂等。
4. 氯酸盐:氯酸盐是一类含有氯酸根离子(ClO3-)的化合物。
常见的氯酸盐有氯酸钠(NaClO3)和氯酸钾(KClO3)。
氯酸盐可用作氧化剂、火药和爆炸物等。
5. 三氯化硼(BCl3):三氯化硼是一种无色气体,具有刺激性气味。
它可用作催化剂、腐蚀剂和制造其他硼化合物的原料。
三、氯及其化合物在日常生活和工业中的应用1. 食盐:氯化钠是人类日常饮食中不可或缺的食盐成分。
2. 消毒剂:氯化物可用作消毒剂,广泛应用于水处理、游泳池消毒和卫生清洁等领域。
3. 农药和杀虫剂:一些氯化物被用作农药和杀虫剂,用于农田作物的保护和病虫害的防治。
4. 化学工业:氯及其化合物在化学工业中有广泛应用,如制造塑料、合成橡胶、染料和颜料等。
结论:氯是一种重要的化学元素,它的化合物在日常生活和工业中有着广泛的应用。

卤素的知识点归纳总结一、卤素的性质1. 物理性质卤素的物理性质各异,如氟气为浅黄色气体,氯气为黄绿色气体,溴为红褐色液体,碘为紫黑色晶体,烷为暗紫色晶体。
卤素的沸点和熔点逐渐升高,原子量增大。
2. 化学性质卤素在化学性质上也有很多相似之处,例如:(1)卤素的电负性逐渐减小,化活性逐渐减弱;(2)卤素能与氢形成卤化氢,如氟与氢结合为氢氟酸、氯可与氢结合为盐酸,溴合氢结合为溴化氢,碘与氢结合为碘化氢;(3)卤素与金属反应,形成卤化物,如氟与钠反应形成氟化钠,氯与钾反应形成氯化钾,溴与钙反应形成溴化钙,碘与铝反应形成碘化铝。
3. 卤素的氧化性和还原性卤素可以表现出比较复杂的氧化性和还原性。
例如,氟气能与水蒸气反应生成氢氟酸和氧气;氯气与水反应生成盐酸和电子;溴与水反应生成溴化氢和氧气。
二、卤素在生活和工业中的应用1. 卤素在医疗和药物工业中的应用卤素及其化合物在医疗和药物工业中有着广泛的应用。
例如,碘和氯制成的药物可用于消毒和杀菌;氟化合物可用于制作药物和牙膏等。
2. 卤素在农业中的应用卤素及其化合物在农业中也有着重要的应用,例如氯化钠、氯化钾和氯化镁可用于土壤改良和植物生长;氯气可制成杀虫剂和杀菌剂。
3. 卤素在化工生产中的应用卤素及其化合物在化工生产中也有着广泛的应用,比如氯和氯化物可用于橡胶生产、塑料制造和合成纤维等;氟和氟化物可用于制作冷冻剂和高分子化合物。
三、卤素的环境影响1. 卤素对环境的影响卤素及其化合物对环境有着重要的影响,比如氯氟烃类气体和氟化物等对臭氧层和温室气体的破坏,对生态系统的影响;氯化物和碘化物等对水体和土壤的污染。
2. 卤素的环境保护为了减少卤素对环境的影响,需要加强卤素的环境保护工作,采取科学的措施进行处理和利用,减少对环境的影响。
四、卤素元素的发现及历史1. 卤素元素的发现卤素元素的发现可追溯到古代。
人类在早期,就发现了一些卤素原素。
比如,古埃及人用氯化钠制成各种药品,古希腊人发现了碘元素。
第四章卤素本章目标1.通过对卤素代表性元素——氯的学习,掌握氯气的化学性质和实验室制法。
了解卤素性质随着核电荷数的增加、原子半径的增大而递变的性质。
2.掌握氯、溴、碘和卤化物的鉴别。
初步了解卤化银的性质、用途及碘与人体健康等知识。
3.了解可逆反应的涵义。
4.掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法和格式。
5.通过观察、分析演示实验的现象,培养观察和分析问题的能力;通过对卤素结构、性质的对比,培养比较、分析、归纳问题的能力。
本章重点卤族元素性质变化规律本章难点物质的量应用于化学方程式的计算课时分配§4-1 氯气教学目的:1. 了解氯气的物理性质和用途;2. 掌握氯气的化学性质及在实验室中制取氯气的原理和方法;3. 掌握氯离子的检验方法;4. 通过观察、分析实验现象,培养观察和分析问题的能力。
教学重点:氯气的化学性质学习方法:实验探索——研讨总结——练习提高教学过程:第一课时[引言] 前面我们学习了碱金属元素,知道碱金属元素是几种在原子结构和性质上都具有一定相似性的金属元素。
这一章我们将要学习几种在原子结构和性质上都具有一定相似性的非金属元素——卤素,它包括F、Cl、Br、I、At等五种元素。
卤素及其化合物的用途非常广泛。
卤素中最主要的单质是氯气。
这一节我们学习氯气的性质和用途。
一、氯气的性质和用途(一)物理性质:氯气是色、味、态单质,易(在101kPa、-34.6℃时,氯气液化成液氯,将温度继续冷却到-101℃时,液氯变成固态氯)。
注意:闻气体方法:。
(二)化学性质:氯气的化学性质是否活泼呢?物质的宏观性质是由物质的微观结构决定的,请回忆氯的原子结构示意图:。
[提问] 1.根据氯的原子结构,推断氯气的化学性质是否活泼?它具有强还原性还是强氧化性?为什么?2.写出金属钠和氯气反应的化学方程式,并指出哪个是氧化剂?哪个是还原剂?1.与金属反应氯气与金属钠(活泼金属)反应方程式:[实验4-1] 氯气与金属铜反应现象:氯气与金属铜(不活泼金属)反应方程式:[介绍] CuCl2溶于水,可观察到不同的颜色,这与溶液浓度有关。

高考化学卤素元素知识点化学是高考中最重要的科目之一,其中的卤素元素的知识点是高考化学中一个非常关键的部分。
卤素元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
下面将详细介绍卤素元素的性质、应用和相关化合物的特点,以帮助大家更好地掌握这一知识点。
一、卤素元素的性质1. 原子结构:卤素元素的原子结构都有一个外层电子,通常称为“卤素电子”,它们的电子构型都是ns2np5(n代表能级)。
2. 原子半径:卤素元素的原子半径随着原子序数的增加而增大。
在同一周期中,原子序数越大,电子层数越多,电子云的半径越大。
3. 电离能:卤素元素的电离能在周期表中呈现递减的趋势。
原因是原子半径增大,外层电子与原子核之间的距离增大,电子屏蔽效应增强,电子的引力减弱,因此电离能降低。
4. 电负性:卤素元素在周期表中的电负性递减,氟元素的电负性最高。
电负性越高,元素越容易吸引其他原子中的电子。
二、卤素元素的应用1. 消毒杀菌:氯是广泛应用于消毒和杀菌的元素之一。
氯化池、消毒剂等产品中都含有氯元素。
2. 牙膏添加剂:氟元素在牙膏中作为添加剂,能够有效预防龋齿。
3. 荧光灯:氖和氙是荧光灯中常用的填充气体。
4. 染料和药物:卤素元素在染料和药物的合成中起到重要作用。
5. 聚合物材料:氯化聚乙烯和氟化聚四氟乙烯等卤素化合物是制备塑料、涂料等材料的重要原料。
三、卤素元素的化合物特点1. 卤素化合物的稳定性:卤素元素与金属形成的盐类稳定性递增。
氟化物的稳定性最差,碘化物的稳定性最好。
2. 化学反应特点:卤素元素常以-1价参与化学反应。
它们能够与金属发生置换反应,形成相应的卤化物。
3. 双原子卤化物:氯、溴和碘能与一些金属形成双原子卤化物,如NaCl、KBr和KI。
4. 氢卤酸:卤素元素与氢反应形成的酸称为氢卤酸。
氢卤酸的酸性随着卤素原子序数的增加而递减。
5. 氧化性:卤素元素的气体状态具有较强的氧化性。
氟气是最强的氧化剂,其次为氯气、溴气和碘气。


知识点详解的高一化学卤素考点教案本教案主要讲述高一化学卤素考点,其中包括卤素的常见性质、卤素的化学反应、卤素的应用等内容。
希望通过本教案的学习,能够对同学们的化学学习有所帮助。
一、卤素的常见性质1.化学性质卤素具有较强的氧化性和还原性。
在分子中,卤素的氧化数为-1,卤素根在化合物中的氧化数为正。
克服上述差异所需的能量就可以使卤素发生氧化还原反应。
卤素与氢气的化学反应也是重要的卤素氧化还原反应之一。
2.物理性质卤素齐市香味,有毒,易挥发。
氟和氯气状,臭味;溴冠上紫红色常温常压下的液体;碘呈深紫色晶体,易升华为紫红色气体。
二、卤素的化学反应卤素与氢气的反应1.卤素化氢的制备卤素化氢是卤素与氢的化合物,可以由卤素和钠铝对的混合物或盐酸和碲酸钠的混合物所制备。
其中,卤素化氢的制备好坏主要决定于反应条件的控制。
2.卤素化氢的反应卤素化氢与在合适的条件下的反应可以制备出卤素酸。
当然,这也是卤素化氢的一种重要化学反应之一。
卤素的氧化与还原反应卤素在氢氧化物溶液或电解液中发生氧化还原反应时,卤素由氧化态转化为还原态,当原子取得电子时,就会出现在还原态。
卤素在这些反应中发生氧化还原反应,也是我们常说的卤素的氧化还原反应。
卤素的碱性反应卤素在氢氧化物中发生碱性反应时,就能够形成相应的卤化物盐,如氯酸银等。
这种化学反应是卤素的重要的化学反应之一。
三、卤素的应用卤素具有广泛的应用价值,可用于生产有机物、药物等。
其中,氯、氟、溴化物常见于池塘里的消毒剂或清洁剂中,碘在医疗中用来煮消毒。
此外,卤素还被广泛地用于橡胶制造中的共聚反应、催化剂、有机合成化学等领域。
知识要点:1.卤素的常见性质:化学性质、物理性质等;2.卤素的化学反应:卤素与氢气的反应、卤素的氧化和还原反应、卤素的碱性反应。
3.卤素的应用:常用于生产有机物、药物等,在消毒、清洁、医疗等领域也有广泛应用。
本教案所列出的内容虽然简单,但十分重要,其中也涉及到一些化学基础知识,希望同学们在学习时多加辨别、注重理解,这样才可在化学考试中获得好成绩。

高考卤素知识点高考是每个学生都要经历的一场考试,是决定他们未来发展方向的重要一环。
卤素是高考化学中的一个重要知识点,它涉及到化学元素的性质、反应以及应用等方面。
本文将从基础概念开始,逐步展开对高考卤素知识点的解析。
一、基本概念 1. 卤素的定义:卤素是指位于周期表第17族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和石碱(M)五种元素。
2. 物理性质:卤素在常温下以分子形式存在,具有不同的颜色和状态。
例如,氟气是无色的,氯气呈黄绿色,溴液呈棕红色,碘呈紫色。
石碱是固体,呈白色结晶。
3. 化学性质:卤素在化学反应中具有活泼性,容易与其他物质发生反应。
例如,卤素可以与金属反应生成卤化物,与非金属反应生成卤化物或卤代烃等。
二、卤素的周期表位置卤素位于周期表的第17族,属于主族元素。
它们的原子结构特点是:外层电子层有7个电子,其中一个未成对的电子,具有较强的电负性和活泼性。
三、卤素的化合价与化合物 1. 卤素的化合价:卤素的化合价多变,通常为-1、+1、+3、+5、+7。
这是因为卤素的外层电子层只缺少一个电子或只需要一个电子即可达到稳定的八电子结构。
2. 卤素化合物:卤素与其他元素结合形成的化合物称为卤化物。
常见的卤素化合物有氯化钠(NaCl)、溴化银(AgBr)、碘化铅(PbI2)等。
四、卤素的应用卤素及其化合物在生活和工业中有着广泛的应用。
1. 消毒杀菌:氯化钠是常用的消毒剂,可用于杀灭细菌和病毒,保障饮用水的卫生安全。
2. 制药工业:碘是制备碘酒、碘酸钾等药品的重要原料,具有消炎和杀菌的作用。
3. 光敏材料:卤化银是一种光敏感材料,广泛应用于胶片、相纸和印刷等领域。
4.荧光剂:一些卤素化合物可以发出明亮的荧光,被应用于荧光灯、指示灯和荧光笔等产品中。
五、考点分析与解题技巧 1. 基本概念的理解:理解卤素的定义、物理性质和化学性质是解题的基础。
在学习过程中要重点掌握各个卤素的颜色、状态和一些常见的化学反应。



化学卤素知识点高一笔记化学卤素是高中化学课程中的重要内容之一,掌握其知识点对于学好化学课程至关重要。
下面将对化学卤素的相关知识进行整理和总结,提供给高一学生作为学习笔记参考。
一、卤素的基本概念和性质卤素是周期表第17族元素,包括氟(F)、氯(Cl)、溴(Br)和碘(I)。
这些元素具有以下共同的性质:1. 电负性高:卤素电负性逐渐减小,氟的电负性最大,碘的电负性最小。
这也使得卤素与其他元素的反应性增加。
2. 产生离子:卤素能够在化学反应中失去一个电子,形成带负电荷的卤素离子(如F-,Cl-,Br-,I-)。
3. 盐类生成:卤素与碱金属或碱土金属反应,会生成相应的卤化物盐。
例如,氯与钠反应生成氯化钠(NaCl)。
二、卤素的制备和性质应用1. 制备方法:卤素的制备方法主要有以下几种:a) 直接获取:如氯气可以通过电解食盐水制取。
b) 氧化反应:如氯气可以通过铁与盐酸的反应制得。
c) 还原反应:如通过加热氢气与氯气反应制取氯化氢。
2. 物理性质:卤素在常温下呈现不同的状态,氟和氯为气体,溴为液体,碘为固体。
此外,卤素具有特殊的颜色和气味,如氯气有刺激性气味,溴呈现红棕色。
3. 化学性质:卤素具有较强的氧化性和还原性,可与许多物质发生反应。
其中,卤素与非金属发生反应能够形成相应的卤化物,与金属反应会生成相应的盐类。
三、卤素的化合物1. 卤化物:卤素与金属形成的化合物称为卤化物。
卤化物具有较好的溶解性和稳定性,常用作实验室荧光灯和消毒剂的成分。
2. 卤代烷烃:卤素可以取代烷烃中的氢原子,形成卤代烷烃。
卤代烷烃在有机合成和医药领域具有重要的应用,如氯仿和溴苯等。
3. 氯代烃和全氟碳化合物:特殊的卤素化合物还包括氯代烃和全氟碳化合物。
氯代烃在制冷剂和消防装备中应用广泛;全氟碳化合物是一类具有优异性能的材料,如特氟龙。
四、卤素的环境和生物效应1. 环境问题:卤素化合物对环境具有一定的影响,如氯氟烃类物质对臭氧层的破坏,需要引起重视。
卤族元素复习一、卤族元素的相似性、递变性和特殊性二、基础知识梳理一、卤素的原子结构和单质的物理性质 随卤素核电荷数增加,电子层数依次递增,原子半径渐增大,其原子结构的递变而使卤素单质的物理性质呈规律性变化. 从F 2I 21.颜色渐加深,状态从气 液 固,密度从小 大,熔沸点由低 高(分子晶体)2.单质的溶解性——除氟外(与水剧烈反应)在水中溶解度都较小,且由大 小,都易溶于有机溶剂,下表列出Cl 2、Br 2、I 2在不同溶剂中的颜色.二、卤素的化学性质由于最外层均为7个电子,极易得一个电子,因此卤素都是强氧化剂,在自然界均只以化合态存在.但随着电子层数递增,原子半径渐增大,核对外层电子的引力渐减弱,得电子能力渐减弱,其氧化性逐渐减弱,主要表现:1.都能与金属反应①F 2和所有金属都能反应. ②Cl 2和绝大多数金属反应.③Br 2和较活泼金属反应.④I 2只和活泼金属反应.2.都能与H 2、P 等非金属反应.①F 2和H 2在暗处即爆炸②Cl 2和H 2需光照爆炸③Br 2和H 2需加热且缓慢化合(不爆炸)④I 2(蒸气)和H 2持续加热且仍为可逆反应. 3.特性:易升华①I 2 ②溴——唯一的常温呈液态的非金属,易挥发保存时加水封.③F 2——最强氧化剂,不能用氧化剂将F -氧化为F 2(只能用电解法)F 元素无正价.且能与稀有气体化合.④卤化氢——均易溶于水,在空气中形成白雾,其中只有HF 剧毒,但HX 都是大气污染物,水溶液均呈酸性,只有氢氟酸是弱酸,从HF →HI ,酸性逐渐增强.⑤NaX ——只有NaF 有毒可用作农药.⑥CaX 2——只有CaF 2不溶于水,CaCl 2作干燥剂.⑦AgX ——只有AgF 可溶,AgX 均具感光性,AgBr 作感光材料,AgI 作人工降雨材料。
⑧HClO 、HClO 2、HClO 3、HClO 4酸性逐渐增强,氧化性逐渐减弱卤素的性质○1卤素能溶于水,易溶于有机溶剂(酒精、苯、四氯化碳、丙酮等)。
高一氯元素知识点氯元素是化学元素周期表中的一种卤素,其化学符号为Cl,原子序数为17。
氯元素在自然界中广泛存在,具有广泛的应用和重要的化学性质。
1. 氯元素的基本性质氯元素是一种黄绿色气体,有刺激性臭味,密度较大,不溶于水。
氯元素在常温下存在于二原子分子形式Cl2,即氯气。
氯气具有毒性,有强烈的氧化性,可与大多数金属和非金属反应。
2. 氯元素的电子结构氯元素的电子结构为1s2 2s2 2p6 3s2 3p5,其中最外层电子数为7个。
氯元素通过接受一个电子可以稳定地达到八个外层电子,形成Cl-离子,具有稳定的负电荷。
3. 氯元素的化合价和化合物氯元素的化合价主要为-1、+1、+3、+5和+7。
在化合物中,氯元素可以与多种元素发生反应,形成氯化物。
氯化物的离子式通常为Cl-,如氯化钠(NaCl)、氯化铁(FeCl2)等。
氯元素也可以形成二原子分子化合物,如氯气(Cl2)和亚氯化物(Cl2-)等。
4. 氯元素的应用氯元素在工业生产和生活中有广泛的应用。
其中最重要的应用是作为消毒剂和漂白剂。
氯化合物常用于净水处理、游泳池水处理和消毒剂的生产中。
此外,氯元素还用于制造塑料、杀虫剂、氯胺等化学品。
5. 氯元素的环境影响虽然氯元素在许多方面具有重要的应用,但其使用也带来了一些环境问题。
氯化合物可以在水体中形成臭氧消耗物质,对大气层造成破坏。
此外,过量的氯元素也可能对生态系统和人类健康产生不利影响。
总结:氯元素是一种重要的化学元素,具有广泛的应用和重要的化学性质。
了解氯元素的基本性质、电子结构、化合价和化合物以及其应用和环境影响对于高一学生来说是必要的。
通过学习氯元素的知识,我们能够更好地理解化学元素和化学反应的本质,为进一步的学习打下基础。
高三卤素知识点卤素是指周期表中第17族元素,包括氟、氯、溴、碘和砹。
它们具有一些独特的性质和应用,是化学中重要的研究对象。
本文将介绍高三学生需要掌握的卤素知识点。
一、卤素的性质1. 物理性质:卤素是一组有色气体或液体,只有碘是固体。
它们具有较强的刺激性气味,可以和金属、非金属反应生成化合物。
2. 化学性质:卤素具有较强的活性,容易与金属反应生成卤化物。
卤素也能与氢反应生成相应的氢卤酸。
其中,氯气与水反应生成盐酸,溴气与水反应生成溴酸,碘气与水反应生成碘酸。
3. 卤素的氧化性:卤素越往下周期表延伸,其氧化性逐渐减弱。
最强氧化性的是氟,其次是氯、溴和碘。
二、卤素的存在形态1. 自由态:卤素在自然界中以离子、分子或原子的形式存在。
例如,氯离子存在于海水中,氯气存在于工业废气中。
2. 化合物形态:卤素广泛存在于化合物中,形成无机和有机卤化物。
常见的无机卤化物有氯化钠、溴化钾等,有机卤化物有氯仿、溴苯等。
三、卤素的应用1. 消毒剂:氯化物广泛用作消毒剂,如漂白粉、消毒液等。
2. 制药工业:卤化物在制药工业中具有重要作用,如碘酊可以用于消毒和消肿。
3. 光敏材料:卤素广泛应用于摄影胶片、X光片等光敏材料中,用于记录和成像。
4. 防腐剂:卤素可以用来制备防腐剂,防止木材腐烂。
5. 氟化物的应用:氟化物广泛应用于铝冶炼、制备帆布和塑料等化工过程中。
四、卤素的环境影响1. 氯氟烃:氯氟烃是一类对臭氧层破坏严重的物质,如氟利昂等,对环境和人类健康造成潜在危害。
2. 氯化物和溴化物:大量排放的氯化物和溴化物污染了水体和土壤,对生态环境产生负面影响。
3. 放射性碘:放射性碘是核辐射产物,对人体健康有辐射危害,因此在核事故发生后需要采取相应的防护措施。
结语:以上是高三卤素知识点的介绍,包括卤素的性质、存在形态、应用和环境影响等方面。
通过对这些知识点的学习,可以更好地理解卤素的特性及其在化学和日常生活中的应用。
希望本文能对高三学生的学习和备考有所帮助。
高中化学卤族元素知识点归纳[卤族元素]简称卤素.包括氟(F)、氯(C1)、溴(Br)、碘(I)和放射性元素砹(At).在自然界中卤素无游离态,都是以化合态的形式存在〔1〕位置:VIIA〔2〕原子构造:一样点:最外层电子数均为7不同点:F I电子层数逐渐增多,原子半径逐渐增大。
〔3〕相似性:①单质均为双原子非极性分子②主要化合价为 -1价,最高正价为+7价〔F除外〕③都具有强氧化性[卤素单质的物理性质]说明(1)实验室里,通常在盛溴的试剂瓶中加水(即“水封”),以减少溴的挥发.(2)固态物质不经液态而直接变成气态的现象,叫做升华.升华是一种物理变化.利用碘易升华的性质,可用来别离、提纯单质碘.(3)Br2、I2较难溶于水而易溶于如汽油、苯、四氯化碳、酒精等有机溶剂中.医疗上用的碘酒,就是碘(溶质)的酒精(溶剂)溶液.利用与水互不相溶的有机溶剂可将Br2、I2从溴水、碘水中提取出来(这个过程叫做萃取).[卤素单质的化学性质](1)卤素的原子构造及元素性质的相似性、递变性.卤化氢:易溶于水,在空气中形成白雾。
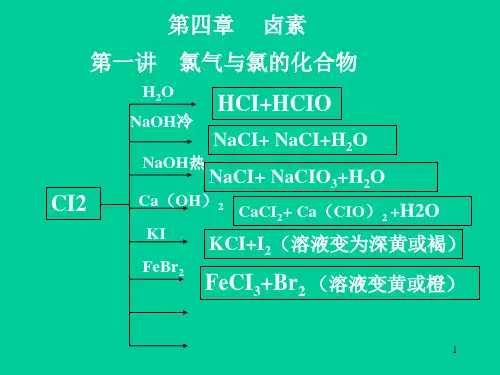
①HCl2 + 2H2O =4HF + O2(置换反响) 氧化性:F2>O2注意:将F2通入某物质的水溶液中,F2先跟H2O反响.如将F2通入NaCl的水溶液中,同样发生上述反响,等等.②X2 + H2O ~HX + HXO 〔X=Cl 、Br、I〕 Cl2 、Br2、I2与H2O的反响逐渐减弱,都是可逆反响。
〔4〕与金属反响卤族元素与变价元素一般生成高价态化合物,但 Fe + I2 = FeI2 〔碘化亚铁〕〔5〕与碱的反响:2F2 + 2NaOH =2NaF + OF2 + 2H2O X2〔Cl2 、Br2、I2〕+2NaOH NaX + NaXO + H2O(6)卤素单质间的置换反响.2NaBr + C12(新制、饱和) = 2NaCl + Br2 2Br- + C12 = 2C1- + Br2参加CCl4并振荡后,液体分层.上层为含有NaCl的水层,无色;下层为溶有Br2的CCl4层,显橙色.2NaI + C12(新制、饱和) =2NaCl + I2 2I- + Cl2 =2C1- + I2①参加CCl4并振荡后,液体分层.上层为含有NaI的水层,无色;下层为溶有I2的CCl4层,显紫红色.②将反响后的溶液加热蒸干灼烧,生成的I2升华,故残留的固体为NaCl(C12足量时)或NaCl和NaI的混合物(C12缺乏量时).2NaI + Br2 =2NaBr + I2 2I- + Br2 =2Br- + I2①参加CCl4并振荡后,液体分层.上层为含有NaBr的水层,无色,下层为溶有I2的CCl4层,显紫红色.②将反响后的溶液加热蒸干灼烧,生成的I2升华,故残留的固体为NaBr(Br2足量时)或NaBr和NaI(Br2缺乏量时).F2 + NaX(熔融) =2NaF + X2 (X=C1、Br、I)注意将F2通入含Cl-、Br-或I-的水溶液中,不是发生卤素间的置换反响,而是F2与H2O反响.(7)碘单质(I2)的化学特性.I2 + 淀粉溶液→ 蓝色溶液说明①利用碘遇淀粉变蓝的特性,可用来检验I2的存在.②只有单质碘(I2)遇淀粉才显蓝色,其他价态的碘无此性质.例如,向NaI溶液中滴加淀粉,溶液颜色无变化.假设再滴加新制氯水,因有I2被置换出来,那么此时溶液显蓝色.卤素检验⑴单质检验:Cl2、Br2—淀粉-KI试纸 I2—淀粉⑵C l-、Br-、I-检验:先加HNO3再加AgNO3〔8〕萃取和分液实验萃取是一种常用的别离液-液混合物的方法,它是利用一种溶质在两种互不相溶的溶剂里溶解度的不同,把溶质从一种溶剂转移到另一种溶剂的操作。
高一化学卤素的知识点归纳总结在高一的化学学习中,我们学习了许多关于卤素的知识。
卤素是周期表中第17族元素,包括氟(F)、氯(Cl)、溴(Br)和碘(I)。
下面是我对高一化学卤素知识点的归纳总结:一、卤素的特点卤素是非金属元素,大部分在自然界以化合物的形式存在。
卤素的电负性较大,具有活泼的化学性质。
卤素的原子半径逐渐增大,电子层外侧第7个主量子层的电子趋向稳定。
在同一周期中,原子半径逐渐增大。
二、卤素的物理性质1. 氟(F)是最轻的卤素,碘(I)是最重的卤素。
2. 卤素的颜色逐渐加深,气体为黄绿色,液体为红棕色,固体为黑色。
3. 卤素的密度逐渐增大,氟(F)的密度最小,碘(I)的密度最大。
4. 卤素的沸点、熔点逐渐增大。
三、卤素的化学性质1. 卤素的元素存在多种化合价。
氯(Cl)常见的化合价有-1、+1、+3、+5,+7。
溴(Br)和碘(I)的化合价主要有-1、+1、+3、+5。
2. 卤素可以与金属反应形成卤化物,如氯化钠(NaCl)。
3. 卤素可以与非金属反应形成卤素化合物,如氯化氢(HCl)。
4. 卤素可以与氢气反应生成卤化氢,如氯气与氢气反应生成氯化氢(HCl)。
5. 卤素可以与氢氧化物反应生成卤化氢酸,如氯气与氢氧化钠反应生成氯化钠(NaCl)和氢氧化钠(NaOH)。
四、卤素的用途1. 氯(Cl)广泛应用于消毒、制取氯气和制备盐酸等。
2. 氟(F)在制备氟化物、制取氟气、人工合成氟化金刚石方面具有重要应用。
3. 溴(Br)广泛用于制取溴化物、制备有机溴化合物等。
4. 碘(I)在医药、制剂、染料、防腐剂等方面有广泛应用。
五、卤素的环境影响卤素化合物在一些特定条件下,会对大气、土壤和水体等环境产生污染和破坏。
例如,氯氟烃和卤酸盐是对臭氧层破坏较严重的物质。
总结:卤素是一组重要的非金属元素,具有活泼的化学性质。
我们需要了解卤素的特点、物理性质、化学性质、用途以及环境影响。
通过对卤素知识的归纳总结,希望能够帮助读者更好地理解和掌握高一化学中有关卤素的重要知识点。
卤素知识点总结1. 卤素的基本性质卤素是一组非金属元素,它们具有共同的化学性质,包括具有较强的还原性和活性等。
在单质状态下,它们通常以二元分子的形式存在,如F2、Cl2、Br2、I2等。
此外,卤素还有一些共同的化学特性,比如它们都可以与氢化合,形成卤化氢酸,如氢氟酸(HF)、氢氯酸(HCl)等。
2. 卤素的物理性质卤素在常温下的物理性质有一定差异,氟和氯是气态,溴是液态,而碘和砹是固态。
除了氟之外,其他卤素在常温下都是有色的:氯是淡黄色,溴是红棕色,碘是紫黑色。
此外,卤素的熔点和沸点随着原子质量的增加而逐渐增加。
3. 卤素化合物卤素可以形成众多的化合物,包括卤化物、卤代烃、卤酸盐等。
其中最重要的化合物是卤化物,它们与多种金属形成盐类,用于各种工业生产和实验室操作。
此外,卤素还可以与碳形成各种有机卤化物,如氯甲烷、溴苯等。
这些有机卤化物在工业上广泛应用,同时也是环境和人类健康的问题之一。
4. 卤素在生物体中的作用卤素在生物体中具有重要的作用。
氟化合物可以加强骨齿的硬度,对于牙齿健康起到重要的作用。
但同时,过量的氟摄入也会导致氟中毒。
另外,碘是甲状腺激素的重要成分,对于人体新陈代谢和生殖系统的发育具有重要影响。
甲状腺功能亢进和甲状腺肿瘤等疾病也与碘的摄入有关。
5. 卤素的应用卤素在工业、医药、农业等领域都有广泛的应用。
在工业生产中,卤化物常用于制取氟化氢、氯化氢等工业原料。
在医药领域,氯化物和碘化物常用于消毒和杀菌。
在农业领域,氯化物和溴化物也可以用于制作杀虫剂和杀菌剂。
6. 环境和健康问题随着卤素的广泛应用,环境和健康问题也日益凸显。
例如,氯氟烃和氟化合物的广泛使用导致大气臭氧层的破坏,这对于人类和其他生物的生存都造成了威胁。
同时,地下水和土壤中卤素化合物的浓度升高也会对环境和人类健康造成影响。
因此,科学家和工程师一直在努力寻找新的环保的替代品,以减少卤素的使用对环境的影响。
综上所述,卤素作为非金属元素的一种,具有多种重要的化学性质和应用价值。