第九章 吸收
- 格式:doc
- 大小:922.51 KB
- 文档页数:26


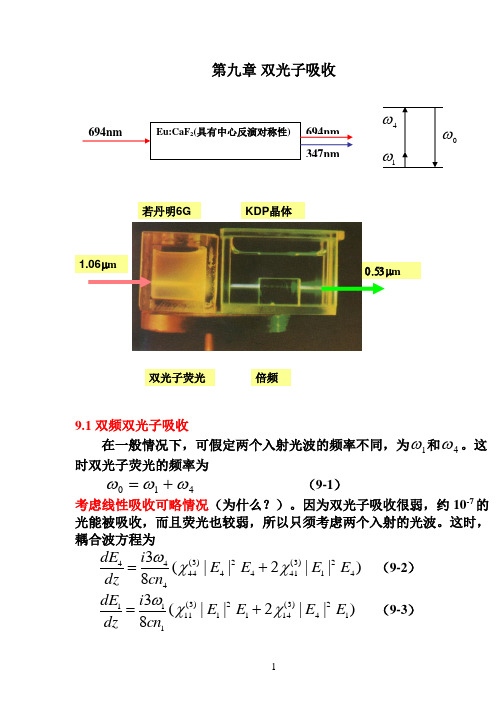
第九章 双光子吸收9.1 双频双光子吸收在一般情况下,可假定两个入射光波的频率不同,为1ω和4ω。
这时双光子荧光的频率为410ωωω+= (9-1)考虑线性吸收可略情况(为什么?)。
因为双光子吸收很弱,约10-7的光能被吸收,而且荧光也较弱,所以只须考虑两个入射的光波。
这时,耦合波方程为)||2||(83421)3(41424)3(44444E E E E cn i dz dE χχω+= (9-2) )||2||(83124)3(14121)3(11111E E E E cn i dz dE χχω+= (9-3) 1.06μm若丹明6G KDP 晶体双光子荧光 倍频0.53μm或421)3(4144424)3(44444||43||83E E cn i E E cn i dz dE χωχω+= (9-4) 124)3(1411121)3(11111||43||83E E cn i E E cn i dz dE χωχω+= (9-5)用*4E 乘(9-4)两边,用*1E 乘(9-5)两边,得2421)3(414444)3(44444*4||||43||83E E cn i E cn i dz dE E χωχω+=(9-6)2124)3(141141)3(11111*1||||43||83E E cn i E cn i dz dE E χωχω+= (9-7)两边取共轭,得(根据上图及(9-1)式,1ω,4ω,11ωω+,44ωω+皆 远离介质的共振频率,)3(44χ和)3(11χ皆为实数)2421*)3(414444)3(4444*44||||43||83E E cn i E cn i dz dE E χωχω--=(9-8)2124*)3(141141)3(1111*11||||43||83E E cn i E cn i dz dE E χωχω--= (9-9)(9-6)+(9-8),(9-7)+(9-9)得2421")3(414424||||23||E E cn dz E d χω-= (9-10) 2124")3(141121||||23||E E cn dz E d χω-= (9-11)")3(41χ是)3(41χ的虚部,")3(14χ是)3(14χ的虚部。


第八章传质过程导论第九章气体吸收1-1 吸收过程概述与气液平衡关系1-1 在25℃及总压为101.3kPa的条件下,氨水溶液的相平衡关系为p*=93.90x kPa。
试求(1) 100g水中溶解1g的氨时溶液上方氨气的平衡分压和溶解度系数H;(2) 相平衡常数m。
1-2 已知在20℃和101.3kPa下,测得氨在水中的溶解度数据为:溶液上方氨平衡分压为0.8kPa时,气体在液体中溶解度为1g (NH3)/1000g(H2O)。
试求在此温度和压力下,亨利系数E、相平衡常数m及溶解度系数H。
1-3 在总压为101.3kPa,温度为30℃的条件下,含有15%(体积%)SO2的混合空气与含有0.2%(体积%)SO2的水溶液接触,试判断SO2的传递方向。
已知操作条件下相平衡常数m=47.9。
1-2 传质机理1-4 组分A通过厚度为的气膜扩散到催化剂表面时,立即发生化学反应:,生成的B离开催化剂表面向气相扩散。
试推导稳态扩散条件下组分A、B的扩散通量及。
1-5 假定某一块地板上洒有一层厚度为1mm的水,水温为297K,欲将这层水在297K的静止空气中蒸干,试求所需时间为若干。
已知气相总压为101.3kPa,空气湿含量为0.002kg/(kg 干空气),297K时水的饱和蒸汽压为22.38 kPa。
假设水的蒸发扩散距离为5mm。
1-3 吸收速率1-6 采用填料塔用清水逆流吸收混于空气中的CO2。
已知25℃时CO2在水中的亨利系数为1.66×105kPa,现空气中CO2的体积分率为0.06。
操作条件为25℃、506.6kPa,吸收液中CO2的组成为。
试求塔底处吸收总推动力∆p、∆c、∆ X和∆ Y。
1-7 在101.3kPa及20℃的条件下,在填料塔中用清水逆流吸收混于空气中的甲醇蒸汽。
若在操作条件下平衡关系符合亨利定律,甲醇在水中的溶解度系数H=1.995kmol/(m3·kPa)。
塔内某截面处甲醇的气相分压为6kPa,液相组成为2.5 kmol/m3,液膜吸收系数k L=2.08×10-5m/s,气相总吸收系数K G=1.122×105 kmol/(m2·s·kPa)。

第一节概述一、什么是吸收?吸收是利用气体混合物中各组分在某种溶剂中溶解度的差异,而将气体混合物中组分加以分离的单元操作。
溶质: 气体混合物中能溶解的组分称为溶质,以A表示;惰性组分: 不溶或微溶组分称为惰性组分或载体,以B表示;溶剂: 吸收过程所用的溶剂称为吸收剂,以S表示;吸收液: 所得的溶液称为吸收液。
二、吸收在石油化工中的应用(1)回收有用组分(2)制取液态产品(3)净化气体(废气治理)三、吸收的工艺流程四、吸收分类按溶质和溶剂之间是否发生明显的化学反应吸收按溶于溶剂的组分数吸收按吸收过程是否发生明显的温度变化吸收五、吸收剂的选择1.溶解度大;2.选择性好;3.挥发度低;4.粘度低;5.无毒、无腐蚀;6.吸收剂应尽可能不易燃、不易发泡、价廉易得、稳定。
第二节吸收过程的相平衡关系一、气体在液体中的溶解度在一定的温度与压力下、使气体混合物与一定量的溶剂接触,气相中的溶质便向液相中的溶质转移,直至液相中溶质达到饱和为止,这时,我们称之为达到了相平衡状态。
达到了相平衡状态时气相中溶质的分压,成平衡分压;液相中溶质的浓度称为平衡浓度(或溶解度)。
大量实验表明,溶解度和气相中溶质的分压有关。
从图上可以看出:分压高,溶解度大温度高,溶解度小吸收操作应在低温高压下进行,脱吸应在高温、低压下进行二、亨利定律1.亨利定律在一定的温度下,当总压不很高(<500kpa)时,稀溶液上方溶质的平衡分压与该溶质在液相中的摩尔分率成正比,其表达式如下式中------溶质在气相中的平衡分压,KN/m2;------溶质在液相中的摩尔分率;E------亨利系数,。
式(9-1)称为亨利(Henry)定律。
亨利系数E值由实验测定,常见物系的E值可由有关手册查出。
当物系一定时,亨利系数随温度而变化。
一般说来,值随温度升高而增大,这说明气体的溶解度随温度升高而减小,易溶气体值小,难溶气体的值大。
2.用溶解度系数表示的亨利定律若将亨利定律表示成溶质在液相中的摩尔浓度与其在气相中的平衡分压之间的关系,则可写成如下形式(9-2)式中C──液相中溶质的摩尔浓度,kmol/m3H──溶解度系数,溶液中溶质的摩尔浓度和摩尔分率及溶液的总摩尔浓度之间的关系为(9-3)把上式代入式(9-2)可得将上式与式(9-1)比较,可得(9-4)溶液的总摩尔浓度可用1m3溶液为基准来计算,即(9-5)式中──溶液的密度(kg/m3)──溶液的摩尔质量。
第九章吸收本章学习要求1.掌握的内容相组成的表示方法及换算;气体在液体中的溶解度,亨利定律各种表达式及相互间的关系;相平衡的应用;分子扩散、菲克定律及其在等分子反向扩散和单向扩散的应用;对流传质概念;双膜理论要点;吸收塔的物料衡算、操作线方程及图示方法;最小液气比概念及吸收剂用量的确定;填料层高度的计算,传质单元高度与传质单元数的定义、物理意义、传质单元数的计算。
2.熟悉的内容各种形式的传质速率方程、传质系数和传质推动力的对应关系;各种传质系数间的关系;气膜控制与液膜控制;吸收剂的选择。
3.了解的内容分子扩散系数及影响因素。
第1节概述9.1.1.气体吸收过程和工业应用1.吸收吸收~利用混合气体中各组份在同一种液体(溶剂)中溶解度差异而实现组分分离的过程称为气体吸收。
2.吸收操作在化工生产中的应用(1)分离混合气体以获得一定的组分。
(2)除去有害组分以净化气体。
(3)制备某种气体的溶液。
(4)保护环境。
3.吸收与脱吸作为一种完整的分离方法,吸收过程应包括“吸收”和“脱吸”两个步骤。
“吸收”仅起到把溶质从混合气体中分出的作用,在塔底得到的是由溶剂和溶质组成的混合液,此液相混合物还需进行“脱吸”才能得到纯溶质并回收溶剂。
9.1.2 吸收过程的分类吸收过程可按多种方法分类1.按过程有无化学反应分类(1) 物理吸收~在吸收过程中,如果溶质与溶剂之间不发生明显的化学反应,可看做是气体中可溶组分单纯溶解于液相的物理过程,称为物理吸收。
用水吸收二氧化碳、用洗油吸收芳烃等过程都属于物理吸收。
(2) 化学吸收~如果溶质与溶剂发生显著的化学反应,则称为化学吸收。
用硫酸吸收氨、用碱液吸收二氧化碳等过程均为化学吸收。
2.按被吸收的组分数目分类(1) 单组分吸收~混合气体中只有一个组分进入液相,其余组分不溶解于溶剂中,称为单组分吸收。
例如合成氨原料气中含有N2、H2、CO、CO2等组分,而只有CO2一个组分在高压水中有较为明显的溶解度,这种吸收过程属于单组分吸收过程。
第九章 吸收第一节 概述9-1 吸收操作利用气体混合物各组分在某种溶剂中溶解度的不同而分离气体混合物的操作称为吸收。
一些基本概念:据图9-1 进行介绍。
一. 吸收操作的工业目的1. 原料气的净化此目的应用最广。
例如合成氨工业氨中作为合成氨反应原料气的H2是通过下列变换反应得到的CO+H 2O =CO 2+H 2上述变换反应含有副产物CO2,必须在合成反应之前将其除去。
一般采用水或碱液将上述变换反应得到的混合气体中的CO2通过吸收的方法将其除去。
2. 有用组分的回收 例如用水吸收合成氨厂中放空气体中的氨,用洗油回收焦炉煤气中的粗苯。
3. 制备产品例如盐酸和福尔马林的工业生产。
4. 废气处理例如工业上一些含有酸性气体的尾气通过吸收后再排放。
二. 分类 图9-1 吸收塔示意图1. 按吸收时有否发生明显的化学反应分●物理吸收:吸收时不发生明显的化学反应●化学吸收:吸收时发生明显的化学反应,例如NaOH+CO 2NaHCO 3NaHCO 3 +NaOH Na 2CO 3+HO9-2 吸收流程和溶剂选择一. 吸收流程吸收操作所用的溶剂,有的需要回收,有的不需要回收。
如果溶剂不需要回收,则吸收操作流程只有吸收部分;如果所用溶剂需要回收,则吸收操作流程包括吸收部分和脱吸部分,如图9-2所示。
关于吸收流程的几个问题:1).气液流向2).多塔吸收,参见图9-3和9-43).温度和压力4).脱吸过程图9-2焦炉煤气中的粗苯回收流程示意图图9-3多塔吸收:气液逆流串联图9-4多塔吸收:气体串联液体并联二.溶剂的选择1).溶解度大2).选择性好3).不易挥发4).其它物理性质要求(粘度、比热、发泡性等)5).其它化学性质要求(腐蚀性、毒性、燃爆性等)6).其它要求第二节 吸收基本理论9-3 吸收过程的相平衡关系一. 气体在溶液中的溶解度在一定的温度和压强下,使一定量的吸收剂与混合气体接触,开始了溶解过程。
经过一定时间后,除了气体溶质分子进入溶液外,也有溶质分子从溶液中逸出进入气体,但总的说来入大于出。
经过足够长的时间后,入等于出,物系处于相际动态平衡,简称为相平衡。
平衡状态下气相中的溶质分压称为平衡分压或饱和分压,液相中的溶质浓度称为平衡浓度或饱和浓度。
所谓气体中溶质在溶剂中的溶解度,就是指气体中溶质在溶剂中的饱和浓度。
溶解过程自由度F :对于单组分物理吸收而言F =C (组分数)-Φ(相数)+2=3-2+2=3自由度为3,则在温度t 、压力P (总压)、气相组成y 、液相组成x 四个变量中,只要任意三个变量确定,则第四个变量随之确定,不能独立变化。
由实验知,总压P 在几个大气压的范围内对平衡的影响很小,可以忽略,于是在一定温度下,一定溶质的液相平衡浓度为气相组成的函数,可表示为c A * = f(p A ) (9-1)同理有p A * = f(c A ) (9-2)在同一溶剂中,不同气体的溶解度有很大差别,图9-5为一定温度下几种气体在水中的溶解度曲线。
由溶解度曲线的斜率可判断其溶解度的大小。
温度是影响溶解度的重要参数。
图9-6是SO2于两个温度下在水中的溶解度曲线示图,由图可见,温度越高,溶解度越小,这一现象具有普遍性。
压力对溶解度的影响:压力增大,溶解度增大;压力减小,溶解度减小。
图9-5 几种气体在水中的溶解度曲线二. 气液平衡方程1. 用亨利常数关联在总压不高(一般小于5-10atm ),一定温度下,有p A *=Ex A (9-3)上述关系称为亨利定律,式中的E 称为亨利常数。
E 值的大小表征气体溶解度的大小,E 值越大,溶解度越小。
亨利定律的适用情况a.对于理想溶液,在所有浓度范围内适用,且E=p A 0,于是与拉乌尔定律一致。
b.对于非理想溶液,仅适用于稀溶液(参见图9-5)。
在亨利定律适用的范围内, E 值只是温度的函数,而与P 、c A 、p A 无关。
2. 用溶解度关联p A *= (9-4)式中H 称为溶解度常数,其与E 的关系为H = (9-5)3. 用相平衡常数关联y A *=mx A (9-6)对于单组分吸收,可表示为y*=mx (9-6a)式中m 称为相平衡常数,其与E 的关系为m= (9-7)注意,m 值既是温度的函数,又与总压有关。
9-4 吸收过程机理和传质速率方程一. 吸收过程机理-双膜理论以膜模型为基础的双膜理论在传质机理研究中占有重要地位,其物理模型如图9-7所示,其理论要点:1).气液间存在稳定的相界面,两侧各有很薄的当量层流膜层,溶质以分子扩散的方式串联通过二膜层;2).相界面气液达成平衡,无传质阻力;3).气液主体浓度处处相同。
二. 传质速率方程1. 亨利定律适用于气液平衡的情况图9-7 传质双膜模型示意图H c A E c t P E将前一章得到的固体壁面与流体间的传质速率方程应用于气液传质的两膜层,得N A =k G (p G –p i ) (9-8) N A =k L (c i –c L ) (9-9)注意上二式推动力顺序的不同。
由于pi 、 ci 实际上很难测定,上二式不便应用,解决办法是设法消除其中的p i 、 c i 。
对于亨利定律适用于气液平衡的情况:c i = p i H (9-10)设与c L 达成平衡的气相组成为p L *,则有c L = p L *H (9-11) 将式(9-10)和(9-11)代入式(9-9)得N A =k L H(p i –p L * ) (9-12)将式(9-12)与(9-8)联立并全部写成(推动力/阻力)的形式得N A =上式中,1/k G 为气相传质分阻力, 1/Hk L 为气相传质分阻力。
应用加比定律 NA =令K G = (9-13a )或(9-13b )于是得N A =K G (p G –p L * ) (9-14)K G 称为以压强差为推动力的总传质系数,简称为总传质系数。
1/ K G 则为总传质阻力。
同理可得N A =K L (c G * –c L ) (9-15)式中K L = (9-16a ) L L i G i G Hk 1p p k 1p p *-=-L G L G Hk 1k 1p p +-*LG Hk 1k 11+L G G Hk 1k 1K 1+=LG k 1k H 1+或(9-16b )注意式中各参数的意义。
比较式(9-13)和(9-16)得K G =HK L (9-17)上述公式的推导与两流体对流传热总传热速率方程的推导相似,较复杂的是需利用亨利定律进行气相或液相组成的换算。
经相似的推导还可得N A =K y (y –y* ) (9-18)N A =K x (x* –x ) (9-19)式中K y = (9-20a )或(9-20b )K x = (9-21a )或(9-21b )K x =mK y (9-22)2. 亨利定律不适用于气液平衡的情况当溶液浓度超出亨利定律的适用范围时,用来关联气液平衡关系的三个平衡常数的数值将随着浓度的变化改变,不能应用式(9-12)至(9-22)计算传质速率,应寻求其它方法计算传质速率。
不管亨利定律是否适用于气液平衡的情况,式(9-8)和(9-9)都成立,联立这两个计算式得L G L k 1k H K 1+=xy k m k 11+x y y k m k 1K 1+=x y x k 1mk 1K 1+=x y k 1mk 11+(9-23)由上式可知,代表界面组成的点I(c i , p i )落在过点P (c L , p G ),斜率为-k L /k G的直线上,且点I又符合平衡关系。
据此,可用图解法求得点I,如图9-8所示,然后利用式(9-8)或(9-9)计算传质速率。
3.总传质速率方程的分析●推动力分析据图9-9进行分析,指出各线段与推动力的对应关系。
●阻力分析以下式为例进行分析图9-8气液相界面组成的图解图9-9传质推动力图示上式左侧表示气相总传质阻力,右侧第一项表示气相分阻力,第二项表示液相分阻力,注意这种情况下的液相阻力不是1/k L,气液分阻力之和构成总阻力。
同理左侧表示液相总传质阻力,右侧第一项表示液相分阻力,第二项表示气相分阻力。
其它表示方式的传质系数可作相似分析。
当气膜阻力远大于液膜阻力时,称为气膜控制;反之,当液膜阻力远大于气膜阻力时,称为液膜控制。
一般说来,k G、k L的变化范围不大,如填料塔中以水作溶剂时k L的数量级为10-4m/s,常压下k G的为10-3 -10-4kmol/(m2.s.atm),所以决定气液膜阻力相对大小的主要因素是H值的大小。
气膜控制时,K G≈k G,液膜控制时GLLiGikkccpp-=--LGGHk1k1K1+=GLLkHk1K1+=LGGHk1k11K+=上式右侧分母两项中,1/k G大小与气膜控制时相当,另一项由于H值很小使得1/Hk L远大于1/k G,因此算得的K G远小于气膜控制时的K G,故液膜控制(难溶气体)时不仅溶解度小,而且传质速率也小,所以选择溶剂时溶解度大应放在第一考虑因素。
补例9-1在常压及20˚C下测得氨在水中的平衡数据为:浓度为0.5gNH3/100gH2O的稀氨水上方的平衡分压为400Pa,在该浓度范围内平衡关系可用亨利定律表示。
试求E、H及m。
解:x=(0.5/17)/(0.5/17+100/18)=0.00527E=(p/x)=400/0.00527=7.59×104Pay=mxy=p/P=400/101.33×103=0.00395m=0.00395/0.00527=0.75c A=n A/V=(0.5/17)/((0.5+100)/1000)=0.293kmol/m3H=c A/p=0.293/400=7.33×10-4kmol/(m3.Pa)补例9-21)氨水的浓度和温度与上题相同,而上方的总压强变为200kPa,试求E、H及m。
2)又如果氨水的浓度与总压与上题相同,而氨水温度升高到50˚C,已知此时氨水上方的平衡分压为500Pa,再求E、H及m。
解:1)E=7.59×104PaH=7.33×10-4kmol/(m3.Pa)m=E/P=7.59×104/200×103=0.382)E=p/x=500/0.00527=9.49×104PaH=c A/p=0.293/500=5.86×10-4kmol /(m3.Pa)m=y/x=E/P=9.49×104/101.33×103=0.937结论:1)对于一定的物系,E和H只与温度有关,而m则还与总压P有关;2)P越大,m越小,对吸收有利;3)温度越低,E及m越小,H越大,对吸收有利,反之则相反。