铁系元素
- 格式:ppt
- 大小:1.69 MB
- 文档页数:47

铁系元素知识点铁系元素是指周期表中的8个元素,包括铁(Fe)、铬(Cr)、锰(Mn)、钴(Co)、镍(Ni)、铜(Cu)、锌(Zn)和钌(Ru)。
这些元素在化学性质和应用中有许多相似之处,下面将逐步介绍铁系元素的一些知识点。
1.铁(Fe)铁是地壳中含量最丰富的金属元素之一。
它的特点是具有良好的延展性和导电性,而且能够与氧反应生成氧化铁。
铁广泛应用于建筑、制造业和能源等领域。
2.铬(Cr)铬是一种硬质且具有优异耐腐蚀性的金属。
它在不锈钢制造和电镀行业中得到广泛应用。
铬还可以形成一种绿色的化合物——铬酸盐,被用作颜料和染料。
3.锰(Mn)锰是一种重要的合金元素,可以提高钢的硬度和韧性。
锰还被用于制造电池、化肥和染料。
锰的化合物在玻璃工业中也有应用。
4.钴(Co)钴是一种重要的金属元素,具有磁性和耐高温性能。
它广泛应用于合金制造、电池和催化剂等领域。
钴还用于制造钴蓝颜料,被广泛用于陶瓷和玻璃工艺品中。
5.镍(Ni)镍是一种耐腐蚀的金属,广泛应用于合金制造和电镀行业。
镍合金在航空航天、化工和核工业中具有重要作用。
镍也是一种重要的催化剂,被用于化学反应中。
6.铜(Cu)铜是一种良好导电性能和导热性能的金属。
它广泛应用于电线、电缆和电子设备制造。
铜还是一种重要的合金元素,例如青铜就是铜和锡的合金。
7.锌(Zn)锌是一种常见的金属元素,具有抗腐蚀性。
锌广泛应用于镀锌、电池、合金制造和化工等领域。
锌还是人体必需的微量元素,对维持免疫系统和生长发育具有重要作用。
8.钌(Ru)钌是一种稀有的金属元素,具有良好的耐腐蚀性。
钌常被用作催化剂和合金元素。
它还被用于制造钌红颜料、电子元件和光学器件。
以上是铁系元素的一些知识点介绍。
铁系元素在工业和科学研究中扮演着重要角色,它们的性质和应用各不相同,但又有些相似之处。
了解这些知识点有助于我们更好地理解和应用这些元素。

铁的化学元素
铁(Fe)是化学元素周期表中的第二十五号元素,其原子序数为26,拉丁字母及符号为Fe,属于金属元素,属于第八组,元素体系中的分子量为56。
铁元素有十种同位素,其中54Fe为主要的同位素,占地壳的比例为95.8%,57Fe占2.2%,58Fe占0.7%,55Fe占0.2%。
铁在自然中以铁矿石的形式存在,铁矿石主要有黑色金长岩、褐色超铁质岩物和磁铁矿,其中以黑色长岩和褐色超铁质岩物为主,磁铁矿仅占少数。
铁元素具有较强的韧性、磁性、电导性和化学反应性,能与水、氧及其他化学物质形成反应,有很强的电阻性。
其它化学物质与铁发生反应,可以形成碳氢化合物、氧化铁元素的化合物等多种化学物质。
铁的正常气温下已形成多种氧化状态:Fe0(金属铁)、Fe2+(亚铁铁)、Fe3+(铁酸铁)。
此外,铁的反应也可以形成其它铁氧化物,如氧化铁亚铁、氧化铁钙、氧化铁钠和氧化铁锆等。
在绝大多数情况下,金属铁是铁的最稳定状态,它是铁元素最重要的一个氧化状态,它属于稳定的超强铁矿物,具有较强的磁性、坚韧性、抗氧化性及高熔点等特性。
此外,它的电导性和抗磨性也较强。
同时,铁的化学性质也会随着其含量的变化而发生变化,当含量小于4.3%时,钢又是另外一种特殊的金属,其主要成分为镍、锰、磷和铬。
这些元素使钢具有强度、韧性和耐腐蚀性等特性,使其成为重要的建筑材料、工业材料和必需品等。


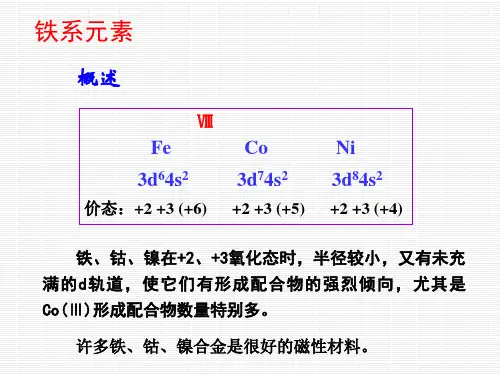
22 铁系元素和铂系元素22-1铁系元素通性ⅧB族元素与其它各族元素不同,有三个直行共九个元素,即第四周期的铁、钴、镍,第五周期的钌、铑、钯,第六周期的锇、铱、铂,通常把这九个元素按其性质上的接近程度分为两组,把第四周期的Fe、Co、Ni称为铁系元素,而其余六个元素则称为铂系元素,这里先讨论铁元素。
1.铁系元素的基本情况价电子构型3d64s2 3d74s2 3d84s2主要氧化数 +1.+2.+3 +2.+3.+4 +2.+3.+4原子半径(pm) 124.1 125.3 124.6离子半径(M2+) 74 72 69电离势(KJ/mol-1) 764.0 763 741.1电负性 1.83 1.88 1.91φ0M2+/M(V) -0.473 -0.227 -0.232①从价电子构型看,外层4s轨道均有2个电子,次外层3d轨道分别为6.7.8而原子半径,离子半径以很相近,因此性质相似。
②由于3d轨道已超过5个电子,全部价电子参与成键的可能性减少,随着价电子数的增加,从Fe-Co-Ni形成高氧化态的趋势减小;Fe有稳定的+2.+3氧化态,在强氧化剂存在下,可出现不稳定的+6氧化数(高铁酸盐FeO42-);Co则通常表现为+2,在强氧化剂存在下可出现不稳定的+3氧化态;Ni则经常表现为+2氧化态。
这可理解为在电子层数相同的情况下,随着原子序数增加(3d电子增加),有效核电荷增加,使核对价层电子的吸引力增强,故3d电子的稳定性增加而难于参加成键。
因而显高氧化态趋于困难。
③从电离势和φ0值可以看出从Fe-Ni金属活泼性减弱,这也可从Z*的变化加以理解。
2.单质的性质①都具有铁磁性,即经磁场作用后,能使磁场大大加强,磁场取消后也不立即消失。
②都是中等活泼的金属。
(见φ0M2+/M)a.在常温和无水蒸汽存在时,几乎不与O2、S、Cl等非金属单质反应,但在高温下,则能与很多非金属和水蒸汽反应。
如:b. 它们都能溶于稀酸。


【考必备·清单】铁、钴、镍同属于元素周期表中的Ⅷ族,性质相近,故统称为铁系元素,其主要化合价为+2和+3价。
1.Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)性质差异(1)氧化物氧化铁与酸只发生复分解反应,而氧化钴与氧化镍在酸性溶液中显示出强氧化性:Co2O3+6HCl===2CoCl2+Cl2↑+3H2O、Ni2O3+6HCl===2NiCl2+Cl2↑+3H2O。
(2)氢氧化物铁的氢氧化物只与酸发生酸碱中和反应:Fe(OH)3+3H+===Fe3++3H2O。
镍、钴的氢氧化物与还原性酸发生氧化还原反应:2Co(OH)3+6H++2Cl-===2Co2++Cl2↑+6H2O,2Ni(OH)3+6H++2Cl-===2Ni2++Cl2↑+6H2O。
(3)离子存在状态Fe3+在酸性溶液中可以稳定存在,而Co(Ⅲ)、Ni(Ⅲ)仅能够存在于固态物质或配合物中,在水溶液中会发生如下反应(镍同):4Co3++2H2O===4Co2++4H++O2↑。
2.Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)性质差异(1)氢氧化物还原性[Fe(OH)2>Co(OH)2>Ni(OH)2]①Fe(OH)2在空气中极易被氧化成Fe(OH)3;②Co(OH)2在空气中被O2氧化的速度较慢;可以被强氧化剂(H2O2)迅速氧化;③Ni(OH)2在空气中不易被氧化,只有在更强的氧化剂条件下才会氧化生成Ni(OH)3。
(2)与氨水反应①Fe(OH)2―→Fe(OH)3;②Co(OH)2―→[Co(NH3)6]2+;③Ni(OH)2―→[Ni(NH3)6]2+。
借此反应,可以使三种离子分离。
[名师点拨]①Co(OH)2可被氧气缓慢地氧化成棕褐色Co(OH)3,Ni(OH)2与氧气不反应,可采用较强的氧化剂将其氧化。
②Co(OH)3、Ni(OH)3在H2SO3溶液中被还原:2Co(OH)3+H2SO3+2H+===2Co2++SO2-4+5H2O,2Ni(OH)3+H2SO3+2H+===2Ni2++SO2-4+5H2O。

一、实验目的1. 了解铁系元素的基本性质和特点。
2. 掌握铁系元素在化学实验中的应用。
3. 通过实验,加深对铁系元素的认识。
二、实验原理铁系元素是指铁、钴、镍这三种性质相似的元素,它们在周期表中分别位于8族、9族及10族(合称B族)之首,位于6个铂族元素上方。
铁系元素的电子壳层最外层都有两个电子,但第二外层的电子数不同,分别为6、7、8。
由于它们具有相近的原子半径,因此它们的性质也会很相似。
铁系元素的一大特征为其单质在常温下表现出铁磁性。
三、实验材料与仪器1. 实验材料:铁、钴、镍单质,盐酸,硫酸,氢氧化钠,硫酸铜溶液,硫酸亚铁溶液,硫酸钴溶液,硫酸镍溶液,氯化铁溶液,氯化钴溶液,氯化镍溶液等。
2. 实验仪器:烧杯,试管,酒精灯,铁架台,滴定管,移液管,玻璃棒,滤纸等。
四、实验步骤1. 铁的实验(1)取一定量的铁片,用砂纸打磨表面,观察其颜色和硬度。
(2)将铁片放入盐酸中,观察铁片表面产生的气泡,记录反应速率。
(3)取一定量的硫酸亚铁溶液,加入氢氧化钠溶液,观察沉淀的形成。
(4)将硫酸亚铁溶液与硫酸铜溶液混合,观察颜色变化。
2. 钴的实验(1)取一定量的钴片,用砂纸打磨表面,观察其颜色和硬度。
(2)将钴片放入盐酸中,观察铁片表面产生的气泡,记录反应速率。
(3)取一定量的硫酸钴溶液,加入氢氧化钠溶液,观察沉淀的形成。
(4)将硫酸钴溶液与硫酸铜溶液混合,观察颜色变化。
3. 镍的实验(1)取一定量的镍片,用砂纸打磨表面,观察其颜色和硬度。
(2)将镍片放入盐酸中,观察铁片表面产生的气泡,记录反应速率。
(3)取一定量的硫酸镍溶液,加入氢氧化钠溶液,观察沉淀的形成。
(4)将硫酸镍溶液与硫酸铜溶液混合,观察颜色变化。
五、实验结果与分析1. 铁的实验(1)铁片表面呈现银白色,硬度较高。
(2)铁片与盐酸反应产生气泡,反应速率较快。
(3)硫酸亚铁溶液与氢氧化钠溶液反应生成白色沉淀。
(4)硫酸亚铁溶液与硫酸铜溶液混合后,溶液颜色变为浅绿色。

铁系元素知识点总结高中一、铁系元素的基本概念铁系元素是指周期表中第八族元素,包括铁、钴、镍等。
它们在自然界中非常常见,广泛存在于地壳、生物体中,对人类社会起着非常重要的作用。
铁系元素具有一些共同的特点,如具有相似的电子结构、物理性质和化学性质等。
二、铁的性质及应用1. 铁的性质铁是一种银白色的金属,具有很高的导电、导热性能和韧性,易于加工成各种形状,因此被广泛用作建筑材料、工业原料等。
2. 铁的应用铁广泛用于制造建筑材料、机械设备、交通工具、武器等。
在现代社会中,铁已成为不可或缺的航空工业的材料。
三、钴的性质及应用1. 钴的性质钴是一种贵金属,具有非常高的磁性和耐热性,是一种重要的合金原料。
钴的化学性质相对较稳定,不易氧化腐蚀。
2. 钴的应用钴广泛用于生产合金、电池、化工催化剂等。
其中,钴钼合金被广泛用于制造飞机发动机零件,电池中的锂钴酸锂也成为了电动汽车电池的主要材料。
四、镍的性质及应用1. 镍的性质镍是一种金属元素,与铁相似,具有较高的硬度、耐腐蚀性和磁性,是一种重要的合金原料。
镍的化学性质稳定,在氧化环境中不易被氧化。
2. 镍的应用镍广泛用于生产合金、电池、催化剂等。
其中,不锈钢是一种重要的合金材料,镍在其中起着非常重要的作用。
此外,镍在航空航天、医疗器械等领域也有着广泛的应用。
五、铁系元素在生物体中的作用铁系元素在生物体中起着非常重要的作用。
铁是血红素和肌红蛋白的组成成分,参与体内的氧气运输和储存,维持机体的生物活动。
在植物中,铁也是一种重要的微量元素,对植物的生长发育起着至关重要的作用。
六、铁系元素的环境影响铁系元素在工业生产、矿产开采等过程中会产生大量的废水、废气、废渣等,对环境造成了严重的污染。
特别是镍、铁等元素的矿产开采和冶炼过程中会产生大量的氧化镍、氧化铁等废渣,对土壤和地下水造成了严重的污染。
此外,钴、镍等元素的大量排放也对周围的生态环境产生了不良的影响。
七、铁系元素的利用与保护为了充分利用铁系元素的资源,减少对自然环境的破坏,需要采取一系列的措施,包括加强资源勘探、加强对冶炼废渣的处理、推广循环利用技术等,以实现可持续发展的目标。

实验五:铁、钴、镍铁、钴、镍属于第八族元素,又称铁系元素。
氢氧化铁为红棕色固体,氢氧化亚铁为白色固体,但是氢氧化亚铁很容易被氧气氧化为氢氧化铁。
在Fe3+的溶液中滴加NH4SCN会得到Fe3+的血红色配合物,而在Fe2+的溶液中滴加NH4SCN不会有沉淀生成,也不会有颜色;在Co2+和Ni2+的溶液中滴加强碱,会生成粉红色氢氧化钴(II)和苹果绿色的氢氧化镍(II)沉淀,氢氧化钴(II)会被空气中的氧缓慢氧化为暗棕色的氧化物水合物Co2O3.xH2O。
氢氧化镍(II)需要在浓碱溶液中用较强的氧化剂(如次氯酸钠)才能氧化为黑色的NiO(OH)。
Co2O3和NiO(OH)会和水或酸根离子迅速发生氧化还原反应;在水溶液中Fe3+和Fe2+的水配合物的颜色分别为淡紫色和淡绿色的形式存在。
在Fe3+和Fe2+的溶液中分别滴加K4[Fe(CN)6]和K3[Fe(CN)6]溶液,都得到蓝色沉淀,它们是组成相同的普鲁士蓝和滕氏蓝,可以用来鉴定Fe3+和Fe2+的存在;由于Co3+在水溶液中不稳定,所以一般是将Co2+的盐溶在含有配合物的溶液中,用氧化剂将其氧化,从而得到Co3+的配合物;在含有Co2+的溶液中滴加NH4SCN溶液,会生成蓝色的[Co(NCS)4]2+,由此鉴定Co2+的存在;在含有Ni2+的溶液中逐滴滴加氨水,会得到蓝色Ni2+的配合物,在此基础上继续滴加丁二酮肟,得到鲜红色鳌合物沉淀,由此鉴定Ni2+的存在。
实验内容:1:Fe3+的氧化性、Fe2+的还原性及其离子鉴定(1)离子鉴定:分别用K4[Fe(CN)6]、K3[Fe(CN)6]、NH4SCN和0.25%邻菲罗啉来鉴定Fe3+和Fe2+。
(2)氧化还原特性;2:铁、钴、镍的氢氧化物,Co2+和Ni2+二价氢氧化物的制备与对比;3:钴、镍的配合物。
Co2+和Ni2+的鉴定反应。
注意事项:(1)此次实验是定性实验,颜色变化是实验的关键内容,颜色变化和离子的价态一一对应,仔细观察实验并在实验报告中反映、思考;药品:0.2M的FeCl3,2M的硫酸,铁粉,0.5M的NH4SCN,浓硝酸,0.1M的KMnO4,0.2M的Co(NO3)2,2M的NaOH,2M的HCl,0.2M的Ni(NO3)2,NH4Cl固体,6M的氨水,5%的H2O2,戊醇,饱和NH4SCN(溶解度:300C下,208克/100克水),0.2M的Ni(NO3)2,丁二酮肟(补加的药品)。

铁系元素光催化
铁系元素在光催化反应中起到了重要的作用。
光催化是利用光能
激发催化剂,从而促使化学反应发生的过程。
铁系元素作为催化剂具
有很高的活性和选择性,可以在可见光范围内吸收光能,并将其转化
为化学反应所需的能量。
铁系元素的光催化主要应用在环境保护和能源领域。
例如,在水
处理中,铁系元素可用于光分解污染物,如有机染料和重金属离子。
光催化反应可以有效降解有害物质,提高水质的净化效果。
此外,铁系元素的光催化也在能源转换领域具有重要作用。
比如,利用铁系元素催化剂,可以将太阳能转化为化学能,从而实现可再生
能源的制备。
这一技术对于解决能源短缺和减少碳排放具有重要意义。
然而,铁系元素光催化仍面临一些挑战。
其中之一是寻找更高效
的催化剂,以提高光催化反应的效率和选择性。
此外,光催化反应的
机理仍不完全清楚,需要进一步的研究来揭示其反应机制。
总的来说,铁系元素的光催化具有巨大的潜力,并在环境保护和
能源领域发挥着重要作用。
通过持续的研究和创新,铁系元素光催化
技术将为可持续发展和绿色化学提供重要支持。
磁铁元素符号磁铁元素符号磁铁元素是指具有磁性的元素,它们在物理、化学和工业领域都有广泛的应用。
以下是一些常见的磁铁元素及其符号。
第一部分:铁系元素1. 铁(Fe)铁是最常见的磁性金属,也是地球上最丰富的金属之一。
它在自然界中以多种形式存在,包括天然铸造品、蚀变岩和陨石中的铁镍合金等。
在化学方面,铁可以形成多种氧化态,其中最常见的是二价和三价。
2. 钴(Co)钴是一种稀有的过渡金属,具有高度的耐腐蚀性和抗氧化能力。
它通常用于制造高温合金、磨料、电池和涂料等产品。
钴也是许多工业催化剂中不可或缺的成分。
3. 镍(Ni)镍是一种白色有光泽的过渡金属,在自然界中以硫化物或氧化物形式存在。
它具有优异的耐腐蚀性和高度可塑性,在许多行业中广泛应用,如电池、合金、催化剂和磁性材料等。
4. 锰(Mn)锰是一种灰色有光泽的过渡金属,通常以氧化物或碳酸盐的形式存在。
它具有优异的抗氧化性能和耐腐蚀性,常用于制造钢铁、合金和电池等产品。
第二部分:稀土元素5. 钕(Nd)钕是一种稀土元素,具有高度的磁性和导电性。
它通常用于制造强磁体、电机和发电机等产品。
钕也是许多高科技产品中不可或缺的成分,如手机、平板电脑和音响设备等。
6. 铕(Eu)铕是一种稀土元素,具有优异的荧光效果和磁性能力。
它通常用于制造荧光材料、显示器件和强磁体等产品。
铕也是许多医学设备中不可或缺的成分。
7. 铽(Tb)铽是一种稀土元素,具有高度的磁性能力和荧光效果。
它通常用于制造强磁体、显示器件和荧光材料等产品。
铽也是许多医学设备和高科技产品中不可或缺的成分。
第三部分:其他磁铁元素8. 钇(Y)钇是一种化学元素,常用于制造强磁体、电池和热障涂层等产品。
它也是许多工业催化剂和医学设备中不可或缺的成分。
9. 铁氧体(Fe3O4)铁氧体是一种黑色有光泽的物质,具有高度的磁性能力。
它通常用于制造磁性材料、电池和催化剂等产品。
10. 金属钕铁硼(Nd2Fe14B)金属钕铁硼是一种强磁性材料,具有优异的导磁性和耐腐蚀性。
合金元素的过渡系数一、铁系元素铁系元素是合金中最常用的过渡系元素之一。
铁作为一种重要的工业金属,具有良好的机械性能和导电性能。
通过添加铁系元素,可以改善合金的硬度、强度和耐磨性。
例如,将铬添加到铁中可以形成不锈钢,具有良好的耐腐蚀性;将钼添加到铁中可以形成钢,具有高强度和耐磨性。
二、铜系元素铜系元素在合金中也起着重要的作用。
铜具有良好的导热性和导电性,因此常用于制作电线、电缆和导热器件。
通过添加其他铜系元素,可以改变合金的性质。
例如,将锡添加到铜中可以形成青铜,具有高强度和耐蚀性;将铝添加到铜中可以形成铝青铜,具有良好的耐磨性和耐蚀性。
三、镍系元素镍系元素在合金中具有独特的性质。
镍具有良好的耐腐蚀性和高温性能,因此常用于制作耐腐蚀合金和高温合金。
例如,将镍添加到铁中可以形成镍铁合金,具有良好的耐腐蚀性和磁性;将镍添加到铜中可以形成镍铜合金,具有良好的导热性和耐腐蚀性。
四、钛系元素钛系元素具有良好的耐腐蚀性和高强度,因此常用于制作耐腐蚀合金和高强度合金。
例如,将钛添加到铁中可以形成钛铁合金,具有良好的耐腐蚀性和高强度;将钛添加到铝中可以形成铝钛合金,具有良好的高温性能和强度。
五、锆系元素锆系元素具有良好的耐腐蚀性和高温性能,因此常用于制作耐腐蚀合金和高温合金。
例如,将锆添加到钢中可以形成锆钢合金,具有良好的耐腐蚀性和高温性能;将锆添加到镍中可以形成锆镍合金,具有良好的耐腐蚀性和高温性能。
六、钼系元素钼系元素在合金中具有重要的作用。
钼具有高强度、高熔点和良好的耐腐蚀性,因此常用于制作高温合金和耐腐蚀合金。
例如,将钼添加到铁中可以形成钼铁合金,具有高强度和耐磨性;将钼添加到镍中可以形成钼镍合金,具有高温性能和耐蚀性。
合金中的过渡系元素具有独特的性质和应用。
通过合理选择和添加过渡系元素,可以改善合金的性能和使用范围。
合金的研究和应用对于提高材料的性能和开发新材料具有重要意义。
希望本文对于过渡系元素在合金中的应用和作用有所启发,并促进相关领域的研究和发展。
铁系元素实验注意事项
(1)只含Fe2+的溶液:检验Fe2+加入试剂的顺序待测液KSCN图波不变色如氯水、加KSCN溶液前,防止加入氧化性的物质使Fe2+氧化。
氧化剂不能选用酸性KMn04溶液,原因:酸性KMnO 4溶液本身显紫红色,对Fe(SCN)3红色有干扰; 酸性KMnO 4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe2+。
(2)同时含有Fe 2+和Fe3+的溶液
Fe2+对检验Fe 3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能采用加KSCN溶液检验Fe 2通常向溶液中滴加适量酸性KMn04溶液,溶液紫红色褪色说明含有Fe2+。
(3)固体粉末装入试管的操作,将固体粉末放入纸槽(或药匙),然后将试管平放,将纸槽(或药匙)送入试管,慢慢直立,取出纸槽(或药匙)即可。
(4)pH试纸的使用方法:取一小块pH 试纸放在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在试纸中部,待变色后与标准比色卡对照,读出pH。
(5)沉淀洗涤的方法:向漏斗中加蒸馏至没过沉淀, 静置,待水自然滤出,重复操作2—3次。
铁系元素的单质元素周期表第Ⅷ族中包括(Fe)、(Co)、(Ni)、(Ru)、(Rh)、(Pd)、(Os)、(Ir)、(Pt)共9种元素。
通常将前三种元素称为铁系元素,后六种元素称为铂系元素。
铁系元素的价电子构型为(n-1)d6~8ns 。
除2个s 电子参加成键外,内层的d轨道电子也可能参加成键,因而,铁系元素除形成稳定的+2氧化态外,还有其他氧化态。
铁的稳定氧化态为+2和+3,也存在不稳定的+6氧化态。
钴和镍的稳定氧化态为+2。
铁的矿物主要有赤铁矿Fe2O3、磁铁矿Fe3O4、褐铁矿2Fe2O3·3H2O、菱铁矿FeCO3。
钴的矿物是砷化物矿和硫化物矿,如砷钴矿CoAs2、辉钴矿CoAsS和硫钴矿Co2S4等。
镍的重要矿物有硅镁镍矿(Ni,Mg)6Si4O10(OH)8、镍黄铁矿(Ni,Fe)9S8、红砷镍矿NiAs等。
铁、钴和镍在地壳中的丰度分离为4.1%、2.9×10-3%和9.9×10-3%。
铂系元素中,惟独Os(5d6s2)和Ir(5d96s2)电子正常排布,其他4种元素的电子均为特别排布:Ru 4d75s1,Rh 4d5s1,Pd 4d105s0,Pt5d96s1,最外层s轨道削减1个或2个电子,而排布在次外层d轨道上。
铂系元素的内层d轨道参加成键能力更强,表现出更多的氧化态。
铁系元素的单质铁在人类社会进展的过程中起到了无可替代的作用。
公元前1400年左右,人类社会开头进入“铁器时代”,铁制工具的用法使大面积的农田开垦和耕作成为可能,社会生产力显著提高,推进了人类由原始社会进入奴隶社会。
铁系元素单质都是银白色具有光泽的金属,都有强磁性,许多铁、钴、镍合金是很好的磁性材料。
铁和镍延展性好,钴则硬而脆,低纯度的铸铁也是脆性的。
铱铁、钴、镍挨次,原子半径逐渐减小,金属的密度铱次增大。
铁系金属耐强碱性好,铂系金属抗酸能力强。
金属镍、钯、铂都有汲取氢的能力,其中金属把汲取氢的能力最强,1体积钯最多可汲取900多体积的氢。