2019年医学生物化学(代码731)考试大纲
- 格式:pdf
- 大小:279.47 KB
- 文档页数:8


739检验综合考试大纲主要包括临床生物化学检验技术、临床微生物学检验技术、临床免疫学检验技术等方面的内容。
具体如下:
临床生物化学检验技术:
1. 临床生物化学检验技术的基本知识;
2. 临床生物化学检验技术的实验方法和应用;
3. 临床生物化学检验技术的质量控制和管理;
4. 临床生物化学检验技术在疾病诊断和治疗中的应用。
临床微生物学检验技术:
1. 微生物学的基本知识;
2. 微生物学检验的方法和技术;
3. 微生物学检验的质量控制和管理;
4. 微生物学检验在感染性疾病诊断和治疗中的应用。
临床免疫学检验技术:
1. 免疫学的基本知识;
2. 免疫学检验的方法和技术;
3. 免疫学检验的质量控制和管理;
4. 免疫学检验在自身免疫性疾病、肿瘤等诊断和治疗中的应用。
考生应掌握以上各部分的基本概念、原理和方法,能够运用所学知识进行实验设计、实验操作和结果分析,并能够将检验结果应用于临床实践。


《生物化学》专业考试大纲1.蛋白质化学蛋白质的分类。
蛋白质的一级结构及空间结构,蛋白质结构与功能的关系。
蛋白质的重要理化性质(胶体性质,两性本质,沉淀和变性)。
蛋白质的分离、纯化及鉴定。
2.核酸核酸的化学本质及DNA和RNA在组分、结构和功能上的差异。
瞟呤、嘧啶、核苷、核苷酸的核酸在分子结构上关系。
核酸的一级结构,DNA的二、三级结构及RNA的二、三级结构。
核酸的重要理化性质(紫外吸收、变性)。
核酸的生物学功能和实践意义。
3.维生素维生素与辅酶、辅基。
各种维生素的分布、化学本质、生理功能和缺乏症。
4.酶学弄清酶的化学本质,作为生物催化剂的酶与一般化学催化剂的异同。
活化能、活性中心、酶活性、Km、最适pH、最适温度酶元、竞争性抑制等名词的准确含义。
影响酶促作用的各种因素。
酶的催化机制。
诱导酶、同工酶和固相酶的本质和应用。
酶在人类生活上的重要性。
5.生物能学与生物氧化生物氧化的含义,它与物质体外氧化的异同点。
标准氧化还原电位、磷氧比、氧化磷酸化作用的准确含义。
吸呼链的组成、类型和传递顺序。
ATP的生成、转移、能量的贮存和利用。
氧化磷酸化作用机理。
6.糖代谢糖的消化吸收。
糖的分解代谢(糖酵解、糖的有氧分解、磷酸戊糖途径)。
三羧酸循环的酶促历程及它有机体代谢中的作用。
糖异生作用的途径及生理意义。
糖代谢调节。
7.脂类代谢脂类的消化、吸收、转运和贮存。
脂肪酸的分解代解β—氧化。
酮体的生成及利用。
磷脂的代谢。
胆固醇代谢,要了解胆固醇对人体的重要性和危害性。
脂类代谢紊乱。
8.蛋白质代谢蛋白质的消化吸收。
必需氨基酸,氧化脱氨基作用,转氨基作用,联合脱氨基作用。
氨基酸的一般代谢。
蛋白质与核酸的相互关系。
9.核酸代谢核酸的分类,水解产物。
核酸生物学功能。
核苷酸;核苷的酶促分解和相互转化。
嘌呤、嘧啶分解代谢的基本途径和产物。
中心法则、复制、半保留复制、不连续复制、冈崎片段、转录、反转录、有意义连翻译。
DNA指导下的DNA复制与反转录的一般过程,DNA损伤和修复机制。

生物化学执业医师大纲
生物化学执业医师大纲是指生物化学专业的执业医师考试的考试大纲。
该大纲主要包括以下内容:
1. 生物化学基础知识:包括生物分子的组成、结构和功能,生物化学反应的原理和机制,酶的特性与功能等。
举例:生物化学基础知识可以包括对蛋白质的结构与功能的了解,如蛋白质的一级、二级、三级和四级结构,以及蛋白质在生物体内的功能和作用。
2. 代谢与能量:包括碳水化合物、脂类、蛋白质和核酸的代谢途径、能量产生与调控等。
举例:代谢与能量的内容可以包括糖原的合成与降解途径,脂肪酸的合成与氧化途径,以及蛋白质的合成与降解等。
3. 遗传学与分子生物学:包括基因的结构与功能,遗传信息的传递与表达,基因调控等。
举例:遗传学与分子生物学的内容可以包括DNA的结构与复制,RNA的合成与转录,基因突变与遗传病等。
4. 免疫学与病理生化学:包括免疫系统的结构与功能,免疫应答的机制,疾病的发生与发展等。
举例:免疫学与病理生化学的内容可以包括免疫系统的细胞组成与功能,免疫应答的类型与调节,以及一些常见疾病的病理生化学机制等。
总体而言,生物化学执业医师大纲涵盖了生物化学的基础知识和与医学相关的内容,帮助执业医师深入了解生物化学在医学领域的应用和意义。

701《生物化学》考试大纲一、考试大纲的性质生物化学课程是生物学专业重要的专业基础课,是林学、园林植物学、环境学等专业的选修课,它是报考理科植物学、生化和分子生物学、遗传育种学等专业研究生的考试科目之一。
为帮助考生明确考试复习范围和有关要求,特制定本考试大纲。
本考试大纲主要根据北京林业大学本科生物科学、生物技术专业与林科类各专业《生物化学》教学大纲编制而成,适用于报考北京林业大学硕士学位研究生的考生。
二、考试内容第一章蛋白质1. 蛋白质的化学组成及分类;蛋白质的分子大小与形状;蛋白质生物功能的多样性。
2. 氨基酸的基本结构;氨基酸的分类:20种氨基酸的英文名称、缩写符号及结构式及其分类标准;氨基酸的理化性质;氨基酸的分离和分析鉴定。
3. 肽的化学结构;肽的物理化学性质;天然存在的活性肽;多肽合成;肽链上氨基酸的排列顺序,N端、C端;氨基酸顺序测定的一般步骤。
4. 蛋白质空间构象的研究方法;多肽链折叠的空间限制;蛋白质的二级结构;纤维状蛋白;а-角蛋白和β-角蛋白,胶原蛋白与三股螺旋构象,弹性蛋白、肌纤维。
超二级结构、结构域和三级结构,球状蛋白质构象的基本特征、蛋白质分子中的次级键、次级键在维系蛋白质空间构象中的作用;蛋白质的变性和复性。
5. 寡聚蛋白质的构象和四级结构;蛋白质一级结构决定高级结构;细胞色素c的种属差异与生物进化;蛋白质一级结构的变异与分子病;肌红蛋白与血红蛋白的结构和功能;蛋白质的分离纯化和鉴定。
第二章酶学1. 酶催化作用的特点;酶的化学本质及其分子组成;酶的命名和分类;酶的专一性。
2. 酶活力测定和酶的分离纯化。
3. 酶促反应动力学。
4. 酶的作用机理和酶的调节;酶的活性中心;酶促反应机理;酶活性的调节控制。
5. 核酶和抗体酶;同工酶、诱导酶的定义及生物学意义。
第三章维生素和辅酶脂溶性维生素的结构和功能;水溶性维生素的结构和功能第四章核酸1. 核酸的分类、分布。
2. 核酸的生物学功能:DNA是遗传物质的基础(细菌的转化实验、病毒转导),RNA与蛋白质合成。

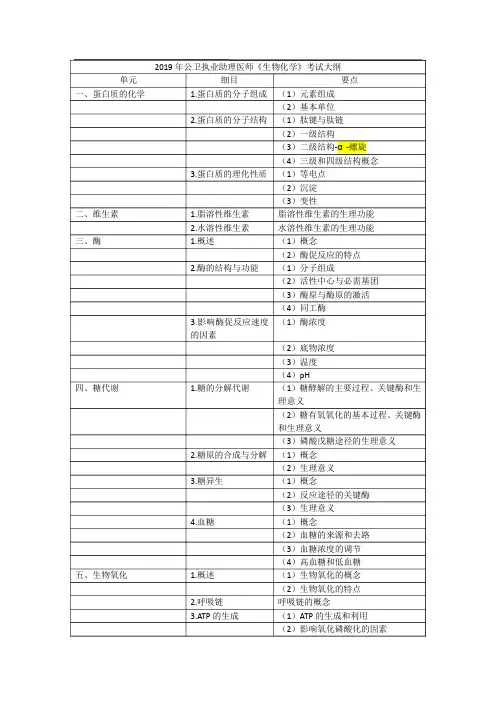
医学生物化学复习大纲第一章蛋白质化学第二节蛋白质的分子结构第三节蛋白质分子结构与功能的关系【考核要求】1.把握蛋白质的重要生理功能。
2.把握蛋白质的含氮量及其与蛋白质定量关系;差不多结构单位——是20种L、α-氨基酸,熟悉酸性、碱性、含硫、含羟基及含芳香族氨基酸的名称。
3.把握蛋白质一、二、三、四、级结构的概念;一级结构及空间结构与功能的关系。
4.熟悉蛋白质的重要理化性质――两性解离及等电点;高分子性质(蛋白质的稳固因素――表面电荷和水化膜);沉淀的概念及其方式;变性的概念及其方式;这些理化性质在医学中的应用。
第二章核酸化学【考核内容】第二节核酸的化学组成第三节 DNA的分子结构第五节核酸的理化性质【考核要求】1.熟悉核酸的分类、细胞分布及其生物学功能。
2.核酸的分子组成:熟悉核酸的、平均磷含量及其与核酸定量之间的关系。
核苷酸、核苷和碱基的差不多概念。
熟记常见核苷酸的缩写符号。
把握两类核酸(DNA与RNA)分子组成的异同。
熟悉体内重要的环核苷酸——cAMP和cGMP。
3.核酸的分子结构:把握多核苷酸链中单核苷酸之间的连接方式——磷酸二酯键及多核苷酸链的方向性。
把握DNA二级结构的双螺旋结构模型要点、碱基配对规律;了解DNA的三级结构——核小体。
熟悉rRNA、mRNA和tRNA的结构特点及功能。
熟悉tRNA二级结构特点——三叶草形结构及其与功能的关系。
4.核酸的理化性质:把握核酸的紫外吸取特性,DNA变性、Tm、高色效应、复性及杂交等概念。
第三章酶【考核内容】第二节、酶的结构与功能第三节、酶的作用机理第五节酶与医学的关系【考核要求】1.把握酶的概念;酶的特性。
2.把握酶的化学组成。
结合蛋白酶〔全酶〕类的特性;酶的活性中心、必需基团、酶原的激活、同工酶和变构酶的概念。
3.了解酶促反应的机理――降低反应活化能。
4.把握阻碍酶促反应的因素:温度、pH、酶浓度、作用物浓度、抑制物及兴奋剂对酶促反应速度的阻碍;米氏方程、米氏常数意义;竞争性抑制作用概念;三种抑制作用对最大速度和Km的阻碍。

《生物化学》考试大纲一、考试科目生物化学二、适用专业生物技术三、考试内容第一章蛋白质化学. 了解蛋白质是生命活动的主要物质基础的含义。
. 掌握蛋白质的化学组成,元素组成的特点;组成蛋白质常见氨基酸的基本结构、性质及等电点的概念;掌握蛋白质一,二,三,四级结构及与功能的关系。
第二章酶. 掌握酶的化学本质,酶催化作用的特征。
. 了解酶促反应的机理,酶的活性中心,中间产物学说,诱导契合学说等基本概念。
理解酶活性单位的概念。
. 掌握酶促反应动力学的基本内容,温度、、酶浓度作用物浓度、抑制剂激活剂对酶促反应的影响。
理解米氏方程、米氏常数的意义。
第三章核酸的化学.了解核酸的分类及其生物学功能。
.掌握核酸的元素组成,核苷酸、核苷和碱基的基本概念及其结构。
.掌握多核苷酸中单核苷酸之间的连接方式。
掌握二级结构的双螺旋结构模型要点,碱基配对规律和生物学意义。
.了解的结构特点。
.掌握核酸的基本生物化学性质。
第四章生物氧化.掌握生物氧化的基本概念、特点与意义、电子传递链的组成、排列顺序和的生成、的生成。
. 熟悉胞浆中的进入线粒体基质以及线粒体基质中的进入呼吸链各成员的化学本质和作用特点、线粒体内膜结构特点及其与氧化磷酸化的关系和影响氧化磷酸化的主要因素及其作用。
.了解合酶的结构及功能、化学渗透假说。
第五章糖代谢.熟悉糖酵解的生物学意义,全部反应过程及其主要调控机制。
.掌握糖异生途径的生物学意义及主要步骤。
.掌握三羧酸循环的全部反应过程。
第六章脂类代谢.掌握饱和偶数碳脂肪酸β氧化反应原理及过程。
.掌握脂肪酸合成的反应原理及过程。
.了解脂肪代谢与糖代谢的关系。
第七章氨基酸代谢.熟悉氨基酸的脱氨基、转氨基和联合脱氨基反应原理及过程。
.理解鸟氨酸循环反应原理及过程。
第八章核苷酸代谢.了解核苷酸的降解,碱基分解主要过程。
.了解核苷酸生物合成的基本途径。
第九章中心法则概论.掌握遗传中心法则的基本内容。
.理解半保留复制本质及复制的过程。

生物化学与分子生物学专业初试考纲(医学院各方向)615《生物化学》:一、考试科目简介《生物化学》是生命科学、医学、药学和化学等专业的一门基础课程。
它的主要任务是从分子水平和化学变化的本质上阐述各种生命现象。
它所涉及的研究内容包括活细胞化学成分的组成、结构与功能。
生物化学不仅需要运用各种化学的理论与方法,而且随着研究的深入和发展,已融入了生物学、物理学、微生物学、遗传学以及免疫学等知识和技术,以适应生物化学学科飞速发展的需要。
《生物化学》是报考“生物化学与分子生物学”硕士研究生考生的一门必考科目。
着重考察考生对生物化学基本理论的掌握程度,考察考生了解现代生物化学的最新进展,考察考生运用生物化学基本原理和技术分析和解释生命现象本质的能力。
二、考试内容类目:蛋白质的结构与功能、核酸的结构与功能、酶、糖代谢、脂类代谢、生物氧化、氨基酸代谢、核苷酸代谢、物质代谢的联系与调节、DNA的复制、转录、翻译、基因表达调控、基因工程、细胞信号转导等。
三、题型分布:1、选择题;2、填空题;3、名词解释;4、问答题。
830《分子生物学》:一、考试科目简介《分子生物学》是生命科学和医学各专业本科学生的重要基础课程,其在各个相关领域中的渗透使生命科学进入分子水平,如组织学、动物学、植物学、细胞学、解剖学、病理学、遗传学与药理学等。
相信分子生物学的发展最终将解决诸多重大的生命科学和医学问题,如生物改良、疾病防治、器官移植、免疫调节、人脑机理、新药开发等。
该科目要求考生必须掌握分子生物学的基本原理,用分子生物学原理解释生命现象、疾病发生和发展的机制,以及分子生物学的实际应用。
二、考试内容类目及具体要求:熟悉基因和基因组的结构与功能、DNA复制损伤与修复方式和原理;掌握基因表达与基因表达调控特点及方式;了解基因组学、功能基因组学、蛋白质组学等概念;熟悉细胞信号转导途径和细胞增殖与分化以及基因变异与疾病的关系;熟悉基因工程原理并掌握常规基因操作相关实验技术原理和步骤。

【考试大纲】生物化学一、蛋白质化学(一)氨基酸氨基酸的类型和化学性质。
(二)肽肽键,多肽链和蛋白质。
(三)蛋白质分子的基本结构蛋白质分子的一级、二级、三级、四级结构。
(四)蛋白质分子结构与功能的关系蛋白质分子的一级结构决定其高级结构和生物学功能。
(五)蛋白质的理化性质1.蛋白质的酸碱性质2.分子的大小与形状3.胶体性质4.变性和复性5.紫外光吸收6.显色反应(六)蛋白质组和蛋白质组学蛋白质组、蛋白质组学的基本概念。
二、酶学(一)酶的一般特性1.酶的化学本质和结构2.转换数(Kcat)和米氏常数(Km)3.酶的活力4.核酶。
(二)酶的催化机制1.过渡态、活化能2.诱导契合。
(三)酶活性的调控1.蛋白酶解激活(酶原的激活)2.可逆共价修饰3.别构调节。
三、细胞信号转导(一)细胞信号分子及其受体1.细胞间和细胞内的信号分子2.信号分子受体的类型3.细胞内信号转导途径的共同特征4.信号分子NO(二)G蛋白偶联受体介导的信号转导途径1.G蛋白偶联受体和G蛋白2.cAMP信号转导途径3.Ca2+信号转导途径(三)酶偶联受体介导的信号转导途径1.受体酪氨酸激酶(RTK)2.SH2和SH3结构域3.Ras蛋白4.MAP激酶(MAPK)5.RTK-Ras-MAPK信号转导途径6.受体鸟苷酸环化酶7.受体Tyr磷酸酶8.受体Ser/Thr激酶9.结合Tyr激酶的受体。
四、核酸化学(一)核酸的化学组成核糖和2-脱氧核糖,碱基(嘧啶和嘌呤),磷酸;核苷和脱氧核苷;核苷酸和脱氧核苷酸;核酸,核糖核酸(RNA),脱氧核糖核酸(DNA)。
(二)核酸的分子结构1.核苷酸的连接2.DNA分子结构3.RNA分子结构与功能(三)核酸的理化性质与应用水解;酸碱性;紫外线吸收特性;变性,复性;退火和分子杂交。
五、DNA的生物合成与损伤修复(一)DNA复制1.核酸生物合成的一般规律2.染色体DNA复制的一般特征3.大肠埃希菌DNA复制4.真核细胞DNA复制5.线粒体和噬菌体DNA复制6.DNA复制的忠实性(二)DNA损伤修复1.碱基切除修复2.核苷酸切除修复3.重组修复4.DNA倾向差错合成5.SOS应答(三)反转录1.反转录和反转录酶2.反转录病毒的生活周期六、RNA的生物合成和加工(一)转录1.转录、基因表达和中心法则2.RNA聚合酶3.启动子和增强子4.转录因子5.终止子和终止因子6.RNA生物合成的抑制剂。
《生物化学》考试大纲一、考试内容第一章蛋白质化学1.蛋白质在生命活动中的重要性2.蛋白质的元素组成3.氨基酸的结构、分类及其理化性质4.蛋白质的结构:一级结构:概念及维持键蛋白质的构象--- 构象的结构单元α-螺旋、β -折叠、β -转角、无规则卷曲,二级结构,三级结构,四级结构,维持构象的一些次级键超二级结构和结构域的概念5. 蛋白质的功能与性质的关系:一级结构与功能;构象与功能-- 变性作用,变构作用6.蛋白质的性质:等电点,胶体性质,蛋白质沉淀反应,紫外吸收性质重点掌握:必需氨基酸的种类、结构及三字母缩写蛋白质和氨基酸的两性解离和等电点蛋白质的基本结构层次及其维持力蛋白质的结构与功能之间的关系,变性、变构作用概念蛋白质沉淀的方法及其特点第二章核酸的化学1.核酸的组成与类别2.DNA 的结构与功能3.RNA 的结构与功能4.核酸的性质重点掌握:核酸的组成与类别DNA双螺旋结构学说要点及其生物学意义tRNA三叶草结构特点及其在机体内的重要功能核酸热变性特点,DNA的熔解温度( Tm)概念及其影响因素第三章糖类的结构与功能1.糖类的概念、作用与分类2.单糖:链式结构;立体结构;环式结构;糖的构象;糖的分类;重要的单糖;单糖的重要衍生物;单糖的理化性质;3.寡糖:麦芽糖;乳糖;蔗糖;纤维二糖;棉籽糖;4.多糖:淀粉;糖原;纤维素;其它常见多糖化合物;重点掌握:单糖、寡糖和多糖的结构第四章脂类和生物膜1.脂类的分类2.构成生物膜的重要的磷脂第五章酶学1.酶的基本概念:生物催化剂,酶的作用特点,酶的组成分类等2.酶的命名和分类3.酶的活性部位和酶原激活4.酶的作用机制:降低反应活化能,中间产物学说,诱导锲合学说,使酶具高效催化活性的因素5.酶的分离提纯与活力测定6.酶促反应动力学重点掌握:酶的分类酶的化学本质、作用特点酶活性部位概念,酶原激活实质中间产物学说,诱导锲合学说,米氏常数与米氏方程酶促反应动力学中底物浓度、温度、pH、抑制剂对酶促反应速度的影响第六章维生素和辅酶1.脂溶性维生素: A、 D、E、 K2.水溶性维生素:维生素 C, B1, B2,PP,泛酸,叶酸,生物素,硫辛酸,B12重点掌握:水溶性维生素与辅酶(辅基)之间的关系,在酶促反应中的作用;常见维生素缺乏病与维生素之间的对应关系。
教学要求及内容绪论【目的要求】1、掌握生物化学的含义;2、熟悉生物化学研究的主要内容;3、了解生物化学的发展史,在医学中的地位和作用及与中医药学的关系。
【教学内容】1、生物化学发展简史2、生物化学研究的主要内容3、生物化学在医学中的地位和作用及与医学及中医药学的关系第一章蛋白质的结构与功能【目的要求】1、掌握蛋白质的组成和分子结构;2、熟悉蛋白质在生命活动过程中的重要性与理化性质;3、了解蛋白质的分子结构与功能的关系【教学内容】1、蛋白质的分子组成⑴氨基酸的结构⑵氨基酸的分类⑶非标准氨基酸⑷氨基酸的两性电离与等电点⑸蛋白质中的非氨基酸成分2、蛋白质的分子结构⑴肽⑵蛋白质的一级结构⑶蛋白质的二级结构⑷蛋白质的三级结构⑸蛋白质的四级结构⑹维持蛋白质构象的主要作用力3、蛋白质的生理功能4、蛋白质结构与功能的关系5、蛋白质的理化性质⑴一般性质:紫外吸收特征,呈色反应;两性电离与等电点⑵大分子特性:蛋白质是胶体溶液,透析,沉降与沉降系数,沉淀,变性与复性第二章酶【目的要求】1、掌握酶的化学本质、组成、酶反应特点和酶原与同工酶的概念;2、熟悉酶促反应动力学;3、了解酶与医学的关系。
【教学内容】1、酶的分子结构与催化功能⑴酶的分子组成⑵酶的活性中心⑶酶催化作用机制2、酶促反应特性⑴酶促反应的高效性⑵酶促反应的特异性⑶酶促反应的调节性3、酶促反应动力学:酶浓度、底物浓度、温度、pH、抑制剂、激活剂对酶促反应速度的影响。
4、酶的命名与分类5、酶与医学的关系第三章核酸的结构与功能【目的要求】1、掌握核酸的化学组成,核苷酸的从头合成途径、补救合成途径,DNA的分子结构及生物学意义;2、熟悉嘌呤核苷酸分解代谢产物的临床意义,RNA的种类及其生物学作用;3、了解嘌呤核苷酸与嘧啶核苷酸的抗代谢物的作用机理,核酸的理化性质。
【教学内容】1、核酸的结构单位⑴核苷酸的组成⑵核苷酸的结构⑶核苷酸的功能2、核苷酸代谢⑴嘌呤核苷酸合成⑵嘧啶核苷酸合成⑶核苷酸的抗代谢物3、DNA的结构与功能⑴核酸的一级结构⑵DNA的二级结构⑶DNA的超螺旋结构⑷RNA的功能RNA的分子结构4、RNA的结构与功能⑴信使RNA⑵转运RNA⑶核糖体RNA⑷其他RNA5、核酸的理化性质⑴核酸的紫外吸收⑵DNA的变性与复性⑶分子杂交与探针技术补充:糖类化学【目的要求】1、掌握单糖的结构;2、熟悉单糖的化学性质,双糖的分子组成和结构;3、了解糖的分类、命名,单糖的构象,同多糖的组成、结构。