Mg,Al,Zn,Fe分别与硝酸铜,硝酸银,硫酸铜的化学方程式
- 格式:pdf
- 大小:6.11 KB
- 文档页数:3

中学化学常见物质化学式氧化物:水H2O 二氧化碳CO2 二氧化硫SO2 三氧化硫SO3 一氧化碳CO 氧化汞HgO 五氧化二磷P2O5 四氧化三铁Fe3O4 氧化亚铁FeO 三氧化二铁(氧化铁)Fe2O3 氧化镁MgO 三氧化二铝Al2O3 二氧化氮NO2氧化铜CuO 氧化钙CaO酸:硫酸H2SO4盐酸HCl 硝酸HNO3 碳酸H2CO3 醋酸CH3COOH 亚硫酸H2SO3 碱:氢氧化钠NaOH 氢氧化钙Ca(OH)2 氢氧化钡Ba(OH)2 氢氧化铜Cu(OH)2 氢氧化铁Fe(OH)3 氢氧化亚铁Fe(OH)2 氢氧化钾KOH 氢氧化镁Mg(OH)2 一水合氨NH3·H2O两性氢氧化物:氢氧化铝Al(OH)3盐:碳酸钠(苏打、纯碱)Na2CO3 碳酸氢钠(小苏打)NaHCO3 碳酸钙CaCO3碳酸钾K2CO3 碳酸钡BaCO3 碳酸铵(NH4)2CO3 氯化钠NaCl 氯化铜CuCl2 氯化镁MgCl2氯化钾KCl 氯化铁FeCl3 氯化亚铁FeCl2氯化钙CaCl2氯化锌ZnCl2 氯化铵NH4Cl 氯化铝AlCl3氯化银AgCl 氯化钡BaCl2硫酸钠Na2SO4硫酸铜CuSO4 硫酸镁MgSO4 硫酸铁Fe2(SO4)3硫酸亚铁FeSO4 硫酸铝Al2(SO4)3 硫酸铵(NH4)2SO4 硫酸钡BaSO4硫酸钙CaSO4硫酸钾K2SO4硫酸锌ZnSO4硝酸钠NaNO3 亚硝酸钠NaNO2 硝酸镁Mg(NO3 )2 硝酸铜Cu(NO3)2硝酸钾KNO3硝酸铵NH4NO3 硝酸银AgNO3 硝酸钡Ba(NO3)2碱式碳酸铜Cu2(OH)2CO3 高锰酸钾KMnO4锰酸钾K2MnO4 氯酸钾KClO3亚硫酸钠Na2SO3其他:氧气O2 氢气H2 氮气N2 氯气Cl2 氨气NH3 甲烷CH4乙醇C2H5OH 甲醇CH3OH 过氧化氢H2O2常见阴离子:亚硫酸根离子SO32-磷酸根离子PO43-硫酸根离子SO42-碳酸根离子CO32- 碳酸氢根离子HCO3- 硝酸根离子NO3 --- 氢氧根离子OH---铵根离子NH4+ 高锰酸根离子MnO4--- 锰酸根离子MnO42--亚硝酸根离子NO2 --- 氯离子Cl---常见阳离子:Na+NH4+Ca2+Mg2+Fe2+Fe3+Al3+Cu2+Ba2+Ag+Zn2+常见元素化合价金属只有正价,非金属通常显负价(特殊:在含氧酸跟中也显正价:例如亚硫酸根离子SO32-)K Na H Ag +1F Cl Br I —1Ca Mg Zn Ba +2O —2 Fe +2 +3 C +2 +4Cu +1 +2 Al +3 S —2 +4 +6N +1 +2 +3 +4 +5 —3化合价规律:(1)单质为零价(2)化合物中各元素正负化合价代数和为零(3)根中各元素正负化合价代数和等于该根化合价。


硝酸与金属反应的化学方程式硝酸是一种强氧化剂,常用于实验室和工业生产中。
它可以与许多金属发生反应,生成相应的金属盐和氮氧化物。
下面是一些常见的硝酸与金属反应的化学方程式及其解释。
1. 硝酸与铜反应:3Cu + 8HNO3 -> 3Cu(NO3)2 + 2NO + 4H2O解释:硝酸与铜发生反应时,铜被氧化为二价铜离子,硝酸被还原为一氧化氮和水。
生成的铜离子与硝酸根离子结合形成铜硝酸盐。
同时,反应过程中放出的一氧化氮气体可以形成棕色烟雾。
2. 硝酸与铁反应:3Fe + 8HNO3 -> 3Fe(NO3)2 + 2NO + 4H2O解释:硝酸与铁发生反应时,铁被氧化为二价铁离子,硝酸被还原为一氧化氮和水。
生成的铁离子与硝酸根离子结合形成铁硝酸盐。
同时,反应过程中放出的一氧化氮气体可以形成棕色烟雾。
3. 硝酸与锌反应:Zn + 2HNO3 -> Zn(NO3)2 + H2O解释:硝酸与锌发生反应时,锌被氧化为二价锌离子,硝酸被还原为水。
生成的锌离子与硝酸根离子结合形成锌硝酸盐。
4. 硝酸与铝反应:2Al + 6HNO3 -> 2Al(NO3)3 + 3H2O解释:硝酸与铝发生反应时,铝被氧化为三价铝离子,硝酸被还原为水。
生成的铝离子与硝酸根离子结合形成铝硝酸盐。
这些反应中,硝酸起到了氧化剂的作用,将金属氧化为相应的离子形式。
同时,硝酸自身被还原为氮氧化物和水。
生成的金属离子与硝酸根离子结合形成相应的金属硝酸盐。
硝酸与金属反应的特点是产生氮氧化物。
在反应过程中,一氧化氮气体会释放出来,形成棕色烟雾。
这是由于一氧化氮与空气中的氧气反应形成二氧化氮,而二氧化氮在空气中会与水蒸气反应形成硝酸,从而形成可见的棕色烟雾。
硝酸与金属反应是一种常见的化学反应,它具有重要的实验室和工业应用。
在实验室中,我们可以利用这些反应来制备金属盐,用于分析和实验。
在工业上,硝酸与金属反应可以用于生产金属盐和氮氧化物。

常见的离子符号和化学式一、一些常见离子1、阳离子:铵根离子:NH4+ 钾离子:K+钠离子:Na+ 氢离子:H+ 银离子:Ag+ 钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 锌离子:Zn2+亚铜离子:Cu+ 铜离子:Cu2+ 亚铁离子:Fe2+ 铁离子:Fe3+铝离子:Al3+ 2、阴离子:氢氧根离子:OH- 硝酸根离子:NO3-氟离子:F- 氯离子:Cl - 溴离子:Br- 碳酸根离子:CO32-硫酸根离子:SO42- 氧离子:O2- 硫离子:S2-二、一些常见物质的化学式1、单质氢气:H2氮气:N2氧气:O2氯气:Cl2臭氧:O3氦气:He 氖气:Ne 氩气:Ar碳:C 硫:S 磷:P 石墨:C 金刚石:C钠:Na 镁:Mg 铝:Al 钾:K 钙:Ca 铁:Fe 铜:Cu 锌:Zn 汞:Hg2、化合物(1)氧化物:水:H2O 过氧化氢:H2O2一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2 五氧化二磷:P2O5二氧化硫:SO2 氧化钠:Na2O 氧化钾:K2O 氧化镁:MgO 氧化铝:Al2O3氧化钙/生石灰:CaO 二氧化锰:MnO2氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4氧化亚铜:Cu2O 氧化铜:CuO 氧化汞:HgO (2)酸盐酸:HCl 的水溶液硝酸:HNO3硫酸:H2SO4碳酸:H2CO3 (3)碱氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3氢氧化铜:Cu(OH)2(4)盐(部分)氯化钠:NaCl 硝酸钠:NaNO 3 硫酸钠:Na2SO4 碳酸钠:Na2CO3 氯化钾:KCl 硝酸钾:KNO 3 硫酸钾:K2SO4 碳酸钾:K2CO3 氯化铝:AlCl3 硝酸铝:Al(NO3)3 硫酸铝:Al2(SO4)3氯化亚铁:Fe Cl2硝酸亚铁:Fe(NO3)2 硫酸亚铁:FeSO4氯化铁:FeCl3 硝酸铁:Fe(NO3)3 硫酸铁:Fe2(SO4)3氯化镁:MgCl2 硝酸镁:Mg(NO3)2 硫酸镁:MgSO4 碳酸镁:MgCO3 氯化钙:CaCl2 硝酸钙:Ca(NO3)2 硫酸钙:CaSO4 碳酸钙:CaCO3氯化锌:ZnCl2硝酸锌:Zn(NO3)2硫酸锌:ZnSO4氯化铜:CuCl2 硝酸铜:Cu(NO3)2 硫酸铜:CuSO4氯化银:AgCl 硝酸银:AgNO3硫酸银:Ag2SO4氯化钡:BaCl2 硝酸钡:Ba(NO3)2 硫酸钡:BaSO4碳酸钡:BaCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4 )2SO4 碳酸铵:(NH4)2CO3 高锰酸钾:KMnO4 锰酸钾:K2MnO4 氯酸钾:KClO3三、物质构成的规律:1、由分子构成的物质:(1)某些非金属氧化物:如H2O、CO、CO2、H2O2、P2O5、SO2 ……(2)非金属气体单质:如H2、O2、N2、Cl2、O3 ……(3)稀有气体(特殊的单原子分子):如He、Ne、Ar ……(4)酸:如HCl、H2SO4、H2CO3、HNO3、H2S……2、由原子构成的物质:(1)金属单质:如Hg、Fe、Mg……(2)某些固体非金属单质:如Si 金刚石、石墨……3、由离子构成的物质:(1)盐:如NaCl、KCl、MgCl2、CuSO4……(2)碱:如NaOH KOH ……。


精心整理常用物质的化学名称、化学式及反应的化学方程式:一、单质:1、常见气体:氧气:O2氢气:H2氯气:Cl2氮气:N22、稀有气体:氦气:He氖气:Ne氩气:Ar3、金属和非金属单质(1)金属单质:锂:Li铍:Be钠:Na镁:Mg铝:Al钾:K钙:Ca铜:Cu铁:Fe锌:Zn钡:Ba 银:Ag汞:Hg(2)非金属单质:碳:C硅:Si磷:P硫:S二、化合物二、制取气体的化学方程式:1(1)2KClO 3↑(2)2MnO 4+MnO 2+O 2↑(3)2H 2O 2(4)2H 22(1)(2)(3)2(4)3、制取氢气的化学方程式:(1)镁、铝、铁、锌与稀盐酸反应制取H 2:Mg +2HCl =MgCl 2+H 2↑2Al +6HC l =2AlCl 3+3H 2↑ (24(1(2Na 2注意:①往NaOH 溶液中通入CO 2,会发生反应2NaOH+CO 2=====Na 2CO 3+H 2O ;若继续通入Na 2CO 3+H 2O +CO 2===2NaHCO 3而2CO 3+H 2O +CO 2↑②往Ca(OH)2溶液中通入CO 2,会发生反应Ca(OH)2+CO 2====CaCO 3↓+H 2O 若继续通入CO 2,CaCO 3会逐渐溶解,则会发生反应CaCO 3+2===2Ca(HCO 3)2Ca(HCO 3)3↓+H 2O +CO 2↑形成钟乳石、石笋等5、生成陈定的化学方程式:(1)生成BaSO4白色沉淀,不溶于稀HNO3。
离子方程式:Ba2++SO42—=BaSO4↓Ba(OH)2+H2SO4=BaSO4↓+2H2OBa(NO3)2+H2SO4=BaSO4↓+2HNO3Ba(OH)2+Na2SO4=BaSO4↓+2NaOHBa(NO3)2+Na2SO4=BaSO4↓+2NaNO3Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓Ba(NO3)2+CuSO4=BaSO4↓+Cu(NO3)2Ba(OH)2+K2SO4=BaSO4↓+2KOHBa(NO3)2+K2SO4=BaSO4↓+2KNO3 BaCl2+H2SO4=BaSO4↓+2HClBaCl2+Na2SO4=BaSO4↓+2NaClBaCl2+CuSO4=BaSO4↓+CuCl2(2)生成AgCl白色沉淀,不溶于稀HNO3。


铜 银 锌及其化合物的化学方程式和离子方程式 、铜点燃1、 铜在氯气中燃烧:Cu + C 2 CuC 2△2、 铜和氧气加热: 2Cu + O 2 2CuO△3、 铜与硫共热:2Cu + S CU 2S4、 铜绿的形成:2Cu + O 2+ CQ + H 2O^=Cu 2(OH )2 CQ△4、 铜与浓硫酸共热: Cu + 2H 2SO 4 CuSQ + SQ f + 2H 2O5、 铜与浓硝酸反应: Cu + 4HNO3^=C U (NQ )2 + 2NO 2 f + 2H 2O+ — 2 +Cu + 4H + 2NO 3 Cu + 2NO 2 f + 2H 2O6、铜和稀硝酸反应: 3Cu + 8HNO3^=3C U (NO 3)2 + 2NO f+ 4H 2O3Cu + 8H ++ 2NO 3—3C U 2+ + 2NO f + 4H ?O7、铜与硝酸银溶液反应: Cu + 2AgNO 3 ---------- Cu(NO 3)2 + 2AgCu + 2Ag +^= Cu 2+ + 2Ag&铜与氯化铁溶液反应:Cu + 2FeC b^=2FeC b + CuC 23+ _______ 2+ , 2+Cu + 2Fe ^=2Fe + Cu、氧化铜△4、碳粉与氧化铜共热: 2CuO + C 2Cu + CO 2 f5、氧化铜与硫酸反应: CuO + H 2SQ^=C U SQ +也0+ 2 + CuO +H 2 Cu + H 2 0 高温 3CuO + 2Al 3C U + AI 2O 3△CuO + CO Cu + C021、 氢气通过灼热的氧化铜:2、 铝与氧化铜高温反应:3、 一氧化碳与氧化铜共热:CuO+ 2H Cu + H2O6、氧化铜与氯化铁溶液反应:3CuO+ 2FeC3 + 3H2O^=2Fe(OH)3 + 3CuC23CuO+ 2Fe3++ 3H2O^=2Fe(OH)3 + 3Cu2+三、氢氧化铜1、氢氧化铜溶于稀硫酸:Cu(OH》+ H2SQ^=C U SC4+ 2H2OC U(OH)2 + 2H Cu2+ 2H2O2、氢氧化铜与氯化铁溶液反应:3C U(OH)2 + 2FeC3^=2Fe(OH)3 + 3CuC 23+ 2+3C U(OH)2 + 2Fe 2Fe(OHp + 3Cu△3、加热氢氧化铜:Cu(OH)2 -------------------CuO+ H2O四、硫酸铜1、硫酸铜溶液与氯化钡溶液反应:CuSQ+ BaC b^=CuC b+ BaSQ JBa2++ SO42一------- BaSO J2、硫酸铜溶液与硫化钠溶液反应:CuSQ+ Na2S^=CuSj + Na2SQcU + S CUS J3、硫酸铜与碳酸钠溶液反应:CuSQ+ Na z CC b^CuCQ J+ Na2SQ2+ 2-Cu + CQ ^^=CuCO3 J4、硫酸铜溶液呈酸性:CuSO4 + 2H2O、一Cu(OH)2 + H2SO42 +Cu + 2H2O-一C U(OH)2 + 2H5、硫酸铜溶液与氢氧化钠溶液反应:CuSQ + 2NaOH^Cu(OHb J + Na z SQ2 + —Cu + 2OH --------- Cu(OHR J6、硫酸铜溶液中加入氨水:CuSQ + 2NH3H2O=C U(OH)2 J + (NH4)2SQ2 + +Cu + 2NH3 H2O^=C U(OH)2 J + 2NH47、硫酸铜溶液和偏铝酸钠溶液混合:CuSQ + 2NaAlO2 + 4H2O^=Cu(OH)2 J + 2Al(OH)3 J + Na z SQCu + 2AIO2 + 4H2O^=C U(OH)Z J + 2Al(OH)3 J&硫酸铜溶液中加入锌:Zn + CuSQ^^Z nSQ + Cu2+ 2+Zn+ Cu‘ ^=Z n + Cu9、铁和硫酸铜溶液反应:Fe+ CuSQ^=FeSQ+ CuFe+ Cu2*^= Fe2+ + Cu△10、加热硫酸铜晶体:CuSQ • 5出0 CuSQ+ 5出011、水蒸气通过无水硫酸铜:CuSQ+ 5H2O^=CuSQr 5^0五、银1、银与浓硝酸反应:Ag+ 2HNO3——AgNO a+ NO? f + H2OAg+ 2H + NO3 + NO2 f + H2O2、银与稀硝酸反应:3Ag+ 4HNO3^=3AgNOa+ NO f + 2战。

九年级化学—金属的化学性质一、金属与氧气的反应1.镁与氧气:2Mg + O 22MgO2.铁与氧气:3Fe + 2O 2Fe3O43.铜与氧气:2Cu + O 2 2CuO4.铝与氧气:4Al + 3O2 ==2Al2O3二、金属与酸的反应1.铁与稀硫酸:Fe + H2SO4 == FeSO4 + H2↑2.铁与稀盐酸:Fe + 2HCl == FeCl2 + H2↑3.锌与稀硫酸:Zn + H2SO4 == ZnSO4 + H2↑4.锌与稀盐酸:Zn + 2HCl == ZnCl2 + H2↑5.镁与稀硫酸:Mg + H2SO4 == MgSO4 + H2↑6.镁与稀盐酸:Mg+ 2HCl == MgCl2 + H2↑7.铝与稀硫酸:2Al +3H2SO4 == Al2(SO4)3 +3H2↑三、金属与金属的盐溶液1.铁与硫酸铜:Fe + CuSO4 == Cu + FeSO4(“湿法冶金”原理)2.镁与硫酸铜:Mg + CuSO4== MgSO4 + Cu3.铝与硫酸铜:2Al + 3CuSO4== Al2(SO4)3 + 3Cu4.铁与硝酸银:Fe + 2AgNO3 == 2Ag + Fe(NO3)2四、金属活动性顺序K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au金属活动性由强逐渐减弱1.铝与稀盐酸:2Al + 6HCl == 2AlCl3 + 3H2↑(说明铝的金属活动性比氢强)2.铜与稀盐酸:不反应。
说明铜的金属活动性比氢弱。
3.锌与硝酸铜:Zn + Cu(NO3)2==Cu + Zn(NO3)2(说明锌的金属活动性比铜强)4.铜与硝酸银:Cu + 2AgNO3 == 2Ag + Cu(NO3)2(说明铜的金属活动性比银强)5.铜与硝酸镁:不反应。
说明铜的金属活动性比镁弱。
6.银与硝酸铜:不反应。
说明银的金属活动性比铜弱。
五、金属资源的保护(一)金属的锈蚀1.铁生锈的条件:铁与O2、水接触(铁锈的主要成分:Fe2O3)❖铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。

九年级化学式大全一、熟记下列元素名称、符号:1、O 氧 H氢 N氮 Cl氯 C碳 P磷 S硫2、K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜Hg汞 Ag银 Mn锰 Ba钡二、熟记下列物质的化学式:1、单质:H2氢气 O2氧气 N2氮气 C碳 P磷 S硫Fe铁 Cu铜 Hg汞2、化合物(1)氧化物: H2O水 CO2二氧化碳 CO一氧化碳 SO2二氧化硫P2O5五氧化二磷 Fe2O3氧化铁 Fe3O4四氧化三铁 CaO氧化钙MgO氧化镁 CuO氧化铜 H2O2过氧化氢 MnO2二氧化锰(2)酸: HCl盐酸 H2SO4硫酸 HNO3硝酸 H2CO3碳酸(3)碱:NaOH氢氧化钠 KOH氢氧化钾 Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡 Cu(OH)2氢氧化铜 Fe(OH)3氢氧化铁Al(OH)3氢氧化铝 Mg(OH)2氢氧化镁(4)盐:NaCl氯化钠 Na2CO3碳酸钠 ZnCl2氯化锌 CaCl2氯化钙KCl氯化钾 Na2SO4硫酸钠 CuSO4硫酸铜 AgCl氯化银FeCl3氯化铁 FeCl2氯化亚铁 AlCl3氯化铝 FeSO4硫酸亚铁Fe2(SO4)3 酸铁 ZnSO4硫酸锌 CaCO3碳酸钙 BaCl2氯化钡BaSO4硫酸钡 KClO3 氯酸钾 KMnO4 高锰酸钾 K2MnO4锰酸钾KNO3硝酸钾 Cu(NO3)2硝酸铜 NH4Cl氯化铵 NH4NO3硝酸铵NaHCO 3碳酸氢钠 (5)有机物:甲烷CH 4 乙醇(酒精)C 2H 5OH 葡萄糖C 6H 12O 6 乙酸CH 3COOH初中化学方程式大全一、氧气的性质:1、单质与氧气的反应:(化合反应) 镁在空气中燃烧:2Mg + O 2 2MgO 铁在氧气中燃烧:3Fe + 2O 2 点燃Fe 3O 4铜在空气中受热:2Cu + O 2△2CuO铝在空气中燃烧:4Al + 3O 2 点燃2Al 2O 3 氢气中空气中燃烧:2H 2 + O 2 点燃2H 2O红磷在空气中燃烧 4P + 5O 2 点燃2P 2O 5点燃SO 2硫粉在空气中燃烧: S + O 2碳在氧气中充分燃烧:C + O 2点燃CO 2碳在氧气中不充分燃烧:2C + O 2 点燃2CO2、化合物与氧气的反应: 一氧化碳燃烧2CO + O 2 点燃2CO 2甲烷燃烧CH 4 + 2O 2 点燃CO 2 + 2H 2O 酒精燃烧C 2H 5OH+3O 2 点燃2CO 2+3H 2O3、氧气的来源:玻义耳研究空气的成分:2HgO 2Hg+ O 2↑高锰酸钾制氧气2KMnO4 K2MnO4 + MnO2+O2↑过氧化氢制氧气2H 2O 22H 2O+ O 2↑△△△MnO2氯酸钾制氧气2KClO32KCl+3O2↑△二、水的性质电解水2H2O通电2H2↑+O2↑生石灰加入水中:CaO + H2O == Ca(OH)2二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:镁燃烧2Mg + O2点燃2MgO铁和硫酸铜溶液Fe+CuSO4==FeSO4+Cu氢气还原氧化铜H2+CuO△2O四、碳和碳的氧化物:1、碳的化学性质碳充分燃烧:C + O2点燃CO2炭还原氧化铜C+2CuO高温2Cu + CO2↑炭还原氧化铁3C+2Fe2O3高温4Fe+3CO2↑炭还原二氧化碳:CO2 + C 高温2CO2、二氧化碳的制法与性质:实验室制二氧化碳:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑工业制二氧化碳:CaCO3高温CaO + CO2↑碳酸分解:H2CO3 == H2O + CO2↑二氧化碳溶于水:H2O + CO2== H2CO3石灰水与二氧化碳反应鉴别二氧化碳:Ca(OH)2 + CO2 == CaCO3↓+ H2O 3、一氧化碳的性质:一氧化碳还原氧化铜CO+CuO△Cu+CO2一氧化碳的可燃性2CO+O2点燃2CO2五、燃料及其利用:甲烷在空气中燃烧CH4+2O2点燃CO2+2H2O酒精在空气中燃烧C2H5OH+3O2点燃2CO2+3H2O 氢气中空气中燃烧2H2 + O2点燃2H2O六、金属的性质1、金属与氧气反应:镁在空气中燃烧:2Mg + O2点燃2MgO铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4铜在空气中受热:2Cu + O2△2CuO铝在空气中形成氧化膜4Al+3O2=2Al2O32、金属单质+酸--盐+氢气(置换反应)锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑铁和稀硫酸Fe + H2SO4 = FeSO4+ H2↑镁和稀硫酸Mg+H2SO4 = MgSO4+H2↑铝和稀硫2Al+3H2SO4==Al2(SO4)3+3H2↑锌和稀盐酸Zn+2HCl==ZnCl2+H2↑铁和稀盐酸Fe +2HCl==FeCl2+H2↑镁和稀盐酸Mg+2HCl==MgCl2+H2↑铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑3、金属单质+盐(溶液)--新金属+新盐铁和硫酸铜溶液Fe + CuSO4 == FeSO4 + Cu锌和硫酸铜溶液2Al +3 CuSO4 == Al2(SO4)3 +3 Cu铜和硝酸银溶液Cu+2AgNO3==Cu(NO3)2+2Ag4、金属铁的治炼原理:3CO+ 2Fe2O3高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)与酸碱指示剂反应(2)金属单质+酸--盐+氢气(置换反应)(3)酸+ 金属氧化物---盐+ 水盐酸除锈Fe2O3 +6HCl==2FeCl3 + 3H2O硫酸除锈Fe2O3+3H2SO4==Fe2(SO4)3+3H2O氧化铜和稀盐酸CuO+2HCl==CuCl2+H2O氧化铜和稀硫酸CuO+H2SO4== CuSO4 +H2O(4)酸+ 碱-- 盐+ 水(中和反应)盐酸和氢氧化钠HCl+NaOH ==NaCl+H2O硫酸和氢氧化钠H2SO4+2NaOH==Na2SO4+2H2O盐酸和氢氧化钙2HCl+Ca(OH)2== CaCl2+2H2O硫酸和氢氧化钙H2SO4+Ca(OH)2==CaSO4+2H2O盐酸和氢氧化铝(治疗胃酸):3HCl+Al(OH)3==AlCl3+3H2O 盐酸和氢氧化铜2HCl+Cu(OH)2==CuCl2+2H2O(5)酸+盐--另一种酸+另一种盐大理石与稀盐酸CaCO3+2HCl==CaCl2+H2O+CO2↑碳酸钠与稀盐酸Na2CO3+2HCl==2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸NaHCO3+HCl==NaCl+H2O+CO2↑硫酸和氯化钡溶液H2SO4+BaCl2==BaSO4↓+2HCl盐酸与硝酸银HCl + AgNO3 = HNO3 + Ag Cl↓2、碱的化学性质:(1)与酸碱指示剂反应(2)碱+ 非金属氧化物--- 盐+ 水氢氧化钠变质2NaOH+CO2==Na2CO3+H2O氢氧化钙变质Ca(OH)2+CO2==CaCO3↓+H2O(3)碱+ 酸-- 盐+ 水(中和反应)(4)碱+ 盐--另一种碱+ 另一种盐氢氧化钙与碳酸钠Ca(OH)2+Na2CO3==CaCO3+2NaOH 3、盐的化学性质(1)盐(溶液)+金属单质--另一种金属+另一种盐铁和硫酸铜溶液反应Fe+CuSO4==FeSO4+Cu(2)盐+ 酸---- 另一种酸+ 另一种盐碳酸钠与稀盐酸Na2CO3+2HCl==2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸NaHCO3+HCl==NaCl+H2O+CO2↑(3)盐+ 碱--另一种碱+ 另一种盐(4)盐+ 盐----- 两种新盐氯化钠溶液和硝酸银NaCl+AgNO3==AgCl↓+NaNO3硫酸钠和氯化钡Na2SO4+BaCl2==BaSO4↓+2NaCl。
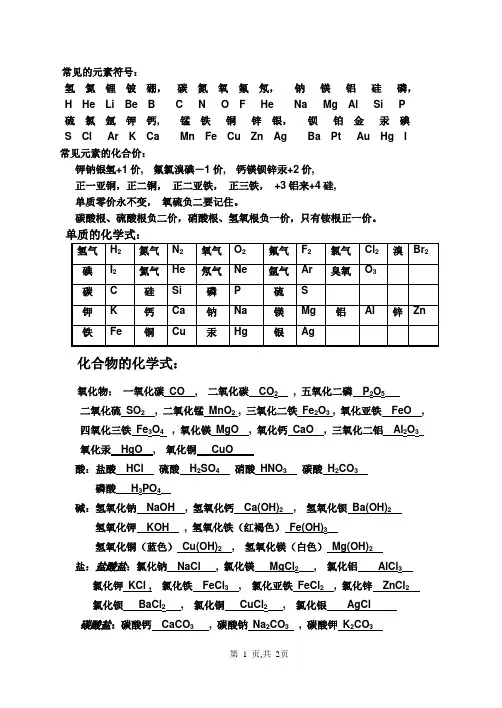
常见的元素符号:氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,H He Li Be B C N O F He Na Mg Al Si P硫氯氩钾钙, 锰铁铜锌银,钡铂金汞碘S Cl Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg I常见元素的化合价:钾钠银氢+1价, 氟氯溴碘-1价, 钙镁钡锌汞+2价,正一亚铜,正二铜,正二亚铁,正三铁,+3铝来+4硅,单质零价永不变,氧硫负二要记住。
碳酸根、硫酸根负二价,硝酸根、氢氧根负一价,只有铵根正一价。
单质的化学式:化合物的化学式:氧化物:一氧化碳CO , 二氧化碳CO2, 五氧化二磷P2O5二氧化硫SO2, 二氧化锰MnO2 , 三氧化二铁Fe2O3 , 氧化亚铁FeO , 四氧化三铁Fe3O4 , 氧化镁MgO , 氧化钙CaO , 三氧化二铝Al2O3氧化汞HgO , 氧化铜CuO酸:盐酸HCl 硫酸H2SO4硝酸HNO3碳酸H2CO3磷酸H3PO4碱:氢氧化钠NaOH , 氢氧化钙Ca(OH)2, 氢氧化钡Ba(OH)2氢氧化钾KOH , 氢氧化铁(红褐色)Fe(OH)3氢氧化铜(蓝色)Cu(OH)2, 氢氧化镁(白色)Mg(OH)2盐:盐酸盐:氯化钠NaCl , 氯化镁MgCl2, 氯化铝AlCl3氯化钾KCl , 氯化铁FeCl3, 氯化亚铁FeCl2, 氯化锌ZnCl2氯化钡BaCl2, 氯化铜CuCl2, 氯化银AgCl 碳酸盐:碳酸钙CaCO3, 碳酸钠Na2CO3, 碳酸钾K2CO3碳酸钡BaCO3硫酸盐: 硫酸亚铁FeSO4, 硫酸铁Fe2(SO4)3, 硫酸钠Na2SO4硫酸镁MgSO4, 硫酸铝Al2(SO4)3, 硫酸铜CuSO4硫酸锌ZnSO4, 硫酸钡BaSO4硝酸盐:硝酸银AgNO3硝酸汞Hg(NO3)2硝酸锌Zn(NO3)2硝酸钡Ba(NO3)2硝酸铝Al(NO3)3硝酸铁Fe(NO3)3硝酸铜Cu(NO3)2硝酸钙Ca(NO3)2常见的离子:钾离子K+,钠离子Na+,银离子Ag+,氢离子H+ ,氟离子F-,氯离子Cl-,钙离子Ca2+,镁离子Mg2+, 钡离子Ba2+ , 锌离子Zn2+,汞离子Hg2+,铜离子Cu2+,亚铁离子Fe2+ , 铁离子Fe3+,铝离子Al3+,氧离子O2-, 硫离子S2-,碳酸跟离子CO32-, 硫酸根离子SO42- , 硝酸根离子NO3-氢氧根离子OH- , 铵根离子NH4+, 磷酸根离子PO43-化学方程式一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、铜在空气中受热:2Cu+ O2加热 2CuO5、氢气在空气中燃烧:2H2 +O2点燃 2H2O6、红磷在空气中燃烧:4P +5O2点燃 2P2O57、硫粉在空气中燃烧: S+ O2点燃 SO28、碳在氧气中充分燃烧:C +O2 点燃 CO2二、分解反应1、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑2、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑3、加热氯酸钾(有少量的二氧化锰):2KClO3 2KCl+3O2↑4、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑。
最新金属和金属材料专项练习经典一、金属和金属材料选择题1.废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,为了回收重金属,将旧手机的部件粉碎并浸入足量稀硫酸中充分反应过滤,所得固体中含有的金属是A.Mg和Al B.Cu和Ag C.Al和Cu D.Mg和Ag【答案】B【解析】【详解】由金属活动性顺序“K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au”可知:Mg>Al(H)>Cu>Ag,则Mg、Al、Cu、Ag与稀硫酸反应的物质为Mg、Al,不反应的金属Cu和Ag.故选B.2.4.5g 镁和铝的合金加入到一定质量、一定质量分数的稀盐酸中,恰好完全反应,产生0.4g 氢气。
向反应后的溶液中加入一定质量的 NaOH 溶液,恰好使上述产生的 MgCl2 和AlCl3 完全转化为沉淀,则生成 NaCl 的质量为()A.23.4g B.29.25g C.11.7g D.5.85g【答案】A【解析】【详解】根据H~HCl~NaCl,则设生成NaCl的质量为x。
H HCl NaCl~~158.50.4g x10.4g=58.5x则x=23.4g,故生成NaCl 的质量为23.4g。
故选A。
【点睛】解决本题的技巧在于发现最终生成的氯化钠中氯元素全部来自于与镁铝合金发生反应的盐酸,这样就把看似无法解决的化学方程式的计算转变为根据化学式的计算,从而巧妙地解决问题。
3.用“W”型玻璃管进行微型实验,如图所示。
下列说法不正确的是()A.a处红棕色粉末变为黑色B.b处澄清石灰水变浑浊证明有CO2生成C.a处的反应化学方程式为CO+Fe2O3=2Fe+CO2D.可利用点燃的方法进行尾气处理【答案】C【解析】【详解】A、一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,a处红棕色粉末变为黑色,故选项说法正确。
B、二氧化碳能使澄清的石灰水变浑浊,b处澄清石灰水变浑浊,证明有CO2生成,故选项说法正确。
稀盐酸是一种常见的无机酸,通常用于实验室化学实验和工业生产中。
在化学反应中,稀盐酸可以与许多金属元素发生反应,其中包括镁(Mg)、锌(Zn)、铁(Fe)和铜(Cu)。
下面将分别探讨这些金属元素与稀盐酸发生反应的化学方程式。
1. 镁(Mg)与稀盐酸反应的化学方程式:当镁与稀盐酸发生化学反应时,生成氢气和氯化镁。
该化学方程式可以表示为:Mg + 2HCl → MgCl2 + H22. 锌(Zn)与稀盐酸反应的化学方程式:当锌与稀盐酸反应时,也会生成氢气和氯化锌。
该化学方程式可以表示为:Zn + 2HCl → ZnCl2 + H23. 铁(Fe)与稀盐酸反应的化学方程式:铁与稀盐酸反应时,会生成氢气和氯化铁。
化学方程式如下所示:Fe + 2HCl → FeCl2 + H24. 铜(Cu)与稀盐酸反应的化学方程式:铜虽然是一种活泼的金属,但在常温下通常无法与稀盐酸反应。
铜不会与稀盐酸生成氢气和氯化铜的化学反应。
通过以上化学方程式的描述,我们可以了解到镁、锌和铁与稀盐酸反应时会生成氢气和相应的金属盐。
我们也知道铜在常温下通常无法与稀盐酸发生化学反应。
这些化学方程式的描述对于理解金属与稀盐酸反应的化学性质具有重要的参考价值。
基于前文中关于镁、锌、铁和铜分别与稀盐酸的化学反应方程式的讨论,我们将继续探讨这些反应的特性及其在日常生活和工业生产中的应用。
1. 镁与稀盐酸反应的特性及应用:镁是一种轻质金属,与稀盐酸反应产生氢气和氯化镁,这个反应是一种典型的金属和酸发生单替换反应。
由于镁的特性,镁与稀盐酸的反应会迅速放出大量氢气,并伴随着剧烈的气体冒泡和持续的化学反应,因此可以应用在一些需要氢气的实验室和工业生产过程中。
2. 锌与稀盐酸反应的特性及应用:和镁类似,锌也是一种活泼的金属,它与稀盐酸反应产生氢气和氯化锌。
这种化学反应可以在实验室中用来制备氢气,也可以作为制备氯化锌的重要步骤之一。
3. 铁与稀盐酸反应的特性及应用:铁与稀盐酸反应同样会放出氢气,产生氯化铁。
九年级下化学方程式一、金属与金属材料相关方程式。
1. 金属与氧气反应。
- 铝在空气中形成致密氧化膜:4Al + 3O_2=2Al_2O_3。
- 铜在空气中受热:2Cu+O_2{}{=}2CuO。
2. 金属与酸反应(金属活动性顺序中氢前金属)- 镁与稀盐酸反应:Mg + 2HCl = MgCl_2+H_2↑。
- 锌与稀硫酸反应:Zn + H_2SO_4=ZnSO_4+H_2↑,此反应常用于实验室制取氢气。
- 铁与稀盐酸反应:Fe+2HCl = FeCl_2+H_2↑,反应后溶液变为浅绿色,因为生成了亚铁离子(Fe^2 + )。
3. 金属与金属盐溶液反应(金属活动性顺序:前金换后金)- 铝与硫酸铜溶液反应:2Al+3CuSO_4=Al_2(SO_4)_3+3Cu。
- 铜与硝酸银溶液反应:Cu + 2AgNO_3=Cu(NO_3)_2+2Ag,反应现象为铜丝表面有银白色物质析出,溶液由无色变为蓝色。
二、溶液相关方程式。
1. 酸碱中和反应。
- 氢氧化钠与盐酸反应:NaOH+HCl = NaCl + H_2O,这是典型的中和反应,反应无明显现象,可借助酚酞等指示剂判断反应是否发生。
- 氢氧化钙与硫酸反应:Ca(OH)_2+H_2SO_4=CaSO_4+2H_2O。
2. 酸与盐反应。
- 盐酸与碳酸钙反应:2HCl+CaCO_3=CaCl_2+H_2O + CO_2↑,此反应常用于实验室制取二氧化碳气体。
- 硫酸与碳酸钠反应:H_2SO_4+Na_2CO_3=Na_2SO_4+H_2O+CO_2↑。
3. 碱与盐反应(反应物需可溶)- 氢氧化钠与硫酸铜反应:2NaOH + CuSO_4=Cu(OH)_2↓+Na_2S O_4,反应现象为产生蓝色沉淀。
- 氢氧化钙与碳酸钠反应:Ca(OH)_2+Na_2CO_3=CaCO_3↓+2NaOH,工业上用于制取氢氧化钠。
三、盐与盐反应(反应物需可溶)1. 氯化钠与硝酸银反应:NaCl+AgNO_3=AgCl↓+NaNO_3,反应现象为产生白色沉淀,此反应常用于检验氯离子(Cl^-)。
初中化学置换反应方程式嘿,朋友们!今天咱们来唠唠初中化学里超有趣的置换反应方程式。
首先呢,金属铁和硫酸铜溶液的反应就像一场“金属大换位”。
铁(Fe)这个“大力士”把硫酸铜(CuSO₄)里的铜(Cu)给挤走了,自己霸占了原来铜的位置,就变成了硫酸亚铁(FeSO₄)。
方程式是Fe + CuSO₄ = FeSO₄ + Cu,这就好比铁对铜说:“兄弟,你这个位置不错,我来啦,你走人吧。
”再看镁(Mg)和稀盐酸(HCl)的反应,那简直是一场“激烈的抢夺战”。
镁像个超级饥饿的家伙,看到稀盐酸里的氢(H)就扑上去,把氢给抢过来,自己变成了氯化镁(MgCl₂),氢就只能变成氢气(H₂)飞走啦。
方程式Mg + 2HCl = MgCl₂ + H₂↑,就像镁在喊:“氢,你归我啦,我要带你走咯。
”还有铝(Al)和硫酸铜溶液的反应,铝就像一个神秘的“魔法师”。
它一进入硫酸铜溶液这个“魔法池”,就把铜从溶液里变出来了,自己变成了硫酸铝(Al₂(SO₄)₃)。
方程式2Al+ 3CuSO₄ = Al₂(SO₄)₃+ 3Cu,这就像铝在施展魔法:“变变变,铜出来,我进去。
”锌(Zn)和稀硫酸(H₂SO₄)的反应也很有趣。
锌像个勇敢的小战士,冲向稀硫酸这个“堡垒”,把里面的氢给解救出来,自己变成硫酸锌(ZnSO₄)。
方程式Zn + H₂SO₄ = ZnSO₄ + H₂↑,仿佛锌在说:“氢啊,别怕,我带你脱离这个硫酸的束缚。
”铜和硝酸银溶液(AgNO₃)的反应呢,铜就像一个小偷。
它偷偷潜入硝酸银溶液这个“银库”,把银(Ag)给偷了出来,自己变成了硝酸铜(Cu(NO₃)₂)。
方程式Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag,就好像铜在小声嘀咕:“嘿嘿,银,跟我走咯。
”铁和稀硫酸的反应也很有看头。
铁像个贪心的家伙,遇到稀硫酸就把里面的氢拽走,自己变成硫酸亚铁。
方程式Fe + H₂SO₄ = FeSO₄ + H₂↑,感觉铁在说:“氢,你是我的啦。
硝酸银和铜化学方程
硝酸银和铜反应的化学方程式为:
$2AgNO_3 + Cu → Cu(NO_3)_2 + 2Ag$
这个反应是一种置换反应,其中硝酸银($AgNO_3$)中的银离子($Ag^+$)被铜($Cu$)原子取代,生成硝酸铜($Cu(NO_3)_2$)和银($Ag$)。
在这个反应中,铜逐渐溶解,表面出现银白色物质,同时溶液颜色由无色逐渐变为蓝色。
这是因为生成的硝酸铜在水中溶解呈现蓝色。
这个反应在化学实验室中常用于制备银,也可用于检测溶液中是否存在铜离子。
需要注意的是,硝酸银对皮肤和黏膜有刺激性,操作时应注意安全。
此外,硝酸银和铜的反应还可以通过改变反应条件(如温度、浓度等)来影响反应速率和产物的性质。
这些方面的研究对于理解化学反应的机理和应用具有重要意义。
希望以上内容对你有所帮助!如果你对这个反应或其他化学问题有任何进一步的疑问,我将很愿意继续为你提供帮助。
方程式整理可以说:“化学玩的就是反应方程式!”化学没学好,就是没有记住和理解好反应方程式。
1. 铝与硫酸铜溶液反应2Al + 3CuSO4 = Al2(SO4)3 + 3Cu 2Al + 3Cu2+ = 2Al3+ + 3Cu2. 铜丝与硝酸银溶液反应Cu + 2AgNO3 = Cu(NO3)2 + 2Ag Cu + 2Ag+ = Cu2+ + 2Ag3. 镁条与稀盐酸反应Mg + 2HCl = MgCl2 + H2↑ Mg + 2H+ = Mg2+ + H2↑4. 在常温下,钠与氧气反应4Na + O2 = 2Na2O 无离5. 加热条件下,钠与氧气反应2Na + 2H2O = 2NaOH + H2↑ 2Na + 2H2O = 2Na+ + 2OH–+ H2↑6. 钠与水的反应2Na + 2H2O = 2NaOH + H2↑ 2Na + 2H2O = 2Na+ + 2OH–+ H2↑7. 加热条件下,铁与水蒸气反应O(g) Fe3O4 + 4H2无离3Fe + 4H8. 铝与氢氧化钠溶液反应2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 2Al + 2OH– + 2H2O = 2AlO2– + 3H2↑9. 铝与盐酸溶液反应2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑10. 氧化钠与水反应Na2O + H2O = 2NaOH Na2O + H2O = 2Na+ + 2OH–11. 氧化钠与二氧化碳反应Na2O + CO2 = Na2CO3无离12. 过氧化钠与水反应2Na2O2 + 2H2O = 4NaOH + O2↑ 2Na2O2 + 2H2O = 4Na+ + 4OH–+ O2↑13. 过氧化钠与二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O2无离14. 碳酸钠溶液与盐酸反应Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O CO32– + 2H+ = CO2↑+ H2O15. 碳酸氢钠溶液与盐酸反应NaHCO3 + HCl = NaCl + CO2↑+ H2O HCO3– + H+ = CO2↑+ H2O16. 碳酸氢钠固体受热分解(无离)Na2CO3 + CO2↑+ H2O 无离2NaHCO17. 氧化铝与盐酸反应Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 6H+ = 2Al3+ + 3H2O18. 氧化铝与氢氧化钠溶液反应Al2O3 + 2NaOH = 2NaAlO2 + H2O Al2O3 + 2OH– = 2AlO2– + H2O 19. 硫酸铝溶液与氨水反应Al2(SO4)3+6NH3H2O=2Al(OH)3↓+3(NH4)2SO4Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+20. 氢氧化铝与盐酸反应Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O 21. 氢氧化铝与氢氧化钠溶液反应Al(OH)3 + NaOH = NaAlO2 + 2H2O Al(OH)3 + OH– = AlO2– + 2H2O 22. 氯化铝溶液与少量氢氧化钠溶液反应(1:3)AlCl3 + 3NaOH = Al(OH)3↓+ 3NaCl Al3+ + 3OH– = Al(OH)3↓23. 氯化铝溶液与过量氢氧化钠溶液反应(1:4)AlCl3 + 4NaOH = NaAlO2 + 3NaCl + 2H2O Al3+ + 4OH– = AlO2– + 2H2O 24. 氢氧化铝受热分解(无离)2Al2O3 + 3H2O 无离2Al(OH)25. 氧化亚铁与盐酸反应2Al(OH)2Al2O3 + 3H2O 无离26. 氧化铁与盐酸反应Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O 27. 氯化铁溶液与氢氧化钠溶液反应FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl Fe3+ + 3OH– = Fe(OH)3↓28. 硫酸亚铁溶液与氢氧化钠溶液反应FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 Fe2+ + 2OH– = Fe(OH)2↓氢氧化亚铁被空气里的氧气氧化4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 无离29. 氯化铁溶液滴加硫氰化钾(KSCN)溶液FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl Fe3+ + 3SCN– = Fe(SCN)3(红色) 30. 氯化铁溶液中加入铁粉2FeCl3 + Fe = 3FeCl2 2Fe3+ + Fe = 3Fe2+31. 氯化铁溶液中加入铜粉2FeCl3 + Cu = 2FeCl2 + CuCl2 2Fe3+ + Cu = 2Fe2+ + Cu2+32. 氯化亚铁溶液中通入氯气2FeCl2 + Cl2 = 2FeCl3 2Fe2+ + Cl2 = 2Fe3+ +2Cl–33. 二氧化硅与氢氟酸反应(腐蚀玻璃)SiO2 + 4HF = SiF4↑+ 2H2O 无离34. 二氧化硅高温下与氧化钙反应)SiO+ CaO CaSiO3 无离35. 二氧化硅与烧碱溶液反应SiO2 + 2NaOH = Na2SiO3 + H2O SiO2 + 2OH–= SiO32– + H2O36. 硅酸钠溶液(水玻璃)加盐酸制硅酸(难溶)Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ SiO32– + 2H+ = H2SiO3↓37. 软锰矿(MnO2)与浓盐酸加热下制氯气+ 4HCl(浓) MnCl2 + Cl2↑+ 2H2OMnO+ 4H+ + 2Cl–Mn2+ + Cl2↑+ 2H2OMnO38. 钠在氯气中燃烧2Na + Cl22NaCl无离39. 铁在氯气中燃烧)2Fe + 3Cl2 2FeCl3 无离40. 铜在氯气中燃烧(无离)Cu + Cl2CuCl2 无离41. 氯气通入水中Cl2 + H2O = HCl + HclO Cl2 + H2O = H+ + Cl– + HClO 42. 次氯酸见光分解↑ 2HClO 2H+ + 2Cl– + O2↑2HClO 2HCl + O43. 氯气通入氢氧化钠溶液中制得漂白液(84消毒液)Cl2 + 2NaOH = NaCl + NaClO + H2O Cl2 + 2OH– = Cl– + ClO– + H2O 44. 氯气通入冷的消石灰中制得漂白粉2Cl2 + 2Ca(OH)2 = CaCl2 +Ca(ClO)2+ 2H2O 无离45. 漂白粉失效Ca(ClO)2+ CO2 + H2O = CaCO3 +2HclO 无离↑ 无离2HClO 2HCl + O46. 氯气通入碘化钾溶液中Cl2 + 2KI = 2KCl + I2 Cl2 + 2I– = 2Cl– + I2。
Mg,Al,Zn,Fe分别与硝酸铜,硝酸银,硫酸铜的化学方程式
Mg+Cu(NO3)2=Mg(NO3)2 +Cu
Mg+2AgNO3=Mg(NO3)2+2Ag
Mg+CuSO4=MgSO4+Cu
2Al+ 3Cu(NO3)2=2Al(NO3)3+3Cu
Al+ 3AgNO3=Al(NO3)3+3Ag
2Al+ 3CuSO4=Al2(SO4)3+3Cu
Zn+Cu(NO3)2=Zn(NO3)2 +Cu
Zn+2AgNO3=Zn(NO3)2+2Ag
Zn+CuSO4=ZnSO4+Cu
Fe+Cu(NO3)2=Fe(NO3)2 +Cu
Fe+2AgNO3=Fe(NO3)2+2Ag
Fe+CuSO4=FeSO4+Cu
金属元素M的相对原子质量为70,它在化合物中只有一种化合价。
已知它的磷酸盐的式量为165,它的硫酸盐的式量[]A.等于166 B.等于428 C.等于236 D.无法计算
磷酸根的相对分子质量是95,所以我们可以得到金属M的化合价是+3价的,
所以它的硫酸盐就是M2(SO4)3 所以它的式量为:428
所以选B
将1.12g铁粉加入到25mL2oml/L的Fecl3的溶液中,充分反应后,其结果是()
A,铁有剩余
B.往反应后溶液中滴入KSCN溶液,显粉色
C.Fe2+与fe3+物资的量之比6:1
D.氧化产物与还原产物的物质的量之比2:5
0.025*2=0.05mol
Fe +2FeCl3 =3FeCL2
56 2 3
1.12g 0.04mol 0.06mol
这时可以说氯化铁是过量的,所以反应后有氯化铁剩余
所以A不正确
B是正确的
C正确氯化亚铁是0.06,剩余的氯化铁是0.01mol
D不正确,氧化产物与还原产物的比应是2:1
一块质量为4g的合金,与足量的盐酸反应,生成0.2g氢气,则该合金可能是下列哪组
[](要过程,谢谢) A.铁镁 B.铁铝 C.铁锌D.镁铝
设这种合金的化合价都是+2价的。
M+2HCl=MCl2+H2
M 2
4 0.2
M=40
这时要求一种金属的相对原子质量大于40,一种小于40.铝的相对原子质量应折算成27*2/3=18
A铁56 镁24 可以
B铁56 与铝18 可以
C铁56 锌65 不可以
D镁24 铝18不可以。
用硝酸银溶液分别与氯化钠,氯化钙,氯化铝溶液反应生成等质量的氯
化银沉淀,则消耗硝酸银溶液的质量比为
A;1;1;1B;1;2;3C;3;2;1D;6;3;2 三个反应的离子方程式都是
Ag++Cl-=AgCl(沉淀)
因为生成的氯化银的沉淀是一样的,所以用的银离子是一样的,所以用的硝酸银也是一样多的,所以应1:1:1。